
Ректификация / РЕКТИФИКАЦИЯ(процессы)
.doc
КАФЕДРА ПРОЦЕССОВ И АППАРАТОВ
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
К КУРСОВОМУ ПРОЕКТУ ПО ПРАЦЕССАМ И АППАРАТАМ НА ТЕМУ :
«РЕКТИФИКАЦИЯ. определение средних величин,
потоков пара и жидкости
на примере СИСТЕМЫ ВОДА – УКСУСНАЯ КИСЛОТА»
ПРОЕКТИРОВАЛ СТУДЕНТ : * г
РУКОВОДИТЕЛЬ ПРОЕКТА : .
Проект защищен с оценкой________________
2003
СОДЕРЖАНИЕ
Стр.
1. Содержание. --------------------------------------------------------------------------------
-
Введение -------------------------------------------------------------------------------------
-
Определение средних физических величин, потоков пара и жидкости.
Простая полная колонна. -----------------------------------------------------------------
а) Для жидкой фазы в верхней и нижней частях колонны .------------------------
б) Для паровой фазы в верхней и нижней частях колонны. -----------------------
4. Список используемой литературы. ----------------------------------------------------
ВВЕДЕНИЕ
Ректификация — массообменный процесс, который осуществляется в большинстве случаев в противоточных колонных аппаратах с контактными элементами (насадки тарелки) аналогичными используемым в процессе абсорбции. Поэтому методы подход к расчету и проектированию ректификационных и абсорбционных установок имею много общего. Тем не менее ряд особенностей процесса ректификации (различие соотношение нагрузок по жидкости и пару в нижней и верхней частях колонны, переменные по высоте колонны физические свойства фаз и коэффициент распределения, совместное протекание процессов массо- и теплопереноса) осложняет его расчет.
Одна из сложностей заключается в отсутствии обобщенных закономерностей для расчета кинетических коэффициентов процесса ректификации. В наибольшей степени это относится к колоннам диаметром более 800 мм с насадками и тарелками, широко применяемым в химических производствах. Большинство рекомендаций сводится к использованию для расчета ректификационных колонн кинетических зависимостей, полученных при исследовании абсорбционных процессов (в приведенных в данной главе примерах в основном использованы эти рекомендации).
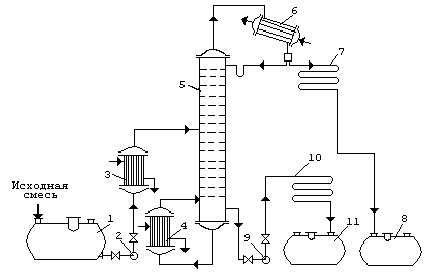
Принципиальная схема ректификационной установки представлена на рис. 1. Исходную смесь из промежуточной емкости 1 центробежным насосом 2 подают в теплообменник 3, где она подогревается до температуры кипения. Нагретая смесь поступает на разделение в ректификационную колонну 5 на тарелку питания, где состав жидкости равен составу исходной смеси хF
Рис.1 Принципиальная схема ректификационной установки:
ёмкость для исходной смеси ; 2, 9- насосы; 3- теплообменник-подогреватель; 4 - кипятильник;
5- ректификационная колонна; 6- дефлегматор; 7- холодильник дистиллята; 8- ёмкость для сбора дистиллята; 10- холодильник кубовой жидкости; 11- ёмкость для кубовой жидкости.
Стекая вниз по колонне, жидкость взаимодействует с поднимающимся вверх паром, образующимся при кипении кубовой жидкости в кипятильнике 4. Начальный состав пара примерно равен составу кубового остатка хW , т. е. обеднен легколетучим компонентом. В результате массообмена с жидкостью пар обогащается легколетучим компонентом. Для более полного обогащения верхнюю часть колонны орошают в соответствии с заданным флегмовым числом жидкостью (флегмой) состава хР , получаемой в дефлегматоре 6 путем конденсации пара, выходящего из колонны. Часть конденсата выводится из дефлегматора в виде готового продукта разделения - дистиллята, который охлаждается в теплообменнике 7 и направляется в промежуточную емкость 8.
Из кубовой части колонны насосом 9 непрерывно выводится кубовая жидкость - продукт, обогащенный труднолетучим компонентом, который охлаждается в теплообменнике 10 и направляется в емкость 11.
Таким образом, в ректификационной колонне осуществляется непрерывный неравновесный процесс разделения исходной бинарной смеси на дистиллят (с высоким содержанием легколетучего компонента) и кубовый остаток (обогащенный труднолетучим компонентом).
Расчет ректификационной колонны сводится к определению ее основных геометрических размеров - диаметра и высоты. Оба параметра в значительной мере определяются гидродинамическим режимом работы колонны, который, в свою очередь, зависит от скоростей и физических свойств фаз, а также от типа насадки.
ОПРЕДЕЛЕНИЕ СРЕДНИХ ФИЗИЧЕССКИХ ВЕЛИЧИН,
ПОТОКОВ ПАРА И ЖИДКОСТИ.
Для определения основных размеров колонны (аппарата), расходов греющего пара и воды требуется найти средние мольные, массовые составы, мольные, массовые и объемные расходы по жидкости и по пару, а также некоторые физические величины.
Простая полная колонна.
Для простой полной колонны, обогреваемой глухим паром (горячей водой) или острым паром, средние составы и расходы по жидкости и по пару, а также физические величины определяют отдельно для верхней и нижней частей колонны.
а) Для жидкой фазы в верхней и нижней частях колонны:
- мольные составы хАв и хАн определяют как среднеарифметические:
хАв=(хF+xD)/2=0,692
хАн=(хF+xW)/2=0,212
где А - легколетучий компонент;
- массовые составы хАв и хАн определяют по уравнению
хAi=MAxAi/Mxi,*
где Мxi - мольная масса смеси;
хAв=0,402 хAн=0,0747
* В этой и последующих формулах индекс i относится либо к верхней, либо к нижней частям колонны.
- мольные массы Мxв, Мxн определяют по формуле:
Mxi=MAxAi + MВ(1-хАi) , (**)
где МA , МВ - мольные массы исходных веществ, кг/кмоль;
Мхв=30.9 Мхн=51.1
- средние температуры tхв , txн определяют по диаграмме t-х,y при соответствующих значениях хАв и хАн;
-плотности хв, хн определяют по уравнению:
1/xi = хАi/Ai + xВi/Вi ,
где Ai , Вi -плотности легколетучего и труднолетучего компонентов при соответствующих температурах, кг/м3;
хв =955 хн =941
-динамические коэффициенты вязкости хв , хн рассчитывают по уравнению:
lgxi = xAilgAi + xВilgВi ;
хв=0,322 мПа.с хн=0,376 мПа.с
- коэффициенты диффузии Dхв , Dхн рассчитывают по приближенной формуле:
Dxi = D20,i[1+bi(txi – 20)] ,
где D20,i - коэффициент диффузии бинарной смеси при t=20 С, м2/с.
При 20 С Dхв = 0,984.10-9м2/с Dхн = 0,942.10-9 м2/с
При 100.1С Dхв = 2,64.10-9 м2/с Dхн = 2.74.10-9 м2/с
Температурный коэффициент bi в предыдущем уравнении может быть определен по эмпирической формуле:
bi = 0,2 xi/ xi
где xi - динамический коэффициент вязкости жидкости при t=20 С, мПа.с;
xi - плотность жидкости при t=20 С, кг/м3.
bв = 2,046.10-2 bн = 2,124.10-2
Коэффициент диффузии D20,i рассчитывают по приближенной формуле:
D20,i=1.10-6/ AB xi (vA1/3 + vB1/3)2 . 1/MA+ 1/MB ,
где xi - динамический коэффициент вязкости жидкости при t=20 С,мПа с;
МA и МB- мольные массы исходных веществ ,кг/кмоль; vA ,vB - мольные объемы растворенного вещества и растворителя, см3/моль; А и В – коэффициенты, зависящие от свойств растворенного вещества и растворителя.
D20,в= 2,68м2/с D20,н= 2,91м2/с
Значения коэффициентов А и В, а также атомные объемы приведены в Приложении. (А=4,7 В=1,27)
- поверхностные натяжения в, н определяют по уравнению:
1/i = xAi/Ai + xBi/Bi ,
где Ai , Bi - поверхностные натяжения исходных веществ при соответствующих температурах, Н/м.
в =36.2 мН/м н =21.9 мН/м
Для органических веществ значения Ai , Bi ,как правило, близки и величины i могут быть определены как среднеарифметические.
- удельные теплоемкости питания, кубового остатка и дистиллята определяют по аддитивным формулам:
cF = xAF cAF + xBF cBF=2.732
cW = xAW cAW + xBW Cbw=2.473
cD = xAD cAD + xBD cBD=4.084
-мольные расходы Lxв , Lхн рассчитывают по уравнениям:
Lхв = GDR = 0.197
Lхн = GDR + GF =0.299
где GD ,GF -мольные расходы питания и дистиллята, кмоль/с; R – флегмовое число.
- массовые расходы Lxв , Lхн рассчитывают по уравнениям:
Lxв = GDRMхв /MD = 6.1кг/с
Lхн = GDRMхн /MD + GFMхн /MF =15.33кг/с ,
где GD ,GF - массовые расходы питания и дистиллята, кг/с;
- объемные расходы Vхв , Vхн (в м3/с) рассчитывают по соотношению:
Vxi = Lxi /xi
Vхв= 0,006 м3/с Vхн= 0,0163 м3/с
б)Для паровой фазы в верхней и нижней частях колонны:
- мольные составы yAв, yAн определяют по уравнениям рабочих линий при подстановке в них соответственно хАв, хАн ;
- мольные массы Мyв,Мyн определяют по уравнению (**) при соответствующих значениях yAв, yAн ;
- массовые составы yAв, yAн определяют по уравнению:
yAi = MAyAi / Myi ;
yAв= 0,464 yAн= 0,096
- средние температуры tyв, tyн определяют по диаграмме t-x,y при соответствующих значениях yAв, yAн ;
tyв =103.0 C tyн = 111,0 C
- плотности yв , yн рассчитывают по уравнению :
yi = yAiAi + yBiBi ,
где Ai , Bi -плотности паров веществ А и В при соответствующих температурах, кг/м3;
yв =0.933 yн = 1,555
- динамические коэффициенты вязкости yв , yн рассчитывают по приближенной формуле :
Myi/i = yAiMA/Ai + yBiMB/Bi
yв =1,11.10-5 Па.с yн =1,04. 10-5 Па.с
- коэффициенты диффузии Dyв, Dyн рассчитывают по приближенной формуле :
Dyi = 4,3.10-7.Ti3/2 /p(vA1/3 + vB1/3)2 1/MA+1/MB ,
где Ti – средняя температура пара , К; р – среднее давление в колонне, ат; остальные обозначения смотри ранее ;
Dyв = 1,90.10-5 м2/с Dyн = 1,96.10-5 м2/с
- удельная теплота конденсации паров дистиллята рассчитывается по аддитивной формуле :
rD = yDrA + (1-yD)rB ,
где rA , rB – удельные теплоты конденсации паров веществ А и В при температуре дистиллята tD , кДж/кг; yD – массовая доля легколетучего компонента в парах дистиллята (при использовании дефлегматора yD = xD);
rD = 2110.2 кДж/кг
- мольный расход пара, который принимается постоянным по высоте колонны, определяется по уравнению (в кмоль/с):
Gyi = GD(R+1)/MD = 0,239 кмоль/с
где GD – массовый расход дистиллята, кг/с;
- массовые расходы Gyв, Gyн определяют по уравнению:
Gyi = GD(R+1)Myi/MD
Gyв =6.9 кг/с Gyн 11,74 кг/с
- объемные расходы пара Vyв , Vyн (в м3/с) рассчитывают по соотношению :
Vyi = GD(R+1). 22,4Tip0/MDT0p ,
или по формуле:
Vyi = Gyi/см,i ,
где см,i - плотность смеси паров компонентов, кг/м3.
Vyв = 7,39 м3/с Vyн = 7,55 м3/с
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ.
-
Павлов К.Ф., Романков П.Г., Носков А.А.
Примеры и задачи по курсу процессов и аппаратов химической технологии.
10-е изд. Л:Химия, 1987.576 с.
-
Романков П.Г., Фролов В.Ф., Флисюк О.М., Курочкина М.И
Методы расчета процессов и аппаратов химической технологии
(примеры и задачи)/. СПб:Химия, 1993,496 с.
