
- •Передмова
- •Тема 1. Комплексні сполуки
- •Контрольні запитання та задачі
- •Тема 2. Лужні метали
- •Контрольні запитання та задачі
- •Тема 3. Берилій. Магній. Лужноземельні метали
- •Контрольні запитання та задачі
- •Тема 4. Бор та алюміній
- •Контрольні запитання та задачі
- •Тема 5. Карбон силіцій та їх сполуки
- •Контрольні запитання та задачі
- •Тема 6. Станум, плюмбум та їх сполуки
- •Контрольні запитання та задачі
- •Тема 7. Нітроген та його сполуки
- •Контрольні запитання та задачі
- •Тема 8. Р-елементи VI групи
- •Контрольні запитання та задачі
- •Тема 9. Р-елементи vіі групи
- •Тема 10. Хром та його сполуки
- •Контрольні запитання та задачі
- •Тема 11. Манган та його сполуки
- •Контрольні запитання та задачі
- •Тема 12. Ферум. Кобальт. Нікель
- •Контрольні запитання та задачі
- •Тема 13. Купрум. Аргентум
- •Контрольні запитання та задачі
- •Тема 14. Цинк. Кадмій. Меркурій
- •Контрольні запитання і задачі
- •Список використаної літератури
- •Тема1. Комплексні сполуки 4
Контрольні запитання та задачі
1. Написати електронно-графічні формули Бору та Алюмінію в основному та збудженому станах. Указати можливі ступені окиснення цих елементів.
2. За допомогою рівнянь реакцій здійсніть перетворення:

3. Яку кількість
речовини ортоборатної кислоти можна
отримати з аморфного бору при окисненні
його 65,3%-ним розчином нітратної кислоти
(![]() =1,4
г\
=1,4
г\![]() )
об’ємом 100мл?
)
об’ємом 100мл?
4. Визначити титр і молярну концентрацію еквівалентів розчину бури, якщо 20 мл цього розчину нейтралізується 16 мл 0,1 н розчину хлоридної кислоти.
5. Написати рівняння реакцій одержання алюміній гідроксиду з а) металічного алюмінію; б) карбіду алюмінію; в)натрій сульфіду та алюміній сульфату.
6. Закінчити рівняння реакцій та підібрати коефіцієнти методом електронного балансу:
а)
![]()
б)
![]()
в)![]()
г)
![]()
д)![]()
Тема 5. Карбон силіцій та їх сполуки
Основні теоретичні положення
До головної підгрупи IV групи періодичної системи належать елементи карбон С, силіцій Si та елементи підгрупи германію: германій Ge, станум Sn, плюмбум Рb.
Атоми р-елементів IV групи містять у зовнішньому електронному шарі ns2 nр2 -електронів.
Наявність чотирьох електронів у зовнішньому електронному шарі атомів цих елементів є ознакою того, що вони можуть бути чотиривалентними. Стабільність зовнішнього електронного шару може визначатись як відщепленням, так і приєднанням чотирьох електронів.
Отже, елементи даної групи можуть утворювати сполуки як з активними неметалами, так і з металами, виявляючи у цьому разі ступені окиснення від +4 до -4.
У разі переходу від карбону до плюмбуму радіуси атомів зростають, а здатність до приєднання електронів, і отже, неметалічні властивості — послаблюються. Лише С та Sі неметали. Здатність до утворення сполук з гідрогеном та металами від карбону до плюмбуму послаблюється.
Дані елементи завдяки наявності двох неспарених р-електронів здатні утворювати сполуки, в яких вони двовалентні. Роль ns2-електронів із збільшенням радіусів атомів послаблюється, а неспарені р-електрони легше притягуються орбіталями інших атомів, тому від карбону до плюмбуму зростає здатність елементів виявляти ступінь окиснення +2.
У більшості неорганічних сполук карбон має ступінь окиснення +4, в оксиді CO і карбонілах металів ступінь окиснення його дорівнює +2, в диціані C2N2 — +3.
Електронна структура атома карбону 1s22s22p2. Залежно від числа σ-зв'язків координаційне число атома карбону може дорівнювати чотирьом (sр3-гібридизація), трьом (sр2-гібридизація) і двом (sр-гібридизація). Ступені окиснення Карбону бувають —4, 0, +4 і +2.
На відміну від інших елементів, число валентних електронів атома карбону дорівнює числу валентних орбіталей.
Карбон знаходиться в природі як у вільному стані так і у вигляді багатьох сполук. Вільний карбон зустрічається у вигляді алмазу, що кристалізується в кубічній системі та графіту, який належить до гексагональної системи. Атоми карбону в алмазі знаходяться у стані sp3 – гібридизації і утворюють трьохвимірну тетраедричну сітку, в якій вони зв’язані один з одним ковалентним зв’язком. Графіт має слоїсту решітку і всі атоми карбону знаходяться тут в стані sp2 – гібридизації: кожен з них утворює три ковалентні σ – зв’язки з сусідніми атомами. «Аморфний» карбон (вугілля) складається з маленьких кристалів з розупорядкованою структурою графіту (Такі форми його, як дерев’яне вугілля, кокс, сажа, мають неупорядковану структуру).
Вугілля легко сполучається з киснем під час нагрівання і є добрим відновником.
Безпосередньо з воднем вуглець сполучається лише в разі дуже сильного нагрівання за наявності каталізатора. Реакція оборотна:
С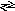 +2Н2
СН4.
+2Н2
СН4.
Карбон утворює багато сполук з галогенами, найпростіші з них мають формулу СГ4. Безпосередньою взаємодією вуглецю з фтором добувають CF4; з іншими галогенами вуглець не взаємодіє. Діючи галогенами на метан, добувають СС14.
Велике практичне значення мають карбіди — сполуки карбону з елементами, що мають меншу, ніж він, електронегативність.
Під час нагрівання в електропечі оксиду кальцію з вугіллям утворюється карбід кальцію:
СаО + 3С = CO + СаС2
Карбіди поділяють на три групи: солеподібні, карбіди вкорінення і ковалентні карбіди.
До солеподібних карбідів належать сполуки карбону з активними металами, що мають зв'язок проміжний між йонним і ковалентним із переважанням йонного. Це такі карбіди, як Ве2С, Mg2C3, CaC2, А14С3 тощо. Під час взаємодії їх з водою утворюються відповідні гідроксиди і вуглеводні:
СаС2 + 2Н2О = Са(ОН)2 + C2H2↑;
А14С3 + 12Н2О = 4А1(ОН)3 + 3СН4↑.
Оксид карбону (ІІ) CO — безбарвний газ без запаху, погано розчиняється у воді, дуже отруйний (чадний газ). Потрапляючи в організм, CO сполучається з гемоглобіном крові і позбавляє його здатності переносити кисень. Організм гине, якщо близько 80 % гемоглобіну сполучиться з CO.
CO — несолетворний оксид, він не взаємодіє з водою. За тиску 0,5 МПа і температури 120°С CO розчиняється в лугах (наприклад, у NaOH) з утворенням форміату натрію HCOONa. Дана сполука сильний відновник, однак відновні властивості він виявляє за підвищеної температури. Внаслідок взаємодії СО з хлором утворюється дуже отруйний газ фосген:
СО + С12 = СОС12.
Фосген здатний повільно гідролізувати:
СОС12 + 2Н2О = 2НС1 + Н2СО3.
Отже, фосген є хлорангідридом карбонатної кислоти. Під час нагрівання СО взаємодіє з сіркою, утворюючи сульфуроксид карбону:
СО + S = COS.
Під дією високої температури і тиску CO з воднем утворює метанол.
Перебіг вищезазначених реакцій зумовлений валентною ненасиченістю атома Карбону в оксиді карбону (ІІ).
У молекулі CO, на відміну від інших сполук Карбону, в атомі С є неподілена пара електронів. Тому молекула СО може виступати як ліганд у різних комплексних сполуках. На особливу увагу заслуговують карбоніли d-елементів: Сr(СО)6, Fe(CO)5, Ni(CO)4 тощо. Карбоніли — це діамагнітні сполуки, тобто під час їх утворення відбувається спарювання валентних електронів d-елементів. σ-Зв'язки у молекулах карбонілів утворюються за донорно-акцепторним механізмом за рахунок вільних орбіталей d-елементів і електронних пар молекул CO.
Оксид карбону (ІV) СО2 утворюється в природі під час окиснення органічних речовин, виділяється у великих кількостях з вулканічних тріщин і з мінералізованих джерел. У лабораторних умовах СО2 добувають дією кислот на карбонати:
СаСО3 + 2НС1 = СаС12 + Н2О + СО2↑.
Добувають оксид карбону (ІV) також випалюванням карбонату кальцію:
СаСО3 = СаО + СО2↑.
СО2 — безбарвний, важкий і негорючий газ із слабким кислуватим запахом і смаком, не підтримує горіння і дихання.
Під час взаємодії СО2 з водою утворюється слабка і нестійка двохосновна карбонатна кислота Н2СО3:
С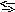 О2
+
Н2О
Н2СО3.
О2
+
Н2О
Н2СО3.
Рівновага цієї реакції зміщена вліво, тому більша частина розчиненого оксиду карбону (ІV) перебуває у вигляді СО2, а не Н2СО3.
Солі карбонатної кислоти — карбонати — мало розчинні у воді, за винятком карбонатів лужних металів, талію (І) та амонію.
У разі взаємодії з лугами оксид карбону (ІV) утворює два типи солей: карбонати (середні солі) і гідрогенкарбонати (кислі солі):
2NaOH + СО2 = Na2CO3 + Н2О;
NaOH + СО2 = NaHCO3.
Два типи солей карбонатної кислоти відомі лише для активних металів. Метали, що входять до складу слабких основ, утворюють лише основні карбонати. Так, для Купруму відома сіль СuСО3·Сu(ОН)2 (малахіт), для Бісмуту — (ВіО)2СО3 тощо. Основні карбонати у воді не розчиняються.
Під впливом СО2 здатні розчинятися карбонати кальцію, плюмбуму і феруму (ІІ), оскільки у цьому разі утворюються гідрогенкарбонати, розчинність яких більша, ніж карбонатів:
СаСО3 + СО2 + Н2О = Са(НСО3)2.
Під час нагрівання до 800 °С вуглець сполучається з сіркою з утворенням дисульфіду карбону (сірковуглецю) CS2:
С + 2S = CS2.
З сульфідами лужних металів та з лугами він утворює тіокарбонати:
Na2S + CS2 = Na2CS3;
4KOH + 3CS2 = 2K2CS3 + СО2 ↑+ 2H2O.
Під дією на тіокарбонати сильних кислот-неокисників виділяється тіокарбонатна кислота у вигляді оліїстої рідини жовтого кольору:
K2CS3 + 2НС1 = 2КС1 + H2CS3.
H2CS3 стійкіша сполука, ніж Н2СО3, проте теж розкладається на H2S і CS2.
З азотом вуглець сполучається важче, ніж із сіркою. Для утворення сполуки карбону з нітрогеном C2N2 необхідна дуже висока температура (температура електричної дуги):
2C+N2 = C2N2
Під час взаємодії з металами він утворює ціаніди, а в разі розчинення в лугах — дві солі: ціанід і ціанат:
C2N2 + 2NaOH = NaCN + NaOCN + H2O.
Тому диціан належить до псевдогалогенів.
Важливою сполукою карбону з нітрогеном є ціанідна, або синильна, кислота. Добути її можна з аміаку й оксиду карбону (ІІ):
NH3 + CO = HCN + Н2О.
Ця реакція відбувається за температури 500 °С і наявності каталізатора (А12О3, ТhO2).
Розчинні ціаніди внаслідок гідролізу мають лужну реакцію і пахнуть HCN:
К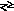
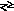 CN
+ Н2О
HCN
+ КОН.
CN
+ Н2О
HCN
+ КОН.
Ціанідна кислота і ціаніди містять карбон у ступені окиснення +2, тому вони порівняно легко окислюються. Так, при нагріванні розчини ціанідів поступово окислюються киснем повітря, утворюючи ціанати:
2 КCN
+ О2
КCNО,
КCN
+ О2
КCNО,
а при кип’ятінні розчинів ціанідів з сіркою утворюються тіоціанати (роданіди):
КCN + S КCNS.
Силіцій після оксигену — найпоширеніший елемент земної кори. Він є основою мінеральної оболонки нашої планети. Земна кора більш ніж наполовину складається з SiO2, силікатних і алюмосилікатних порід.
SiO2 трапляється як у кристалічній формі (кварц), так і у вигляді аморфних прихованокристалічних мінералів (яшма, агат, опал, кремінь).
Кварц трапляється поодинокими кристалами або невеликими скупченнями (нарости гірського кришталю), а також у вигляді зерен у граніті.
У лабораторних умовах силіцій добувають відновленням оксиду силіцію (ІV) магнієм:
SiO2 + 2Mg = Si + 2MgO.
У цьому разі утворюється бурий порошок аморфного силіцію. Процес сильно екзотермічний і супроводжується розжарюванням реакційної суміші.
У промисловості оксид силіцію (ІV) відновлюють вуглецем в електричній печі:
SiO2 + 2С = Si + 2СО.
Силіцій високого ступеня чистоти добувають відновленням тетрахлориду силіцію SiCl4 воднем або внаслідок термічного розкладання силану:
SiH4 = Si + 2Н2↑.
Додатково силіцій очищують методом зонної плавки.
Силіцій досить твердий, непрозорий, тугоплавкий (температура плавлення 1423°С), хімічно інертний. За кімнатної температури взаємодіє тільки з F2 і С12. Максимальна ковалентність силіцію як елемента третього періоду дорівнює шести, а стійкий валентний стан відповідає sр3-гібридизації валентних орбіталей. На відміну від карбону, sp2- і sp-гібридизовані стани силіцію нестійкі. У своїх сполуках атом силіцію виявляє ступені окиснення -4; 0;+4.
З хімічної точки зору Силіцій дещо ближчий до неметалів, ніж до металів. Аморфний Силіцій хімічно більш активний, ніж кристалічний. Аморфний і кристалічний Силіцій добре зберігаються на повітрі, майже не взаємодіють з водою, не розчиняються в індивідуальних кислотах, розчиняються у суміші концентрованої нітратної і фторидної кислот. Цей процес відбувається завдяки утворенню міцного комплексного йона [SiF6]2-:
3Si + 4HNO3 + 9H2F2 = 3H2[SiF6] + 4NO↑ + 8H2O.
Силіцій взаємодіє з лугами подібно до металів, оксиди яких амфотерні, з виділенням водню:
Si + 2NaOH + Н2О = Na2SiО3 + 2H2↑.
За високої температури Силіцій взаємодіє з багатьма металами з утворенням силіцидів. Силіциди також є продуктами взаємодії оксидів відповідних металів із Силіцієм в інертній атмосфері. Процес відбувається під час нагрівання:
2Mg + Si = Mg2Si;
6MnO + 5Si = 2Mn3Si + 3SiO2.
Силіциди активних металів CaSi2, Mg2Si тощо розкладаються кислотами-неокисниками і навіть водою з утворенням силанів:
Mg2Si + 4Н2О = 2Mg(OH)2 + SiH4↑.
Крім SiH4 відомі також інші силани: дисилан Si2H6, трисилан Si3H8.
Силан SiH4 — безбарвний газ, який самозаймається і згоряє в повітрі:
SiH4 + 2О2 = SiO2 + 2Н2О.
Силани реакційноздатні і належать до сильних відновників. На відміну від вуглеводнів, силани взаємодіють з водою за кімнатної температури:
SiH4 + (х + 2)Н2О = SiO2·xH2O + 4Н2↑.
Ще енергійніше відбувається цей процес у лужному середовищі:
SiH4 + 2NaOH + Н2О = Na2SiО3 + 4H2↑.
З галогенами силани взаємодіють з вибухом, утворюючи сполуку SiГ4. Силіцій з фтором за кімнатної температури утворює SiF4, з хлором — SiCl4.
Процес гідролізу SiF4 супроводжується комплексоутворенням:
SiF4 + 3Н2О = H2SiО3 + 4HF;
SiF4 + 2HF = H2[SiF6].
Гексафторосилікатна кислота H2[SiF6] — стійка у водному розчині, належить до сильних кислот.
Із штучних силікатів дуже важливим є тверде скло. Склад звичайного, або віконного, скла приблизно відповідає формулі Na2O·СаО·6SiO2. Його добувають сплавлянням суміші білого піску з содою та вапняком, або крейдою:
СаСО3 + Na2CO3 + 6SiO2 = CaO∙Na2О∙6SiO2+ 2СО2↑;
Якщо соду замінити на карбонат калію, то утворюється тверде тугоплавке калійне скло. Сплавлянням суміші карбонату калію, оксиду силіцію (ІV) й оксиду плюмбуму (ІІ) добувають кришталеве скло. Хімічне скло добувають частковим заміщенням оксиду силіцію (ІV) SiO2 на оксид бору В2О3.
За кімнатної температури кварц з лугами реагує повільно, у разі нагрівання швидкість реакції зростає:
SiO2 + 2NaOH = Na2SiО3 + H2O.
Силікати натрію, що утворюються, мають різні склад і будову залежно від умов проведення реакції, тому формула Na2SiО3 умовна.
SiO2 — кислотний оксид, йому відповідають мало розчинні у воді силікатні кислоти, що мають загальну формулу nSiO2·mH2O. У разі добавляння кислот до розчину силікату натрію утворюється драглистий осад — гель силікатної кислоти змінного складу:
Na2SiО3 + H2SO4 + (m - 1)Н2О = SiO2·mH2O + Na2SO4.
Кислоти, що відповідають оксиду силіцію (ІV) як ангідриду, можна розділити на три групи: метасилікатні, або поліметасилікатні (H2SiО3)n, ортосилікатні H4SiO4 та полісилікатні H6Si2О7, H4Si3О8. Всі силікатні кислоти — тверді безбарвні речовини, які можна добути із силікатів (їхніх солей) у вигляді драглистих осадів. Силікатні кислоти — слабкі, вони осаджуються з розчину під дією СО2 на розчини силікатів.
Силікатні кислоти дуже погано розчиняються у воді, однак вони добре змочуються нею. Полімета-, орто- та полісилікатні кислоти за певних умов утворюють з водою суміші, які на перший погляд подібні до звичайних розчинів. Проте ці розчини не однорідні, це системи, в яких розчинена речовина перебуває у розчиннику не у вигляді йонів або молекул, а у вигляді великих агрегатів молекул розміром від 1 до 100 нм. Такі розчини називаються колоїдними, або золями. За допомогою стабілізаторів можна добути стійкі золі силікатних кислот високої концентрації. За відсутності стабілізаторів золь силікатної кислоти переходить у гель — затверділий колоїдний розчин, який утворюється внаслідок злипання колоїдних часточок з одночасним захопленням ними молекул розчинника.
Більшість солей силікатної кислоти практично не розчинні у воді. Винятком є силікати натрію Na2SiО3 і калію K2SiО3, які дістали назву розчинного скла.
SiO2 + 2NaOH = Na2SiО3 + H2O;
SiO2 + К2СО3 = K2SiО3 + СО2↑.
Оскільки Na2SiО3 і K2SiО3 є солями дуже слабких кислот, у водних розчинах вони сильно гідролізують.
Лабораторна робота
Дослід 1. Адсорбційні властивості активованого вугілля
Воду у пробірці підфарбувати фуксином, внести 1-2 мікрошпателя активованого вугілля. Вміст пробірки перемішати скляною паличкою. Дати розчину відстоятися. Відмітить зміну його забарвлення.
Дослід 2. Відновні властивості вугілля.
У суху пробірку внести невеличку кількість деревного вугілля, додати декілька крапель концентрованої сульфатної кислоти і нагріти. Який газ виділяється? Написати рівняння реакції.
Дослід 3. Одержання солей карбонатної кислоти
а). У пробірку з
5-6 краплями вапнякової води – розчину
![]() - пропустити вуглекислий газ. Спостерігати
утворення білого осаду. Продовжувати
пропускати
- пропустити вуглекислий газ. Спостерігати
утворення білого осаду. Продовжувати
пропускати
![]() до повного розчинення осаду. Написати
рівняння відповідних реакцій.
до повного розчинення осаду. Написати
рівняння відповідних реакцій.
б). Одержаний розчин
![]() розлити у дві пробірки. Одну з них
підігріти, у другу – додати вапнякової
води. В обох випадках випадає білий
осад. Написати рівняння реакцій.
розлити у дві пробірки. Одну з них
підігріти, у другу – додати вапнякової
води. В обох випадках випадає білий
осад. Написати рівняння реакцій.
Дослід 4. Гідроліз солей
а). Випробувати дію розчину натрій карбонату та натрій гідроген карбонату на нейтральний розчин лакмусу. Написати рівняння реакцій гідролізу відповідних солей в молекулярній та йонних формах. Яка сіль у найбільшій мірі піддається гідролізу?
б). У пробірку з 3-4 краплями розчину натрій карбонату додати 1 краплю фенолфталеїну, а потім краплями розчин алюміній сульфату до знебарвлення фенолфталеїну та утворення осаду. Написати в молекулярній та йонній формі рівняння реакцій гідролізу.
Дослід 5. Отримання аморфного силіцію та силанів
(Роботу виконувати за склом витяжної шафи)
Насипати в пробірку 1/3 її об’єму суміш порошку магнію та ретельно подрібненого чистого сухого піску (у співвідношенні 4:5). Потім закріпити пробірку вертикально в штативі. Трохи підігріти дно пробірки до тих пір, доки суміш не розжариться. Написати рівняння реакції, приймаючи до уваги, що крім силіцію і магній оксиду утворюється також трохи магній силіциду.
Після охолодження пробірку з продуктами реакції розбити в ступці і отриману масу невеликими порціями пересипати у склянку з розбавленим розчином (1:1) хлоридної кислоти, стежачи за виділенням газу, що спалахує на повітрі. Які продукти суміші взаємодіють з хлоридною кислотою? Написати рівняння реакцій взаємодії магній оксиду і магній силіциду з розчином хлоридної кислоти. Оцінити відновні властивості силану, приймаючи до уваги, що білий дим, який при цьому виділяється – продукт горіння силану. Зробити висновок про відношення силіцію до розведеного розчину хлоридної кислоти.
Після закінчення реакції змити рідину з осаду аморфного силіцію. Осад промити водою, відфільтрувати і висушити. Відзначити його колір і зберегти для наступного досліду.
Дослід 6. Взаємодія силіцію з лугами
Невеличку порцію
аморфного силіцію, який отримали в
попередньому досліді, нагріти у пробірці
з 1-2 мл концентрованого розчину
![]() або
або![]() .
Що при цьому спостерігається? Переконатися,
що газ, який виділяється при цьому –
водень. Написати рівняння відповідної
реакції.
.
Що при цьому спостерігається? Переконатися,
що газ, який виділяється при цьому –
водень. Написати рівняння відповідної
реакції.
Дослід 7. Отримання силікатної кислоти
а). Отримання гелю силікатної кислоти.
У пробірку налити 5 крапель концентрованого розчину натрій силікату і додати удвічі більший об’єм хлоридної кислоти (1:1). Суміш добре перемішати і спостерігати утворення драглистої силікатної кислоти. Написати рівняння реакції.
Дослід 7. Гідроліз солей силікатної кислоти
а). В пробірку з 3-4 краплями розчину натрій силікату додати 1-2 краплі фенолфталеїну. Відмітити, що спостерігається?
б). У пробірку з 3-4 краплями розчину натрій силікату додати 1 краплю фенолфталеїну, а потім краплями розчин амоній хлориду до знебарвлення фенолфталеїну та утворення осаду. Написати йонні та молекулярні рівняння гідролізу натрій силікату у воді та за наявності амоній хлориду.
