
Лекции ТМП / Лекция_8
.pdf
8 ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ ГАЗООБРАЗНЫМИ ВОССТАНОВИТЕЛЯМИ
8.1 Общая термодинамическая характеристика реакций восстановления
В общем виде реакция между оксидом металла и восстановителем (В)
может быть описана уравнением
MeO + B = BO + Me . |
(8.1) |
Реакцию (8.1) можно рассматривать как результат последовательного протекания следующих частных реакций
MeO = Me + 0,5O , |
− ΔGo |
2 |
MeO |
B + 0,5O = BO . |
ΔGo |
2 |
BO |
В соответствии с принятой схемой
ΔGo |
= ΔGo |
− ΔGo . |
(8.2) |
8.1 |
BO |
MeO |
|
Если вещества взаимодействуют в стандартных состояниях, с учетом со-
отношения
ΔGo = − RT ln K |
p |
, |
(8.3) |
|
|
|
выражение (8.2) можно привести к виду
ln K8.1 |
= ln K BO |
= 0,5 ln P
O (MeO)
2
Из формулы (8.4) получим
− ln KMeO |
= |
− ln P . (8.4)
O (BO)
2
|
|
P |
|
|
K8.1 |
= |
O2(MeO) |
. |
(8.5) |
P |
||||
|
|
O2(BO) |
|
|
Из формул (8.2) и (8.5) видно, что направление протекания реакции (8.1)
в стандартных условиях можно установить, исходя из соотношения стандарт-
ных значений изменения энергии Гиббса реакций образования оксидов металла
2
и восстановителя или соотношения величин упругости диссоциации этих ве-
ществ. |
|
|
|
|
|
Если | Go |
| > | |
Go |
| и P |
< P |
, реакция (8.1) будет |
BO |
|
MeO |
O2(BO) |
O2(MeO) |
|
протекать в направлении образования оксида восстановителя и восстановления металла, то есть в направлении образования более прочного оксида. При этом,
чем больше различие между P |
|
и P |
|
, тем больше численное зна- |
||||||
|
|
|
O2(MeO) |
|
O2(BO) |
|
|
|
||
чение константы равновесия реакции и полнота превращения. |
||||||||||
Если | Go |
| = | |
Go |
|
| и P |
|
|
= P |
|
|
, система находится в |
BO |
|
MeO |
O2(BO) |
O2(MeO) |
|
|||||
состоянии термодинамического равновесия. |
|
|
|
|
||||||
Если | Go |
| < | |
Go |
| и P |
|
> |
P |
|
, произвольное протека- |
||
BO |
|
MeO |
|
O2(BO) |
|
O2(MeO) |
|
|
||
ние реакции (8.1) возможно только в направлении окисления металла.
Если реакция (8.1) протекает в условиях, отличающихся от стандартных,
вывод направлении реакции также может быть получен из соотношения вели-
чин изменения энергии Гиббса реакций образования оксидов металла и восста-
новителя или значений равновесного парциального давления кислорода в газо-
вой фазе для этих реакций.
8.2Термодинамическая характеристика реакций восстановления оксидов газами
Для восстановления твердых оксидов широко используются газообразные реагенты, которые по трещинам и порам легко проникают внутрь кусков вос-
станавливаемого материала и обеспечивают протекание реакции на наружной и внутренней его поверхности.
Далее основные закономерности восстановления оксидов металлов газо-
образными восстановителями будут показаны на примере восстановления ок-
сида двухвалентного металла оксидом углерода по реакции

|
3 |
MeO + CO = Me + CO2 . |
(8.6) |
В соответствии с ранее принятой схемой реакцию (8.6) можно рассматри-
вать как результат последовательного протекания частных реакций диссоциа-
ции оксида на металл и газообразный кислород и горения оксида углерода. То-
гда в соответствии с законом Гесса
H o |
= H o |
− H o |
= − 282695 − H o |
Дж/моль. |
8.6 |
CO |
MeO |
MeO |
|
Из последнего соотношения можно видеть, что реакция (8.6) может быть
как экзотермической, так и эндотермической. Если изменение энтальпии реак-
ции образования оксида металла | H MeOo | < 282695 Дж/моль, реакция (8.6) бу-
дет экзотермической и наоборот.
Так как реакция (8.6) протекает практически без изменения объема взаи-
модействующих веществ, при сравнительно низких давлениях влиянием изме-
нения давления на протекание реакции можно пренебречь.
Константа равновесия реакции (8.6) определяется из выражения
|
|
a |
Me |
× P |
|
|
||
K8.6 |
= |
|
|
|
CO2 |
. |
(8.7) |
|
a |
MeO |
× P |
||||||
|
|
|
CO |
|
|
|||
Если металл и оксид металла участвуют в реакции как чистые вещества, перей-
дя от парциальных давлений газов к их объемным концентрациям, получим
|
= |
(%CO2) p |
|
K8.6 |
(%CO) p . |
(8.8) |
Если реакция (8.6) является экзотермической, при повышении температу-
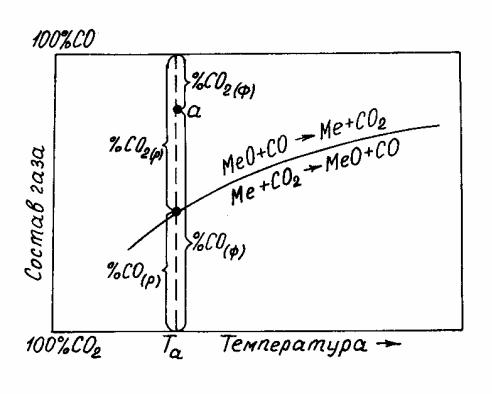
ры константа равновесия реакции уменьшается. При этом, как показано на ри-
сунке 8.1, в равновесной газовой смеси увеличивается содержание СО, а со-
держание СО2 уменьшается.
В каждом конкретном случае вывод о направлении реакции (8.6) может быть получен, исходя из величины изменения энергии Гиббса
|
|
|
(%CO ) |
|
(%CO |
) |
p |
|
|
|
ΔG |
= |
RT ln |
2 ф |
− ln |
2 |
|
|
. |
(8.9) |
|
|
|
|
|
|
||||||
8.6 |
|
|
(%CO) |
|
(%CO) |
|
|
|
|
|
|
|
|
ф |
|
|
|
p |
|
|
|
4
Из уравнения (8.9) видно, что направление реакции определяется соотноше-
ниями фактических и равновесных концентраций СО и СО2 в газовой фазе. Ес-
ли
(%CO2 )ф |
< |
(%CO2 )р |
, |
(8.10) |
|
(%CO) |
|
(%CO)р |
|||
|
|
|
|
||
ф |
|
|
|
|
|
изменение энергии Гиббса реакции является отрицательной величиной. Смесь такого состава будет восстановительной по отношению к оксиду. На рисунке
8.1 системам, в которых выполняется условие (8.10), соответствует область,
расположенная выше равновесной кривой.
Область ниже равновесной кривой соответствует системам, газовая фаза которых по отношению к металлу является окислительной.
8.3 Условия восстановления различных оксидов
Реакция (8.6) находится в состоянии термодинамического равновесия, ес-
ли выполняется условие P |
= P |
|
|
. Для реакции горения оксида |
||||
O2(MeO) |
|
O2(CO2 ) |
|
|
|
|
||
углерода |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
P |
= |
|
(%CO2 )p |
|
. |
(8.11) |
||
|
|
2 |
||||||
O (CO ) |
|
K |
2 |
|
|
|
|
|
2 2 |
|
CO2 |
×(%CO)p |
|
|
|||
|
|
|
|
|
|
|
|
|
Из уравнения (8.11) видно, что, изменяя содержание СО и СО2, можно полу-
чить газовую фазу, которая будет восстановительной для любого оксида.
При неизменной температуре увеличение прочности оксида приводит к изменению состава равновесного газа в направлении уменьшения концентра-
ции окислителя (СО2) и увеличения концентрации восстановителя (СО).
В зависимости от прочности оксиды принято подразделять на следующие группы:
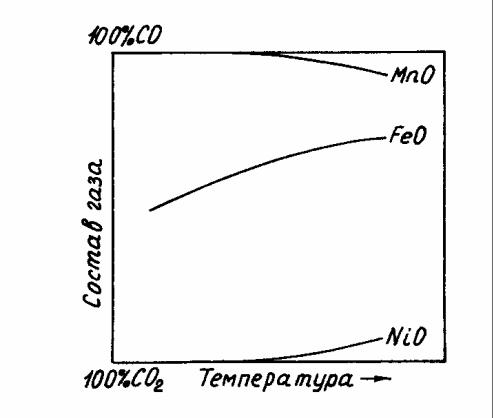
5 1. К легковосстановимым относят оксиды, которые являются менее проч-
ными, чем низший оксид железа FeO. К их числу относят Cu2O, NiO, CoO,
Fe2O3, Mn2O3, MnO2 и др. Реакции восстановления оксидов этой группы яв-
ляются практически необратимыми, экзотермическими реакциями. Константы равновесия реакции (8.6) для этих оксидов очень велики, а состав равновесной газовой фазы приближается к 100% СО2 (рисунок 8.2).
2. Ко второй группе относят оксиды близкие по прочности к FeO. К их числу относят Fe3O4, Mn3O4, WO2, MoO2 и др. Реакции восстановления окси-
дов этой группы являются обратимыми, слабыми экзотермическими или сла-
быми эндотермическими реакциями. Для этих оксидов константы равновесия реакции (8.6) близки к единице, а равновесной газовой фазе присутствуют со-
измеримые количества СО и СО2.
3. К трудно восстановимым относят оксиды, которые являются значи-
тельно более прочными, чем FeO. К их числу относят MnO, SiO2, Al2O3, CaO,
MgO и др. Реакции восстановления оксидов этой группы являются эндотерми-
ческими. Для этих оксидов константы равновесия реакции (8.6) очень малы, а
состав равновесной газовой фазы приближается к 100% СО. Например, для восстановления оксида MnO при 1000К содержание СО2 в газовой фазе не
должно превышать 7 ×10-6%.
8.4 Минимальный расход газообразного восстановителя
Восстановление оксидов металлов оксидом углерода принято описывать уравнением реакции (8.6), согласно которому для восстановления 1 моля окси-
да необходим 1 моль СО. Однако такая запись уравнения реакции не совсем корректна, так как после полного восстановления оксида газовая фаза содержит
100% СО2 и является окислительной по отношению к любому металлу.
6
Окисления восстановленного металла можно избежать, если образовав-
шаяся в результате реакции газовая фаза по отношению к металлу будет вос-
становительной. Для этого СО потребуется в большем количестве, а процесс восстановления будет описываться уравнением реакции
MeO + nCO = Me + |
|
CO2 |
+ (n −1 )CO . |
(8.12) |
|||
Расход восстановителя будет минимальным, если газовая фаза из 1 моля |
|||||||
СО2 и (n-1) моля СО будет равновесной для реакции (8.6), то есть |
|
||||||
K8.6 |
= |
1 |
|
|
. |
|
(8.13) |
|
|
|
|
||||
nmin |
|
|
|
||||
|
|
−1 |
|
|
|||
Из уравнения (8.13) получим |
|
|
|
|
|
|
|
nmin |
= 1 + |
1 |
. |
(8.14) |
|||
|
|
|
|||||
|
K8.6 |
||||||
|
|
|
|
|
|
||
Для легковосстановимых оксидов константы равновесия реакции (8.6)
имеют большие значения, поэтому минимальный расход восстановителя близок к стехиометрическому.
Для оксидов второй группы константы равновесия реакции (8.6) близки к единице. При этом минимальный расход газообразного восстановителя сущест-
венно отличается от стехиометрического. Например, константа равновесия ре-
акции восстановления FeO при 1000К равна 0,624. Согласно уравнению (8.14)
для восстановления 1 моля оксида потребуется 2,6 моля СО.
Для трудно восстановимых оксидов константы равновесия реакции (8.6)
очень малы. Поэтому минимальный расход восстановителя является очень вы-
соким.
Например, для полного восстановления 1 моля MnO при 1000К потребу-
ется 1,4×106 молей СО. Такой большой расход восстановителя обычно обеспе-
чить не удается, поэтому на практике процесс восстановления с использовани-
ем газообразных восстановителей может быть реализован только для оксидов первой и второй групп.
7
Полученные выше выводы справедливы также при восстановлении окси-
дов металлов водородом и другими газами.
8
Рисунок 8.1 – Зависимость состава равновесной газовой фазы от температуры
для экзотермической реакции восстановления оксида металла ок-
сидом углерода
9
Рисунок 8.2 – Зависимость состава равновесной газовой фазы от температуры
для реакций восстановления различных оксидов оксидом углеро-
да
