
- •Министерство сельского хозяйства рф
- •Раздел 1 Техническая термодинамика
- •Глава 1 Законы термодинамики
- •1.2. Законы термодинамики
- •Глава 2 термодинамические свойства рабочих тел
- •2.1. Рабочее тело тепловых машин
- •2.2. Теплоемкость гав и газовых смесей
- •2.3. Термодинамические процессы
- •Глава 3 пар и влажный воздух
- •3.1. Парообразование жидкостей
- •3.2. Влажный воздух
- •Глава 4 термодинамика газового потока
- •4.1. Уравнения и параметры движущегося газа
- •4.2. Течение газа в каналах
- •Глава 5 Циклы тепловых машин
- •5.1. Цикл Карно
- •5.2. Идеальные циклы поршневых двс
- •5.3. Идеальный цикл газотурбинного двигателя
- •15.4. Цикл паросиловой установки
- •5.5. Цикл универсальной тепловой машины Стирлинга
- •5.6. Циклы компрессоров
- •5.7. Циклы холодильных машин
- •Раздел II Основы теории теплообмена
- •Глава 6. Теплопроводность
- •6.1. Терминология теплообмена
- •6.2. Сущность теплопроводности
- •6.3. Стационарная теплопроводность
- •6.4 Понятие о решении задач нестационарной теплопроводности
- •Глава 7 Конвективный теплообмен
- •7.1. Теплоотдача
- •7.2. Основы теории теплового подобия
- •7.3. Теплоотдача при естественной конвекции
- •7.4. Теплоотдача при вынужденной конвекции
- •7.5. Теплоотдача при изменении агрегатного состояния
- •Глава 8 Лучистый теплообмен
- •8.1. Закономерности лучистого теплообмена
- •8.2. Лучистый теплообмен между телами, разделенными
- •8.3. Лучистый теплообмен в камерах сгорания
- •Теплопередача и теплообменные аппараты
- •9.1. Уравнение теплопередачи
- •9.2. Теплопередача через плоскую и цилиндрическую стенки
- •9.3. Теплопередача через оребренную стенку
- •9.4. Интенсификация теплопередачи
- •9.5. Тепловая защита
- •9.6. Теплообменные аппараты
- •9.7 Тепловые трубы
- •Приложение
- •Соотношения между единицами давления
- •Теплофизические свойства металлов и сплавов
Раздел 1 Техническая термодинамика
Слово “термодинамика” в переводе с греческого – движущая сила тепла (“терме” – тепло, жар, огонь; “динамис” – сила, работа). Впервые это словосочетание в указанном смысле применил французский инженер
С. Карно (1796-1832) в своей работе “Размышления о движущей силе огня и о машинах, способных развивать эту силу”, опубликованной в 1824 г.
Термодинамике этого периода отводилась роль науки, изучающей переход теплоты в механическую работу, что диктовалось необходимостью создания теоретических основ работы тепловых машин. Она развивалась, когда еще не сложились представления о внутренней структуре материи. Поэтому методы исследования основывалась на изучении самых общих зависимостей между физическими величинами, которые можно было определить непосредственными измерениями, не прибегая к анализу взаимодействия между отдельными частицами материи. Уже к концу ХIХ столетия сформулировались основные понятия и законы термодинамики. Это явилось отправным пунктом для построения логического и математического аппарата - т е р м о- д и н а м и ч е с к о г о м е т о д а исследования явлений, происходящих в материальных системах при взаимопреобразованиях теплоты и работы. Таким образом, сущность т е р м о д и н а м и ч е с к о г о метода состоит в анализе условий и установлении количественных связей между физическими величинами в системах, служащих для взаимного преобразования различных видов энергии.
.Раздел теоретической физики, в котором физические свойства макроскопических систем изучаются с помощью термодинамического метода, именуют т е р м о д и н а м и к о й. Строго говоря, термодинамика – это наука о наиболее общих свойствах макроскопических физических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими системами. То направление термодинамики, где рассматриваются процессы в энергетических системах и установках, связанные с такими формами энергообмена, как т е п л о т а и р а б о т а, а также свойства тел, участвующих в этих процессах, именуется т е х н и ч е ск о й т е р м о д и н а м и к о й.
Развитие технической термодинамики связано с такими именами отечетственнных и зарубежных ученых, как Михаил Васильевич Ломоносов, Дмитрий Иванович Менделеев, Александр Александрович Радциг, Вячеслав Владимирович Сушков, Василий Игнатьевич Гриневецкий, Михаил Петрович Вукалович, Андрей Станиславович Ястржемский, Николай Леонард Сади Карно, Бенуа Поль Эмиль Клапейрон, Роберт Майер, Джеймс Прескотт Джоуль, Виллиам Томсон (Кельвин), Рудольф Клаузиус, Уильям Джон Ренкин и др
Глава 1 Законы термодинамики
Исходные определения и понятия
1.1.1. Термодинамическая система
Материальное тело, выделенное в качестве объекта исследования термодинамическим методом, называется т е р м о д и н а м и ч е- с к о й с и с т е м о й.
За термодинамическую систему может приниматься и совокупность материальных тел, способных взаимодействовать между собой и с другими телами.
Все, что не включено в систему, но может взаимодействовать с ней (обмениваться энергией и веществом), представляет собой о к р у ж а ю- щ у ю с р е д у. Поверхность раздела между системой и окружающей средой принято называть к о н т р о л ь н о й п о в е р х н о с т ь ю. Термодинамическая система формируется в соответствии с решаемой задачей. Пространственные размеры термодинамической системы и время ее существования предполагаются достаточными для проведения измерений. Примерами термодинамических систем могут служить: газ в цилиндре поршневого компрессора; продукты сгорания в тракте газотурбинного двигателя; хладагент в агрегатах паровой компрессорной холодильной машины и т.д.
В зависимости от возможных способов изоляции системы от внешней среды различают несколько видов термодинамических систем. Если термодинамическая система обменивается с окружающей средой веществом, то такую систему называют о т к р ы т о й. У закрытых систем обмен веществом отсутствует. Среди закрытых систем выделяют э н е р г о и з о л и р о- в а н н ы е – такие, которые не обмениваются с окружающей средой никакими видами энергии. Кроме того, закрытые системы могут быть а д и а- б а т н ы м и – они не обмениваются с окружающей средой энергией только в форме теплоты.
Строго говоря, понятия изолированных и адиабатных систем являются абстрактными. Необходимо отметить, что использование научных абстракций при анализе свойств исследуемых систем является характерным для термодинамики.
Тела, входящие в термодинамическую систему, могут находиться в твердом, жидком, газообразном и ионизированном фазовых состояниях. Термодинамическую систему, состоящую из одной фазы, называют г о м о-
г е н н о й, а систему, состоящую из различных фаз, разграниченных поверхностями раздела, – г е т е р о г е н н о й.
В ообще
говоря,любую
термодинамическую систему следует
рассматривать как совокупность
микрочастиц (агрегатов молекул, молекул,
атомов, электронов и т.д.). Все частицы
находятся в состоянии движения, и между
ними существуют силы взаимодействия.
У тел в твердом состоянии силы взаимного
притяжения молекул очень велики,
вследствие чего тело имеет определенную
форму. У тел в жидком состоянии
межмолекулярные связи ослаблены до
такой степени, что тело принимает форму
сосуда, в котором оно находится. В
газообразных телах молекулы находятся
на столь больших расстояниях друг от
друга, что межмолекулярные силы весьма
малы, и поэтому газ стремится к
беспредельному расширению.
ообще
говоря,любую
термодинамическую систему следует
рассматривать как совокупность
микрочастиц (агрегатов молекул, молекул,
атомов, электронов и т.д.). Все частицы
находятся в состоянии движения, и между
ними существуют силы взаимодействия.
У тел в твердом состоянии силы взаимного
притяжения молекул очень велики,
вследствие чего тело имеет определенную
форму. У тел в жидком состоянии
межмолекулярные связи ослаблены до
такой степени, что тело принимает форму
сосуда, в котором оно находится. В
газообразных телах молекулы находятся
на столь больших расстояниях друг от
друга, что межмолекулярные силы весьма
малы, и поэтому газ стремится к
беспредельному расширению.
В данном разделе будут рассматриваться в основном гомогенные системы, состоящие из газообразной фазы.
Совокупность физических свойств, присущих рассматриваемой системе, называют с о с т о я н и е м системы. Величины, характеризующие физические свойства, именуют п а р а м е т р а м и с о с т о я н и я. В зависимости от способа определения их численных значений параметры состояния делятся на т е р м о д и н а м и ч е с к и е и к а л о р и ч е с к и е.
К термодинамическим относят те параметры состояния, которые определяются путем измерений (давление, температура, объем).
Калорические параметры также описывают состояние системы, но их значения определяются только расчетным путем (например, энтальпия, энтропия и др.). Особенностью калорических параметров является то, что их изменение зависит только от начальных и конечных состояний системы. По этой причине калорические параметры состояния еще называют ф у н к-
ц и я м и состояния.
Параметры состояния обладают либо свойствами и н т е н с и в н о с-
т и, либо свойствами э к с т е н с и в н о с т и (а д д и т и в н о с т и).
Интенсивный (с лат. – усиленный) параметр как для всей системы, так и для отдельных ее частей одинаков, он не зависит от количества вещества в системе. К интенсивным параметрам состояния относят температуру, давление и др.
Экстенсивный или аддитивный (с лат. – получаемый сложением) – это тот параметр системы, который вычисляется как сумма идентичных параметров отдельных ее частей. Так как количество вещества в системе равно сумме количеств веществ отдельных ее частей, то термодинамические параметры, пропорциональные количеству вещества в данной части системы, относятся к экстенсивным. Примерами экстенсивных параметров состояния являются внутренняя энергия, энтропия и др.
Будучи отнесены к количеству вещества, экстенсивные величины перестают зависеть от размеров системы, и приобретают свойства интенсивных величин.
Для выражения значений термодинамических величин следует использовать основные и производные, кратные и дольные величины Международной системы единиц (СИ). В табл.1 Приложения приведены основные и производные единицы величин, используемые в теплотехнике.
1.1.2. Термодинамические параметры
К термодинамическим параметрам состояния относят т е м п е р а т у- р у, д а в л е н и е, у д е л ь н ы й о б ъ е м и п л о т н о с т ь.
Температура
Понятие температуры является одним из важнейших в теплотехнике. С молекулярно-кинетической точки зрения температура характеризует интенсивность движения структурных частиц системы. Более строгое определение температуры как физической величины дается при рассмотрении второго закона термодинамики.
Температура – это термодинамический параметр, определяющий тепловое состояние системы. Численное значение температуры является мерой отклонения состояния данного тела от теплового равновесия с другим телом, состояние которого принято за начало отсчета.
Температура системы измеряется с помощью различных по принципу действия термометрических устройств. При этом на шкалах этих устройств регистрируется не интенсивность теплового движения микрочастиц, а изменение физического свойства чувствительного элемента, находящегося в тепловом соприкосновении с системой, например, изменение объема жидкости или газа при нагревании; зависимость электрического сопротивления металла от температуры и др. Шкала таких устройств имеет температурную градуировку. Градуировка производится путем деления разности показаний устройства в двух произвольно выбранных постоянных температурных точках на некоторое число равных частей, называемых г р а д у с а м и. Так как выбор постоянных температурных точек произволен, то существует несколько температурных шкал. Для численного определения температуры в единицах СИ установлено две температурные шкалы: т е р м о д и н а м и ч е с= к а я и Международная п р а к т и ч е с к а я (МПТШ) с одинаковой ценой деления шкалы – градусом.
В термодинамической температурной шкале за начало отсчета принимается наинизшая температура, при которой возможно полное прекращение теплового движения микрочастиц. Эта точка отсчета называется а б с о -
л ю т н ы м н у л е м температуры. Термодинамическая температура обозначается Т, за единицу температуры принят кельвин (К).
По МПТШ за нуль отсчета принимается температура тройной точки воды; за 100 делений шкалы – температура точки кипения воды. Эта градуировка соответствует температурной шкале, предложенной в 1742 г. шведским физиком А. Цельсием, по которой температура обозначается t и за единицу принимается градус Цельсия (оС).
Эталлон градуса основывается на одиннадцати реперных точках с фиксированными значениями температуры. Это температуры фазовых равновесий между жидкостью и паром или жидкостью и твердой фазой чистых веществ при нормальном атмосферном давлении. Ниже приведены температуры ряда реперных точек:
точка кипения водорода – 252,87 0С;
точка кипения кислорода – 182,96 0С;
тройная точка воды + 0,01 0С;
точка кипения воды +100,00 0С;
точка затвердевания цинка +419,58 0С;
точка затвердевания золота +1064,43 0С.
Связь между температурами по установленным шкалам имеет вид:
T = t + 273, 15 (1.1)
В некоторых странах находят применение и другие шкалы: темпера- турная шкала, выраженная в градусах Фаренгейта (0F) и температурная шкала, выраженную в градусах Ренкина (0R). Соотношения между значениями температуры, выраженными в градусах Цельсия (t, 0C), в кельвинах (Т, К), в градусах Фаренгейта (tF, 0F) и в градусах Ренкина (TR, 0R), таковы:
t = T – 273, 15 = (tF – 32)/1, 8 = (TR / 1, 8) – 273, 15. (1.2)
Давление
Давление – физическая величина, характеризующая интенсивнсть
нормальных сил, с которыми одно тело действует на поверхность другого.
В
газах и жидкостях давление создается
в результате воздействия структурных
частиц на контрольную поверхность
системы. Величина давления оценивается
силой, приходящейся на единицу поверхности,
при условии, что сила равномерно
распределена по поверхности и направлена
по нормали к ней.

 Давление
обозначается p,
за его единицу в СИ принят паскаль
(Па).
Давление
обозначается p,
за его единицу в СИ принят паскаль
(Па).
Паскаль равен давлению, вызываемому силой 1Н, действующей на поверх -

 ность
1 м2
. Величина силы в 1Н = 1 кг · 1 м/с 2
= 1(кг· м)/с2
.
ность
1 м2
. Величина силы в 1Н = 1 кг · 1 м/с 2
= 1(кг· м)/с2
.
Д
Рис.
1.1
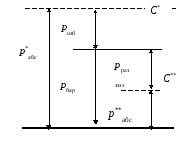
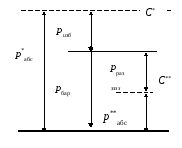
и з б ы т о ч н ы м (ризб), а недостающее до атмосферного – р а з р я ж е н и е м (рраз). На рис. 1.1 наглядно представлена связь указанных давлений в системе С*, где р *абс.> рбар., и в системе С**, где р**абс.< рбар. Отсюда
р*абс = ризб + рбар и р**абс = рбар – рраз .
Иногда используются внесистемные единицы давления: бар; мм рт.ст.; мм вод. ст.; техническая атмосфера (ат); физическая атмосфера (атм ). Численные соотношения между единицами давления приведены в табл.2 Приложения. Ниже внесистемные единицы выражены через паскаль.
1 бар = 1 ×105 Па = 1× 105 Н/м2; 1 мм рт.ст. = 133,3 Па; 1 1 мм вод. ст. = 9,81 Па; 1 бар = 750 мм рт.ст.;
1ат = 1 кг/см2 = 735,6 мм рт.ст. = 0,981 × 105 Па;
1атм = 1,033 кг/см2 = 760 мм рт.ст. = 1,013 × 105 Па.
Удельный объем
Удельный объем – физическая величина, равная отношению объема системы к ее массе:
v
=V/m,
где v – удельный объем, м3 /кг;
m – масса, кг.
Плотность
Плотность
– физическая величина, равная отношению
массы системы к ее объему:
![]() =
m/V,
=
m/V,
где
![]() – плотность, кг/м3.
– плотность, кг/м3.
. Очевидно, что плотность системы – величина, обратная ее удельному объему.
Массу системы и ее объем, как правило, не относят к параметрам состояния, но определенные с их помощью v и ρ являются термодинамическими параметрами.
1.1.3. Состояние термодинамической системы
Состояние термодинамической системы описывается совокупностью термодинамических и калорических параметров, по которым можно отличить данную систему от других, а также проследить за изменениями, возникающими в системе при ее взаимодействии с окружающей средой.
Если термодинамическая система закрытая и энергоизолированная, то с течением времени внутри системы между различными ее частями прекращается обмен энергией и веществом, одноименные параметры во всех точках системы принимают одинаковое значение. Такое состояние системы называется р а в н о в е с н ы м. При невыполнении указанных условий состояние системы является н е р а в н о в е с н ы м.
П онятие
равновесного состояния играет в
термодинамике чрезвычайно важную роль:
только равновесные состояния
термодинамических систем и их изменения
могут быть количественно описаны
методами термодинамики.
онятие
равновесного состояния играет в
термодинамике чрезвычайно важную роль:
только равновесные состояния
термодинамических систем и их изменения
могут быть количественно описаны
методами термодинамики.
Для задания состояния термодинамической системы иногда используют так называемые “н о р м а л ь н ы е ф и з и ч е с к и е у с л о в и я” (НФУ) или “н о р м а л ьн ы е т е х н и ч е с к и е у с л о в и я” (НТУ).
При нормальных физических (атмосферных) условиях значения температуры и давления равны соответственно t = 0 оС, р = 760 мм рт.ст.
При нормальных технических условиях t = 15 оС и р =735,6 мм рт.ст.
Как отдельные, так все параметры системы могут изменяться. Всякое изменения, происходящее в системе и связанное с изменением хотя бы одного из ее параметров состояния, называется т е р м о д и н а м и ч е с к и м
п р о ц е с с о м.
Процесс
изменения состояния системы, который
может происходить в случае какого-либо
взаимодействия с окружающей средой,
представляет собой
отклонение от состояния равновесия.
Если процесс изменения состояния системы
протекает так медленно, что в системе
в каждый момент времени успевает
установиться практически равновесное
состояние, то его можно назвать к в а з
и р а в н о в е с н ы м п р о ц е с с о м.
Степень приближения квазиравновесного
процесса к чисто равновесному будет
тем больше, чем медленнее изменяется
состояние системы.
Равновесные процессы изменения состояния характеризуются определенными зависимостями термодинамических параметров и поэтому допускают графическое изображение.
Среди различных термодинамических процессов особый интерес представляют так называемые “з а м к н у т ы е” (или к р у г о в ы е) процессы, при которых система, пройдя через ряд последовательных состояний, возвращается в начальное состояние.
1.1.4. Энергия термодинамической системы
Энергия
Понятие энергии неразрывно связано с материей. Все, что нас окружает, что воспринимается человеком и существует независимо от него, это материя. Необходимым условием существования материи является движение. И если масса служит количественной характеристикой материи, то энергия является физической мерой ее движения.
Э н е р г и я – это общая количественная мера движения и взаимодействия всех видов материи.
Исторически же сложилось так, что энергию стали классифицировать по формам движения. Механической форме движения соответствует кинетическая энергия; соединению и разложению молекул – химическая энергия; перемещению электронов в проводниках – электрическая энергия и т.д. Такое разделение энергии на виды удобно для исследования и анализа явлений природы.
Всякая термодинамическая система обладает определенной энергией, которая, независимо от конкретных форм проявления, обозначается Е.
За единицу энергии в СИ принят д ж о у л ь (Дж) – производная единица, определяемая через основные величины. Джоуль – это энергия, затраченная системой при перемещении точки приложения силы 1 Н на расстояние 1 м в направлении действия силы, т.е. 1 Дж = 1 Н ٠ 1 м .
Вычислить абсолютное значение энергии термодинамической системы невозможно, нет нуля отсчета энергии. Такое положение не играет существенной роли для практики, потому что при исследовании энергообмена важна не абсолютная величина энергии, а ее изменение. Для отдельных же форм энергии с целью количественной оценки их изменений в процессах устанавливается условное “начало отсчета”.
В общем случае энергия термодинамической системы Е включает в себя кинетическую энергию механического движения тела или тел внутри нее Ек, потенциальную энергию системы во внешнем поле (гравитационном, электромагнитном, сил давления) Еп и в н у т р е н н ю ю энергию (связанную с энергией микрочастиц тел, входящих в систему) Ев:
Е = Ек + Еп + Ев . (1.3)
В технической термодинамике, как правило, рассматривают неподвижную в окружающей среде термодинамическую систему, форма и размеры которой могут изменяться. Однако может иметь место и перемещение тел или тела внутри системы со скоростью с. В большинстве случаев гравитационной и электромагнитной составляющими потенциальной энергии пренебрегают. Существенной в таких системах будет потенциальная энергия в поле сил давления, которая выражается через объем и давление:
Еп = pV. (1.4)
Величина pV представляет собой энергию, которую нужно было затратить для того, чтобы ввести тело объемом V во внешнюю среду, имеющую повсюду одинаковое давление p.
Внутреннюю энергию Ев в технической термодинамике обозначают U.
Таким образом, энергия системы, рассматриваемой технической термодинамикой, равна кинетической энергии, потенциальной энергии в поле сил давления и внутренней энергии:
Е
= m![]() + pV
+ U
. (1.5)
+ pV
+ U
. (1.5)
Внутренняя энергия
Понятие внутренней энергии системы связано с микроскопическим строением последней. Это значит, что систему нужно рассматривать как совокупность большого числа структурных частиц (молекул, атомов, ионов и т.д.). Внутренняя энергия включает в себя энергию хаотичного (теплового) движения всех микрочастиц системы, энергию взаимодействия этих частиц, энергию электронных оболочек атомов. В термодинамической системе, состоящей из идеального газа, учитывается только тепловая энергия микрочастиц, включающая энергию поступательного, вращательного и колебательного движений.
Под внутренней энергией понимают калорический параметр, характеризующий совокупность энергии теплового движения микрочастиц системы.
За единицу внутренней энергии принят джоуль.
Особенностью внутренней энергии U является то, что она однозначно является функцией состояния термодинамической системы. Значение внутренней энергии в каком-либо произвольно выбранном процессе не зависит от того, каким образом система пришла в это состояние. Иначе говоря, изменение внутренней энергии ∆U1-2 при переходе системы из сотояния 1 в состояние 2 не зависит от пути перехода и равно ∆U1-2 = U2 – U1 .
В круговых процессах изменение внутренней энергии равно нулю.
Энтальпия
В уравнении энергии термодинамической системы (1.5) внутренняя энергия U и потенциальная энергия в поле сил давления pV характеризуют физическое состояние системы, допустимо их объединить и представить в виде некоторой функции состояния – э н т а л ь п и и. Название «энтальпия», которое было введено в термодинамику Д. Гиббсом, происходит от греческого слова “нагревать”.
Калорический параметр термодинамической системы, равный сумме внутренней энергии и энергии в поле сил давления, называется энтальпией.
Энтальпия обозначается I. Согласно определению:
I = U + pV. (1.6)
За единицу энтальпии принят джоуль.
С учетом выражения (1.6) уравнение энергии термодинамической системы запишется в виде:
Е
= I
+ m![]() .
(1.7)
.
(1.7)
Если система неподвижна, то энтальпия равна полной энергии системы объемом V, находящейся под давлением р.
Энтальпия является одной из вспомогательных функций, использование которых значительно упрощает термодинамические расчеты. Она не может быть измерена непосредственно, а определяется, как и внутренняя энергия, только расчетным путем.
Внутренняя энергия и энтальпия характеризуются рядом общих свойств:
1) Внутренняя энергия и энтальпия как функции состояния являются неодинаковыми для разных систем и тел, входящих в систему, т.е. являются не универсальными, а индивидуальными параметрами для каждого вещества.
2) Абсолютные значения внутренней энергии и энтальпии определяются с точностью до постоянных U0 и I0, выбранных в качестве стандартных. Так, в состоянии а абсолютные значения U и I запишутся следующим образом:
Uа= Uа-0 + U0 и Ia = Ia-0 +I0 .
В термодинамике, как правило, искомой величиной является изменение внутренней энергии и энтальпии, поэтому выбор стандартного состояния для определения ∆ U и ∆ I может быть произвольным.
3) Внутренняя энергия и энтальпия являются экстенсивными (аддитивными) величинами. Для системы, заданной несколькими телами, внутренняя энергия и энтальпия равны, соответственно, сумме внутренних энергий и энтальпий отдельных тел, т.е.
Uc
=
![]() и Ic
=
и Ic
=
![]() .
.
Однако удельные значения внутренней энергии и энтальпии относятся к интенсивным параметрам. Удельные массовые значения внутренней энергии и энтальпии вычисляют с помощью соотношений:
u =U/m и i = I/m
и выражают в Дж/кг.
1.1.5. Теплота и работа – формы энергообмена
Обмен энергией между закрытой термодинамической системой и внешней средой или между телами внутри системы может осуществляться посредством двух качественно различных форм. Одна форма обмена энергией происходит без видимого перемещения тел и системы в целом, другая - сопровождается изменением ее размеров или расположения ее тел в пространстве.
Для процессов, изучаемых в технической термодинамике, первый способ передачи энергии может быть реализован только при хаотическом, ненаправленном движении микрочастиц внутри неравновесной системы или при обмене энергией термодинамической системы и окружающей среды, имеющих разные температуры. Такую форму называют т е п л о о б м е н о м. Для количественной оценки теплообмена введено понятие т е п л о т ы.
Теплота
Под теплотой понимают количество энергии, которой термодинамическая система обменивается с окружающей средой микроскопическим путем (теплообменом).
Обмен энергией в форме теплоты возможен и между телами внутри системы.
Теплота здесь понимается только как форма передачи энергии, и неверно говорить, что она выражает свойство системы, тем более содержится в системе. Можно говорить о теплоте, подведенной к системе или от нее отведенной, но нельзя говорить об увеличении или уменьшении теплоты в той или иной системе, т.е. не следует путать теплоту и внутреннюю тепловую энергию.
Теплоту обозначают Q. За единицу теплоты принят джоуль. В термодинамике подводимую теплоту принято считать положительной, отводимую – отрицательной.
Вторая форма передачи энергии связана с изменением объема системы и перемещением ее в окружающей среде под воздействием различных силовых полей – гравитационного, упругостного, магнитного; поля сил давления и др. Такая форма энергообмена, реализуемая макроскопическим путем, называется р а б о т о й.
Работа
Под работой понимают количество энергии, которой термодинамическая система обменивается с окружающей средой в результате макроскопического, упорядоченного, направленного движения.
Работа обозначается L. За единицу работы принят джоуль.
В термодинамике работу, совершаемую системой по преодолению внешних сил, принято считать положительной, а совершаемую внешними силами над системой - отрицательной. Работа, связанная с увеличением объема системы, называется работой расширения (Lрасш.); с уменьшением объема – работой сжатия (Lсж.).
Работа процесса
В общем случае термодинамическая система может совершать одновременно работу по увеличению своего объема; работу по преодолению внешних сил давления, сил трения; работу по преодолению воздействия гравитационных, магнитных и других полей. Тогда техническая (полезная) работа системы с учетом правила знаков может быть выражена в виде:
Lтех = Lрасш - Lд - ∑Lпр , (1.8)
где Lтех – техническая работа системы;
Lрасш – работа расширения;
Lд – работа по преодолению поля сил давления;
∑Lпр – сумма работ по преодолению сил трения, гравитационных,
магнитных и прочих полей.
Выразим работу через термодинамические параметры. Пусть система
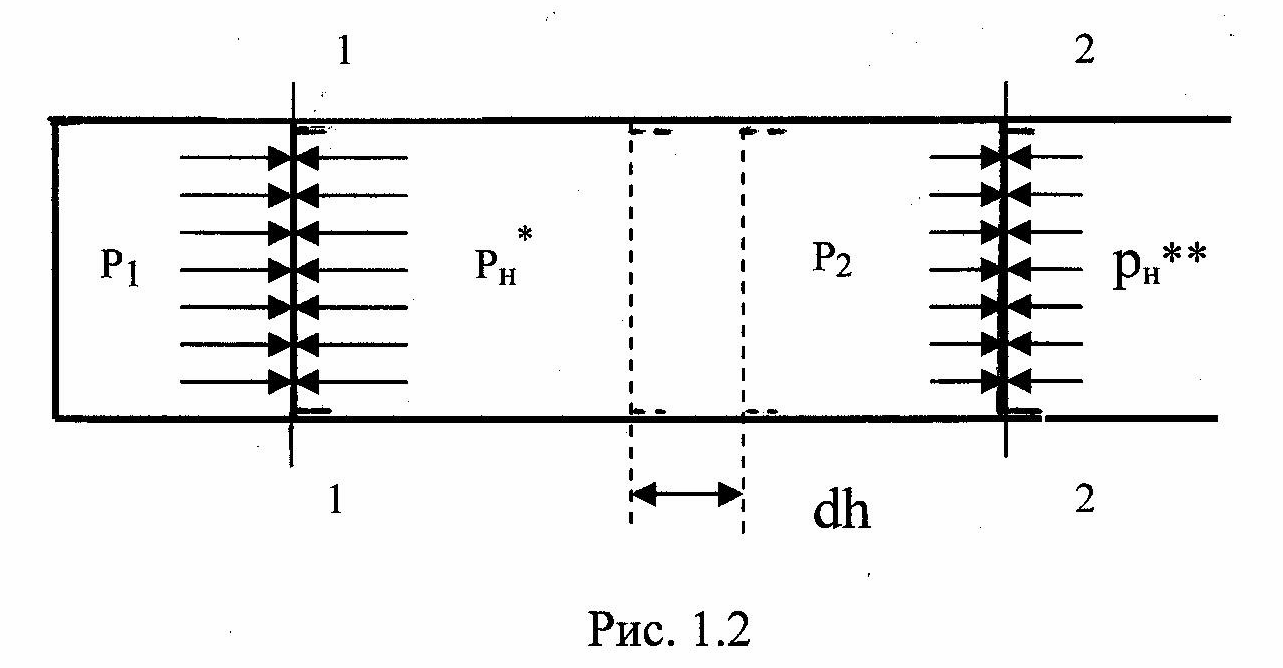 будет
задана в виде объема газа, находящегося
в цилиндре под поршнем, рис. 1.2. Давление
газа над поршнем р1.
При давлении окружающей среды рн*,
равном р1,
поршень будет неподвижен. При бесконечно
медленном уменьшении давления среды
от рн*
до рн**
поршень переместится из положения 1 в
положение 2. Произойдет равновесный
процесс расширения газа с совершением
работы. Элементарное значение этой
работы будет равно силе, действующей
на поршень pF,
умноженной на перемещение поршня dh,
т.е.
будет
задана в виде объема газа, находящегося
в цилиндре под поршнем, рис. 1.2. Давление
газа над поршнем р1.
При давлении окружающей среды рн*,
равном р1,
поршень будет неподвижен. При бесконечно
медленном уменьшении давления среды
от рн*
до рн**
поршень переместится из положения 1 в
положение 2. Произойдет равновесный
процесс расширения газа с совершением
работы. Элементарное значение этой
работы будет равно силе, действующей
на поршень pF,
умноженной на перемещение поршня dh,
т.е.
dLрасш = pF dh,
где F – площадь поршня;
p – давление газа, имеющее величину p1> p> p2.
Так как Fdh = dV, то dL расш = pdV.
Проинтегрировав последнее выражение от начального состояния до конечного, получим:
Lрасш
=![]() .
(1.9)
.
(1.9)
![]() При
увеличении объема системы не вся работа
расширения полезно использована, часть
ее затрачена на вытеснение среды.
Для того, чтобы ввести систему объемом
V
в окружающую среду с давлением p,
необходимо затратить работу по преодолению
поля сил давления среды, равную pV.
Для рассматриваемого примера эта работа
будет равна:
При
увеличении объема системы не вся работа
расширения полезно использована, часть
ее затрачена на вытеснение среды.
Для того, чтобы ввести систему объемом
V
в окружающую среду с давлением p,
необходимо затратить работу по преодолению
поля сил давления среды, равную pV.
Для рассматриваемого примера эта работа
будет равна:
Lд = pн**V2 – pн*V.
Так как при равновесном процессе pн* = р1 и рн**= р2, то
Lд
= p2V2
– p1V1
=![]() .
(1.10)
.
(1.10)
Для систем, расматриваемых в технической термодинамике, величиной ∑Lпр в (1.8) можно пренебречь, тогда техническая работа будет равна разности между работой расширения и работой по преодолению поля сил давления:
Lтех = Lрасш – Lд.
Используя выражения (1.9) и (1.10), получим:
Lтех
= –![]() .
(1.11)
.
(1.11)
Обратимся к выражению (1.8). Если сумма работ по определению сил трения, гравитационных, магнитных и прочих полей принять равной нулю, то работа системы при переходе из одного состояния в другое есть не что иное, как работа техническая.
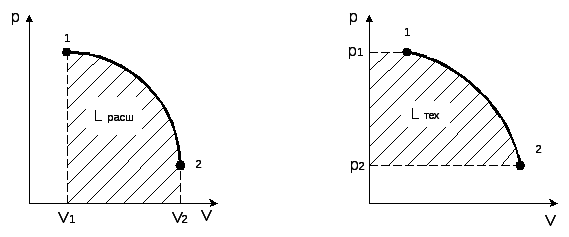
Правые
части выражений (1.9) и (1.11) представляют
собой определенные интегралы непрерывных
и положительных внутри промежутка 1-2
функций. Такие интегралы имеют простое
геометрическое истолкование. Так,
интеграл вида
![]() численно равен площади под кривой
функцииp(V),
изображенной на графике, рис. 1.3, где по
оси ординат отложено давление, а по оси
абсцисс – объем. Интеграл –
численно равен площади под кривой
функцииp(V),
изображенной на графике, рис. 1.3, где по
оси ординат отложено давление, а по оси
абсцисс – объем. Интеграл –![]() =
=![]() также численно равен площади под кривой,
но уже функцииV(p),
изображенной в координатах pV,
рис.1.4.
Отсюда работа
расширения численно равна площади,
ограниченной кривой процесса 1-2,
ординатами V1
и V2
и осью абсцисс, т.е.
Lрасш
= F1-2-V2-V1-1.
также численно равен площади под кривой,
но уже функцииV(p),
изображенной в координатах pV,
рис.1.4.
Отсюда работа
расширения численно равна площади,
ограниченной кривой процесса 1-2,
ординатами V1
и V2
и осью абсцисс, т.е.
Lрасш
= F1-2-V2-V1-1.
Техническая работа численно равна площади, ограниченной кривой процесса 1-2, абсциссами p1 и p2 и осью ординат, т.е. Lтех =L 2-P2-P1-1.
![]()
 Рис.
1.3
Рис. 1.4.
Рис.
1.3
Рис. 1.4.
Работа процесса зависит не только от параметров начального и конечного состояний, но и от того, по какому пути осуществляется этот процесс. Как видно из рис.1.5, работа расширения и работа техническая будут существенно различаться в процессах 1-а-2, 1-б-2 и 1-с-2.
 Отсюда
работа как термодинамическая величина
есть, прежде всего ф у н к ц и я п р о ц
е с с а. Теплоту и работу, отнесенные к
массе системы, называют п р и в е д е н н
ы м и или удельными Приведенная теплота
q
и приведенная работа
l
выражаются в Дж/кг и .вычисляются
с помощью соотношений.
Отсюда
работа как термодинамическая величина
есть, прежде всего ф у н к ц и я п р о ц
е с с а. Теплоту и работу, отнесенные к
массе системы, называют п р и в е д е н н
ы м и или удельными Приведенная теплота
q
и приведенная работа
l
выражаются в Дж/кг и .вычисляются
с помощью соотношений.
q = Q / m и l = L / m.
Учитывая
это, выражения (1.9) и (1.11) запишутся:
Рис.
1.5
lрасш
=
![]() иlтех
= –
иlтех
= –![]() ..
..
Здесь рассматриваются системы, в которых протекают о б р а т и м ы е процессы, хотя в действительности все реальные процессы в той или иной степени н е о б р а т и м ы.
Обратимым называют такой процесс, который может быть осуществ- лен в обратном направлении через те же состояния и точно с тем же обменом энергии в форме теплоты и работы, что и в прямом напправлении.
Это значит, что Qп р= Qобр и Lп р= Lобр. Если хотя бы одно из условий не выполняется, то процесс необратим. Типичным примером нарушения условия обратимости является протекание процесса при наличии трения, так как результатом трения является необратимое преобразование работы в теплоту.
