
- •Самостійна робота і. Основні поняття і закони хімії
- •Періодична система д.І. Менделєєва
- •IV. Класи неорганічних сполук
- •V. Розчини кількісний склад та приготування розчинів
- •Загальні властивості розчинів
- •VI. Електролітична дисоціація
- •VII. Гідроліз солей
- •VIII. Окислювально-відновні реакції
- •IX. Сполуки магнію, кальцію, алюмінію, кремнію
- •X. Сполуки хрому, марганцю та заліза
- •XI. Основи хімії в'яжучих речовин
- •Додатки
- •Фізичні величини та числові значення деяких констант:
Періодична система д.І. Менделєєва
Написати електронні формули атомів елементів з порядковими номерами 9 і 28. Показати розподіл електронів цих атомів по електронним коміркам. До якого електронного сімейства відносяться ці елементи?
Написати, електронні формули атомів елементів з порядковими номерами 16 і 26. Показати розподіл електронів цих атомів по електронним коміркам. До якого електронного сімейства відноситься ці елементи?
Яке найбільше число електронів може знаходитись на s-, p-, d- і f- орбіталях? Чому? Написати електронну формулу атома елемента з порядковим номером 31.
Написати електронні формули атомів елементів з порядковими номерами 25 і 34. Показати розподіл електронів цих атомів по електронним коміркам. До якого електронного сімейства відноситься ці елементи?
Які орбіталі атома заповнюються раніше: 4s чи 3d; 5s чи 4d? Пояснити чому? Написати електронну формулу атома елемента з порядковим номером 21.
Які орбіталі атома заповнюються електронами раніше: 4d чи 5s; 6s чи 5р? Чому? Написати електронну формулу атома елемента з порядковим номером 43.
Написати електронні формули атомів елементів з порядковими номерами 14 і 40. Показати розподіл електронів цих атомів по електронним коміркам. Скільки вільних d - орбіталей у атома останнього елемента?
Чому фосфор порівняно з азотом і хлор порівняно з фтором мають більші валентні можливості? Поясніть це за допомогою електронно-графічних формул.
Які значення можуть набувати квантові числа n, l, ml, ms? Чому вони дорівнюють для зовнішніх електронів атомів літію та кальцію?
Які значення має магнітне квантове число ml, якщо орбітальне число l= 0, 1, 2, 3? Які елементи в періодичній системі називаються s-, p-, d- і f- елементами? Навести приклади.
Назвіть елементи, які мають структуру зовнішнього електронного шару: 2s22p5, 3s23p3, 4s24p6. Напишіть повні електронні формули цих елементів.
Які з електронних формул, що відображають будову атома деякого елемента, неправильні:
а) ls22s22p53s1; б) ls22s22p6; в) ls22s22p63s23p63d4; г) ls22s22p63s23p64s2;
д) ls22s22p63s23d2. Чому? Назвати елементи для атомів яких електронні формули написані правильно.
Чи може бути на атома: р7 - або d12 - електронів? Чому? Скласти електронну формулу атома з порядковим номером 22 і показати його валентні електрони.
Скласти електронні формули атомів елементів з порядковими номерами 32 і 42, враховуючи те, що в останнього відбувається "провал" електрона. До якого електронного сімейства відноситься кожний із цих елементів?
Значення якого квантового числа визначає кількість s-, р-, d- і f-орбіталей в атомі кобальта?
Сформулюйте правило Хунда. Розмістіть 6 електронів на енергетичних d орбіталях - визначте сумарний спін.
Назвіть найактивніший метал та неметал. Наведіть повні електронні формули цих елементів.
Які значення приймають квантові числа? Напишіть електронну формулу атома марганцю.
Сформулюйте правила, які визначають послідовність заповнення електронами підрівнів. Написати електронну формулу атома елемента з порядковим номером 17.
Скільки енергетичних підрівнів на четвертому рівні? Напишіть електронну формулу атома ртуті.
Чому дорівнює сумарний спін електронів для атомів бору, кремнію і хлору? Напишіть електронну формулу атома з порядковим номером 18.
Якими значеннями квантових чисел характеризується кожний із 2р-електронів?
В якому стані - нормальному чи збудженому - перебувають атоми підкреслених у сполуках елементів:
HClO, HClO4, H2SO3, H2S
Запишіть електронні формули цих елементів у відповідних станах.
Складіть електронні формули атома сірки в нормальному і збудженому станах а також іона S2-.
Атоми якого елемента більш активно взаємодіють з гідрогеном: а) фтору чи хлору; б) натрію чи калію? Чому?
Напишіть електронні формули атомів елементів йоду, бору, хлору, вуглецю, сірки і розмістіть їх по порядку збільшення неметалічних властивостей.
Атоми яких елементів мають більшу спорідненість до електрона в кожній приведеній парі: а) сірка і хлор; б) кисень і карбон; в) селен і бром; г) фтор і кисень; д) бром і хлор?
Скільки неспарених електронів мають атоми елементів: берилій, азот, кремній і хлор? Які розміри їх іонів в порівнянні з атомами (більше чи менше)? Відповідь мотивуйте.
Що таке спорідненість до електрона? Як вона змінюється в групах, рядах і періодах? Наведіть приклади.
Напишіть повну електронну формулу атома хлору і іона СІ– .
Що спільного в будові атомів берилію, магнію і кальцію? Відповідь мотивуйте.
Напишіть повну електронну формулу атома брому та іона Br–.
В якому стані - нормальному чи збудженому - перебувають атоми підкреслених у сполуках елементів:
HNO3, HNO2, NO
Запишіть електронні формули цих елементів у відповідних станах.
В якому стані - нормальному чи збудженому - перебувають атоми підкреслених у сполуках елементів:
K2Cr2O7, Cr2O3, H2CrO4
Запишіть електронні формули цих елементів у відповідних станах.
ІІІ. ХІМІЧНИЙ ЗВ’ЯЗОК. БУДОВА МОЛЕКУЛ І КРИСТАЛІВ
Який хімічний зв’язок називається ковалентним? Чим пояснюється напрямленість ковалентного зв’язку? Як метод валентних зв’язків (ВЗ) пояснює будову молекули води?
У яких випадках утворюються речовини з іонним, ковалентним неполярним і ковалентним полярним зв’язками? Навести приклади.
Який тип утворення ковалентного зв’язку називається донорно-акцепторним? Які хімічні зв’язки існують в іонах NH
 і BF
і BF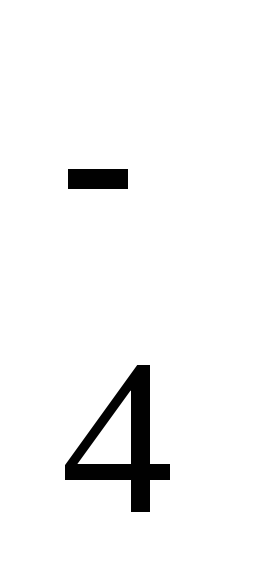 ? Вказати донор і акцептор.
? Вказати донор і акцептор.Який ковалентний зв’язок називається -зв’язком, який π-зв’язком? Розібрати на прикладі.
Розподілити електрони атома сірки по електронним коміркам. Скільки неспарених електронів мають його атоми в нормальному і збудженому станах? Яка при цьому буде валентність сірки?
Що називається дипольним моментом? Які з молекул HCl, HBr і HJ мають найбільший дипольний момент? Чому?
Які кристалічні структури називають іонними, атомними, молекулярними і металевими? Яку кристалічну структуру мають такі речовини: алмаз, хлорид натрію, діоксид вуглецю, цинк?
Скласти електронні схеми будови молекул F2, H2S, CCl4. В яких молекулах ковалентний зв’язок буде полярним?
Чим відрізняється структура кристалів NaCl від структури натрію? Який зв’язок виникає в цих кристалах?
Який зв’язок називається водневим? В яких випадках він виникає? Чим пояснити, що Н2О і HF плавляться і киплять при більш високій температурі, чим HCl, HBr та HI?
Який хімічний зв’язок називається іонним? Який механізм його утворення? Які властивості іонного зв’язку відрізняють його від ковалентного? Навести два приклади типових сполук з іонним зв’язком.
Складіть електронні формули атомів і наведіть схеми перекривання атомних орбіталей у молекулах: Cl2, HF, H2O, N2.
Дати визначення ступеню окислення? Визначити ступінь окислення вуглецю в сполуках: СаC2, H2CO3, CO2,, СО.
Які кристалічні структури називають іонними, атомними, молекулярними і металевими? Яку структуру мають кристали алмаза, хлориду кальцію, діоксида вуглецю, цинка?
Чому сірка не може мати валентність рівну одиниці?
Природа і характеристики іонного і ковалентного зв’язків.
Опишіть sp- гібридизацію атомних орбіталей. Наведіть приклади молекул, утворених за рахунок sp-гібридизації атомних орбіталей.
Утворення ковалентного зв’язку. Параметри ковалентного зв’язку.
Напрямленість ковалентного зв’язку. Пояснити механізм - та - зв’язку.
Як утворюється іонний зв’язок? Параметри іонного зв’язку. Будова сполук з іонним зв’язком.
Характеристики металічного зв’язку? Для яких металів цей зв’язок найбільш характерний?
Як утворюється водневий зв’язок? Чому вода має відносно велику температуру кипіння?
Дайте характеристику видам міжмолекулярної взаємодії. Які види міжмолекулярної взаємодії діють в речовинах: CO2, H2O, H2?
Опишіть sp2-гібридизацію атомних орбіталей. Наведіть приклади молекул, утворених за рахунок sp2-гібридизації атомних орбіталей.
Опишіть sp3-гібридизацію атомних орбіталей. Наведіть приклади молекул, утворених за рахунок sp3-гібридизації атомних орбіталей.
Дайте характеристику ковалентного зв’язку (неполярного, полярного).
Як зміниться характер хімічного зв’язку в з’єднаннях атомів елементів другого періоду з фтором?
Наведіть графічні формули сполук та вкажіть тип хімічного зв’язку в цих сполуках: KOH, NaHCO3, H2O2.
Складіть електронні формули атомів і наведіть схеми перекривання атомних орбіталей у молекулах: CH4, BeCl2, SiCl4, H2O. В яких з наведених молекул однаковий тип гібридизації атомних орбіталей?
Пояснити різницю хімічних зв’язків натрію й хлориду натрію.
Чи можуть атоми одного й того ж самого елемента утворювати металічний і іонний зв’язок? Відповідь поясніть.
Наведіть приклади молекул, у яких зв’язок між атомами здійснюється однією, двома, трьома парами електронів.
В якій з наведених сполук найбільш виражена полярність зв’язку: сірководень, хлор, метан, хлороводень?
До якого елемента зміщена спільна електронна пара у сполуках, формули яких: HCl, CO2, NH3, OF2?
