
- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
Эталоны решения задач
1. Некоторая реакция протекает с уменьшением энтропии. Определить, при каком условии возможно самопроизвольное протекание данной реакции.
Решение.
Условием самопроизвольного протекания реакции является уменьшение свободной энергии Гиббса, т.е. G 0. Изменение G можно рассчитать по формуле:
G H TS
Так как в ходе реакции энтропия уменьшается (S 0), то энтропийный фактор препятствует самопроизвольному протеканию данной реакции. Таким образом, самопроизвольное протекание данной реакции может обеспечить только энтальпийный фактор. Для этого необходимо выполнение следующих условий:
1) H 0 (реакция экзотермическая);
2) ![]() (процесс должен протекать при низких
температурах).
(процесс должен протекать при низких
температурах).
2. Эндотермическая реакция разложения протекает самопроизвольно. Оценить изменение энтальпии, энтропии и величины свободной энергии Гиббса.
Решение.
1) Так как реакция эндотермическая, то H 0.
2) В реакциях разложения энтропия возрастает, следовательно S 0.
3) Самопроизвольное протекание реакции свидетельствует о том, что G 0.
3. Вычислить стандартную энтальпию хемосинтеза, протекающего в бактериях Thiobacillus denitrificans:
6KNO3(тв.) + 5S(тв.) + 2CaCO3(тв.) = 3K2SO4(тв.) + 2CaSO4(тв.) + 2CO2(газ) + 3N2(газ)
по значениям стандартных энтальпий образования веществ:
|
|
K2SO4 |
CaSO4 |
CO2 |
KNO3 |
CaCO3 |
|
|
1438 |
1432 |
393,5 |
493 |
1207 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
Решение.
Запишем выражение первого следствия из закона Гесса с учетом того, что стандартные энтальпии образования серы и азота равны нулю:
![]() (3
(3![]() K2SO4
2
K2SO4
2![]() CaSO4
2
CaSO4
2![]() CO2)
CO2)
(6![]() KNO3
2
KNO3
2![]() CaCO3).
CaCO3).
Подставим значения стандартных энтальпий образования веществ:
![]() 3(1438)
2(1432)
2(393,5)
(6(493)
2(1207)).
3(1438)
2(1432)
2(393,5)
(6(493)
2(1207)).
Получим:
![]() 2593
кДж.
2593
кДж.
Так
как
![]()
0,
то реакция экзотермическая.
0,
то реакция экзотермическая.
4. Вычислить стандартную энтальпию реакции:
2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
по значениям стандартных энтальпий сгорания веществ:
![]() C2H5OH
1368
кДж/моль;
C2H5OH
1368
кДж/моль;
![]() C2H5OC2H5
2727
кДж/моль.
C2H5OC2H5
2727
кДж/моль.
Решение.
Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды (высший оксид) равна нулю:
![]() 2
2![]() C2H5OH
C2H5OH
![]() C2H5OC2H5.
C2H5OC2H5.
Подставим значения стандартных энтальпий сгорания веществ, участвующих в реакции:
![]() 2(1368)
(2727).
2(1368)
(2727).
Получим:
![]() 9
кДж.
9
кДж.
Следствия из закона Гесса позволяют вычислять не только стандартные энтальпии реакций, но и величины стандартных энтальпий образования и сгорания веществ по косвенным данным.
5. Определить стандартную энтальпию образования оксида углерода (II) по следующим данным:
|
(1) |
C(тв.) О2(газ) СО2(газ); |
|
|
(2) |
СО(газ)
|
|
Решение.
Из уравнения (1) видно, что стандартное изменение энтальпии данной реакции соответствует стандартной энтальпии образования CO2.
Запишем выражение первого следствия из закона Гесса для реакции (2):
![]()
![]() CO2
CO2
![]() CO.
CO.
Отсюда:
![]() CO
CO
![]() CO2
CO2
![]() .
.
Подставим значения и получим:
![]() CO
293,5
(283)
110,5
кДж/моль.
CO
293,5
(283)
110,5
кДж/моль.
Эту задачу можно решить и другим способом.
Вычитая из первого уравнения второе, получим:
|
(1) (2) |
C(тв.)
|
|
6. Вычислить стандартную энтропию реакции:
CH4(газ) Cl2(газ) CH3Cl(газ) HCl(газ),
по значениям стандартных энтропий веществ:
|
|
CH3Cl |
HCl |
CH4 |
Cl2 |
|
|
234 |
187 |
186 |
223 |
Решение.
Стандартную энтропию реакции вычислим по формуле:
![]() (
(![]() CH3Cl
CH3Cl
![]() HCl)
(
HCl)
(![]() CH4
CH4
![]() Cl2).
Cl2).
Подставляя табличные значения, получим:
![]() 234
187
(186
223)
12 Дж/(мольK).
234
187
(186
223)
12 Дж/(мольK).
7. Вычислить стандартную энергию Гиббса реакции:
C2H5OH(жидк.) H2O2(жидк.) CH3COH(газ) 2H2O(жидк.)
по следующим данным:
|
|
CH3COH |
C2H5OH |
H2O |
H2O2 |
|
|
129 |
175 |
–237 |
–121 |
Определить, возможно ли самопроизвольное протекание данной реакции при стандартных условиях.
Решение.
Стандартную энергию Гиббса реакции вычислим по формуле:
![]() (
(![]() CH3COH
2
CH3COH
2![]() H2O)
(
H2O)
(![]() C2H5OH
C2H5OH
![]() H2O2).
H2O2).
Подставляя табличные значения, получим:
![]() 129
2(237)
((175)
(121)
307
кДж/моль.
129
2(237)
((175)
(121)
307
кДж/моль.
Так как
![]()
0, то самопроизвольное
протекание данной реакции возможно.
0, то самопроизвольное
протекание данной реакции возможно.
8. Рассчитать стандартную энергию Гиббса для реакции окисления глюкозы:
С6H12O6(тв.) 6O2(газ) 6CO2(газ) 6H2O(жидк.).
по известным данным:
|
|
H2O |
CO2 |
С6H12O6 |
O2 |
|
|
286 |
393,5 |
–1274,5 |
0 |
|
|
70 |
214 |
212 |
205 |
Решение.
Значения стандартных энтальпии и энтропии реакции рассчитаем при помощи первого следствия из закона Гесса:
![]() 6
6![]() CO2
6
CO2
6![]() H2O
H2O
![]() С6H12O6
6
С6H12O6
6![]() O2
O2
6(393,5) 6(286) (1274,5) 60 2803 кДж;
![]() 6
6![]() СО2
6
СО2
6![]() H2O
H2O
![]() С6H12O6
6
С6H12O6
6![]() O2
O2
6214 670 212 6205 262 Дж/К 0,262 кДж/К.
Стандартную энергию Гиббса реакции найдем из соотношения:
![]()
![]() T
T![]()
2803
кДж
298,15 K0,262
кДж/К
2803
кДж
298,15 K0,262
кДж/К
2881 кДж.
9. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой H0 6,08 кДж/моль, S0 5,85 Дж/(мольК). Оценить вклад энтальпийного и энтропийного фактора.
Решение.
Стандартную энергию Гиббса реакции рассчитаем по формуле:
G0 H0 TS0.
Подставив значения, получим:
G0 6,08 кДж/моль 298 К(5,85103) кДж/(мольК)
4,34 кДж/моль.
В
данном случае энтропийный фактор
препятствует протеканию реакции, а
энтальпийный
благоприятствует. Самопроизвольное
протекание реакции возможно при условии,
если
![]() ,
т.е., при низких температурах.
,
т.е., при низких температурах.
10. Определить
температуру, при которой самопроизвольно
пойдет реакция денатурации трипсина,
если
![]()
283 кДж/моль,
283 кДж/моль,
![]()
288 Дж/(мольК).
288 Дж/(мольК).
Решение.
Температуру, при которой равновероятны оба процесса найдем из соотношения:
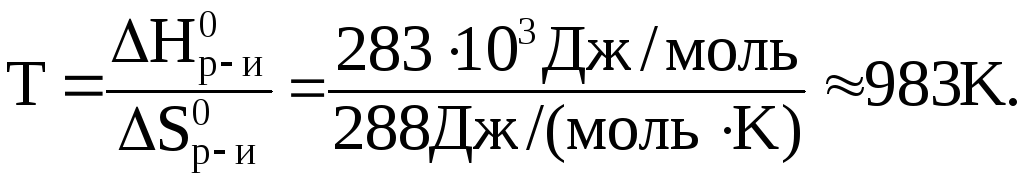
В данном случае энтальпийный фактор препятствует протеканию реакции, а энтропийный благоприятствует. Самопроизвольное протекание реакции возможно при условии, если:
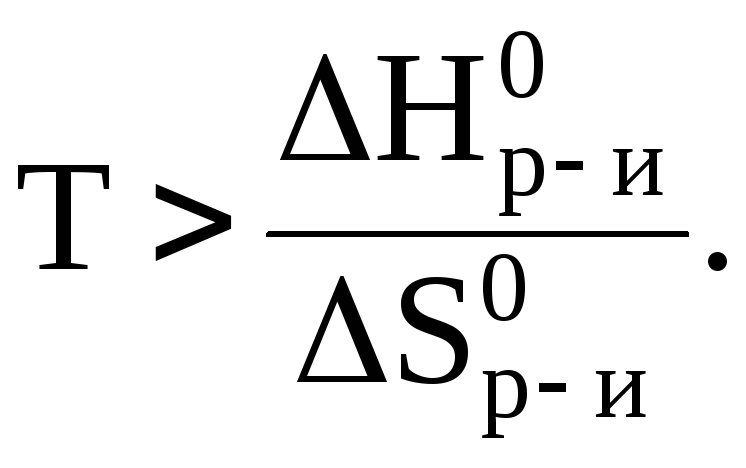
Таким образом, условием самопроизвольного протекания процесса является T 983 K.
