
- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
Смещение химического равновесия. Принцип Ле Шателье
Как уже отмечалось ранее, химическое равновесие всегда отвечает определенным условиям. При изменении внешних параметров (температуры, концентрации, в некоторых случаях – давления) равновесие может нарушиться. Это объясняется тем, что изменение условий неодинаково влияет на скорости прямой и обратной реакций. Через некоторое время эти скорости вновь сравниваются (за счет изменения равновесных концентраций) и наступает состояние равновесия, отвечающее новым условиям. Изменение равновесных концентраций реагирующих веществ, вызванное изменением какого-либо параметра системы, называется смещением, или сдвигом, химического равновесия.
В 1884 г. Ле Шателье сформулировал принцип, который помогает качественно предсказать смещение химического равновесия при изменении одного из параметров:
Если на систему, находящуюся в состоянии химического равновесия, оказано внешнее воздействие, то равновесие сместится в направлении той реакции, которая ослабляет это воздействие.
1. Влияние изменения концентрации.
Введение в равновесную систему дополнительных количеств любого из реагирующих веществ ускоряет ту реакцию, в которой оно расходуется.
Например, в реакции:
2NO O2 ⇄ 2NO2
повышение концентраций NO или O2 смещает равновесие вправо, повышение концентрации NO2 – влево. Равновесие смещается вправо также при уменьшении концентрации NO2, а при уменьшении концентрации NO или O2 – влево.
2. Влияние температуры.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
Таким образом, для того, чтобы судить о влиянии температуры на химическое равновесие, необходимо знать тепловой эффект (изменение энтальпии) реакции.
Например, реакция:
CO(газ) H2O(пар) ⇄ CO2(газ)
H2(газ);
![]()
43,0
кДж
43,0
кДж
характеризуется отрицательным значением стандартной энтальпии, следовательно, прямая реакция является экзотермической, обратная – эндотермической. Таким образом, при увеличении температуры равновесие сместится в сторону эндотермической, т.е., обратной реакции, а уменьшение температуры сместит равновесие в сторону экзотермической (прямой) реакции.
2. Влияние давления.
Изменение давления оказывает существенное влияние только на реакции, протекающие в газовой фазе.
При увеличении давления равновесие смещается в сторону образования меньшего числа моль (молекул) газа.
Действительно, уменьшение общего числа молекул в газовой смеси влечет за собой уменьшение давления в системе, что в свою очередь, ослабляет внешнее воздействие.
Так, уравнение обратимого процесса:
N2 3H2 ⇄ 2NH3,
показывает, что из четырех молекул в левой части (одной молекулы азота и трех молекул водорода) образуются две молекулы аммиака. Таким образом, повышение давления смещает равновесие вправо, а понижение давления – влево.
В тех случаях, когда в результате реакции число молекул остается постоянным, равновесие при изменении давления не смещается.
К таким реакциям относятся, например:
CO H2O ⇄ CO2 H2;
N2 O2 ⇄ 2NO.
Эталоны решения задач
1. Рассчитать константу химического равновесия Kc для реакции:
NO2(газ) SO2(газ) ⇄ NO(газ) SO3(жидк.)
по известным данным:
|
|
NO2 |
SO2 |
NO |
SO3 |
|
|
52 |
–300 |
90 |
–370 |
Оценить возможность самопроизвольного протекания реакции в прямом направлении и значение константы равновесия.
Решение.
Рассчитаем стандартную энергию Гиббса реакции по первому следствию из закона Гесса:
![]()
![]() SО3
SО3
![]() NO
NO
![]() NO2
NO2
![]() SO2
32
кДж.
SO2
32
кДж.
![]() 0,
следовательно, процесс
самопроизвольно протекает в прямом
направлении.
0,
следовательно, процесс
самопроизвольно протекает в прямом
направлении.
Величину Kc найдем из уравнения изотермы Вант-Гоффа:

![]()
Kc 1, т. е. при данной температуре равновесие данной реакции сильно смещено в сторону образования продуктов реакции.
2. Для равновесной реакции:
N2 3H2 ⇄ 2NH3
имеются следующие данные:
![]() 92,4
кДж,
92,4
кДж, ![]()
0,1978
кДж/К.
0,1978
кДж/К.
1) Рассчитать:
а) температуру, при которой система находится в равновесии (Kc 1);
б) значение константы равновесия при 298 К.
2) Указать направление смещения равновесия при повышении (понижении) температуры.
Решение.
При Кс 1 стандартная энергия Гиббса равна нулю. Тогда из соотношения:
![]()
получим:
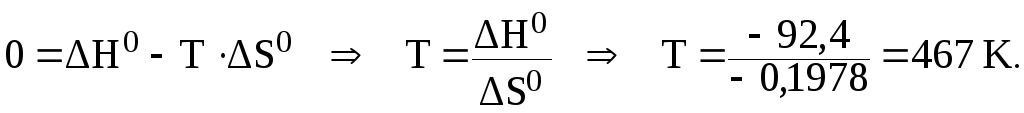
Для данной реакции зависимость энергии Гиббса от температуры выглядит следующим образом:
![]()
При стандартной температуре (298 К):
![]()
Значение Кс при данной температуре найдем из соотношения:
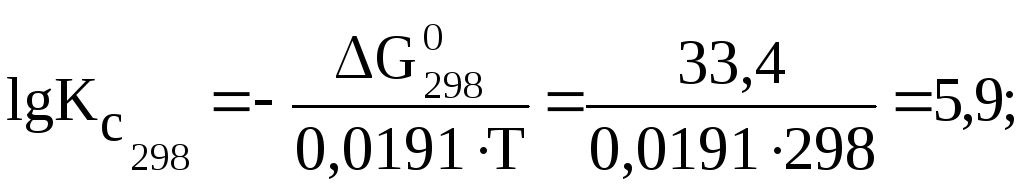
![]()
Проведенный расчет показывает, что:
![]()
Это означает, что при понижении температуры равновесие смещается в прямом направлении.
Аналогичный
вывод можно сделать и исходя из принципа
Ле Шателье. Действительно реакция
образования аммиака –
экзотермическая (![]() 0),
следовательно при
повышении температуры равновесие
смещается в сторону обратной реакции
(разложения аммиака), а при понижении
температуры – в сторону прямой реакции
(синтеза аммиака).
0),
следовательно при
повышении температуры равновесие
смещается в сторону обратной реакции
(разложения аммиака), а при понижении
температуры – в сторону прямой реакции
(синтеза аммиака).
3. Для реакции CO2(газ) H2(газ) ⇄ CO(газ) H2O(пар) константа равновесия равна 1. Исходные концентрации веществ составили: С0(СO2) = 0,2 моль/л; С0(H2) = 0,8 моль/л. Рассчитать, при каких концентрациях всех четырех веществ установилось равновесие.
Решение.
Обозначим концентрации С(СО2) и С(Н2), вступивших в реакцию, через «х», т. е.
С(СO2)прореаг. С(H2)прореаг. х моль/л.
Тогда:
С(СO2)равн. С0(CO2) С(СO2)прореаг. 0,2 х;
С(H2)равн. С0(H2) С(H2)прореаг. 0,8 х.
Из уравнения реакции видно, что:
[СO2] [H2O] x.
Выражение для константы равновесия имеет вид:
![]()
x2 0,16 0,2x 0,8x x2
x 0,16.
Равновесные концентрации всех веществ равны:
[СO2] 0,2 0,16 0,04 моль/л;
[H2] 0,8 0,16 0,64 моль/л;
[СO] [H2O] 0,16 моль/л.
4. Реакция образования йодистого водорода протекает по уравнению:
H2(газ) I2(газ) ⇄ 2HI(газ).
Исходные концентрации веществ составили: С0(H2) 0,02 моль/л; С0(I2) 0,04 моль/л. Известно, что в реакцию вступило 50% Н2.
1) Вычислить константу химического равновесия.
2) В каком направлении сместится равновесие, если:
а) увеличить концентрацию I2?
б) уменьшить концентрацию HI?
в) увеличить давление?
Решение.
Исходя из уравнения реакции, определяем концентрации веществ, прореагировавших между собой:
С(H2)прореаг. 0,5·0,02 0,01 моль/л;
С(I2)прореаг. С(H2)прореаг. 0,01 моль/л.
Находим равновесные концентрации:
[HI] 2c(H2)прореаг. 0,02 моль/л (по уравнению реакции);
[H2] c0(H2) с(H2)прореаг. 0,02 0,01 0,01 моль/л;
[I2] c0(I2) с(I2)прореаг. 0,04 0,01 0,03 моль/л.
Подставляем равновесные концентрации в выражение константы равновесия:
![]()
Увеличение концентрации I2 и уменьшение концентрации HI приведет к сдвигу равновесия в сторону прямой реакции. Увеличение давления не вызовет сдвига равновесия.
5. При определенных условиях в системе установилось равновесие:
2NO O2 ⇄ 2NO2.
Равновесные концентрации веществ составили: [NO] 4 моль/л; [O2] 6 моль/л; [NO2] 10 моль/л. Найти исходные концентрации NО и О2.
Решение.
Исходные концентрации равны сумме равновесных концентраций и концентраций вступивших в реакции веществ. Последние можно определить из стехиометрических соотношений:
С(NO)прореаг. [NO2] 10 моль/л;
С(O2)прореаг.
![]()
5 моль/л.
5 моль/л.
Отсюда:
С0(NO) [NO] С(NO)прореаг. 4 10 14 моль/л;
С0(O2) [O2] С(O2)прореаг. 6 5 11 моль/л.
