
- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
Эталоны решения задач
1. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А В С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Какие количества непрореагировавших газов А и В остались в системе?
Решение.
Из уравнения реакции следует, что:
n(A) n(B) n(C) 2 моль,
где n ‑ изменение количества вещества в ходе реакции.
Следовательно, в сосуде осталось:
n2(A) n1(А) n(A); n2(A) (4,5 2) моль 2,5 моль;
n2(B) n1(B) n(B); n2(B) (3 2) моль 1 моль.
2. Реакция протекает по уравнению: 2A B ⇄ C и имеет второй порядок по веществу А и первый по веществу B. В начальный момент времени скорость реакции равна 15 моль/лс. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 50% вещества B, если начальные концентрации равны: С(A) 10 моль/л; С(B) 5 моль/л. Как изменится скорость химической реакции?
Решение.
Согласно закону действующих масс:
![]() ;
;
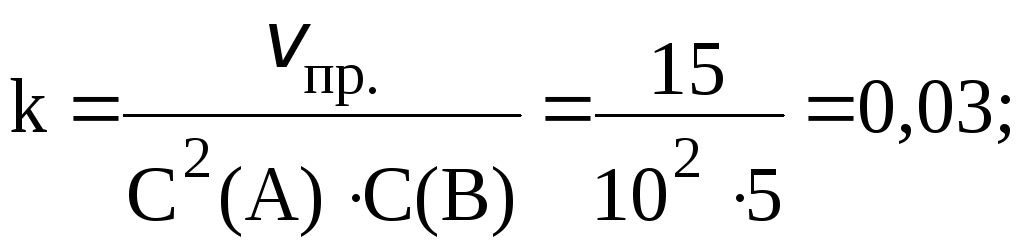
С(B), вступившего в реакцию, равна:
С(B) 0,5·5 2,5 моль/л.
Соответственно С(A), вступившего в реакцию, равна:
2 Моль/л a 1 моль/л b
С(A) 2,5 моль/л B
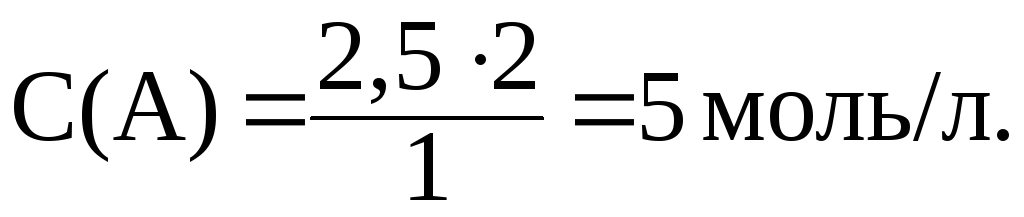
С(A) и С(B) после протекания реакции:
С(A) 10 5 5 моль/л,
С(B) = 5 2,5 = 2,5 моль/л.
Скорость прямой реакции будет равна:
![]()
Скорость химической реакции изменится:
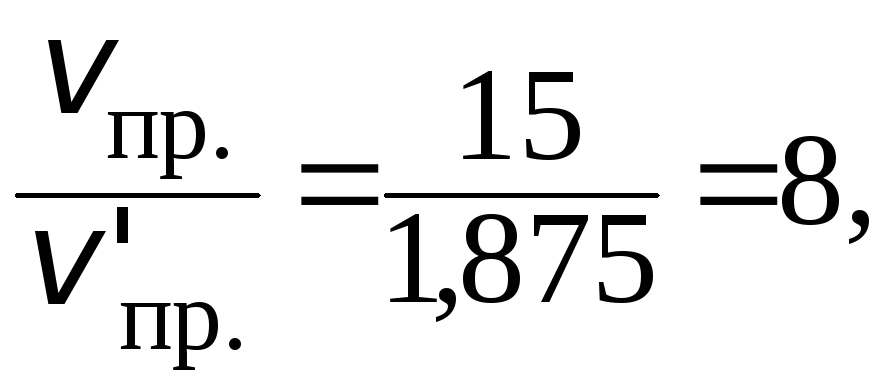
т. е. уменьшится в 8 раз.
3. Реакция между веществами А и В выражается уравнением: А 2В С и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С(А) 2 моль/л; С(В) 4 моль/л; константа скорости равна 1,0. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,3 моль/л.
Решение.
Согласно закону действующих масс:
![]()
Если концентрация вещества А уменьшится на 0,3 моль/л, то концентрация вещества В уменьшится на 0,32 0,6 моль/л. После протекания реакции концентрации равны:
![]()
![]()
![]()
4. Скорости прямой и обратной газофазных реакций, протекающих в замкнутом сосуде, выражаются уравнениями:
![]()
![]()
Рассчитать, как изменятся скорости прямой и обратной реакций при увеличении давления в системе в 3 раза, если исходные концентрации веществ равны: С0(A) 1 моль/л; С0(B) 3 моль/л; С0(C) 2 моль/л.
Решение.
Согласно закону действующих масс, скорости прямой и обратной реакций при начальных условиях равны:
![]()
![]()
Увеличение давления в 3 раза для газообразных систем приводит к уменьшению объема газовой смеси в 3 раза, во столько же раз увеличатся концентрации всех трех газов, и скорости обеих реакций станут соответственно равны:
![]()
![]()
Отношения скоростей реакций составляют:
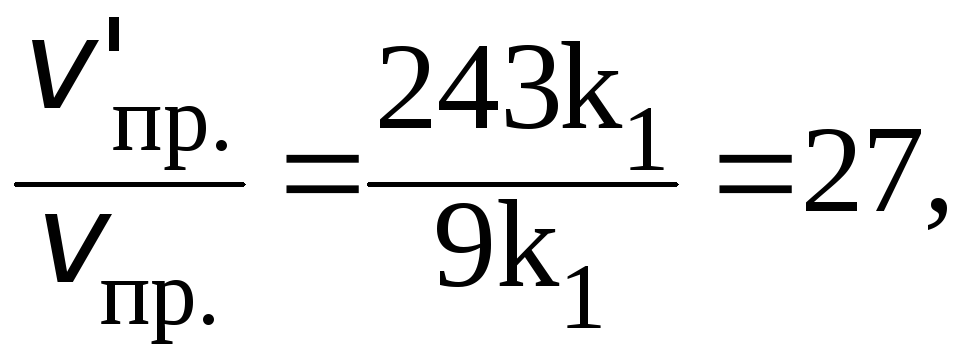
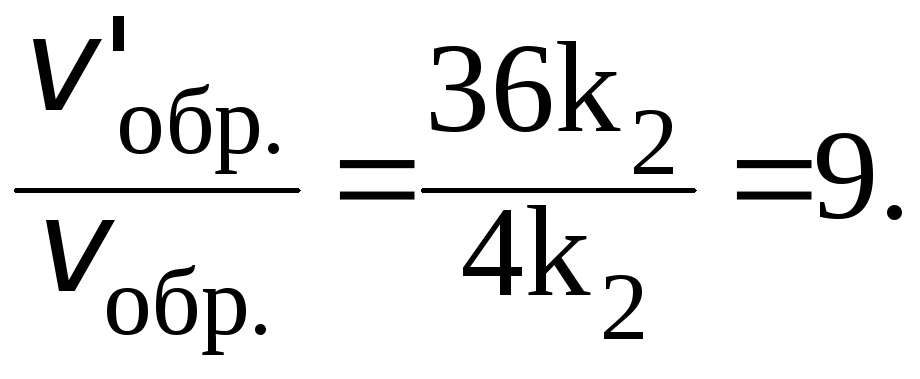
Таким образом, скорость прямой реакции увеличится в 27 раз, обратной в 9.
5. Реакция при температуре 500С протекает за 2 мин 15 с. За какое время закончится эта реакция при температуре 700С, если в данном температурном интервале температурный коэффициент скорости равен 3?
Решение.
При увеличении температуры от 50 до 700С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
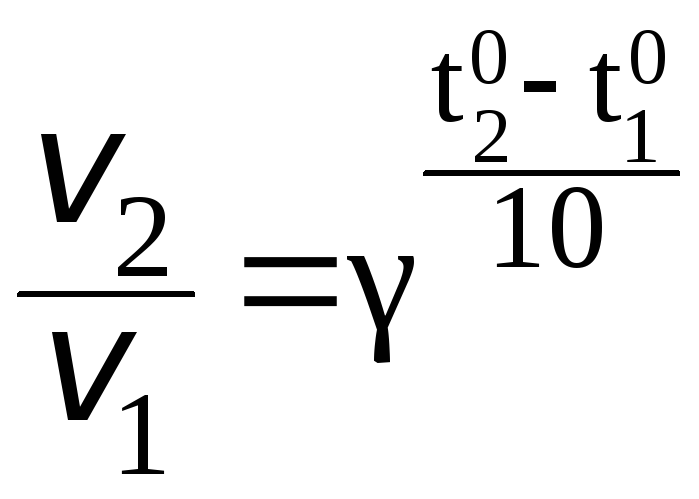
где
![]()
700С,
700С,
![]()
500С,
a
500С,
a
![]() и
и![]()
скорости реакции при данных температурах.
скорости реакции при данных температурах.
Получаем:
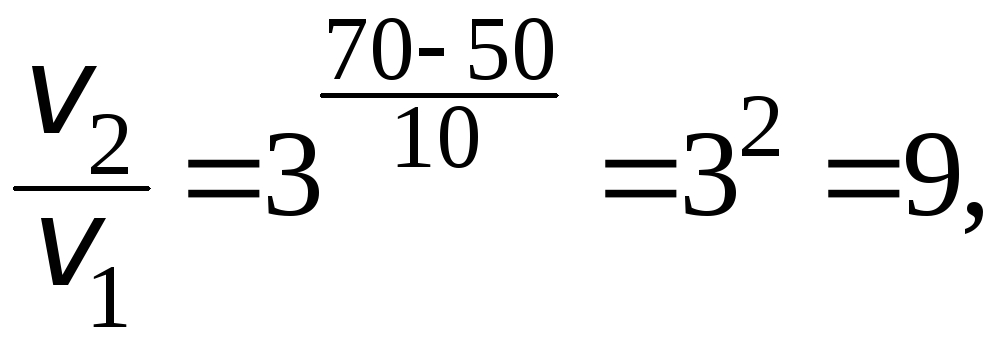
т.е. скорость реакции увеличивается в 9 раз.
В соответствии с определением, время реакции обратно пропорционально скорости протекания реакции, следовательно:
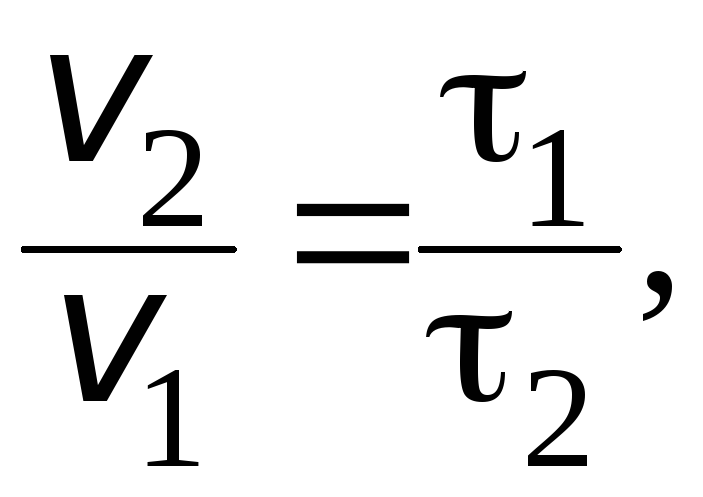
где ![]() и
и ![]()
время реакции при температурах
время реакции при температурах
![]() и
и
![]() .
.
Отсюда получаем:
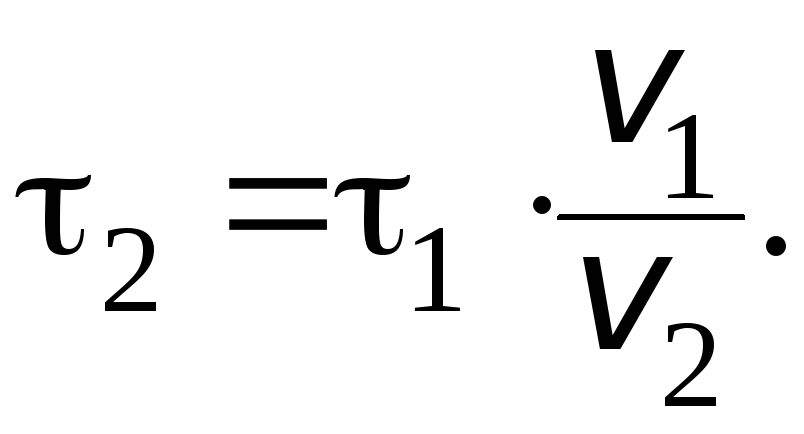
Учитывая,
что ![]()
135 с (2 мин 15 с), определяем время
реакции при температуре
135 с (2 мин 15 с), определяем время
реакции при температуре
![]() :
:
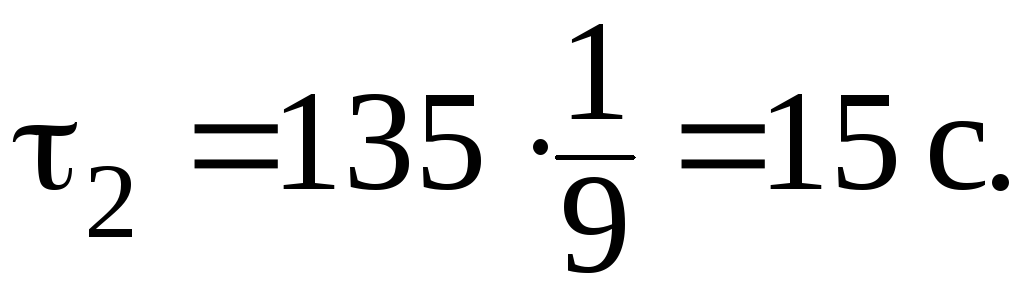
6. Во
сколько
раз
увеличится скорость химической реакции
при повышении температуры от
![]() 100C
до
100C
до
![]() 800С,
если
температурный коэффициент скорости
равен 2?
800С,
если
температурный коэффициент скорости
равен 2?
Решение.
Из правила Вант-Гоффа:
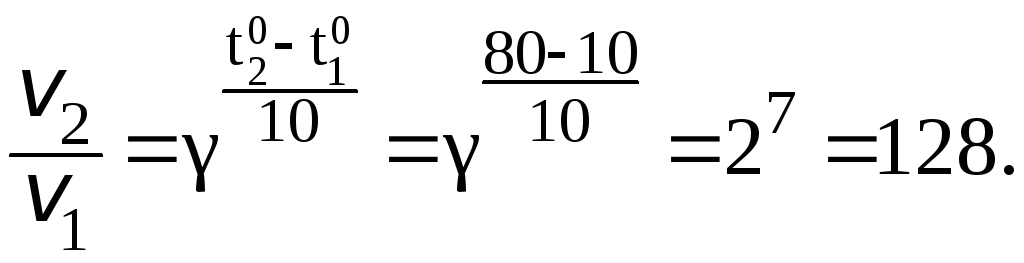
Скорость реакции увеличится в 128 раз.
7. При изучении кинетики выведения лекарственного препарата из организма больного было установлено, что за 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. Определить период полувыведения и константу скорости реакции выведения препарата из организма человека, если известно, что это реакция первого порядка.
Решение.
Так как за данный промежуток времени из организма было выведено 50% препарата, то 1/2 3 часа. Константу скорости реакции рассчитаем из уравнения:
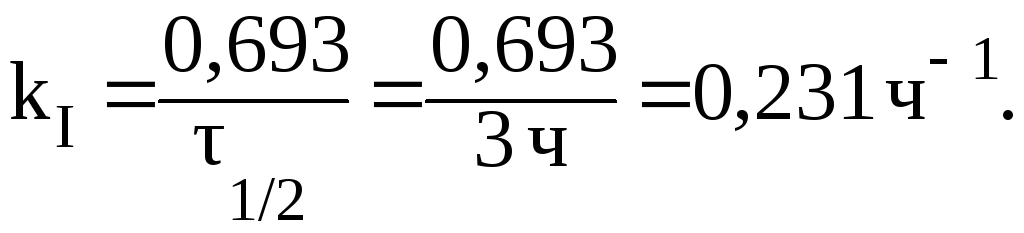
8. При лабораторных исследованиях водных растворов лекарственного средства было установлено, что вследствие гидролиза концентрация препарата за сутки уменьшилась от 0,05 моль/л до 0,03 моль/л. Вычислить период полупревращения реакции гидролиза препарата.
Решение.
Так как реакции гидролиза обычно протекают при значительном избытке воды, то ее концентрацию можно постоянной. Следовательно, в ходе реакции изменяется только концентрация препарата и реакцию гидролиза можно считать реакцией первого порядка.
Значение константы скорости реакции найдем из уравнения:
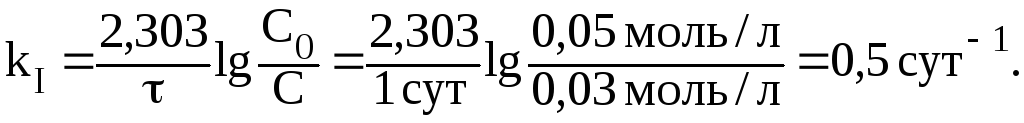
Отсюда:
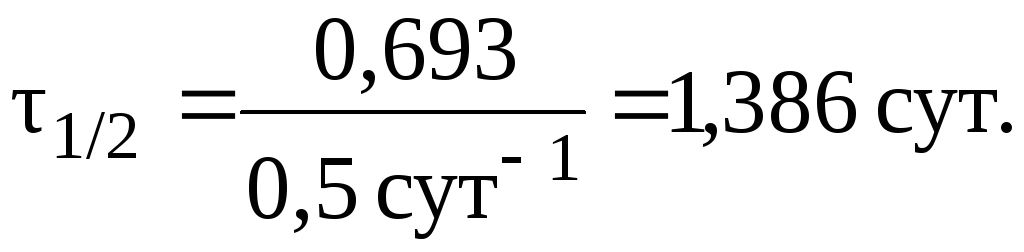
9. Период полувыведения препарата из организма больного (реакция первого порядка) равен 5 часам. Определить время, за которое из организма будет выведено 75% препарата.
Решение.
При выведении из организма 75% препарата отношение С/С0 составит 0,25. В данном случае удобно воспользоваться формулой:
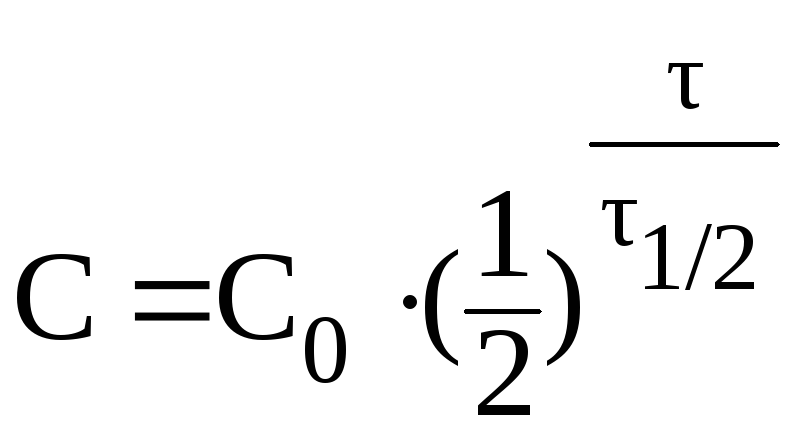
Отсюда:
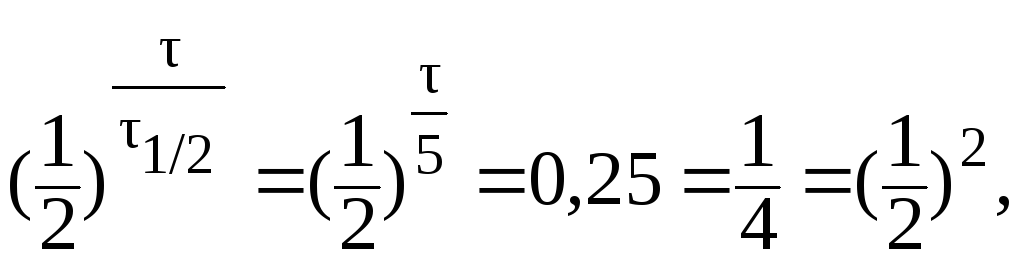
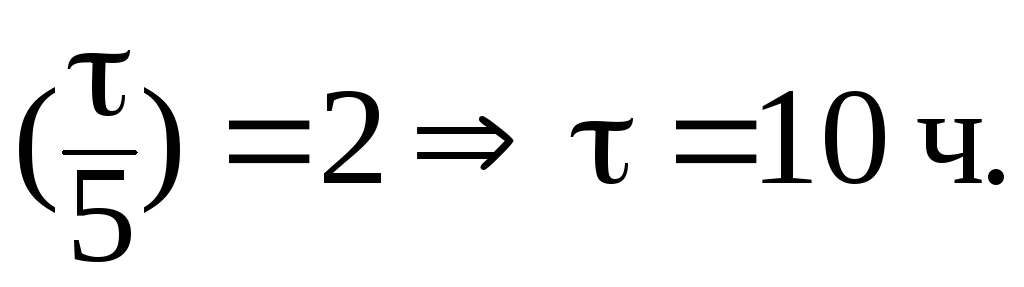 ,
,
10. Константа скорости реакции гидролиза сахарозы равна 2,31103 ч1. Рассчитать:
1) период полупревращения реакции;
2) время, за которое гидролизу подвергнется 20% сахарозы;
3) какая часть глюкозы подвергнется гидролизу через 5 суток.
Решение.
1. Период полупревращения равен:
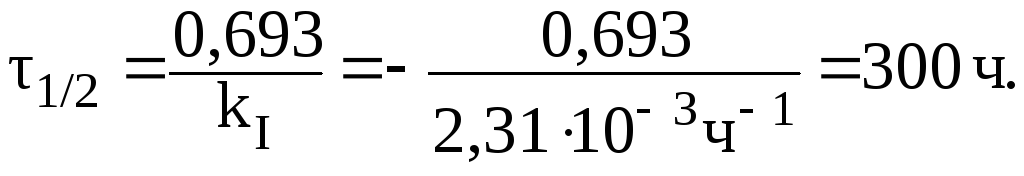
2. После того, как гидролизу подвергнется 20% сахарозы, отношение С/С0 составит 0,8. Следовательно:
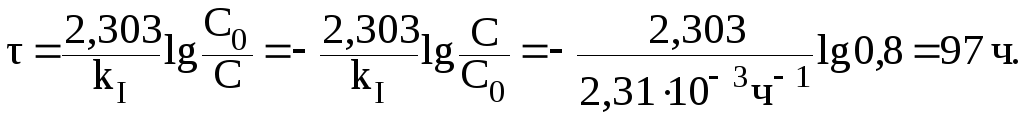
3. Через 5 суток (120 часов) отношение С/С0 составит:
![]()
Следовательно, гидролизу подверглось 24% глюкозы.
11. В ходе некоторой реакции первого порядка за 30 мин превращению подвергается 60% исходного количества вещества. Определить, какая часть вещества останется через 1 час.
Решение.
1. Через 30 минут количество оставшегося вещества составит:
С1 С0 0,6С0 0,4С0.
т.е., отношение С0/С1 равно 2,5.
2. Найдем константу скорости реакции:
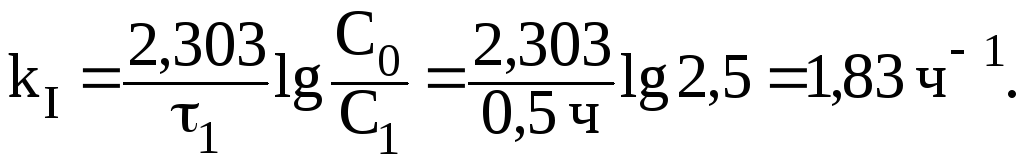
3. Количество вещества С2, оставшееся через 1 час, определим по формуле:
![]()
Таким образом, через 1 час останется 16% от исходного вещества.
