
- •Содержание
- •Электрохимия
- •Электрическая проводимость растворов электролитов
- •Подвижность ионов
- •Электрическая проводимость растворов
- •Кондуктометрия
- •Электрическая проводимость биологических объектов
- •Вопросы для самоконтроля
- •Решение типовых задач
- •Задачи для самостоятельного решения Вариант 1.
- •Вариант 2.
- •Вариант 3.
- •Вариант 4.
- •Вариант 5.
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •Вариант 11.
- •Вариант 12.
- •Вариант 13.
- •Вариант 14.
- •Вариант 15.
- •Электрические явления на границе раздела фаз
- •Электродный потенциал
- •Окислительно-восстановительный (редокс) потенциал
- •Диффузионный потенциал
- •Мембранный потенциал
- •Гальванические элементы
- •Потенциометрия
- •Потенциометрическое титрование
- •Вопросы для самоконтроля
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вариант 1.
- •Вариант 2.
- •Вариант 3.
- •Вариант 4.
- •Вариант 5.
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •Вариант 11
- •Вариант 12.
- •Вариант 13.
- •Вариант 14.
- •Вариант 15.
Потенциометрическое титрование
Потенциометрическое титрование - метод объемного анализа, в котором точка эквивалентности определяется по изменению в ходе титрования ЭДС гальванической цепи, включающей анализируемый раствор.
К порции анализируемого раствора, в который погружены электрод определения и электрод сравнения, постепенно приливают титрант из бюретки, постоянно измеряя ЭДС полученного гальванического элемента. В результате получают кривую потенциометрического титрования, т.е. зависимость ЭДС гальванического элемента от добавленного объема титранта. Она обычно имеет S-об-разный вид (рис.8а). Вблизи точки эквивалентности происходит скачкообразное изменение ЭДС, связанное с качественным изменением состава раствора в колбе для титрования. Более точно можно определить точку эквивалентности, дифференцируя кривую потенциометрического титрования (рис.8б,в,г).




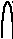




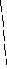


 E
E
2
V
E
E
2
V

V V2 E









т.э. V т.э. V т.э. V т.э. V
а) б) в) г)
Рис.8. Графическое определение точки эквивалентности:
а) кривая титрования; б) дифференциальная кривая по первой
производной; в) дифференциальная кривая по второй производной;
г) в системе координат V/E – V.
Потенциометрическое титрование применяют не только для аналитических целей, но и для определения констант диссоциации слабых электролитов и констант нестойкости комплексных соединений.
Вопросы для самоконтроля
1. Что такое электрод?
2. Как формируется двойной электрический слой: а) при погружении кадмиевой пластинки в раствор сульфата кадмия: б) при погружении серебряной пластинки в раствор нитрата серебра?
3.Что такое электродный потенциал, от чего зависит его величина? Напишите уравнение Нернста для реакции, протекающей на цинковой пластинке в растворе хлорида цинка.
4. Как можно измерить электродный потенциал?
5. Исходя из значений стандартных электродных потенциалов, сравните восстановительную способность железа и никеля, олова и меди, свинца и золота.
6. Какой электрод будет служить катодом при электролизе раствора сульфата меди? Какой электрод будет служить катодом, если погрузить медную и цинковую пластинки в раствор кислоты? Напишите уравнения реакций, протекающих на этих электродах.
7. Окислительно-восстановительный потенциал. Уравнение Нернста - Петерса. Сравните окислительную способность разбавленной и концентрированной азотной кислоты и восстановительную способность хлорид- и иодид-анионов.
8. ЭДС окислительно-восстановительной реакции. Условие самопроизвольного протекания окислительно-восстановительной реакции.
9. Напишите ионное уравнение окислительно-восстановительной реакции, протекающей на платиновом электроде, опущенном в подкисленный раствор дихромата калия и сульфита калия с концентрациями 1 моль/л. Рассчитайте окислительно-восстановительные потенциалы и ЭДС реакции при температуре 25С. Возможно ли самопроизвольное протекание этой реакции в указанных условиях?
10. Сравните условия образования, величину и стабильность диффузионного и мембранного потенциалов.
11. Электроды сравнения и электроды определения. Приведите примеры электродов сравнения. Могут ли эти электроды служить электродами определения?
12. Гальванический элемент. Приведите примеры биметаллического, окислительно-восстановительного, изометаллического концентрационного и газового концентрационного элементов. Изобразите их схемы.
13. Прямая потенциометрия. Сущность, область применения, достоинства и недостатки метода.
14. Как можно использовать прямую потенциометрию для измерения рН растворов?
15. Потенциометрическое титрование. Сущность, область применения, достоинства и недостатки метода.
