- •Лекция 8. Химические свойства алканов. Ациклические непредельные углеводороды.
- •1. Химические свойства.
- •1.2. Сульфонохлорирование.
- •1.3. Нитрование.
- •1.4. Окисление алканов.
- •1.5. Вторичная переработка нефти. Крекинг.
- •2. Алкены.
- •Номенклатура.
- •3. Изомерия структурная и геометрическая.
- •Е, z-номенклатура.
Лекция 8. Химические свойства алканов. Ациклические непредельные углеводороды.
Схема лекции
1. Химические свойства.
1.1. Галогенирование.
1.2. Сульфонохлорирование.
1.3. Нитрование.
1.4. Окисление алканов.
1.5. Вторичная переработка нефти. Крекинг.
2. Алкены. Номенклатура.
3. Изомерия структурная и геометрическая. Е, Z-номенклатура.
1. Химические свойства.
Химические превращения предельных углеводородов могут протекать либо после гомолитического разрыва углерод-углеродных связей, либо за счет отрыва атомов водорода, также обычно гомолитического, и последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.
Расщепление молекулы алкана по σ-связи С-С требует 350 кДж/моль. Расщепление связи С-Н требует 340 - 420 кДж/моль. Т.е. связь углерод-углерод является менее прочной и, казалось бы, реакции должны предпочтительно идти по связи С-С. Однако реакции чаще идут с расщеплением связей С-Н, поскольку эти связи находятся на периферии молекулы и более доступны атаке реагентами.
Наряду с доступностью связей действуют и другие факторы, определяющие реак-ционную способность алканов. Например, по энергии связи С-Н различаются в зависи-мости от того, с каким атом углерода соединен атом водорода. По энергии связи С-Н формируют следующий ряд:

Энергия химической связи относится к разряду так называемых статических факторов, определяющих реакционную способность. На ряду со статическими – действу-ют динамические факторы. В частности в приложении к алканам действует фактор стабильности свободных радикалов.
Определение: Свободными радикалами называются частицы, имеющие один или несколько неспаренных электронов. Наибольшее значение в органической химии имеют свободные радикалы с неспаренным электроном на атоме углерода. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а, следовательно, имеет плоскостное строение:
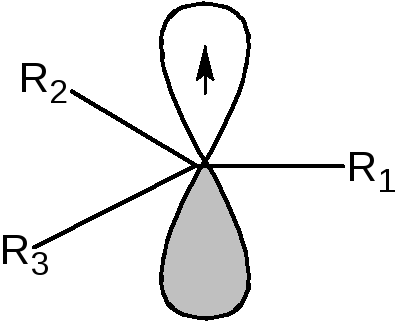
Если радикалы R1, R2и R3являются алкильными радикалами, то возможно взаимодействие (перекрывание) орбитали, на которой находится неспаренный электрон, со связями С-Н:
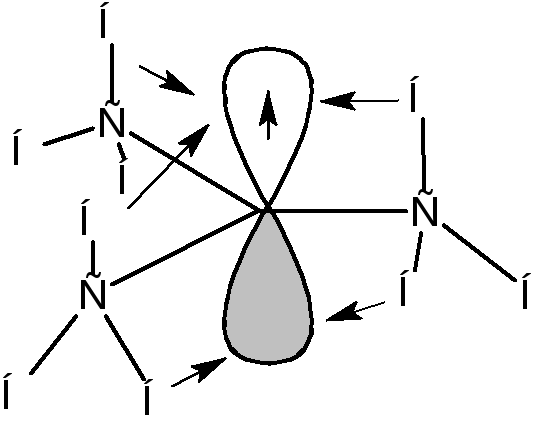
Такое взаимодействие называется сверхсопряжением или гиперконьюгацией. За счет сверхсопряжения неспаренный электрон получает приток электронной плотности с противоположным спином, что способствует его стабилизации. Из этой схемы следует, что чем больше алкильных заместителей у атома, несущего неспаренный электрон, тем более устойчивым является радикал. Соответственно радикалы формируют следующий ряд стабильности:

Ряд стабильности радикалов может иметь другое объяснение. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а алкильные радикалы построены из атомов углерода в состоянии sp3-гибридизации. Поэтому атом углерода, несущий неспаренный электрон является более электроотрицательным, чем атомы углерода заместителей. Соответственно происходит смещение электронной плотности по системе σ-связей к атому, несущему неспаренный электрон. Чем больше будет заместителей, тем больше электронной плотности будет смещено к радикалу, тем выше его стабильность:
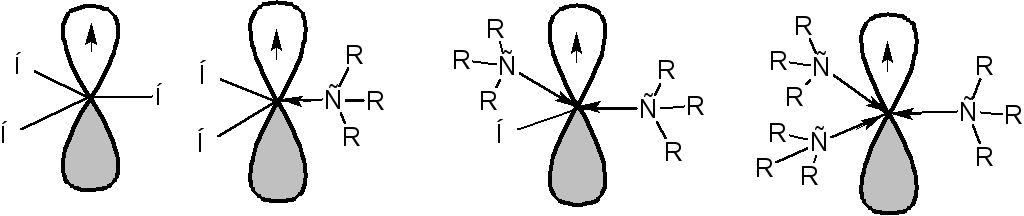
Совокупность статических и динамических факторов определяет характер и направление протекания реакций. В том числе реакций радикального замещения у насыщенного атома углерода. Реакции радикального замещения обозначаются символом SR.
1.1. Галогенирование.
Замещение водородных атомов на атомы галогенов является одной из наиболее характерных реакций предельных углеводородов. Предельные углеводороды вступают в реакцию со всеми галогенами. Причем реакционная способность (скорость галогениро-вания) снижается в ряду фтор > хлор > бром > йод.
Фторирование.
Предельные углеводороды со свободным фтором реагируют со взрывом. Реакции идут очень быстро с большим выделением тепла (горят). Разбавление фтора азотом или применение растворителей, в качестве которых используют полностью фторированные углеводороды, позволяет получать полифтрорированные углеводороды:
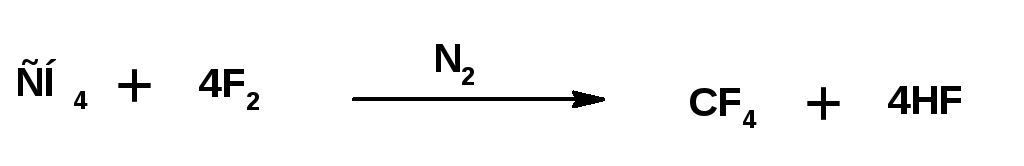
Фторированные углеводороды можно получить с использованием трифторида кобальта.
Хлорирование.
Хлор реагирует с насыщенными углеводородами только под влиянием света, нагревании (300 0С) или в присутствии катализаторов. Причем последовательно замеща-ются хлором все атомы водорода.
Очень важным является вопрос: с одинаковой или различной скоростью замеща-ются атомы водорода у первичного, вторичного и третичного атомов углерода. Много-численными опытами показано, что скорость отщепления атомов водорода изменяется в следующем порядке: третичный > вторичный > первичный. При комнатной температуре, например, относительные скорости на один атом водорода составляют 5.0 : 3.8 : 1.0.
Такое же изменение реакционной способности: третичный > вторичный > первичный – наблюдается и при бромировании, но со значительно большим соотношением относительных реакционных способностей. При 127 0С, например, относительные скорости на один атом водорода составляют 1600 : 82 :1.
Реакционная способность водорода зависит, главным образом, от того, является ли он первичным, вторичным или третичным, а не от алкана, в котором он находится. Стадией, определяющей скорость процесса, является стадия отщепления водород-радикала радикалом галогена.
Легкость отщепления водородных атомов от углерода: третичного > вторичного > первичного > метанового. Различия легкости отщепления, как и большинство различий в скорости родственных реакций, вызваны, вероятно, различиями в Еакт. Найдено, что, чем выше энергия активации, тем больше увеличивается скорость при повышении температуры на определенную величину. Различия в скорости отщепления атомов водорода также вызваны различиями в Еакт. Если этот вывод правильный, то повышение температуры должно больше всего ускорять отщепление первичных атомов водорода и меньше всего – третичных атомов водорода. Следовательно, реакционная способность трех типов атомов водорода будет различаться меньше. Этот эффект выравнивания наблюдался в действительности: по мере повышения температуры относительные скорости в расчете на один атом водорода изменяется от 5.0 : 3.8 : 1.0 до 1 : 1 : 1. при очень высоких температурах фактически каждое столкновение имеет энергию, достаточную для отщепления даже первичного водорода. Следовательно, по мере повышения температуры данный реагент становится менее селективным, и наоборот.
При термическом хлорировании также образуется смесь различных продуктов хлорирования.
Катализаторами реакции, как правило, являются вещества, образующие при температуре реакции свободные радикалы.
Для выяснения роли радикалов в ходе реакции галогенирования, в частности хлорирования, рассмотрим ее механизм.
Определение: Механизм реакции – это истинный путь протекания реакции, который может состоять из совокупности последовательных стадий, приводящих к образованию продуктов из заданных реагентов.
Исследования реакции хлорирования метана или реакции металепсии показали, что эта реакция имеет цепной, радикальный механизм и включает основные три стадии.
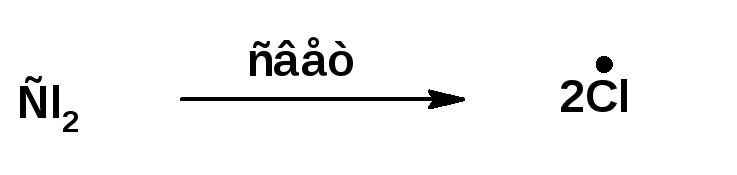
1. Зарождение цепи.
На этой стадии под действием кванта света молекула хлора распадается на два радикала:
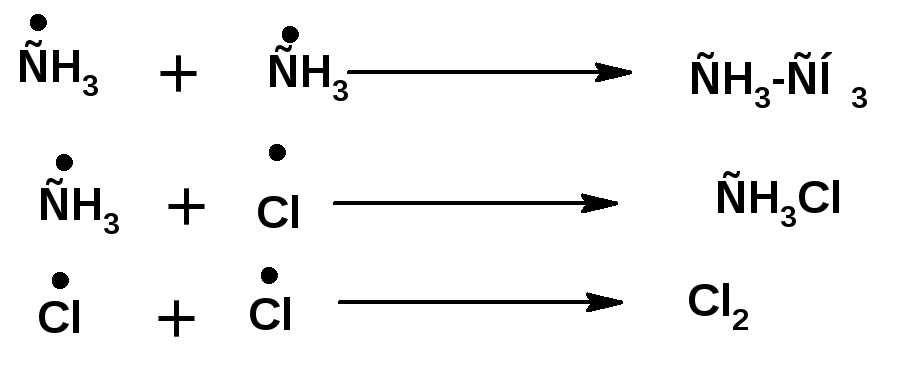
2. Рост цепи:

3. Обрыв цепи:
По ходу реакции можно определить тепловой эффект реакции:
Разрыв молекулы хлора на атомы под действием
фиолетового света, или температуры 3000С 242.8 кДж/моль
Разрыв связи С-Н 427.1 кДж/моль
Образование связи С-Сl -347.5 кДж/моль
Знак «-» означает выделение энергии
Образование связи Н-Сl -431.2 кДэж/моль
Энергетический баланс реакции - 108.8 кДж/моль.
Бромирование.
Реакция бромирования значительно менее экзотермична, чем хлорирование. Причем образование бромистого водорода при росте цепи (отрыв водород-радикала под действием радикала брома) является эндотермической реакцией. Поэтому скорость роста цепи гораздо ниже, чем при хлорировании. Более медленное течение реакции бромирования способствует более высокой избирательности (селективности) по сравнению с хлорированием. Соответственно в продуктах фотохимического бромирования алканов значительно преобладают продукты, образующиеся при разрыве наименее прочной связи С-Н и протекании реакции через наиболее стабильный радикал: