|
Билет
|
Вопросы
|
|
1
|
-
Понятие
о материи и веществе. Предмет химии.
Роль химии в развитии энергетики.
-
Химия
и экология окружающей среды.
-
Какому атому
соответствует электронная формула
1s22s22p63s23p64s23d104p2.
Опишите химические свойства химического
элемента.
|
|
2
|
-
Стехиометрические
законы химии с позиции атомно-молекулярного
учения:
закон постоянства состава, закон
сохранения массы вещества, закон
кратных
отношений,
закон
Авогадро и следствия из него, закон
объемных
отношений.
-
Полимеры.
Олигомеры. Методы
синтеза полимеров.
-
Цинковая руда
содержит 30% сульфида цинка (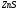 ).
Рассчитайте массу оксида серы (IV),
которую можно получить из 2 тонн такой
руды ).
Рассчитайте массу оксида серы (IV),
которую можно получить из 2 тонн такой
руды
|
|
3
|
-
Классы
неорганических соединений: оксиды,
основания, кислоты, соли. Их номенклатура.
-
Медь.
Электронное строение атомов и степени
окисления. Химические соединения.
Нахождение в
природе,
получение и применение.
-
При электролизе
расплава хлорида натрия выделился
натрий массой 13,8 кг. Определите массу
поваренной соли с массовой долей
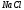 96,8%, которая расходуется на электролиз.
96,8%, которая расходуется на электролиз.
|
|
4
|
-
Закон
эквивалентов. Химический эквивалент.
Расчет мольной массы эквивалента:
элемента, оксида, основания, кислоты,
соли.
-
Железо,
кобальт, никель. Электронное
строение
атомов и степени окисления.
Химические соединения. Нахождение в
природе, применение.
-
Латунь – сплав
меди с массовой долей 68% и цинка с
массовой долей 32%. Определите массу
каждого металла для получения латуни
массой 600 г.
|
|
5
|
-
Основные
понятия химии: химические явления,
простое и сложное вещество,
химический элемент, металлы и неметаллы.
Атомная, молекулярная; молярная
массы, единицы их измерения, моль.
-
Тяжелые
конструкционные металлы: хром,
марганец. Электронное строение
атомов и степени окисления. Химические
соединения. Нахождение
в природе,
получение и применение.
-
Определите
молярную концентрацию 1 л 36,5%-ного
раствора соляной кислоты плотностью
1,18 г/мл.
|
|
6
|
-
Понятие
о термохимии. Закон Гесса и его
следствия.
-
Легкие
конструкционные металлы: магний,
бериллий, алюминий, титан. Электронное
строение атомов и степени окисления.
Взаимодействие с кислотами,
щелочами и кислородом. Нахождение в
природе, получение и применение.
-
Сколько молекул
содержится в 1 мл любого газообразного
вещества при н.у.?
|
|
7
|
-
Понятие
о термодинамике. Первый закон
термодинамики. Внутренняя энергия.
Энтальпия.
-
Металлическая
связь. Кристаллическая структура
металлов. Тины кристаллических
решеток
металлов.
-
Составьте
электронную формулу свинца. Сколько
энергетических уровней в этом атоме?
Сколько электронов находится на
третьем энергетическом уровне в атоме
свинца?
|
|
8
|
-
Второй
закон термодинамики. Энтропия. Энергия
Гиббса. Направленность химических
процессов.
-
Методы
получения чистых металлов (обогащение,
пирометаллургия, гидрометаллургия)
и
особо
чистых металлов
(электронно-лучевая плавка, зонная
плавка, переплав в вакууме, термическое
разложение летучих соединений
металлов).
-
Определите массу
раствора гидроксида калия, необходимого
для нейтрализации 100 мл 0,2М раствора
азотной кислоты
|
|
9
|
-
Химическая
кинетика. Скорость химических реакций.
Зависимость скорости
реакции от различных факторов:
концентрации веществ (закон действия
масс), температуры (правило
Вант-Гоффа),
размера реагирующих веществ,
катализаторов. Цепные реакции.
Колебательные реакции.
-
Распространение
и формы нахождения металлических
элементов в
природе.
-
Мельхиор - сплав
с массовой долей меди 80%, никеля 20%.
Определите массу никеля и меди для
получения мельхиора массой 350кг.
|
|
10
|
-
Химическое
равновесие. Принцип Ле-Шателье. Влияние
температуры, концентрации
веществ
и давления на химические равновесие.
Константа равновесия.
-
Химические
и физические свойства металлов.
Простые соединения металлов
с окислительными элементами: оксиды,
гидроксиды, сульфиды, нитриды,
карбиды, галиды.
-
Гальванический
элемент состоит из никелевого и
серебряного электродов. Рассчитайте
ЭДС такого гальванического элемента
по известным значениям стандартных
потенциалов.
|
|
11
|
-
Развитие
представлений
о
строении атома. Модели строения атома
Томсона
и Резерфорда.
-
Методы
защиты металлов от коррозии:
металлические и неметаллические
покрытия,
катодная и анодная защита, протекторная
защита.
-
Рассчитайте
массовую долю соли в растворе,
полученном при смешивании 150 г 2%-ного
и 350 г 4%-ного растворов.
|
|
12
|
-
Квантовый
характер излучения. Уравнение Планка.
Модели строения атома
Бора-Зоммерфельда.
-
Классы
неорганических соединений: оксиды,
основания, кислоты, соли. Их номенклатура.
-
Рассчитайте ЭДС
гальванического элемента, состоящего
из цинкового и свинцового электродов
по значениям стандартных потенциалов.
|
|
13
|
-
Корпускулярно-волновые
свойства
микрочастиц. Волновое уравнение Луи
де Бройля. Принцип неопределенности
Гейзенберга. Волновое уравнение
Шредингера.
-
Второй
закон термодинамики. Энтропия. Энергия
Гиббса. Направленность химических
процессов.
-
Сколько литров
водорода получится при взаимодействии
воды со сплавом, состоящим из натрия
с массой 4,6 г и калия массой 3,9 г?
|
|
14
|
-
Квантовые
числа, описывающие движение электронов
в атоме: главное, орбитальное,
магнитное, спиновое.
-
Защитные
свойства оксидных пленок. Действие
природной воды на
металлические
конструкции.
-
Вычислите теплоту
образования силиката кальция (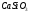 ),
если тепловой эффект реакции
взаимодействия оксида кальция (II)
c
диоксидом кремния 38,5 кДж/моль. ),
если тепловой эффект реакции
взаимодействия оксида кальция (II)
c
диоксидом кремния 38,5 кДж/моль.
|
|
15
|
-
Корпускулярно-волновые
свойства
микрочастиц. Волновое уравнение Луи
де Бройля. Принцип неопределенности
Гейзенберга. Волновое уравнение
Шредингера.
-
Коррозия
металлов. Вида коррозии. Электрохимическая
коррозия металлов
с
водородной и кислородной деполяризацией.
-
В раствор хлорида
олова помещены пластина из железа и
пластина из железа, склепанного медью.
Объясните в каком случае железо будет
разрушаться быстрее. Составьте
уравнения реакций.
|
|
16
|
-
Составление
электронных формул атомов современной
модели строения атома:
порядок заполнения электронных
уровней и подуровней
атома,
принцип
Паули,
правило Гунда,
принцип
наименьшей
энергии
и два правила Клечковского.
-
Электролиз.
Последовательность разряда катионов
и анионов на электродах. Законы
Фарадея.
-
Определите
температуру замерзания раствора,
содержащего 9,2 г этилового спирта в
200 г воды
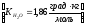 . .
|
|
17
|
-
Состав
ядра (теория Иваненко и
Гапона).
Тины ядерных реакций. Закон
сохранения
массы и заряда.
-
Особенности
электролиза водных растворов и
расплавов солей. Применение электролиза.
-
Какой объем воды
нужно подвергнуть электролизу, чтобы
получить водород, необходимый для
восстановления 0,02 кг оксида меди?
Составьте схему электролиза воды.
|
|
18
|
-
Естественная
радиоактивность. Виды радиоактивного
распада. Период
полураспада.
Правило смещения Содди и Фаянса.
-
Свинцовый
и железо-никелевый аккумуляторы. Их
применение
-
Какой объем
водорода получится из гидрида кальция
( )
массой 200 кг при взаимодействии его
с водой, если гидрид кальция содержит
12% примесей? )
массой 200 кг при взаимодействии его
с водой, если гидрид кальция содержит
12% примесей?
|
|
19
|
-
Искусственная
радиоактивность. Термоядерные реакции.
-
Гальванические
элементы.
Определение ЭДС гальванического
элемента. Явления
поляризации и деполяризации в
гальваническом элементе.
-
Вычислите
изменение энтропии в реакции
 ,
используя табличные данные
термодинамических характеристик
веществ. ,
используя табличные данные
термодинамических характеристик
веществ.
|
|
20
|
-
Изотопы.
Элементы-одиночки
и элементы-плеяды. Устойчивые и
радиоактивные
изотопы. Использование изотопов в
науке и технике.
-
Методы
составления окислительно-восстановительных
реакций: электронного
баланса и электронно-ионный
метод.
-
Вычислите
температуру начала образования
цементита, используя табличные данные
термодинамических характеристик
веществ:
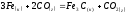 . .
|
|
21
|
-
Диэлектрическое
развитие периодического закона Д.И.
Менделеева на основе
закона Мозли и электронного строения
атома.
-
Степень
окисления. Окислительно-восстановительные
реакции. Типы окислительно-восстановительных
реакций. Определение
окислительно-восстановительных
свойств элементов.
-
Составьте реакцию
термической диссоциации карбоната
кальция. Рассчитайте процент содержания
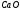 в карбонате кальция.
в карбонате кальция.
|
|
22
|
-
Принцип
построения периодической системы
Д.И. Менделеева на основе электронных
оболочек
атома.
-
Гидролиз
солей.
Типы гидролиза.
-
Сколько негашеной
извести можно получить при прокаливании
10 кг известняка, содержащего 80%
карбоната кальция.
|
|
23
|
-
Энергетические
характеристики атомов: энергия
ионизации, энергия сродства
к электрону, электроотрицательность.
-
Ионно-молекулярные
реакции. Произведение растворимости.
-
В какой
последовательности будут выделяться
на катоде металлы при электролизе
раствора, содержащего ионы:
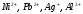 . .
|
|
24
|
-
Изменения
химических свойств элементов и атомных
радиусов элементов
по
периодам и группам в периодической
системе Д.И. Менделеева.
-
Электролитическая
диссоциация воды, Водородный и
гидроксидный
показатели.
Индикаторы.
Какова массовая доля меди в малахите
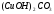 ? ?
|
|
25
|
-
Химическая
связь. Энергия связи и длина связи.
Типы химической связи:
ковалентная
Состояние сильных электролитов в
растворах: кажущаяся степень
диссоциации,
ионная среда растворов (ионная сила
растворов)., ионная, металлическая.
Свойства ковалентной связи.
-
Химические
электроды. Электродные потенциалы.
Ряд стандартных электродных
потенциалов, его особенности. Формула
Нернста.
-
К раствору,
содержащему 30 г
 ,
прибавили 10 г гранул цинка. Какая
масса железа образовалась в осадке? ,
прибавили 10 г гранул цинка. Какая
масса железа образовалась в осадке?
|
|
26
|
-
Гибридизация
атомных
орбиталей и строение простых молекул.
-
Электролиты.
Теория электролитической диссоциации
Аррениуса. Причины
диссоциации электролитов. Изотонический
коэффициент.
-
В воду помещены
пластины: одна из оцинкованного железа
( ),
а другая пластина из луженого железа
( ),
а другая пластина из луженого железа
(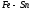 ).
Составьте реакции, протекающие на
пластинах. ).
Составьте реакции, протекающие на
пластинах.
|
|
27
|
-
Водородная
химическая
связь. Межмолекулярное взаимодействие
(ван-дерваальсовая
связь).
-
Степень
окисления. Окислительно-восстановительные
реакции. Типы окислительно-восстановительных
реакций. Определение
окислительно-восстановительных
свойств элементов.
-
Карборунд
получают прокаливанием песка с углем
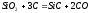 .
Какая масса песка и угля, массовая
доля углерода в котором 95%, потребуется
для получения карборунда массой 200
кг? .
Какая масса песка и угля, массовая
доля углерода в котором 95%, потребуется
для получения карборунда массой 200
кг?
|
|
28
|
-
Растворы.
Физическая и химическая теория
растворов. Сольваты, гидраты,
кристаллогидраты. Растворимость.
-
Распространение
и формы нахождения металлических
элементов в
природе.
-
Вычислите массу
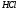 ,
содержащейся в 500 мл раствора, если
на титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора ,
содержащейся в 500 мл раствора, если
на титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
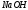 . .
|
|
29
|
-
Классификация
растворов. Концентрация растворов:
процентная, молярная,
эквивалентная
(нормальная), моляльная, в мольных
долях, титр.
-
Типы химической
связи и их особенности.
Вычислите массу
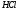 ,
содержащейся в 500 мл раствора, если на
титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора ,
содержащейся в 500 мл раствора, если на
титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
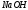 . .
|
|
30
|
-
Неэлектролиты.
Законы Рауля (тонометрический,
криометрический, эбу-лиометрический)
и осмотический закон Вант-Гоффа,
характеризующие свойства
разбавленных растворов неэлектролитов.
-
Химические
электроды. Электродные потенциалы.
Ряд стандартных электродных
потенциалов, его особенности. Формула
Нернста.
-
Определите
координаты атома в периодической
системе по его электронной формуле:
1s22s22p63s23p63d104s24p2.
Опишите химические свойства данного
элемента.
|


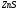 ).
Рассчитайте массу оксида серы (IV),
которую можно получить из 2 тонн такой
руды
).
Рассчитайте массу оксида серы (IV),
которую можно получить из 2 тонн такой
руды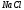 96,8%, которая расходуется на электролиз.
96,8%, которая расходуется на электролиз.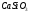 ),
если тепловой эффект реакции
взаимодействия оксида кальция (II)
c
диоксидом кремния 38,5 кДж/моль.
),
если тепловой эффект реакции
взаимодействия оксида кальция (II)
c
диоксидом кремния 38,5 кДж/моль.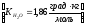 .
. )
массой 200 кг при взаимодействии его
с водой, если гидрид кальция содержит
12% примесей?
)
массой 200 кг при взаимодействии его
с водой, если гидрид кальция содержит
12% примесей? ,
используя табличные данные
термодинамических характеристик
веществ.
,
используя табличные данные
термодинамических характеристик
веществ.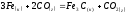 .
.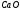 в карбонате кальция.
в карбонате кальция.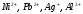 .
.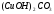 ?
? ,
прибавили 10 г гранул цинка. Какая
масса железа образовалась в осадке?
,
прибавили 10 г гранул цинка. Какая
масса железа образовалась в осадке? ),
а другая пластина из луженого железа
(
),
а другая пластина из луженого железа
(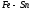 ).
Составьте реакции, протекающие на
пластинах.
).
Составьте реакции, протекающие на
пластинах.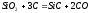 .
Какая масса песка и угля, массовая
доля углерода в котором 95%, потребуется
для получения карборунда массой 200
кг?
.
Какая масса песка и угля, массовая
доля углерода в котором 95%, потребуется
для получения карборунда массой 200
кг?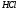 ,
содержащейся в 500 мл раствора, если
на титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
,
содержащейся в 500 мл раствора, если
на титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
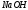 .
.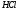 ,
содержащейся в 500 мл раствора, если на
титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
,
содержащейся в 500 мл раствора, если на
титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
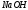 .
.