
- •2.21. Укажите запись объединенного газового закона.
- •2.27. Что характеризует функция распределения Максвелла?
- •1. Относительное число молекул, которые в данный момент времени имеют значения скорости, лежащие в интервале 5 м/ с вблизи заданной скорости.
- •2.31. Какие утверждения справедливы для идеального газа?
- •1. Не изменилась.
- •5. Не изменилась.
- •1) Увеличится в 2 раза; 2) увеличится в раз;
- •3) Уменьшится в раз; 4) увеличится в 4 раза.
- •2. Не изменилась.
Молекулярная физика
2.1. Выберите закон Гей-Люссака.
-
р = р0(1 + Т).
-
рV = const.
-
V /Т = const.
-
М/ = .
-
рV = RT.
2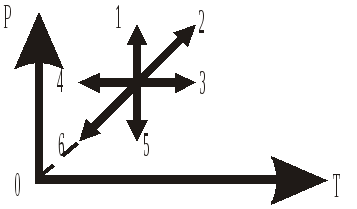 .2.
На графике изображены процессы в
координатах давление P
– температура Т, имеющие одинаковое
исходное состояние. Какие из графиков
являются изохорой идеального газа?
.2.
На графике изображены процессы в
координатах давление P
– температура Т, имеющие одинаковое
исходное состояние. Какие из графиков
являются изохорой идеального газа?
1) 1 2) 2,6 3)3,4
4) 1,5 5) 2
2.3. Какие утверждения справедливы для идеального газа?
1. Взаимодействие молекул на расстоянии отсутствует.
2. Уравнение Менделеева-Клапейрона описывает состояние газа.
3. Молекулы газа взаимодействуют на расстоянии.
4. Внутренняя энергия равна сумме кинетической и потенциальной энергии взаимодействия молекул газа.
5. Собственным объемом молекул можно пренебречь по сравнению с объемом сосуда, в котором газ находится.
1) 1, 2, 5; 2) 3, 4; 3) 2, 3; 4) 1, 4; 5) 2, 5.
2.4. При увеличении абсолютной температуры идеального газа в 4 раза средняя квадратичная скорость движения его молекул:
1) увеличится
в 2 раза; 2) увеличится в
![]() раз;
раз;
3) уменьшится
в
![]() раз; 4) увеличится в 4 раза.
раз; 4) увеличится в 4 раза.
2.5. Какое число частиц находится в 16 г кислорода?
1) 5·1023; 2) 2·1023; 3) 3·1023; 4) 6 ·1023.
2.6. Какой газ называется идеальным?
1. Газ, размеры молекул которого малы по сравнению с длиной свободного пробега.
2. Газ, молекулы которого никогда не взаимодействуют между собой.
3. Газ, молекулы которого сталкиваются как упругие шары.
4. Газ, молекулы которого отражаются от стенок сосуда как упругие шары.
5. Газ, объём молекул которого мал по сравнению с объемом сосуда.
1) 3, 4, 5; 2) 2; 3) 3; 4) 2, 3; 5) 1.
2.7. Укажите запись объединенного газового закона.
1)
![]() ; 2)
; 2) ![]() ; 3)
; 3) ![]() ; 4)
; 4)
![]() .
.
2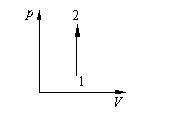 .8.
Для данной массы идеального газа
изменение давления р в зависимости от
объема V
представлена на рисунке. Какой процесс
соответствует переходу газа из состояния
1 в состояние 2?
.8.
Для данной массы идеального газа
изменение давления р в зависимости от
объема V
представлена на рисунке. Какой процесс
соответствует переходу газа из состояния
1 в состояние 2?
-
Изотермическое увеличение объема.
-
Изохорическое уменьшение температуры.
-
Изохорическое увеличение давления.
-
Изобарическое увеличение температуры.
-
Изохорическое уменьшение давления.
2.9. От каких термодинамических параметров зависит энергия молекулы газа? (р- давление газа, V- объём газа, Т- абсолютная температура газа)
1) р, V и Т.
2) р и V.
3) р.
4) V.
5) Т.
2.10. Найти внутреннюю энергию двухатомного газа, находящегося в сосуде объемом 2 л под давлением 150 кПа.
1) 750 Дж; 2) 1000 Дж; 3) 600 Дж; 4) 400 Дж.
2.11. Какие утверждения справедливы для идеального газа?
-
Взаимодействие молекул на расстоянии отсутствует.
-
Уравнение Менделеева-Клапейрона описывает состояние газа.
-
Молекулы газа взаимодействуют на расстоянии.
-
Внутренняя энергия равна сумме кинетической и потенциальной энергии взаимодействия молекул газа.
-
Собственным объемом молекул можно пренебречь по сравнению с объемом сосуда, в котором газ находится.
-
3; 2) 1, 2, 5; 3) 4; 4) 3, 4.
2.12. Укажите формулу для расчета средней арифметической скорости.
1)
![]() ;
2)
;
2)
![]() ; 3)
; 3)
![]() ;
4)
;
4)
![]() ; 5)
; 5)
![]() .
.
2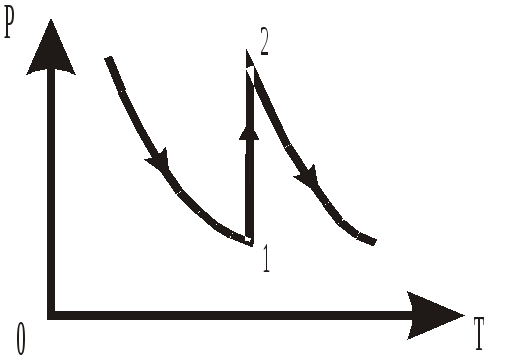 .13.
Для данной массы идеального газа
изменение давления Р в зависимости от
объема V
представлено на рисунке. Какой процесс
соответствует переходу газа из состояния
1 в состояние 2?
.13.
Для данной массы идеального газа
изменение давления Р в зависимости от
объема V
представлено на рисунке. Какой процесс
соответствует переходу газа из состояния
1 в состояние 2?
1. Изотермическое увеличение давления.
2. Изохорическое уменьшение температуры.
3. Изохорическое увеличение давления.
4. Изобарическое увеличение температуры.
5. Изохорическое уменьшение давления.
2.14. При взвешивании груза в воздухе показание динамометра равно 2 Н. При опускании груза в воду показание динамометра уменьшается до 1,5 Н. Выталкивающая сила равна…
1) 0,5 Н; 2) 1,5 Н; 3) 2 Н; 4) 3,5 Н.
2.15. При осуществлении какого изопроцесса увеличение давления в 2 раза приведет к увеличению температуры тоже в 2 раза?
-
Изотермического.
-
Изобарного.
-
Изохорного.
-
Такого процесса не может быть в принципе.
2.16. Приведите верную запись закона Бойля-Мариотта.
1.
![]() . 2.
p
= nkT. 3.
p
= F/S.
. 2.
p
= nkT. 3.
p
= F/S.
4.
![]() . 5.
. 5.
![]() .
.
2.17. Какая из величин не относится к термодинамическим параметрам? 1. Т – абсолютная температура. 2. р – давление. 3. V – объем вещества. 4. Число молей вещества. 5. Масса одной молекулы.
1) 1, 2, 3; 2) 2; 3) 3; 4) 4, 5; 5) 2, 5.
2.18. Как изменяется характер кривой распределения Максвелла при увеличении температуры?
1. Максимальное значение увеличивается, максимум смещается вправо.
2. Максимальное значение уменьшается, максимум смещается влево.
3. Максимальное значение уменьшается, максимум смещается вправо.
4. Максимальное значение увеличивается, максимум смещается влево.
5. Не изменяется.
2.19. Какой процесс соответствует переходу идеального газа из состояния 1 в состояние 2?

-
Изотермический.
-
Изобарический.
-
Изохорический.
-
Адиабатический.
-
Политропический.
2.20. Найти плотность водорода при температуре 15 °С и давлении 97,3 кПа.
1) 0,1 кг/м3; 2) 0,08 кг/м3; 3) 0,05 кг/м3; 4) 0,2 кг/м3.
2.21. Укажите запись объединенного газового закона.
-
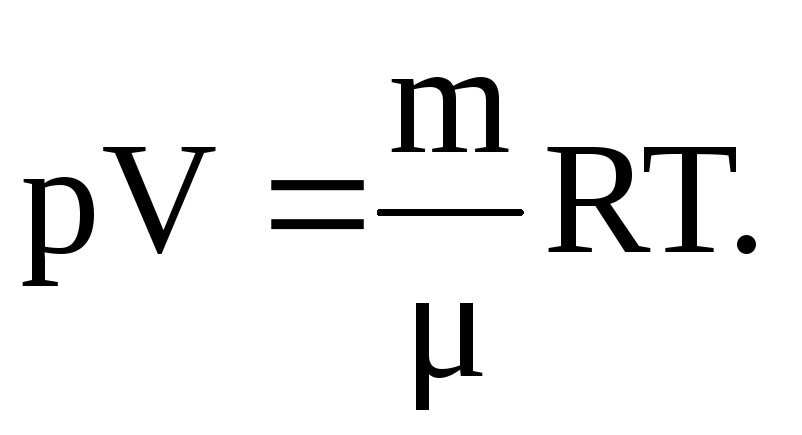
-
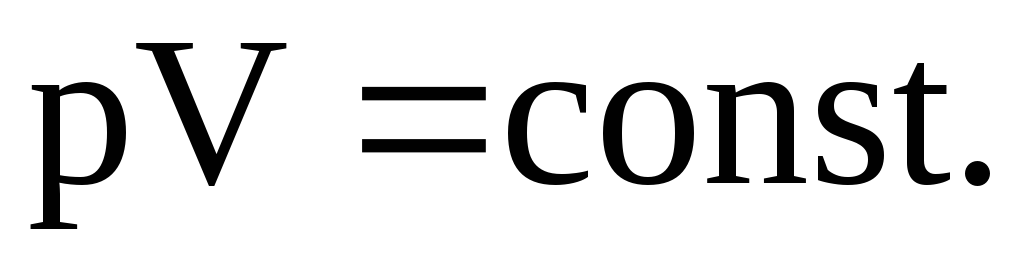
-
 .
. -
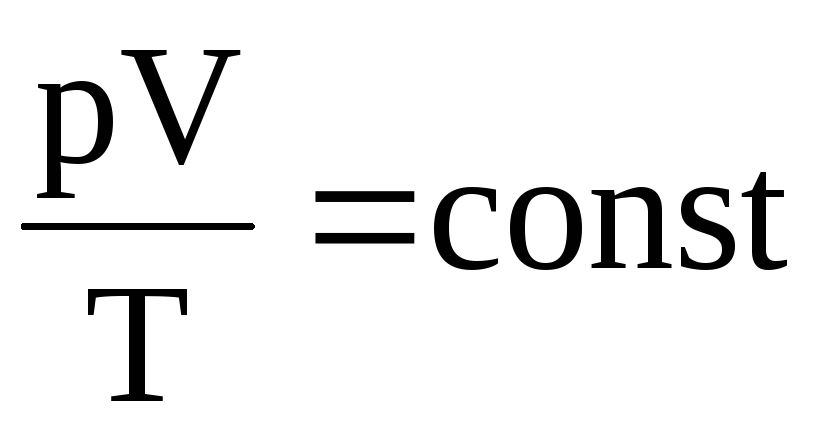 .
. -
2.22. Что характеризует функция распределения Максвелла?
1. Относительное число молекул, которые в данный момент времени имеют заданную скорость.
2. Точное число молекул, которые в данный момент времени имеют значения скорости, лежащие в единичном интервале скоростей вблизи заданной скорости.
3. Вероятность того, что молекулы в данный момент времени имеют значения скорости, лежащие в единичном интервале скоростей вблизи заданной скорости.
4. Общее число молекул, которые в данный момент времени имеют заданную скорость.
5. Относительное число молекул, которые в данный момент времени имеют значения скорости, лежащие в интервале 5 м/ с вблизи заданной скорости.
2 .23.
На рисунке изображен график зависимости
давления газа на стенки сосуда от
температуры. Какой процесс изменения
состояния газа изображен?
.23.
На рисунке изображен график зависимости
давления газа на стенки сосуда от
температуры. Какой процесс изменения
состояния газа изображен?
1) изобарное нагревание;
2) изохорное охлаждение;
3) изотермическое сжатие;
4) изохорное нагревание.
2.24. Молярная теплоемкость двухатомных газов при постоянном объеме равна…
1) 0,5 R; 2) 1,5 R; 3) 2,5 R; 4) 3 R; 5) 3,5 R.
2.25. Абсолютную температуру газа и его объем одновременно увеличили в 2 раза. Как при этом изменится давление газа?
1) увеличится в 2 раза; 2) увеличится в 4 раза;
3) уменьшится в 2 раза; 4) уменьшится в 4 раза;
5) не изменится.
2 .26.
Какой график верно изображает
зависимость средней кинетической
энергии частиц идеального газа от
абсолютной температуры?
.26.
Какой график верно изображает
зависимость средней кинетической
энергии частиц идеального газа от
абсолютной температуры?
1) 1; 2) 2;
3) 3; 4) 4.
2.27. Что характеризует функция распределения Максвелла?
1. Относительное число молекул, которые в данный момент времени имеют значения скорости, лежащие в интервале 5 м/ с вблизи заданной скорости.
2. Точное число молекул, которые в данный момент времени имеют значения скорости, лежащие в единичном интервале скоростей вблизи заданной скорости.
3. Относительное число молекул, которые в данный момент времени имеют заданную скорость.
4. Общее число молекул, которые в данный момент времени имеют заданную скорость.
5. Вероятность того, что молекулы в данный момент времени имеют значения скорости, лежащие в единичном интервале скоростей вблизи заданной скорости.
2.28. На рисунке в координатах давление Р – температура Т стрелкой указано направление изопроцесса идеального газа. Что это за процесс?
-
И
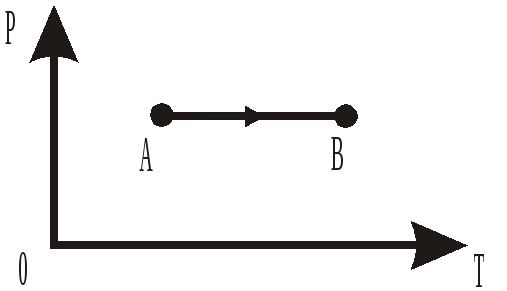 зохорическое
нагревание.
зохорическое
нагревание. -
Изобарическое охлаждение.
-
Изотермическое расширение.
-
Изобарическое нагревание.
-
Изохорическое охлаждение.
2.29. Укажите формулу Лапласа для расчета добавочного давления.
1. р V=const. 2. p = nkT. 3. p = p1 + p2 +… + pN.
4.
![]() . 5.
. 5.
![]() .
.
2.30. В закрытом сосуде температура газа увеличилась от 10 до 50 °С. Как изменилось давление газа?
-
Увеличилась в 5 раз;
-
Уменьшилось в 5 раз;
-
Не изменилась;
-
Среди ответов 1)-3)нет правильного.
2.31. Какие утверждения справедливы для идеального газа?
А. Молекулы газа – очень маленькие упругие шарики, обладающие массой.
Б. Учитывается только силы притяжения между молекулами газа.
В. Потенциальной энергией молекул газа пренебрегают, учитывается только их средняя кинетическая энергия поступательного движения.
1) только А; 2) только Б; 3) только В; 4) А и В.
2.32. При кипении воды…
А) увеличивается ее внутренняя энергия;
Б) увеличивается ее температура
Выберите верное утверждение:
1) только А; 2) только Б; 3) А и Б; 4) Ни А, ни Б.
2 .33.
На графике изображены процессы в
координатах давление Р – температура
Т, имеющие одинаковое исходное состояние
А. Какие из графиков являются изохорой
идеального газа? Укажите номера.
.33.
На графике изображены процессы в
координатах давление Р – температура
Т, имеющие одинаковое исходное состояние
А. Какие из графиков являются изохорой
идеального газа? Укажите номера.
1) 1,5 2) 2,61 3) 4,3
4) 1 5) 4
2.34. Уравнение Ван-дер-Ваальса хорошо описывает состояние…
1) реального газа.
2) разряженного газа.
3) одноатомного газа
4) идеального газа.
5) многоатомного газа.
2.35. Укажите формулу для расчета наиболее вероятной скорости.
1)
![]() ;
2)
;
2)
![]() ; 3)
; 3)
![]() ;
4)
;
4)
![]() ; 5)
; 5)
![]() .
.
2.36. Выберите уравнение состояния идеального газа.
1) р = рo(1 + t); 2) рV = const; 3) V = Vot;
4) M/ = ; 5) рV = RT.
2.37. В первом сосуде находится 8 г кислорода, во втором – 6 г азота, а в третьем – 9 г углекислого газа. В каком из сосудов находится наибольшее количество молекул, а в каком – наименьшее?
1) в первом – наибольшее, во втором – наименьшее;
2) в первом – наименьшее, во втором – наибольшее;
3) в первом – наибольшее, в третьем – наименьшее;
4) в первом – наименьшее, в третьем – наибольшее;
5) во втором – наибольшее, в третьем – наименьшее;
6) во втором – наименьшее, в третьем – наибольшее.
2.38. Какой график характеризует процесс изобарического сжатия?

2.39. Ацетилен из баллона с давлением Р поступает через редуктор в газовую горелку. При этом его давление уменьшается в десять раз, а температура Т убывает вдвое. Как изменится его молярная масса?
-
Увеличится в 5 раз.
-
Уменьшится в 5 раз.
-
Увеличится в 10 раз.
-
Не изменится.
-
Уменьшится в 10 раз.
2.40. Какая постоянная характеризует число молекул, содержащихся в одном моле различных веществ?
-
Постоянная Больцмана;
-
Универсальная газовая постоянная;
-
Число Авогадро;
-
Гравитационная постоянная;
-
Постоянная Планка.
2.41. Какие утверждения справедливы для идеального газа?
-
Взаимодействие молекул на расстоянии отсутствует.
-
Уравнение Менделеева-Клапейрона описывает состояние газа.
-
Молекулы газа взаимодействуют на расстоянии.
-
Внутренняя энергия равна сумме кинетической и потенциальной энергии взаимодействия молекул газа.
-
Собственным объемом молекул можно пренебречь по сравнению с объемом сосуда, в котором газ находится.
1) 5 2) 1,2,5 3) 4
4) 1 5) 5
2.42. Найдите выражение закона Дальтона.
1. р V=const. 2. p = nkT. 3. p = p1 + p2 +… + pN.
4.
![]() . 5.
. 5.
![]() .
.
2.43. Что такое число степеней свободы?
1. Максимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве.
2. Минимальное количество независимых координат, необходимых для описания положения молекулы в пространстве.
3. Минимальное количество координат, необходимых для однозначного описания положения молекулы в атоме.
4. Количество координат, необходимых для однозначного описания положения молекулы в кристаллической решетке.
5. Минимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве.
2.44. Укажите численное значение постоянной Больцмана.
1) 1,38·10-23 Дж/К; 2) 1,38·1023 Дж/К; 3) 6,02·1023 моль-1;
4) 8, 31 Дж/(моль); 5) 8, 31 Дж/(моль К).
2.45. Абсолютная температура газа возросла в 2 раза. Во сколько раз изменилась средняя арифметическая скорость молекул?
