
2013.Термодинамика / Thermo-I / Therm_5
.doc
равновесной системе), свободная энергия сохраняется, так как из (13) dF=0 при A=0. Поэтому сводную энергию называют также изохорно-изотермическим потенциалом.
4 Изобарно-изотермическая равновесная система: dT=dp=diS=0.Здесь из (6) получаем A’=-dU+pdV-TdS=-d(U+pV-TS). (14)
Квазистатическая “механическая” работа равна изменению (с обратным знаком) новой экстенсивной функции состояния – термодинамическому потенциалу Гиббса =U+pV-TS=H-TS=F+pV, (15)
называемому также свободной энтальпией, энергией Гиббса, изобарно-изотермическим потенциалом. (p,T). Используя (14) перепишем (15) в виде A’=-d, (16) а после интегрирования AA’=-.
(p,T). играет роль термодинамического потенциала в отношении квазистатической “немеханической” работы в изобарно-изотермических условиях. (p,T) Знак минус в (16) перед d означает, что термодинамический потенциал Гиббса снижается при совершении системой квазистатической «немеханической» работы.
Термодинамический потенциал сохраняется в равновесной изобарно-изотермической простой системе. Из (16) видно, что d=0 при A’=0.
В изобарно-изотермической равновесной системе одновременно Q=dH, поскольку система изобарна, A=-dF, поскольку система изотермична и равновесна, A’=-d, поскольку система изобарно-изотермична и равновсна.
В изохорно-изотермической простой равновесной системе одновременно Q=dU, поскольку система изохорна, проста и равновесна,A=-dF поскольку система изотермична и равновесна.
Если система изотермична, но не равновесна, то вместо (13) A=-dF-TdiS.. Поскольку diS>0, то в общем случае (не квазистатическом) A<-dF, A<Aквазистат.=-dF
Для изобарно-изотермической системы также для неквазистатического случая имеем A’<-d, A’<‘Aквазистат.=-d -«немеханическая» работа, совершаемая изобарно-изотермической системой, максимальна в квазистатических условиях.
Два важных свойства термодинамических потенциалов:
-
в специальных условиях изменение термодинамических потенциалов равно теплоте или работе. Изменение термодинамических потенциалов при квазистатических процессах равно максимальной работе или максимальной теплоте.
-
В специальных условиях термодинамические потенциалы подчиняются законам сохранения.
В дальнейшем мы рассмотрим и другие свойства термодинамических потенциалов. Свойства термодинамических потенциалов и определяют их физический смысл.
Дифференциалы термодинамических потенциалов
Подставляя в основное термодинамическое равенство (3) выражение для термодинамических потенциалов (10),(12) и (15) можно записать основное термодинамическое равенство в виде эквивалентных выражений
dU=TdS-pdV-A’-TdiS; (19)
dH=TdS+Vdp-A’-TdiS (20)
dF=-SdT-pdV-A’-TdiS (21)
d=-SdT+Vdp-A’-TdiS (22)
Для простой системы
dU=TdS-pdV-TdiS; (23)
dH=TdS+Vdp-TdiS; (24)
dF=-SdT-pdV-TdiS; (25)
d=-SdT+Vdp-TdiS; (26)
Для простой равновесной системы
dU=TdS-pdV; (27)
dH=TdS+Vdp; (28)
dF=-SdT-pdV; (29)
d=-SdT+Vdp; (30)
Термодинамическим
потенциалом является и энтропия,
действительно, из (23) для простой системы
dS=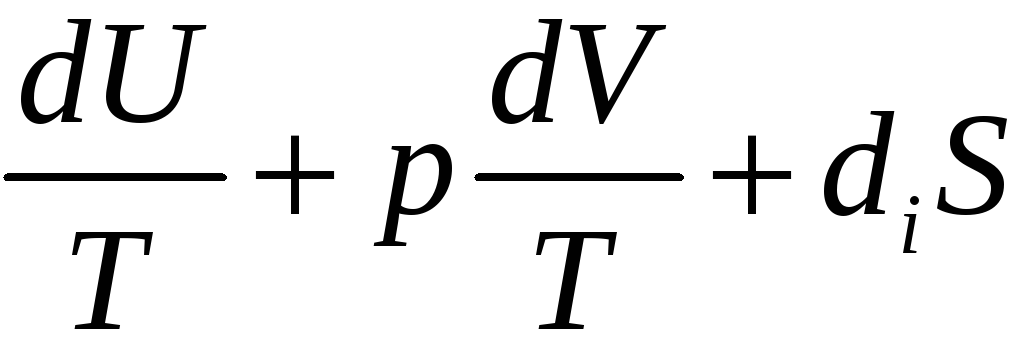 (31)
S(U,V).
Энтропия
сохраняется в изохорно-изоэнергетической
системе.
(31)
S(U,V).
Энтропия
сохраняется в изохорно-изоэнергетической
системе.
Из экстенсивных термодинамических потенциалов U,H,F,,S можно образовать мольные термодинамические потенциалы u=U/n; h=H/n; F=F/n; =/n; s=S/n, которые, как и все мольные параметры являются характеристиками не системы, а вещества, составляющего систему.
Для мольных термодинамических потенциалов справедливы те же соотношения, что и для экстенсивных потенциалов. Так, вместо (10), (12), (15) h=u+pv ; f=u-Ts; =u+pv-Ts=h-Ts=f+pv,
а вместо (27)-(31)
du=Tds-pdv;
dh=Tds+vdp;
df=-sdT-pdv;
d=-sdT+vdp;
ds=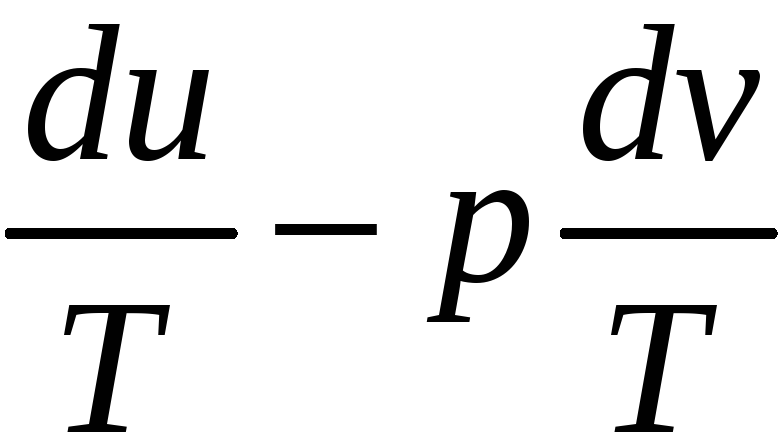 .
.
Задание Для самостоятельной работы:
-
От переменной v можно перейти к переменной =
 - мольной атомной плотности. Запишите
выражения для du,dh,df,d,ds
при замене v
на 1/.
- мольной атомной плотности. Запишите
выражения для du,dh,df,d,ds
при замене v
на 1/. -
Введем плотности u=u внутренней энергии, s=s - энтропии, h=h -энтальпии, f=f - свободной энергии Гельмгольц, = - термодинамического потенциала Гиббса. Запишите основное термодинамическое равенство для дифференциалов плотностей du, dh, df, d, ds.
Теплоемкость
Теплоемкость
представляет собой функциональную
производную
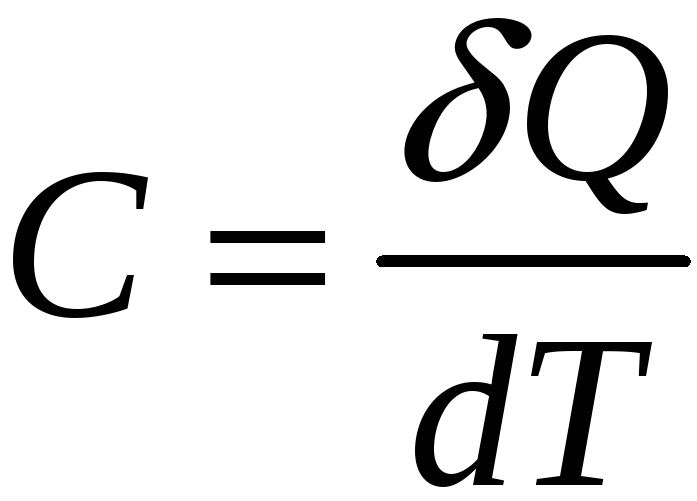 (28)
(28)
(В общем случае Q не полный дифференциал и C не полная производная).
Рассмотрим некоторые специальные условия:
-
Адиабатическая теплоемкость. При
 .CQ=0.
.CQ=0. -
Изотермическая теплоемкость. При dT=0 CT=
Адиабатическая и изотермическая теплоемкость характеризует не вещество, и не систему, а условия, в которых находится система.
Может показаться неожиданной возможность бесконечно большой теплоемкости, какой всегда является CT. Между тем, такую ситуацию легко наблюдать. Бесконечную теплоемкость имеет кипящая вода. К ней подводится тепло (Q0), но температура не меняется (dT=0), пока происходит кипение. Тающий лед.
-
Изохорная теплоемкость. Подставляя в (28) Qv=dU=TdS, получим
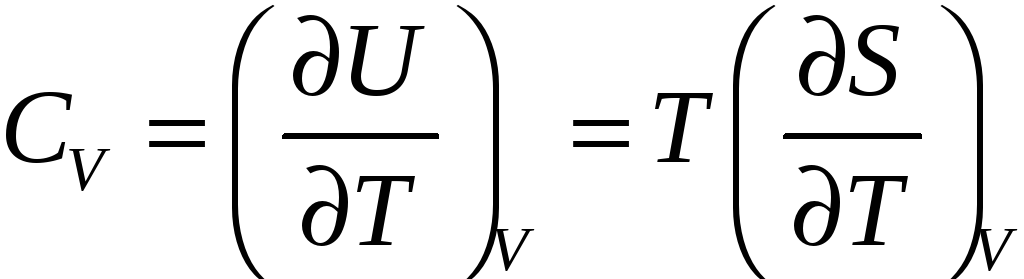 .
. -
Изобарная теплоемкость. Подставляя в (28) Qp=dH=T(dS)p получим Cp=

В отличие от CQ
и CT
изобарная и изохорная теплоемкости
являются экстенсивными характеристиками
системы. Для мольных теплоемкостей cp
и cV
имеем выражения  (29)
(29)
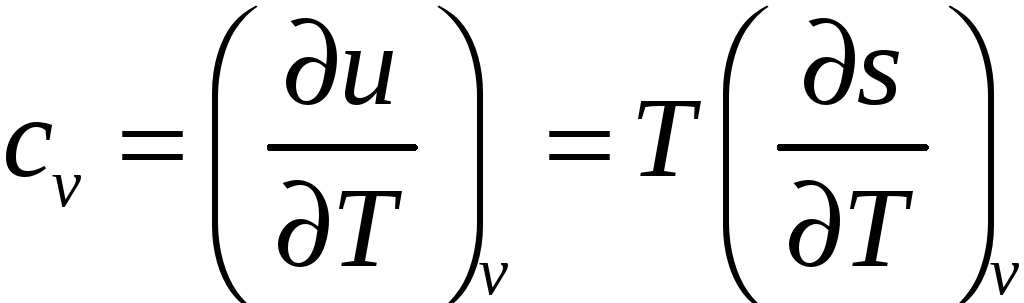 (30)
(30)
Теплоемкость системы – экстенсивный параметр. Мольные теплоемкости, изобарная и изохорная (но не адиабатическая и изотермическая) являются характеристиками вещества, Составляющего систему (однофазную).
Если из эксперимента известна теплоемкость как функция температуры (обычно при p=const), может быть определена по формуле
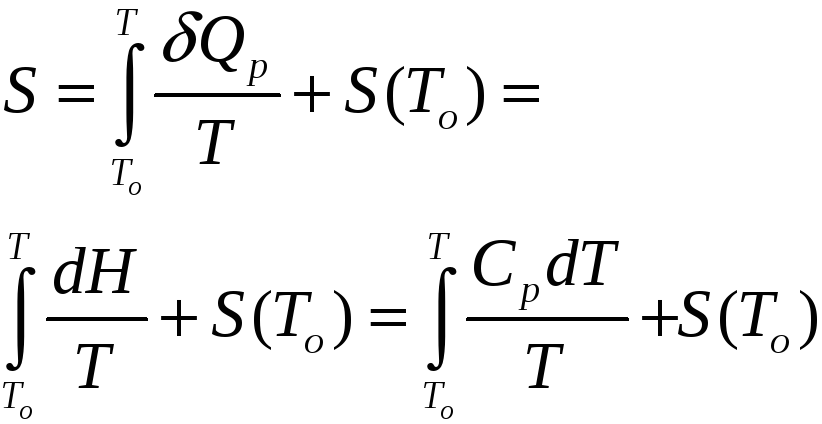 или
или
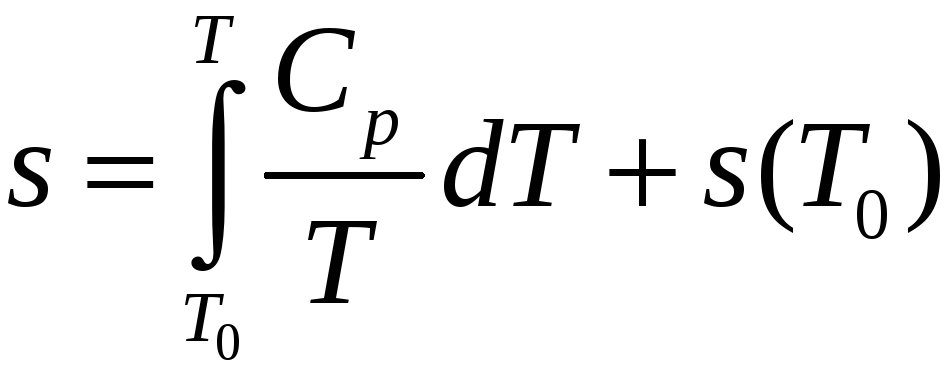 (31)
(31)
Формула (31) выводится
из равновесного уравнения
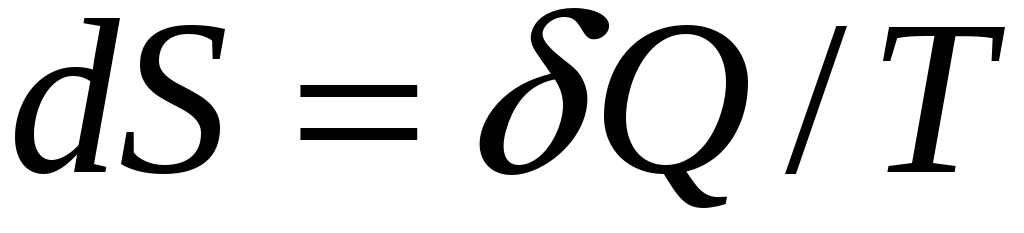 .
Следовательно, функция
.
Следовательно, функция
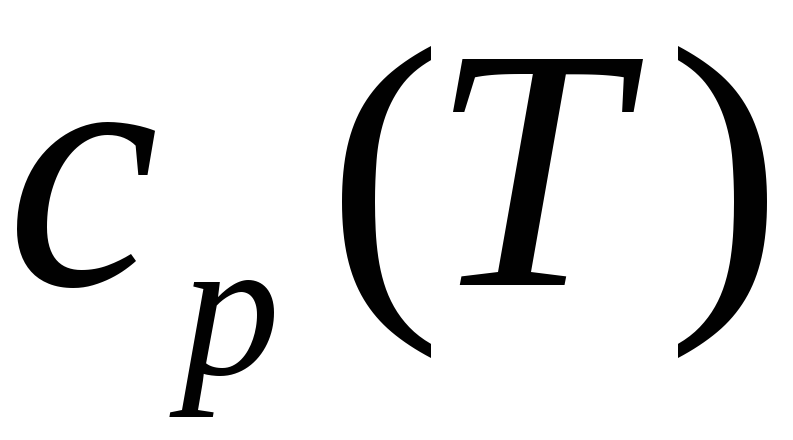 должна быть равновесной, измеренной
при квазистатическом изменении
температуры (очень медленное изменение
желательно с длительными изотермическими
остановками). В действительном эксперименте
непосредственно измеряется теплоемкость
(калориметром), а энтропия определяется
по формуле (31).Если измерение начинается
от температуры Т0
, близкой
к 0К, то
должна быть равновесной, измеренной
при квазистатическом изменении
температуры (очень медленное изменение
желательно с длительными изотермическими
остановками). В действительном эксперименте
непосредственно измеряется теплоемкость
(калориметром), а энтропия определяется
по формуле (31).Если измерение начинается
от температуры Т0
, близкой
к 0К, то и, согласно третьему началу термодинамики
и, согласно третьему началу термодинамики
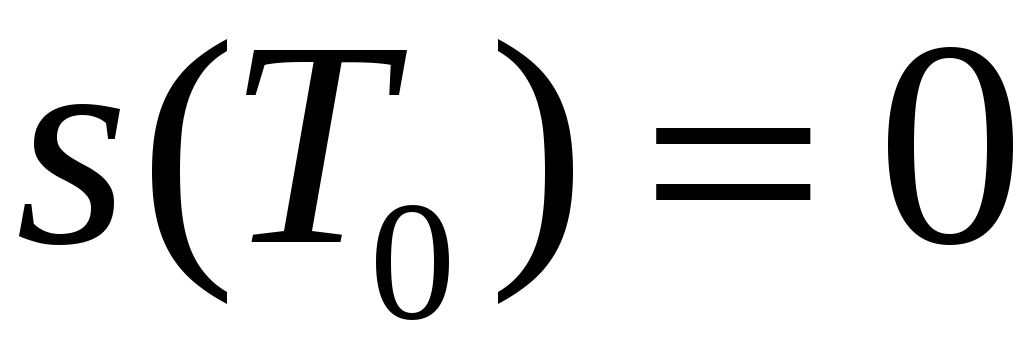 .
.
Калориметрия (измерение выделенного или поглощенного тепла) позволяет определить функцию [h(T)]p. Действительно,
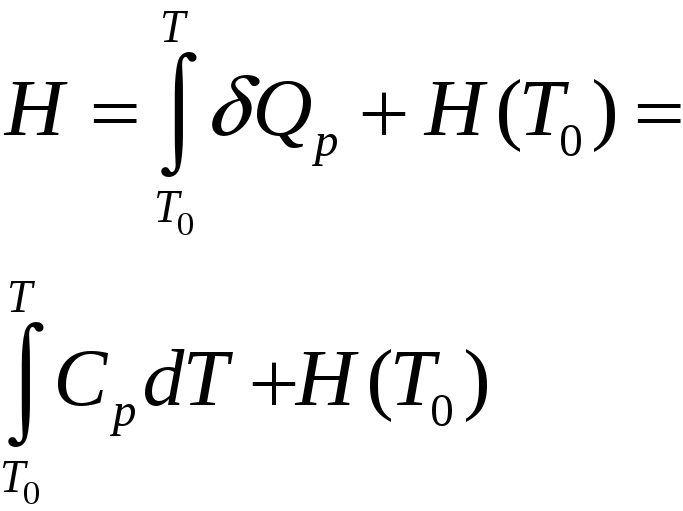 или
или 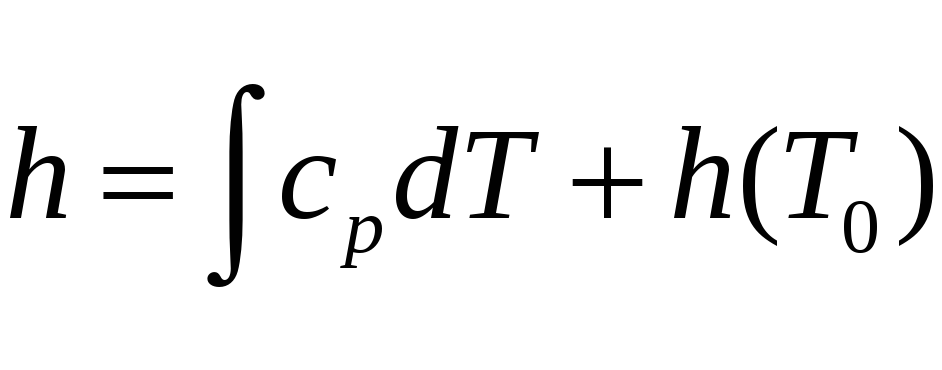 .
.
Если дополнительно к этому измерена функция [v(T)]p, то можно вычислить функцию [u(T)]p=[h(T)]p-P[v(T)]p, . а затем [f(T)]p=[u(T)]p-T[s(T)]p; [(T)]p=[h(T)]p-T[s(T)]p.
-
Функциональные связи между термодинамическими параметрами
В простой системе можно выделить два термодинамических параметра, а остальные параметры, включая все термодинамические потенциалы, представить как функции двух параметров. Из выражений (23)-(26), видно, что любой из термодинамических потенциалов является функцией двух параметров. Мы приходим к основному термодинамическому равенству в какой-либо из записей (23)-(26), составляя полный дифференциал термодинамического потенциала как функции двух переменных U=U(S,V); H=H(S,P); F=F(T,V); =(P,T); S=S(U,V). (32)
Эти параметры (из числа p,v,T,S,U) являются характерными для соответствующего термодинамического потенциала. Можно и по-иному составить функции термодинамических потенциалов, например, U=U(T,V); U=U(P,V); U=U(S,P);
Эти уравнения связывают энергию и два простых параметра. Можно, соответственно записать выражения для полных дифференциалов. Но, особенностью этих выражений будет то, что они не выводятся из начал термодинамики, а берутся из эксперимента или получаются в рамках модельных микроскопических теорий. Их называют уравнениями состояния. Для решения конкретных термодинамических задач необходимо термодинамические соотношения дополнить уравнениями состояния.
Если известен явный вид уравнений состояния то, дифференцируя эти уравнения получим выражения:

Такие записи верны и физически содержательны, но выражаемые ими соотношения отличны от основного термодинамического равенства.
Виду соотношений
(23)-(27) в случае простой системы набор
параметров-аргументов можно составить
из T,P,VS
или T,P,V,U.
Потенциалы f,
обычно
используются как функции, а не как
аргументы. Четыре параметра T,P,V,S
или T,P,V,U
также не являются независимыми, а связаны
двумя функциональными зависимостями,
называемыми уравнениями состояния.
Различают термическое уравнение
состояния, связывающее три
простых
параметры T,P,V 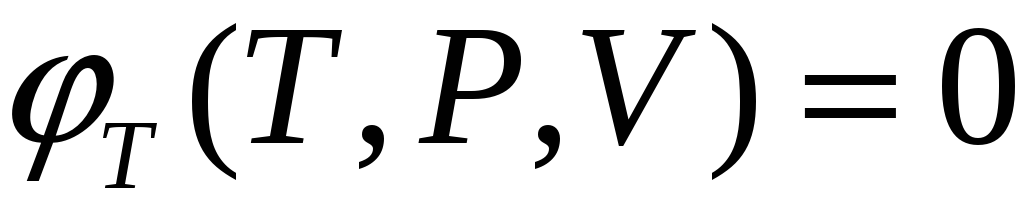 ,
и калорическое уравнение состояния,
связывающее
два простых параметра и энергию:
,
и калорическое уравнение состояния,
связывающее
два простых параметра и энергию:
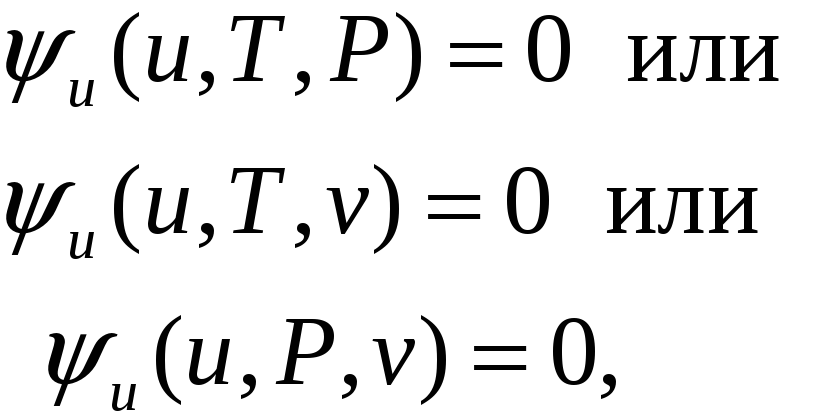
Калорическое
уравнение состояния можно заменить
через U=U(S,V)
уравнением
состояния, связывающим два
простых параметра и энтропию.
Это осуществляется численно. Полученное,
таким образом уравнение так же называют
колорическим. 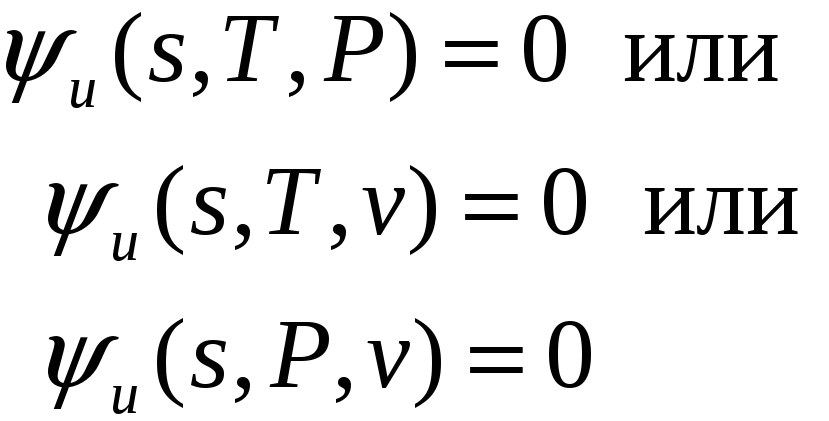 .
.
И так, любой термодинамический параметр простой закрытой системы может быть представлен как функция двух других параметров.
===============================
Первые производные от термодинамических потенциалов.
Первые производные от термодинамических потенциалов по параметрам аргументам, характерным для соответствующего потенциала, легко получить из выражений (23)-(26),(31). Все такие производные оказываются параметрами аргументами из набора S,U,P,T,V.
Из уравнения (23)
![]()
Из уравнения
(24) ![]()
Из уравнения
(25) ![]()
Из уравнения
(26) ![]()
Из уравнения
(31) ![]()
Из этих выражений,
можно установить характер зависимости
термодинамических потенциалов от
параметров аргументов. Поскольку T>0
всегда, то
![]()
![]()
![]()
Поскольку S>0
всегда, то
![]()
![]()
