
Качественный вид термодинамических функций
Располагая формулами для первых вторых производных от термодинамических потенциалов и условиями устойчивости равновесия, можно определить во многих случаях однозначно качественный вид зависимости термодинамических потенциалов от параметров аргументов. Рассмотрим это на примере термодинамического потенциала Гиббса. Выпишем первые и вторые производные от по характерным параметрам, используя очевидные неравенства s>0, V>0 и условия устойчивости T>0,CP>0
![]()
![]()
![]()
![]()
Отсюда видно, что изобара [(T)]P имеет отрицательный наклон и обращена выпуклостью вверх (рис.9а), а изотерма [(T)]T имеет отрицательный наклон и обращена выпуклостью вверх (рис.9б). Тангенс угла наклона изотермы [(T)]T равен объему v, а абсолютное значение тангенса угла наклона изобары [(T)]P равна энтропии s.
Сведения о первых производных от
по p и T
позволяют схематически построить
полибарический график -T
с качественно верным взаимным расположением
изобар [(T)]P
и политермический график -P
(рис.10). Поскольку
![]() ,
то на графике [(T)]p
изобара расположена тем выше, чем
выше P. Поскольку
,
то на графике [(T)]p
изобара расположена тем выше, чем
выше P. Поскольку![]() ,
то на графике [(p)]T
изотерма расположена тем ниже, чем
больше температура T.
,
то на графике [(p)]T
изотерма расположена тем ниже, чем
больше температура T.
 Из
первых и вторых производных от u
по характерным параметрам
Из
первых и вторых производных от u
по характерным параметрам ![]()
![]()
с учетом неравенств T>0,p>0
и условий устойчивости видим, что
изэнтропа [u(v)]s
обращена выпуклостью вниз (рис.11.а)
и имеет отрицательный наклон. Полихорический
[u(s)]v
и полиэнтропический [u(v)]s
графики представлены схематически на
рис.11.a,11.б.
учетом неравенств T>0,p>0
и условий устойчивости видим, что
изэнтропа [u(v)]s
обращена выпуклостью вниз (рис.11.а)
и имеет отрицательный наклон. Полихорический
[u(s)]v
и полиэнтропический [u(v)]s
графики представлены схематически на
рис.11.a,11.б.
Рассмотрев первые и вторые производные по h и f по характерным параметрам (при фиксировании характерных параметров), можно определить наклон и знак кривизны изобары [h(s)]p, изэнтропы [h(s)]s, изотермы [f(v)]T и изохоры [f(v)]v.
В рамках такого анализа можно также определить наклон кривых зависимости термодинамических потенциалов по нехарактерным параметрам при фиксированных характерных параметрах, так для имеем соотношения
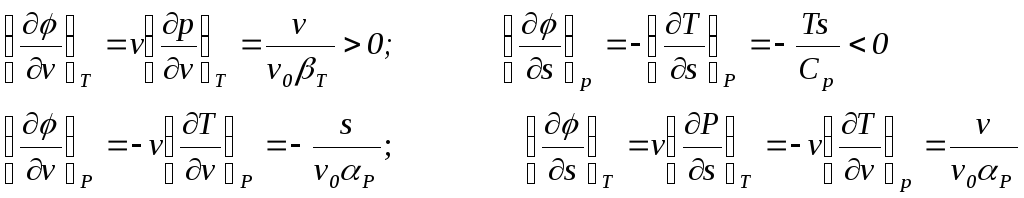
Отсюда видно, что изотерма
[(v)]T
имеет положительный наклон, а изобара
[(s)]p
– отрицательный. Наклон изобары
[(v)]p
и изотермы [(s)]Т
зависит от знака p.
При нормальном, положительном знаке
p
обе кривые имеют отрицательный наклон.
Знак кривизны этих кривых термодинамика
не предсказывает, он определен знаком
вторых производных от одного простого
параметра-аргумента по другому, то есть
знаком производных
![]() и т.п., который может быть установлен
лишь экспериментально. Знак наклона
кривых зависимости термодинамических
потенциалов от характерных
или нехарактерных параметров также не
предсказывается однозначно в рамках
проводимого здесь анализа. Так из
соотношения
и т.п., который может быть установлен
лишь экспериментально. Знак наклона
кривых зависимости термодинамических
потенциалов от характерных
или нехарактерных параметров также не
предсказывается однозначно в рамках
проводимого здесь анализа. Так из
соотношения
![]() видно,
что наклон изэнтропы [(p)]S
может быть как положительным для
видно,
что наклон изэнтропы [(p)]S
может быть как положительным для
![]() так и отрицательным для
так и отрицательным для
![]() .
Общим для всех таких кривых является
то, что в одних условиях их наклон может
быть положительным, а в других
–отрицательным.
.
Общим для всех таких кривых является
то, что в одних условиях их наклон может
быть положительным, а в других
–отрицательным.
Термодинамика открытых систем
1.Однокомпонентная открытая система
Рассмотрим однокомпонентную систему
(состоящую из атомов одного соединения),
которая является открытой, то есть
способна обмениваться со средой
веществом. Не следует противопоставлять
обмен веществом обмену энергией. Обмен
веществом представляет один из возможных
способов обмена энергией. При этом
следует иметь в виду, что обмен веществом
не означает совершения работы (Хотя и
может в специальных случаях сопровождаться
работой.) и представляет собой один из
способов теплообмена. В случае открытой
равновесной системы элементарная
теплота помимо обычного вк4лада содержит
вклад, пропорциональный изменению
количества вещества ( в молях, грамматомах)
dn. Вклад этот, очевидно
положителен, так как перенос вещества
в систему увеличивает количество тепла.
Таким образом ,
Q=TdS+dn, (1)
где
- положительный
коэффициент пропорциональности,
называемый химическим потенциалом.
Выражение можно переписать в виде
![]() . (2)
. (2)
Таким образом, изменение энтропии в
открытой равновесной системе помимо
приведенного тепла содержит вклад,
обусловленный переносом вещества. Для
неравновесной открытой системы, согласно
второму началу
![]() . (3)
. (3)
Для рассматриваемой системы получаем обобщенную запись второго начала термодинамики. Это не означает изменение содержания второго начала; новая запись обусловлена только дополнительным вкладом в Q, согласно выражению (1). Подставляя в (3) (Q =TdS+dn -TiS ) выражение первого начала термодинамики dU=Q-A получим основное термодинамическое неравенство для простой неравновесной системы dU=TdS-pdV+dn-TiS . (4)
Для простой равновесной открытой системы dU=TdS-pdV+dn. (5)
Отсюда видно, что вклад обмена веществом в энергию пропорционален dn, при этом коэффициентом пропорциональности служит химический потенциал .
Иногда это выражение записывают как dU=Q-pdV+dn то есть не включают dn в Q и рассматривают обмен веществ как самостоятельный ( отличный не только от работы, но и от теплоты) способ обмена энергией. Такое различие интерпретаций не сказывается на решении конкретных задач, но интерпретация, излагаемая в курсе более удобна при последующем построении неравновесной динамики.
В выражении (4) энтропия S, объем V и количество вещества n выступают как независимые переменные. Это обстоятельство нуждается в разъяснении: S и V пропорциональны n и в закрытой системе. При прочих равных условиях (где, впрочем, n не является переменной величиной, а постоянным параметром системы) они не могут быть независимы от n. Однако, в открытой системе n, действительно, выступает как новый (дополнительно к S иV в рассматриваем случае) переменный параметр. Объем может изменяться независимо от n в результате совершения работы и деформирования системы. Количество вещества может изменяться независимо от объема, например, при выходе газа из сосуда. Энтропия может изменяться независимо от n. Открытая система не может быть адиабатической, но энтропия может меняться при фиксированном n за счет теплообмена, не связанного с переносом вещества ( теплообмен, осуществляется теплопроводностью, облучением системы) Количество вещества в системе может измениться при постоянной энтропии, если перенос вещества в систему сопровождается снижением температуры за счет теплообмена, не связанного с переносом вещества, или за счет повышения давления под действием внешних сил.
При этом, очевидно, что верны выражения V=vn; S=sn. Однако из них видно, что V может меняться как за счет n, так и при не измененном n. За счет изменения v (или плотности вещества 1/v), а S может меняться как за счет изменения n, так и за счет изменения s. Напротив, n может меняться как за счет S или V, так и за счет изменения s и v при неизменном S и V.
Подставляя в (4) выражения для H,F,,
получим равноценные(4) записи основного
термодинамического равенства для
простой равновесной открытой системы
dH=TdS+Vdp+dn, (6)
dF=-SdT-pdV+dn, (7)
d=-SdT-pdV+dn, (8)
а
также из(4) ![]() . (9)
. (9)
Из записей (4)-(8) получаем соответственно
равноценные выражения для химического
потенциала
![]() , (10)
, (10) ![]() , (11)
, (11)
![]() , (12)
, (12) ![]() , (13)
, (13)
![]() . (14)
. (14)
Таким образом, химический потенциал может быть представлен как производная по n при T,P=const, термодинамический потенциал Гиббса должен быть представлен как функция. =(T,P,n) или =т(T,P). Следовательно, согласно (13) =.
Химический потенциал однокомпонентного вещества тождественен его мольному термодинамическому потенциалу Гиббса и , следовательно, является характеристикой вещества, независимо от того, находится оно в открытой или закрытой системе.
К этому же результату можно придти из любой формулы (10),(11),(12), или (14). Для того чтобы осуществить дифференцирование внутренней энергии (10) по n при S,V=const, необходимо внутреннюю энергию записать как функцию ее характеристических параметров U(S,V) при этом U=nu, но мольная внутренняя энергия должнак быть представлена лишь как функция u=u(s,v)u(S/n,V/n). Таким образом u=u(S/n,V/n).
Выполним дифференцирование (10) не
забывая, что S,V=const.
Получим
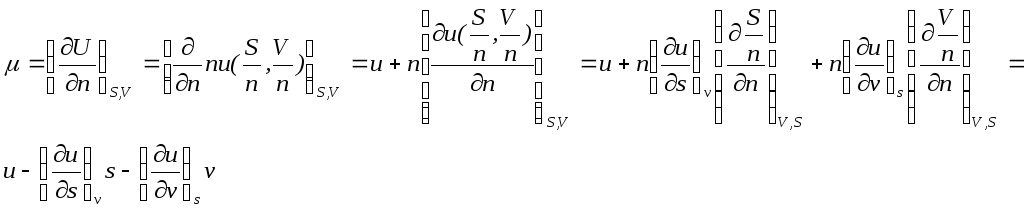
При получении этого выражения использовано,
что при S,V=const производная
по n
 .
Учитывая(27), что
.
Учитывая(27), что
![]() окончательно
получим =u-Ts+pv.
окончательно
получим =u-Ts+pv.
Термодинамический потенциал Гиббса можно представить как произведение химического потенциала на количество вещества n =n (что эквивалентно =n), но никакой другой термодинамический потенциал нельзя представить как произведение химического потенциала на число молей. В этом проявляется особая роль термодинамического потенциала Гиббса при описании любых процессов, связанных с переносом вещества. Химический потенциал обладает свойствами не присущими другим мольным параметрам.
При рассмотрении равновесных открытых систем следует принимать во внимание наличие в среде некоторого резервуара частиц (атомов, молекул), в некотом смысле подобного термостату. При обмене системы веществом с резервуаром частиц свойства последнего не должны заметно изменяться. Это значит, что количество вещества в системе исчезающе мало в сравнении с количеством частиц во внешнем резервуаре.
