
2013.Термодинамика / Thermo-I / Therm_4a_
.doc
Если
же хотя бы с одним из термостатов система
совершает неравновесный теплообмен
(для этого достаточно, чтобы между данным
и предыдущим термостатами существовал
заметный перепад температур), процесс
в целом неравновесным. Тогда можно
перейти от (14) к интегральному выражению
 (15)
(15)
Поскольку это
интегральное соотношение должно
выполняться при любом наборе термостатов
и значении их температур, то должно
быть
 (16)
(16)
Такова математическая формулировка второго начала термодинамики для произвольной (не адиабатической) системы. Из нее совсем легко вывести формулировку (10). Действительно, положив в (16) Q=0, получим dS>0.
Не должно складываться впечатления, что здесь выведено второе начало термодинамики. Получена всего лишь одна формулировка из другой.
Для
дальнейшего использования удобно
переформулировать положение (16) для
произвольных систем, Неравенство (16)
можно представить в виде равенства,
прибавив к правой стороне существенно
положительный вклад iS>0.
Тогда вместо (16) имеем запись
 (17)
(17)
Этот вклад iS называется элементарной произведенной энтропией. Элементарная же приведенная теплота имеет смысл элементарной переданной энтропии. Переданная энтропия – вклад в общее изменение энтропии за счет передачи тепла, теплообмена системы со средой. Произведенная энтропия – дополнительный вклад, обусловленный неравновесными процессами в системе и на ее границе со средой. В частности, в адиабатической неравновесной системе энтропия системы изменяется только за счет произведенной энтропии. dS=iS при Q=0.
Соотношение (17) справедливо для любой неравновесной системы, любого необратимого процесса. Формулировка второго начала, соответствующая записи (17), состоит в том, что при любом неравновесном процессе энтропия производиться. Любой неравновесный процесс является источником энтропии, новой порции энтропии, которой до этого в мире не было. Напротив, нам достоверно неизвестны какие-либо системы и какие-либо макроскопические процессы в мире, которые служили бы стоками энтропии.
Оба положения второго начала можно объединить записью
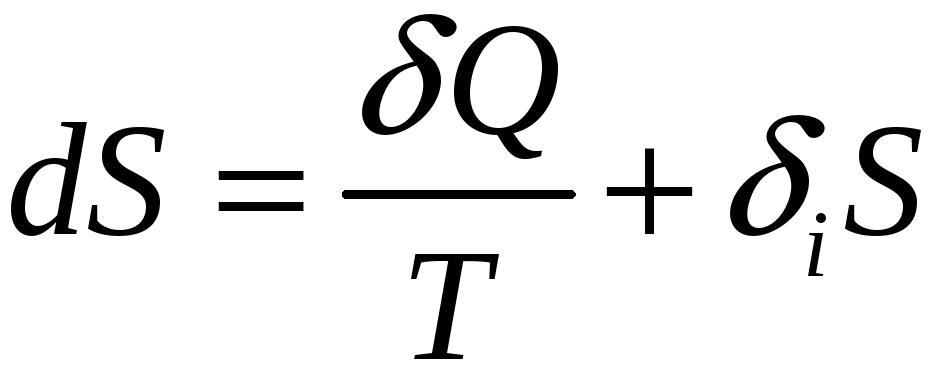
 (18)
(18)
и словесной формулировкой: при любом процессе энтропия не исчезает.
(производиться или в предельной ситуации сохраняется)
10. Принцип компенсации
В любой ограниченной системе, сколь велика бы она ни была, в которой протекают неравновесные процессы, все время возникают новые количества энтропии. Поскольку энтропия является универсальной мерой беспорядка, это означает увеличение общего количества беспорядка, непрерывное разрушение упорядоченных организованных структур, создание высокоэнтропийных, хаотических состояний; предельный случай таких состояний – состояние однородного газа. Это ни в коей мере не противоречит тому очевидному факту, что в мире постоянно происходят и структурирующие процессы, создающие упорядоченность. Возникают низко энтропийные организованные структуры кристаллы, сложные органические молекулы, живые организмы.
Неверно утверждать, что энтропия всегда и везде возрастает. Энтропия должна возрастать только в неравновесной адиабатической системе. Но даже в адиабатической системе достаточно большой и вследствие неравновесности, неоднородности существуют подсистемы, которые при этом снижают свою энтропию, упорядочиваются, организуются. Действительно, из записи (18) вовсе не следует, что dS>0. В правой части (18) всегда iS0, в неравновесном случае S , но переданная энтропия Q/T может быть как положительной (если система поглощает тепло), так и отрицательной (если система отдает тепло). Поэтому при Q/T<0 в целом dS может и бывает отрицательным. Простейший пример процесса, в котором энтропия системы снижается – охлаждение нагретой воды или превращение ее в лед. Энтропия воды при этом снижается, но это сопровождается отдачей тепла в окружающую среду, что повышает энтропию среды. Повышение энтропии среды компенсирует снижение энтропии системы, при этом при неравновесных процессах компенсирует с избытком. В этом и состоит принцип компенсации. Это всего лишь одна из формулировок второго начала термодинамики.
Наглядный пример принципа компенсации может быть бытовой холодильник. Во внутренней камере работающего холодильника температура, а следовательно, и энтропия снижаются. Одновременно с этим холодильник выделяет тепло во внешнюю среду – в комнату, где он находится, повышая температуру и энтропию этого помещения.
Если в системе совершается неравновесный циклический процесс, ее энтропия по завершению цикла принимает исходное значение, и вся произведенная при этом энтропия накапливается в среде, которая по завершению цикла не возвращается в исходное состояние. Эту ситуацию мы уже рассматривали при выводе записи (16) из (10). Рассмотрим ее подробнее.
Перенесем систему из жидкостной ванны с температурой T1 в ванну с температурой T2 (T2>T1), а затем в исходную ванну. В исходное начальное состояние вернется система, но не рабочее вещество ванн. Действительно, когда холодное тело с температурой T1 погружено в горячую ванну, оно отбирает от вещества ванны некоторое количество тепла. Будучи затем погружено в холодную ванну T1, оно отдает тепло веществу ванны. При повторении этой процедуры система будет, все время, переносить тепло из горячей ванны в холодную. Если количество вещества в ваннах ограничено (и отсутствуют терморегуляторы), то вещество горячей ванны будет охлаждаться, а вещество холодной – нагреваться. Если количество вещества в ваннах очень велико (то в термодинамическом смысле ванны могут рассматриваться как термостаты), то температуры T1 и T2 будут постоянными, но заодно с теплотой из горячей ванны в холодную будет переноситься энтропия. При повторении циклов состояние системы будет воспроизводиться, а состояние ванн непрерывно меняться.
Диссипация энергии
Если некоторая система, совершает полезную работу, то при этом неизбежно протекают необратимые изменения во внешней среде. Если для выполнения полезной работы мы используем машины, то необратимые изменения будут заключаться в сжигании бензина, угля, разрушения его структуры, в образовании продуктов сгорания, в неизбежной утечке тепла (вместе с отработанным паром на электростанциях) рассеянии джоулева тепла, выделяемого в проводах электропередачи и т.п. Все эти процессы повышают энтропию среды. Источником энергии будет тепло, выделяемое при сгорании угля, бензина, но лишь некоторая доля тепла будет использована для совершения полезной работы. Остальная ее часть рассеивается, диссипирует во внешней среде.
В любом случае, диссипация состоит в том, что либо не все тепло превращается в электроэнергию и далее в механическую работу, либо в том, что затраченные электрическая и механическая энергии не могут быть целиком преобразованы в полезную работу и отчасти рассеиваются в среде в виде тепла. При этом дело не в конструкционных технических несовершенствах электростанций, линий электропередач и т.д. дело в физическом явлении. Технические усовершенствования могут резко снизить потери на диссипацию, но устранить их не могут.
Величина диссипированной энергии простым образом связана с произведенной энтропией. Она равна TiS.
Диссипация энергии всегда осуществляется в виде тепла, рассеянная энергия – всегда энергия тепловой формы движения. Согласно второму началу любая форма движения может быть нацело преобразовано в тепловую форму движения, но тепловая форма не может быть полностью преобразована в нетепловую форму движения. В этом смысле о диссипации говорят как о деградации энергии.
Тепловой двигатель
Частично теплота может быть преобразована в полезную работу, а тепловая форма движения в нетепловую форму, например, в механическую. Любое устройство, преобразующее теплоту в работу, назовем тепловым двигателем.
Коэффициентом
полезного действия (К.п.д.)
теплового двигателя называется отношение
работы А,
производимой
за цикл, к количеству теплоты Q1,
получаемой машиной за цикл. .
.
Согласно
первому началу термодинамики, .
Здесь,
.
Здесь,
 -
абсолютное значение количества теплоты,
отданного рабочим телом за цикл
-
абсолютное значение количества теплоты,
отданного рабочим телом за цикл ,
поскольку U
– функция состояния. Таким образом,
,
поскольку U
– функция состояния. Таким образом, 
Рассмотрим
цикл, на каждом этапе которого процесс
квазистатический. Тогда


Интеграл
 берется
по участкам цикла, где dS>0.
Следовательно, в этом случае
берется
по участкам цикла, где dS>0.
Следовательно, в этом случае
 (19)
(19)
Траектория
пути процесса за один цикл на диаграмме
S-T
или p-V
должна описывать некоторую плоскую
фигуру. Площадь такой фигуры на диаграмме
S-T
равна
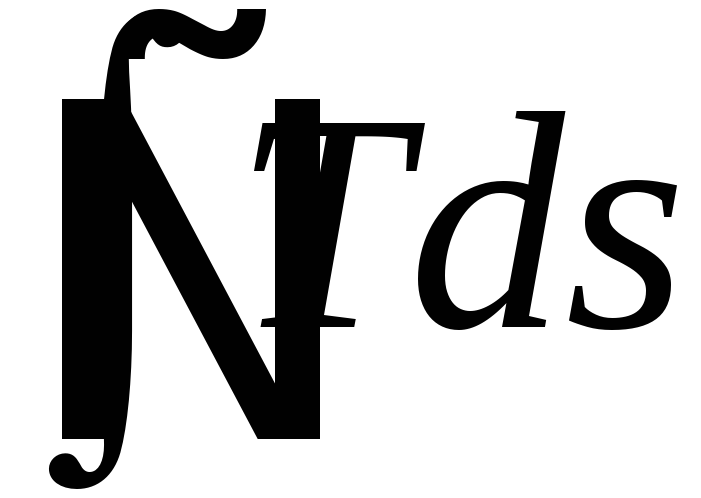 .
Таким образом, даже квазистатический
цикл не
.
Таким образом, даже квазистатический
цикл не
