
- •Энергия смешения раствора с произвольным количеством компонентов
- •Мольная парциальная энергия смешения компонента раствора при произвольном количестве компонентов
- •Регулярные растворы
- •Химическое взаимодействие и термодинамические свойства растворов
- •Регулярная модель как метод возмущения
- •Раствор идеальных газов
- •U,h,V,CvиCpраствора идеальных газов
- •Парциальная внутренняя энергия
- •Парциальный объем и парциальное давление газов
- •Парциальный объем и давление компонента раствора идеальных газов
- •Парциальная энтальпия
- •Энтропия смешения идеального газа
- •Энергия Гиббса и химические потенциалы идеальных газов
- •Парадокс Гиббса
- •Формализм Льюиса. Фугитивность и активность компонентов раствора
- •Фугитивности компонентов раствора
- •Активность компонента раствора
Энергия смешения раствора с произвольным количеством компонентов
Рассмотрим некоторые статистические модельные представления о растворах. Выводы получаемые на основе модельных представлений, безусловно не имеют той общности и той степени истинности, которой обладают термодинамические законы.
Запишем внутреннюю
энергию U
в виде
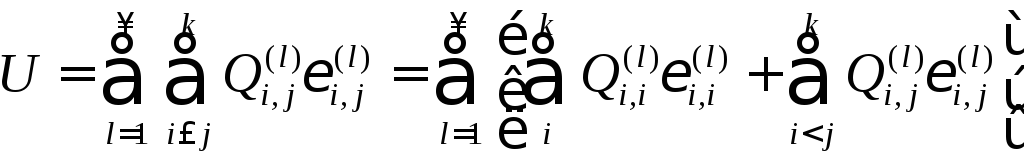 (1)
(1)
Внутренняя энергия
стандартного состояния равна
![]() ,
(2)
где
,
(2)
где![]() – энергия взаимодействия пары атомов
компонентовi
и j,
находящихся
в l–ой
координационной сфере.
– энергия взаимодействия пары атомов
компонентовi
и j,
находящихся
в l–ой
координационной сфере.
![]() -
число пар атомов i
и j.
Примем следующие приближения:
-
число пар атомов i
и j.
Примем следующие приближения:
Энергия взаимодействия пары i и j не зависит от окружения атомов, образующих эту пару, и не зависит от концентрации раствора.
Вычитая из выражения
(1) (2) получим энергию смешения твердого
раствора.
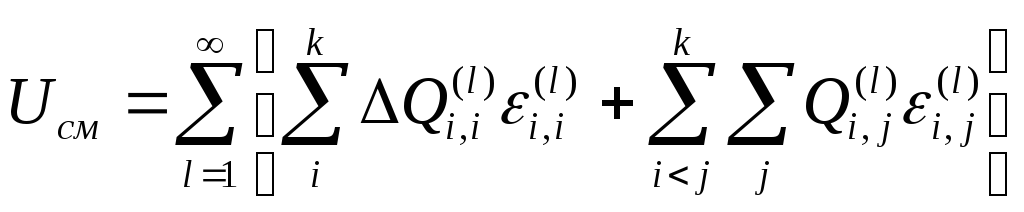 ,
(3)
,
(3)
Где
![]()
Пара ii может разрушиться в одной из (k-1) параллельных реакций
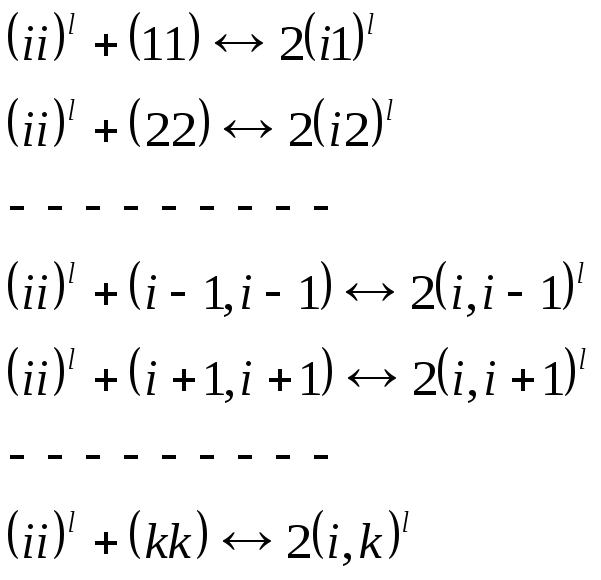
Поэтому запишем,
что
![]() ,
,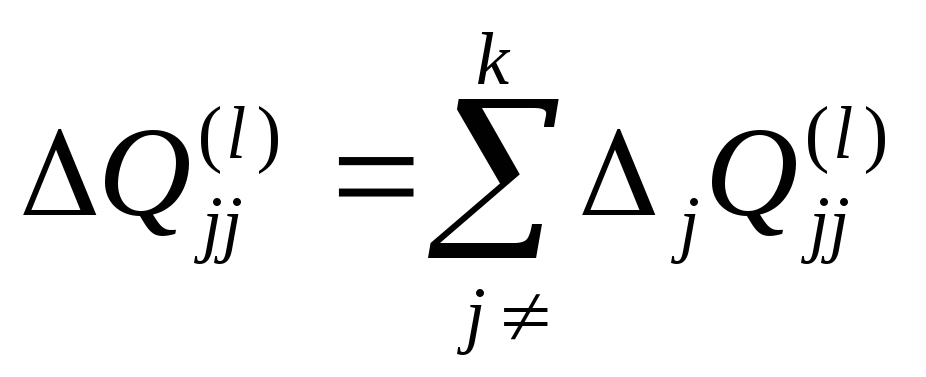 ,
где
,
где![]() – количество связей (ii)(l)
разрушенных в одной из реакций при
образовании
– количество связей (ii)(l)
разрушенных в одной из реакций при
образовании
твердого раствора
(ii)(l)+(jj)(l)↔2)(ij)(l)
j≠i.
Подставляя
![]() вUсм
(3), получим
вUсм
(3), получим
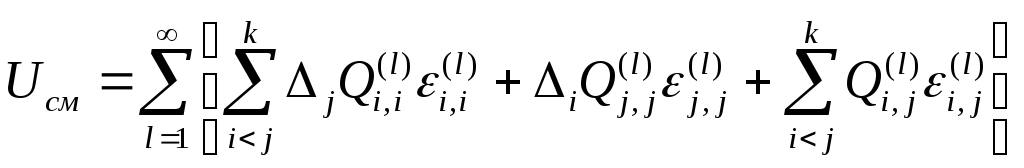 (5)
(5)
В любой реакции
выполняется уравнение баланса
![]()
Обозначим
![]() i≠j,
получим
i≠j,
получим ![]()
Если в растворе
наблюдается полный конфигурационный
беспорядок, то
![]() .
.
Подставив число
пар типа (ij)(l)
в энергию смешения получим
![]()
Введем обозначения
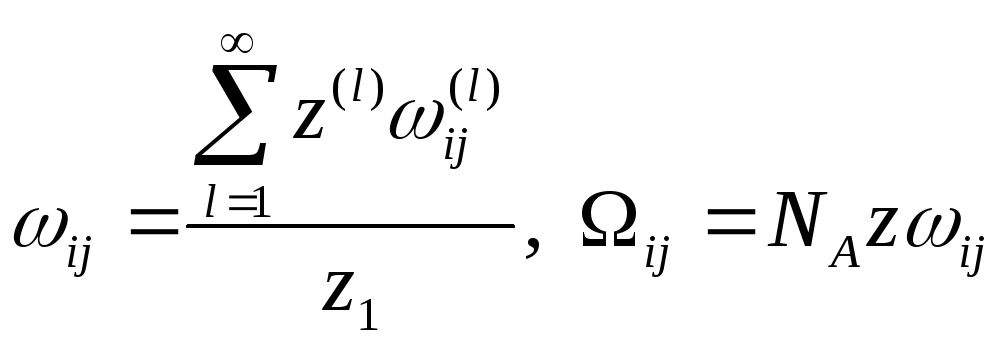
Получим для энергии
смешения
 (6)
(6)
Мольная парциальная энергия смешения компонента раствора при произвольном количестве компонентов
![]() Перепишем
(6) в удобном для данной задачи виде
Перепишем
(6) в удобном для данной задачи виде
![]() .
.
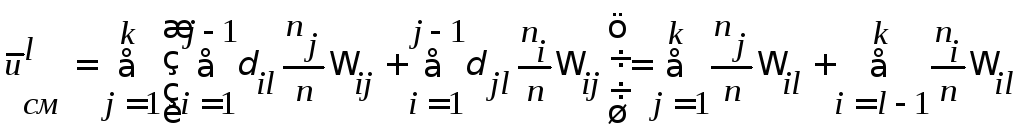
При k=3
![]()
![]()
![]()
Регулярные растворы
Рассмотрим растворы у которых при полном
конфигурационном беспорядке, т.е. при
![]() справедливо выражение
справедливо выражение![]()
Для таких растворов свободная энергия
смешения равна
![]() (7)
(7)
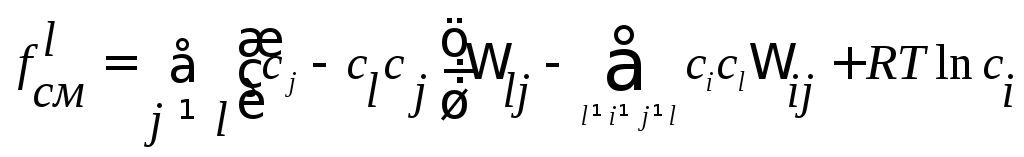
При k=2 для регулярных
растворов![]()
![]()
![]()
Очевидно, что эти растворы обладают свойствами растворов с идеальной энтропией смешения.
Помимо допущений, которые мы сделали в начале, есть еще одно, которое явно мы не предполагали. По существу принято, что размеры атомов одинаковы, иначе необходимо учитывать искажения решетки, которые изменят расстояния между атомами компонентов.
Поскольку энергии парных взаимодействий
![]() зависят от расстояний, то единственным
при заданныхi,jи l значениях
зависят от расстояний, то единственным
при заданныхi,jи l значениях![]() необходимо
заменить спектром значений, соответствующих
различающимся
необходимо
заменить спектром значений, соответствующих
различающимся![]() .
Спектр значений
.
Спектр значений![]() можно заменить средними значениями.
Однако усреднение будет зависеть от
концентрации. Это противоречит, что
можно заменить средними значениями.
Однако усреднение будет зависеть от
концентрации. Это противоречит, что![]() не зависит от концентрации.
не зависит от концентрации.
Если же атомные размеры компонентов
одинаковы и остаются таковыми при
образовании раствора, то объемный эффект
смешения должен быть равен нулю.
![]() и для регулярных растворов
и для регулярных растворов![]() ,
,![]()
![]() ,
,![]() .
.
Теплота смешения
![]()
![]()

При k=2 получим
![]()
![]() (8)
(8)
![]()
Растворы для которых справедливы выражение(8) называются регулярными.
Химическое взаимодействие и термодинамические свойства растворов
Несмотря на грубость модели, полученные
выражения (8) хорошо иллюстрируют
физическую природу термодинамических
свойств растворов. Кроме того, реальные
растворы при определенных условиях
приближаются к поведению регулярных
растворов. Из уравнений(8) легко заключить,
что тепловой фактор простым образом
связан с параметром химического
взаимодействия
![]() .
.![]()
Идеальный раствор можно рассматривать
как частный случай регулярного раствора,
реализующийся при выполнении условия
![]() ,
то есть
,
то есть![]() .
Это условие означает такое различие
энергии взаимодействия разнородных и
однородных атомов, которые не вызывает
изменение энергии или энтропии системы
при образовании раствора из идеальной
смеси. В частности это выполняется,
если
.
Это условие означает такое различие
энергии взаимодействия разнородных и
однородных атомов, которые не вызывает
изменение энергии или энтропии системы
при образовании раствора из идеальной
смеси. В частности это выполняется,
если![]()
Двухкомпонентный регулярный раствор
является положительным или эндотермическим,
если
![]() т.е.
если
т.е.
если![]() .
Поскольку все
.
Поскольку все![]() существенно
отрицательны, последние условие означает,
что
существенно
отрицательны, последние условие означает,
что![]() ,
то есть взаимное притяжение однородных
атомов сильнее взаимного притяжения
разнородных атомов. Понятно, что этот
микроскопический фактор, соответствующий
экзотермичности раствора, противодействует
растворению и ведет к уменьшению
термодинамического стимула образования
раствора.
,
то есть взаимное притяжение однородных
атомов сильнее взаимного притяжения
разнородных атомов. Понятно, что этот
микроскопический фактор, соответствующий
экзотермичности раствора, противодействует
растворению и ведет к уменьшению
термодинамического стимула образования
раствора.
Двухкомпонентный регулярный раствор
является отрицательным или экзотермическим,
если
![]() ,
то если
,
то если![]() или
или![]() .
Это значит взаимное притяжение разнородных
атомов сильнее притяжения однородных
атомов. Это способствует растворению
и ведет к увеличению термодинамического
стимула образования раствора.
.
Это значит взаимное притяжение разнородных
атомов сильнее притяжения однородных
атомов. Это способствует растворению
и ведет к увеличению термодинамического
стимула образования раствора.
В случае K>2различные![]() могут иметь разные знаки. Эндо- или
экзотермичность раствора в отношении
отдельных компонентов и в целом
определяются совокупностью значений
могут иметь разные знаки. Эндо- или
экзотермичность раствора в отношении
отдельных компонентов и в целом
определяются совокупностью значений![]() .
Раствор в целом можно оказаться
эндотермическим при одних и экзотермическим
при других составах.
.
Раствор в целом можно оказаться
эндотермическим при одних и экзотермическим
при других составах.
В случае атомарных систем понятие «идеальный раствор» и «атермический» совпадают. Если энтальпия смешения равна нулю, то энтропия смешения идеальна. Возможны и атермические неидеальные растворы. Если размеры компонентов сильно различаются. В таких системах в отсутствии преимущественного взаимодействия между разноименными и одноименными атомами возможно упорядочение из чисто геометрических факторов (малые атомы могут размещаться в промежутках между большими). В системах с компонентами одинакового размера всякое упорядочения обусловлено «химическим» взаимодействием.
