
Р
Рис.
72.
Кривые свободной энергии для жидких и
твердых растворов при температуре
![]() выше
точек
плавления компонентов
А
и
В
выше
точек
плавления компонентов
А
и
В![]()
![]()
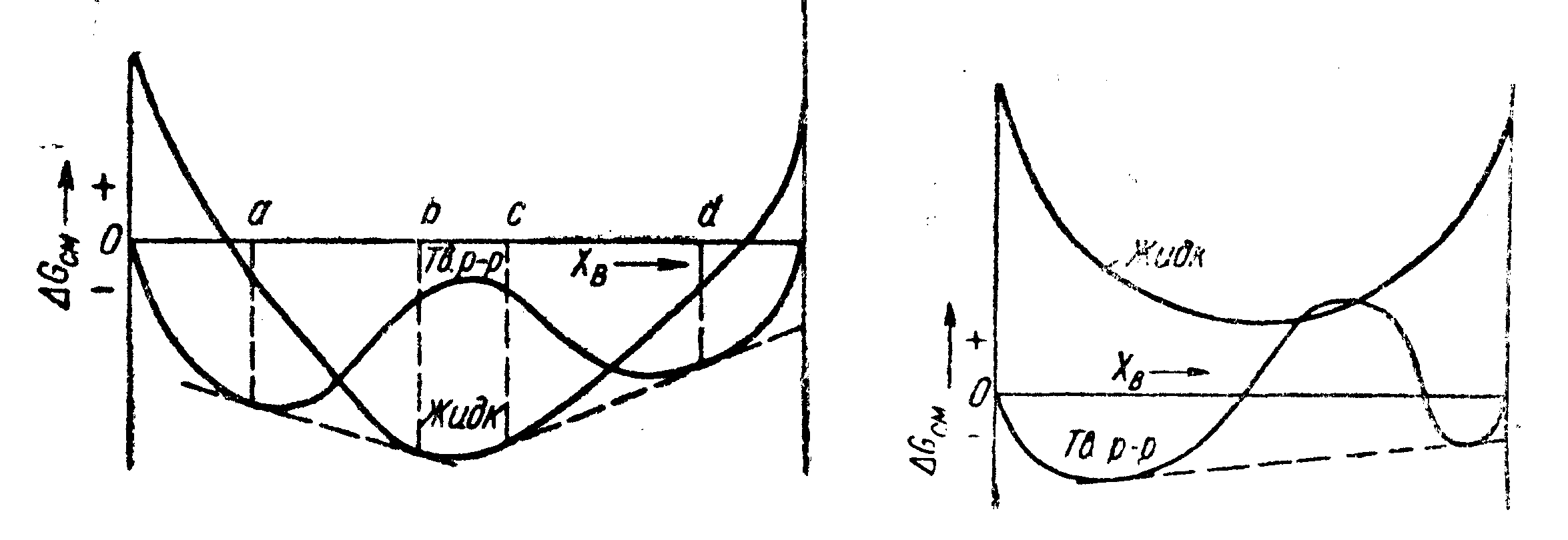
 ассмотрим
теперь случай с положительным значением
теплоты смешения, когда
ассмотрим
теперь случай с положительным значением
теплоты смешения, когда
![]() для
твердого раствора более положительна,
чем для жидкого. Выше точки плавления
того и другого компонента диаграмма
для
твердого раствора более положительна,
чем для жидкого. Выше точки плавления
того и другого компонента диаграмма
![]() может
иметь вид, показанный на рис. 72. При
некоторой температуре
может
иметь вид, показанный на рис. 72. При
некоторой температуре
![]() ниже
точки плавления компонентов кривые
будут иметь вид, показанный на рис. 73.
Кривая свободной энергии для твердого
раствора имела бы минимумы при более
высокой температуре, чем кривая для
жидкого раствора, поскольку
ниже
точки плавления компонентов кривые
будут иметь вид, показанный на рис. 73.
Кривая свободной энергии для твердого
раствора имела бы минимумы при более
высокой температуре, чем кривая для
жидкого раствора, поскольку![]() .
.
Наиболее устойчивое состояние при различных составах будет в следующих случаях:
1 )
)
![]() ,
твердый раствор устойчив;
,
твердый раствор устойчив;
2)![]() ,
твердый и жидкий растворы
сосуществуют;
,
твердый и жидкий растворы
сосуществуют;
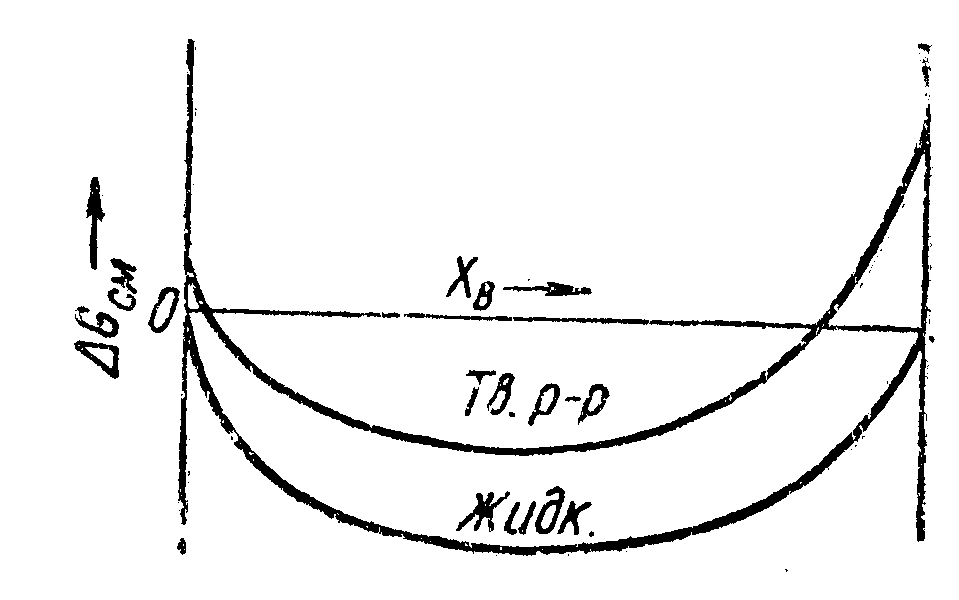
3
Рис.
75. Диаграмма состояния,
соответствующая рис.
72, 73, 74![]() ,
жидкий раствор устойчив;
,
жидкий раствор устойчив;
4)![]() ,
твердый и жидкий раствор сосуществуют;
,
твердый и жидкий раствор сосуществуют;
5) , Твердый раствор устойчив.
На
диаграмме состояния, отвечающей
этим условиям, имеется минимум температуры
плавления. Согласно квазихимической
теории, это объясняется взаимным
отталкиванием между несходными соседними
атомами, а следовательно, ослаблением
структуры кристалла. При более низкой
температуре![]() положение может быть такое, как показано
на рис. 74. При этой температуре будет
иметь место разрыв растворимости.
положение может быть такое, как показано
на рис. 74. При этой температуре будет
иметь место разрыв растворимости.
Диаграмма
состояния, характерная для систем этого
типа, показана на рис. 75, причем рис. 72 —
74 даны соответственно для температур![]() и
и![]() .
Если предположить, что теплота смешения
более положительна, чем в предыдущем
случае, -
.
Если предположить, что теплота смешения
более положительна, чем в предыдущем
случае, -
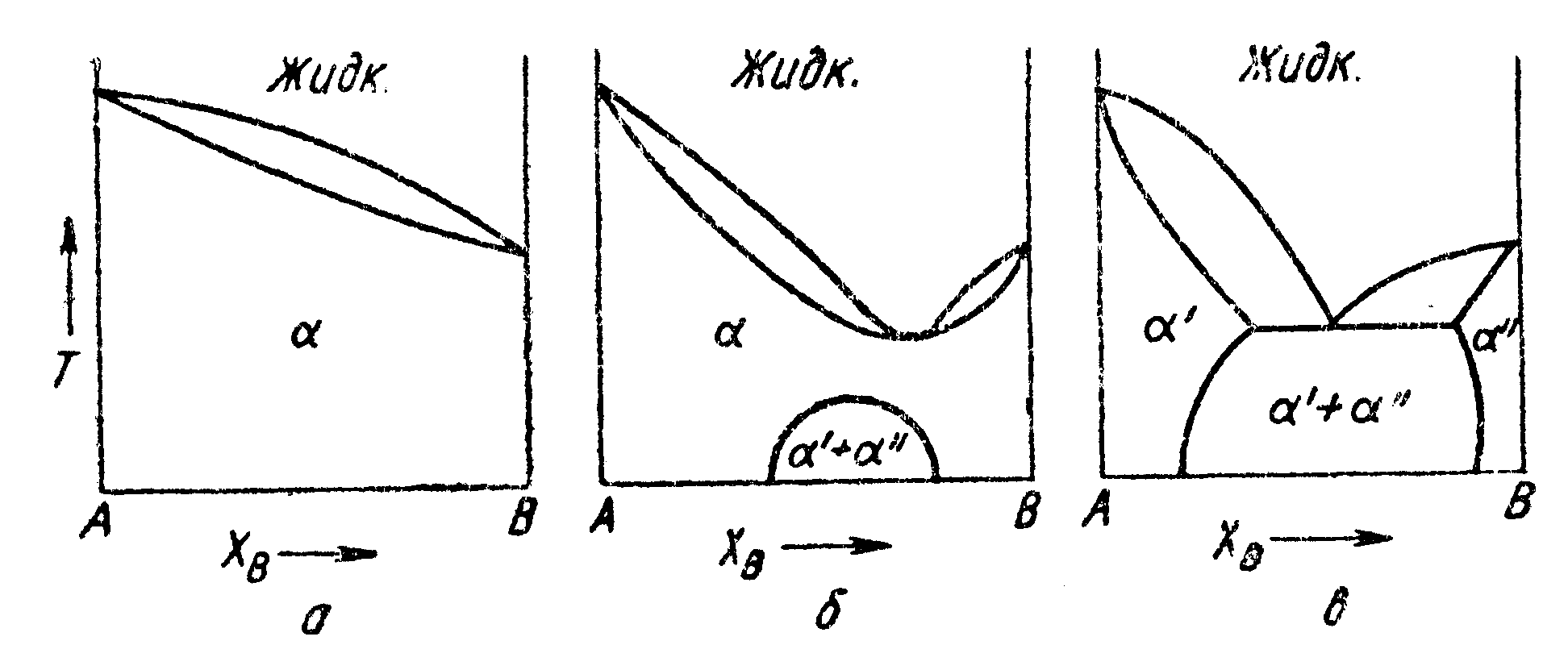
Рис.
76.
Диаграммы состояния:
![]() —
для идеального раствора;
—
для идеального раствора;
![]() ;
;
![]() —
тоже, но
—
тоже, но
![]() более
положительна
более
положительна
минимум
температуры плавления снижается, а
критическая температура предела
несмешиваемости повышается до тех пор,
пока, наконец, не произойдет наложение
этих температур друг на друга. Когда
это произойдет, образуется простая
эвтектика. Этот постепенный переход
диаграмм состояния показан на рис. 76.
На рис. 76, а
показана
диаграмма состояния для идеального
раствора. Если теплота смешения в твердом
и жидком растворах положительна, но
![]() ,
критическая температура предела
несмешиваемости повышается, а минимум
точки плавления снижается до тех пор,
пока, наконец, не произойдет их наложение
один на другой. В результате получается
диаграмма состояния с эвтектикой,
показанная на рис. 76, в.
,
критическая температура предела
несмешиваемости повышается, а минимум
точки плавления снижается до тех пор,
пока, наконец, не произойдет их наложение
один на другой. В результате получается
диаграмма состояния с эвтектикой,
показанная на рис. 76, в.
Дальнейшее
увеличение![]() приведет
к увеличению двухфазной области
приведет
к увеличению двухфазной области
![]() ,
а следовательно, к сужению областей
растворов на обоих концах диаграммы
состояния (граничных растворов).
,
а следовательно, к сужению областей
растворов на обоих концах диаграммы
состояния (граничных растворов).
Фазовые
диаграммы, когда теплота смешения
отрицательна, показаны на рис. 77. Если
теплота смешения жидких и твердых
растворов отрицательна, но![]() более
отрицательна, чем,
более
отрицательна, чем,![]() образуется
максимум температуры плавления. Далее,
при низких температурах твердый раствор
будет стремиться к упорядочению, так
что количество несходных пар атомов в
растворе станет максимальным (см. стр.
112).
Соответствующая диаграмма состояния
показана на рис. 77.
образуется
максимум температуры плавления. Далее,
при низких температурах твердый раствор
будет стремиться к упорядочению, так
что количество несходных пар атомов в
растворе станет максимальным (см. стр.
112).
Соответствующая диаграмма состояния
показана на рис. 77.
По
мере того, как
![]() становится
все более отрицательной, тенденция к
упорядочению в твердом растворе с целью
максимального увеличения количества
несходных пар атомов будет увеличиваться.
В конечном счете, должна образоваться
промежуточная фаза, кристаллическая
структура которой отличалась бы от
исходных фаз. Эта структура была бы
такой, что количество несходных пар
атомов увеличивалось до максимума, а
расстояние между ними снижалось бы до
минимума.
становится
все более отрицательной, тенденция к
упорядочению в твердом растворе с целью
максимального увеличения количества
несходных пар атомов будет увеличиваться.
В конечном счете, должна образоваться
промежуточная фаза, кристаллическая
структура которой отличалась бы от
исходных фаз. Эта структура была бы
такой, что количество несходных пар
атомов увеличивалось до максимума, а
расстояние между ними снижалось бы до
минимума.
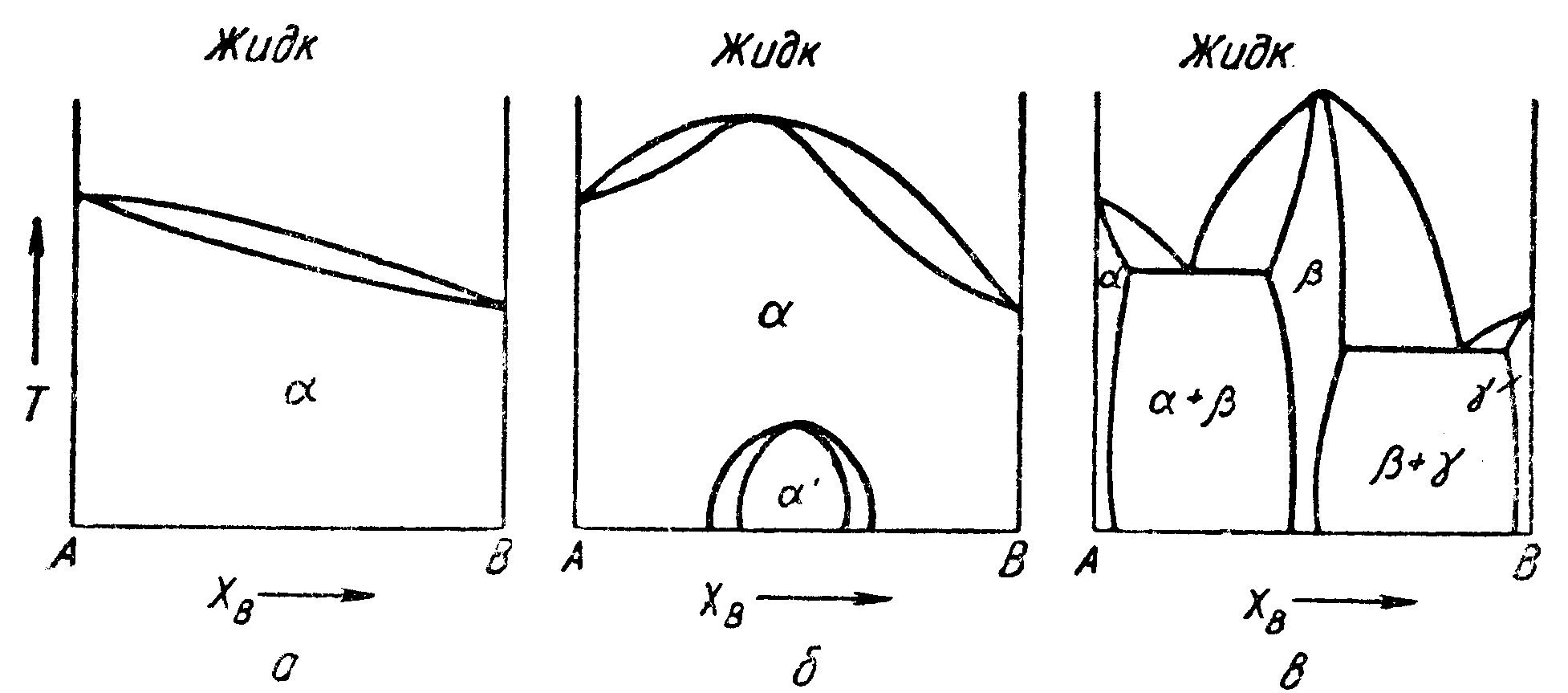
Рис. 77. Диаграммы состояния:
![]() — для
идеального раствора;
— для
идеального раствора;
![]() ;
;
![]() —
то же,
—
то же,
но
![]() более
отрицательна
более
отрицательна
Такая фаза стремилась бы стать устойчивой, а следовательно, имела бы максимальную точку плавления. Температура плавления этой фазы была бы подобна критической температуре, так как с увеличением ее увеличивалось бы упорядочение. Если бы эта фаза обладала достаточной устойчивостью, ее точка плавления была бы выше максимума ликвидуса и солидуса; диаграмма состояния была бы типа, показанного на рис. 77, в.
6. Флуктуации состава в растворах
В главе, посвященной квазихимической теории, упорядочение твердых растворов объяснялось взаимодействием атомов в растворе. Здесь будут представлены термодинамические принципы, которые позволяют делать более широкие обобщения, и имеют первостепенное значение для теории фазовых превращений.
При
повышенной температуре атомы в растворе
находятся в непрерывном движении, в
результате чего образуются различные
метастабильные конфигурации. Рассмотрим
вероятность того, что область,
содержащая![]() атомов
в гомогенном растворе, будет отклоняться
по составу на величину
атомов
в гомогенном растворе, будет отклоняться
по составу на величину
![]() от
среднего состава
от
среднего состава![]() .
Как видно, это явление играет существенную
роль в понимании фазовых превращений,
поскольку при реакции разложения или
осаждения должна образоваться фаза, в
значительной степени отличающаяся по
составу от исходного раствора. Ясно,
что в исходном растворе должна
присутствовать небольшая область,
богатая растворенным веществом. Один
из способов образования таких областей
заключается в беспорядочных флуктуациях
состава.
.
Как видно, это явление играет существенную
роль в понимании фазовых превращений,
поскольку при реакции разложения или
осаждения должна образоваться фаза, в
значительной степени отличающаяся по
составу от исходного раствора. Ясно,
что в исходном растворе должна
присутствовать небольшая область,
богатая растворенным веществом. Один
из способов образования таких областей
заключается в беспорядочных флуктуациях
состава.
Р
Рис. 78.
Свободная энергия
как
функция состава![]() и
средняя свободная энергия
и
средняя свободная энергия![]() на
атом. Предположим теперь, что образуется
область, содержащая
на
атом. Предположим теперь, что образуется
область, содержащая![]() атомов,
атомов,
Рис. 78.
Свободная энергия
как
функция состава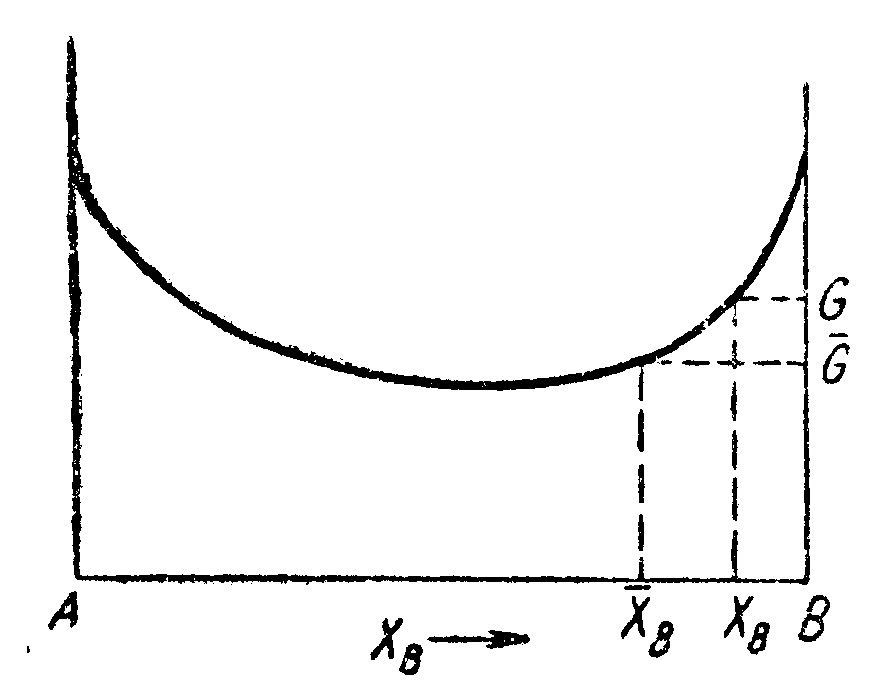
состав
которой![]() .
.
Свободная
энергия на атом в этой области равна
![]() .
На основании статистики Больцмана
вероятность того, что атом будет иметь
свободную энергию
.
На основании статистики Больцмана
вероятность того, что атом будет иметь
свободную энергию![]() ,
отличающуюся от средней свободной
энергии на атом в растворе
,
отличающуюся от средней свободной
энергии на атом в растворе![]() ,
составит
,
составит
![]() (10.22)
(10.22)
Вероятность,
что атомы![]() будут
иметь ту же самую свободную
энергию
будут
иметь ту же самую свободную
энергию![]() одновременно,
равна
одновременно,
равна
![]() (10.23)
(10.23)
Для
простоты расчета предположим, что
![]() мало,
а следовательно, мало и
мало,
а следовательно, мало и![]() .
Разлагаем
.
Разлагаем![]() в
ряд Тейлора по
в
ряд Тейлора по![]() :
:
![]() (10.24)
(10.24)
Если
![]() ,
членами, порядок которых выше второго,
можно
пренебречь. Используя уравнение (10.24),
находим, что вероятность
небольших флуктуации состава, включающего
п
атомов,
равна
,
членами, порядок которых выше второго,
можно
пренебречь. Используя уравнение (10.24),
находим, что вероятность
небольших флуктуации состава, включающего
п
атомов,
равна
![]() (10.25)
(10.25)
Из
уравнения (10.25) следует, что чем меньше
величина
![]() ,
тем больше вероятность флуктуации
состава. Для простоты расчета рассмотрим
выражение для регулярного раствора:
,
тем больше вероятность флуктуации
состава. Для простоты расчета рассмотрим
выражение для регулярного раствора:
![]()
и
![]() (10.26)
(10.26)
Рис.
79. Кривая зависи
мости свободная
энер
гия — состав для случая,
когда.
Первая
производная
от как
функция состава. Вторая производная
от как функция состава
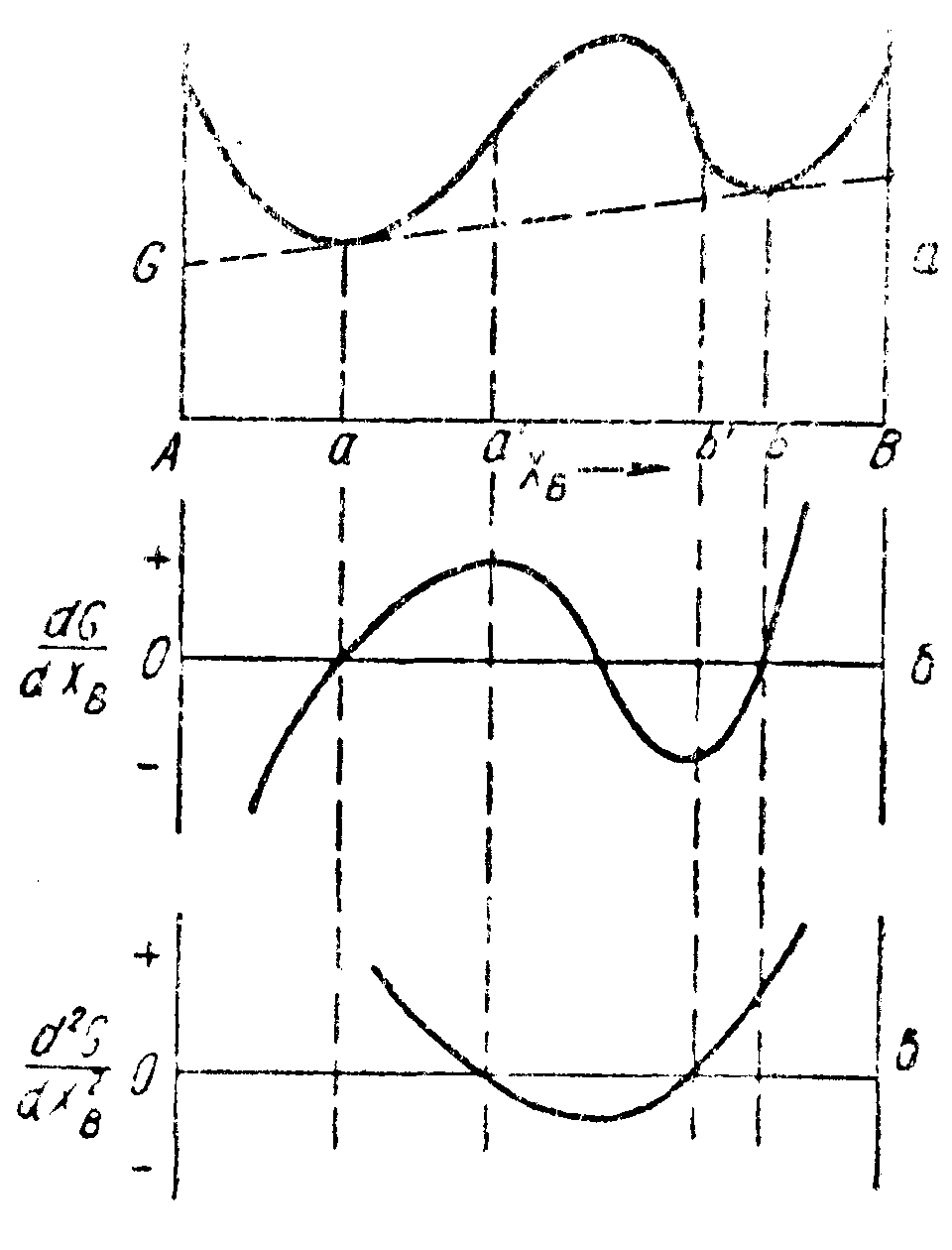 ля
данного исходного состава и температуры
второй член в правой части уравнения
(10.26) является постоянной величиной и,
таким образом,
ля
данного исходного состава и температуры
второй член в правой части уравнения
(10.26) является постоянной величиной и,
таким образом,
![]() (10.27)
(10.27)
Для
экзотермического раствора, в котором
![]() —
большая отрицательная величина, вторая
производная велика, а следовательно,
флуктуации состава будут происходить
с трудом. Но, когда
—
большая отрицательная величина, вторая
производная велика, а следовательно,
флуктуации состава будут происходить
с трудом. Но, когда![]() положительная
(соответствует положительной теплоте
смешения), положение иное. Предположим,
что раствор имеет кривую зависимости
свободная энергия - состав такую, как
на Рис-
79. Безусловно, термодинамически растворы
состава в области
положительная
(соответствует положительной теплоте
смешения), положение иное. Предположим,
что раствор имеет кривую зависимости
свободная энергия - состав такую, как
на Рис-
79. Безусловно, термодинамически растворы
состава в области![]() неустойчивы
при этой температуре
распадаются. Следовательно, интересно
исследовать величину
неустойчивы
при этой температуре
распадаются. Следовательно, интересно
исследовать величину![]() как функцию состава исходного раствора.
На рис. 79, в
можно
видеть, что если исходный раствор имеет
состав в области
как функцию состава исходного раствора.
На рис. 79, в
можно
видеть, что если исходный раствор имеет
состав в области
![]() является
отрицательной величиной, а если
является
отрицательной величиной, а если
![]() или
или![]() ,
то .
,
то .![]() —положительная
величина и, действительно, увеличивается
по мере того, как значение
—положительная
величина и, действительно, увеличивается
по мере того, как значение
![]() приближается
к
приближается
к![]() или
или![]() .
Составы
.
Составы![]() и
и![]() соответствуют спинодным точкам. Когда
соответствуют спинодным точкам. Когда![]() ,
экспонента в уравнении (10.25) положительна,
а следовательно,
,
экспонента в уравнении (10.25) положительна,
а следовательно,
![]() может
быть более 1. Значение вероятности больше
единицы не имеет смысла, поскольку
вероятность, равная единице, означает,
что событие произойдет. В результате
для раствора, первоначальная концентрация
которого находится в этой области
составов, сегрегация должна происходить
довольно легко. Вне этой области
экспонента отрицательна, и флуктуации
состава все менее и менее вероятны по
мере приближения .
может
быть более 1. Значение вероятности больше
единицы не имеет смысла, поскольку
вероятность, равная единице, означает,
что событие произойдет. В результате
для раствора, первоначальная концентрация
которого находится в этой области
составов, сегрегация должна происходить
довольно легко. Вне этой области
экспонента отрицательна, и флуктуации
состава все менее и менее вероятны по
мере приближения .![]() к
составу
к
составу
![]() или
или![]() .
.
ТЕРМОДИНАМИКА ПОВЕРХНОСТЕЙ РАЗДЕЛА
Для удобства объяснения классифицируем поверхности раздела на наружные поверхности и внутренние. Внутренние поверхности раздела можно подразделить на поверхности раздела между кристаллами одной и той же фазы, т. е. границы раздела кристаллов или зерен и поверхности раздела между фазами различной структуры и состава.
Перед тем как приступить к рассмотрению этих поверхностей раздела, приведем некоторые основные положения об их термодинамических свойствах.
