
2013.Термодинамика / Лекция_II_11
.doc
При образовании бинарного раствора
энергия смешения Гиббса
![]() ,
или
выражая через парциальные величины
,
или
выражая через парциальные величины
![]()
![]()
Аналогично можно записать для теплот смешения
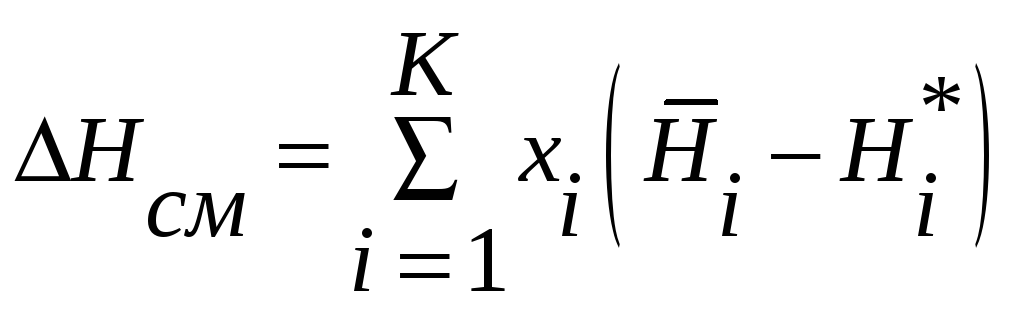
Для энтропии
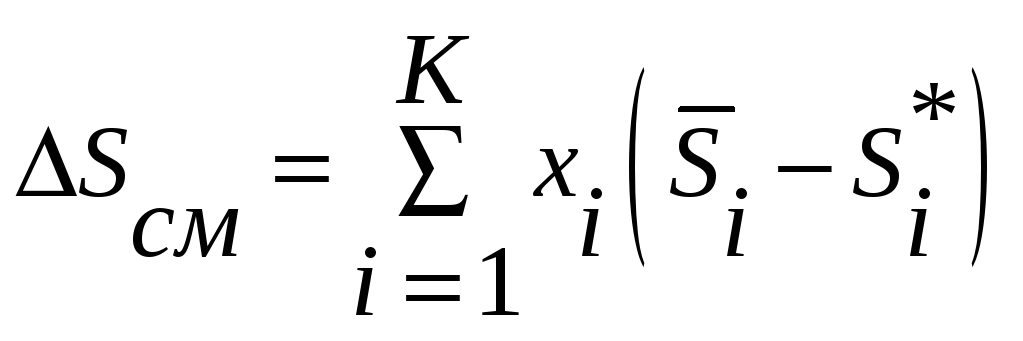 .
Для идеального раствора активность
равна концентрации
.
Для идеального раствора активность
равна концентрации
![]()
![]()
Равновесие между фазами различного состава . Химический потенциал
Рассмотрим очень большое количество
двух фаз, причем обе содержат компонент
A. Компонент A
в
![]() -
фазе будет иметь активность
-
фазе будет иметь активность
![]() ,
а в
,
а в
![]() -
фазе
-
фазе
![]() .
Перенесем 1 г-атом компонента A
из
.
Перенесем 1 г-атом компонента A
из
![]() -
фазы в
-
фазы в
![]() -
фазу при постоянной температуре. Пусть
исходное количество элементов A
и B столь велико
по сравнению с одним г-атомом A,
что состав изменится на бесконечно
малую величину. Реакция, связанная с
переносом вещества, запишется так
-
фазу при постоянной температуре. Пусть
исходное количество элементов A
и B столь велико
по сравнению с одним г-атомом A,
что состав изменится на бесконечно
малую величину. Реакция, связанная с
переносом вещества, запишется так
![]() ,
,
![]()
Компонент A в
![]() -
фазе будет иметь свободную парциальную
энергию Гиббса равную
-
фазе будет иметь свободную парциальную
энергию Гиббса равную
![]() ,
а в
,
а в![]() -
фазе она будет выражаться
-
фазе она будет выражаться![]() и свободная энергия реакции переноса
запишется
и свободная энергия реакции переноса
запишется
 .
.
Величину
![]() - (для одного моля) называют химическим
потенциалом и обозначают
- (для одного моля) называют химическим
потенциалом и обозначают
![]() .
Если
.
Если
![]() ,
то реакция будет происходить
самопроизвольно, Поскольку в этом случае
,
то реакция будет происходить
самопроизвольно, Поскольку в этом случае
![]() .
.
Если состав изменится до такой степени,
что достигается равновесие то
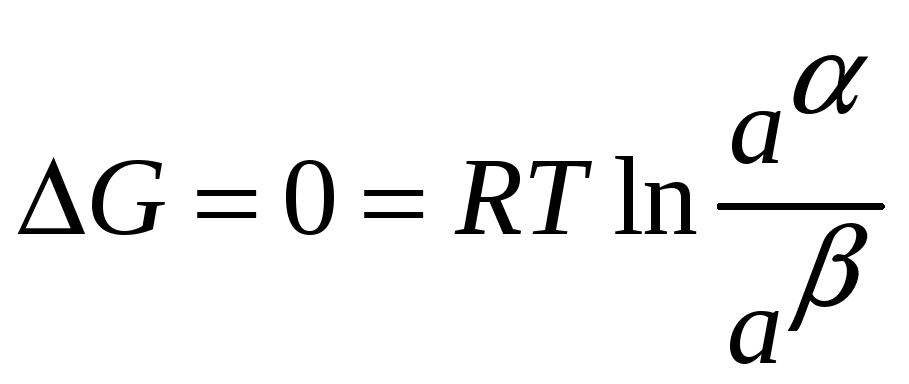
![]() .
Как правило, содержание компонента A
в фазах не бывает равным, поскольку
неодинаковы коэффициенты активности
A в разных фазах.
.
Как правило, содержание компонента A
в фазах не бывает равным, поскольку
неодинаковы коэффициенты активности
A в разных фазах.
Это способ используется для определения коэффициента активности в одной фазе, если известен коэффициент активности в другой. Обычно он применяется к жидкостям. В твердой фазе очень трудно достигнуть равновесия.
Активности компонентов A
в обеих фазах должны относиться к одному
и тому же стандартному состоянию, иначе
выражение
![]() не будут сокращаться.
не будут сокращаться.
Использование диаграмм состояния получение термодинамических данных
Рассмотрим случай, когда компонент
растворим в пределах
![]() в
в
![]() при данной температуре T,
а A имеет бесконечно
малую растворимость в B.
Такое положение можно проиллюстрировать
на диаграмме состояния. Таким образом,
в состоянии равновесия при
при данной температуре T,
а A имеет бесконечно
малую растворимость в B.
Такое положение можно проиллюстрировать
на диаграмме состояния. Таким образом,
в состоянии равновесия при
![]() для любого состава
для любого состава
![]() ,
,
![]() ,
чистый компонент B
будет находится в равновесии с B
в
,
чистый компонент B
будет находится в равновесии с B
в
![]() -фазе
при составе
-фазе
при составе
![]() ,
т.е. для реакции
,
т.е. для реакции
![]()
![]() (1)
(1)
Следовательно,
![]() ,.
,.![]()
Поскольку чистый элемент B
находится в стандартном состоянии, то
(по определению)
![]() .
Если
.
Если
![]() раствор разбавлен, можно предположить,
что компонент B в нем
следует закону Генри, и в результате
можно рассчитать коэффициент активности
раствор разбавлен, можно предположить,
что компонент B в нем
следует закону Генри, и в результате
можно рассчитать коэффициент активности
![]()
![]() .
Следовательно
.
Следовательно

Можно получить сведения о форме линии
ограниченной растворимости
![]() - фазы, как функции температуры для
диаграммы состояния этого типа.
- фазы, как функции температуры для
диаграммы состояния этого типа.
У равнение
(1) равновесной реакции растворения для
этой цели не подойдет поскольку
равнение
(1) равновесной реакции растворения для
этой цели не подойдет поскольку
![]() .
Нужно рассмотреть другое уравнение
растворения. Пусть компонент B
переносится из чистого состояния в
какой-либо произвольный состав в
.
Нужно рассмотреть другое уравнение
растворения. Пусть компонент B
переносится из чистого состояния в
какой-либо произвольный состав в
![]() ,
например в
,
например в
![]() ,
вместо
,
вместо
![]() .
Таким образом,
.
Таким образом,
![]()
![]()
Рассчитаем теперь
![]() .
Исходя из основных положений термодинамики.
.
Исходя из основных положений термодинамики.
 ,
где
,
где
![]() ,
как и прежде, а
,
как и прежде, а
![]() .
.
Таким образом,
![]()
Кроме того, известно термодинамическое
соотношение
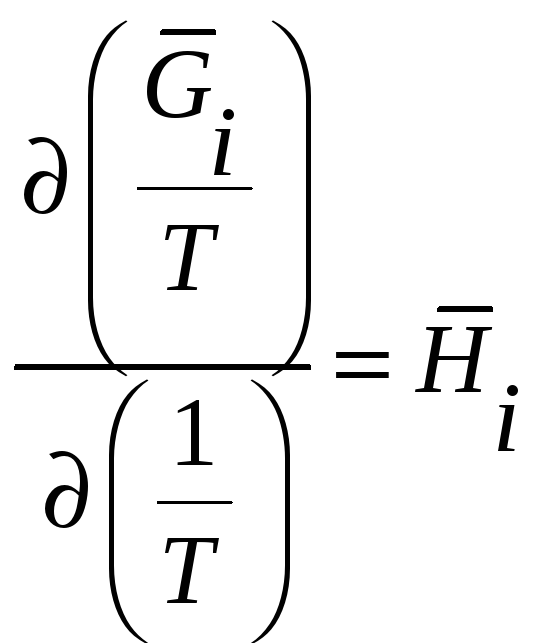 . Поэтому
. Поэтому
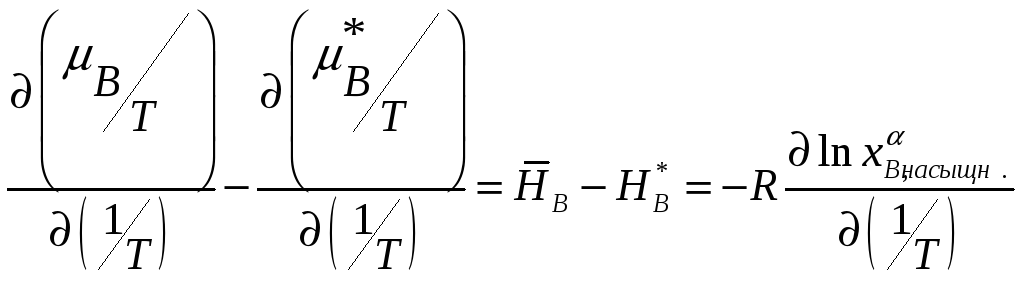
 ,
,
![]()
Из рассматриваемой нами реакции следует,
что
![]() соответствует энтальпии, расходуемой
на перенос чистого компонента B
в разбавленный раствор. Эта величина
является относительной парциальной
энтальпией.
соответствует энтальпии, расходуемой
на перенос чистого компонента B
в разбавленный раствор. Эта величина
является относительной парциальной
энтальпией.
В разбавленном твердом растворе, в
котором растворенное вещество следует
закону Генри,
![]() не зависит от состава. В этом случае
не зависит от состава. В этом случае
![]() можно получить из линии ограниченной
растворимости.
можно получить из линии ограниченной
растворимости.
![]() ,
как и большинство реакций в твердом
теле не зависит от температуры. Если
нанести экспериментальные данные
,
как и большинство реакций в твердом
теле не зависит от температуры. Если
нанести экспериментальные данные
![]() на график в зависимости от
на график в зависимости от
![]() ,
получим линию весьма близкую к прямой,
с наклоном
,
получим линию весьма близкую к прямой,
с наклоном
![]()
В еличина
еличина
![]() для твердых растворов, так что
для твердых растворов, так что
![]() увеличивается с ростом температуры.
увеличивается с ростом температуры.
Если рассмотреть с точки зрения
статистической механики, то мы получим
изменение энтропии.
![]()
Парциальная энтропия смешения на атом
![]() .
Кроме конфигурационной энтропии
изменяется еще и колебательная энтропия.
Тогда изменение парциальной энтропии
на атом будет равно
.
Кроме конфигурационной энтропии
изменяется еще и колебательная энтропия.
Тогда изменение парциальной энтропии
на атом будет равно
![]() .
Кроме того, при переносе атома из чистого
компонента B в раствор
происходит изменение энтальпии
.
Кроме того, при переносе атома из чистого
компонента B в раствор
происходит изменение энтальпии
![]() .
С учетом всего изменение химического
потенциала на атом выразится
.
С учетом всего изменение химического
потенциала на атом выразится
![]()
![]() .
При равновесии
.
При равновесии
![]() ,
для состава
,
для состава
![]() ,
и мольные доля B в
,
и мольные доля B в
![]() равна
равна
![]() Таким образом константа A
равна
Таким образом константа A
равна
![]() .
Логарифмируя
.
Логарифмируя
![]() (1)
(1)
Если нанести на график
![]() в зависимости от обратной температуры
1/T и про экстраполировать
к 1/T=0, второе
слагаемое становится равным нулю, а
отрезок от начала координат до точки
пересечения
в зависимости от обратной температуры
1/T и про экстраполировать
к 1/T=0, второе
слагаемое становится равным нулю, а
отрезок от начала координат до точки
пересечения
![]() равен
равен
![]() .
.
Таким образом, получается метод оценки колебательной энтропии растворенного вещества по отношению к значению энтропии чистого вещества.
Для большинства систем верхний уровень
применимости уравнения (1) составляет
1%. Уравнение (1) можно видоизменить,
сделав разложение экспонент в ряд
Тейлора с сохранением слагаемых до
второго порядка. Тогда получим
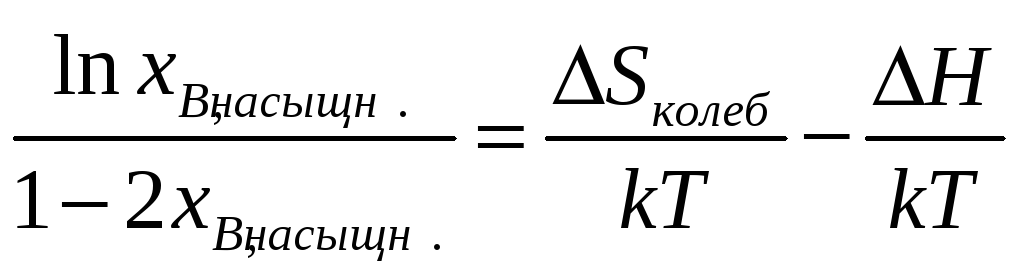
Дл систем рассматриваемого типа. Пределы применимости этого уравнения значительно больше.
Пусть элементы A и B ограниченно растворимы друг в друге. Диаграмма состояния отвечающая этому случаю имеет вид.

