
material / материаловеденье-1 / отв / / Материаловедение шпоры
.doc|
4. Поры кристаллических решёток. В пространственной решетке помимо атомов имеется свободное пространство, образующее поры. Различают октаэдрические и тетраэдрические поры. Радиус октаэдрической поры элементарной кристаллической ячейки решетки ГЦК составляет 0,41 радиуса основного атома (иона), а радиус тетраэдрической – лишь 0,22. поры локализованы в центре ячейки и посередине ее ребер. Радиус пор октаэдрического типа в решетке ОЦК (6 в центре граней и 12 в середине ребер) составляет 0,154 радиуса атома. 24 поры тетраэдрического типа, расположенные по 4 на гранях ячейки, могут принимать «чужой» атом с радиусом 0,29 от радиуса атома основного металла. Радиусы 6 пор октаэдрического типа в решетке ГПУ и 20 пор тетраэдрического типа составляют соответственно r=0,14R и r=0,225R, где R – радиус основного атома ячейки.
|
5. Анизотропия кристаллов. Полиморфизм. Полиморфизм (многообразие формы). Некоторые М в зависимости от t могут изменять тип кристаллической решётки. Полиморфизм (аллотропия) – явление, когда 1 и тот же М при разных t имеет разные кристаллические решётки. Принято обозначать полиморфную модификацию, устойчивую при более низкой t, индексом , при более высокой , затем и т.д. Н-р, Fe: до 910: ОЦК Fe; 910-1392: ГЦК Fe; >1392: ОЦК Fe. t полиморфного превращения - t превращения одной кристаллической модификации в другую. На явлении полиморфизма основана термическая обработка. При переходе из одной полиморфной формы в др меняются св-ва, в частности и соответственно V вещ-ва. Н-р, Fe на 3% больше Fe, а удельный V соответственно меньше. Эти изменения V необходимо учитывать при термообработке. (Олово: при низкой t происходит полиморфное превращение пластичного белого олова с образованием хрупкого серого порошка серого олова – «оловянная чума»). Анизотропия свойств кристаллов (неодинаковость). Плотность расположения атомов по разным плоскостям в кристалле неодинакова, а расстояния м/у атомами в плоскости тоже разное. Даже в 1 и той же плоскости расстояния м/у атомами в разных направлениях разное. Подобная неодинаковость св-в в ТВ телах, представляющих собой 1 кристалл (монокристалл), наз-ся анизотропией. Т.о, кристалл анизотропен, в отличие от аморфных тел, кот изотропны. Анизотропия может приводить к дефектам М (расслоению, волнистости). Анизотропию необходимо учитывать при конструировании и разработке технологии получения деталей. Квазиизотропность – кажущаяся независимость св-в от направления испытания (для поликристаллов). |
6. Точечные дефекты (ТД) кристаллов, их влияние на свойства кристаллов. Реальные кристаллы никогда не имеют идеально правильной кристаллической решётки. Правильное расположение атомов в пространстве в той или иной степени нарушается из-за тепловых колебаний. В кристаллах всегда имеются химические нарушения в виде инородных примесных атомов. Т.о, в реальных условиях крист решётка никогда не бывает совершенной, есть всегда дефекты. Геометрич признаки классификации дефектов, по кот дефекты разделяют на: 1) точечные; 2) линейные; 3) поверхностные. Точечные имеют размеры, близкие к размерам атомов. ТД образуются в процессе кристаллизации под воздействием тепловых, механич, электрич воздействий; при облучении нейтронами, электронами, рентгеновскими лучами. Типы ТД: а) вакансии; б) межузельные атомы (дислоцированные); в) примесные атомы. РИС тетр!!! Вакансии и межузельные атомы могут возникать при t, выше абсолютного 0К. t соответствует своя концентрация вакансий. Из всех точечных дефектов вакансия явл самой важной, т.к. именно они способствуют перемещению атомов внутри кристаллов и за это отвечают (т.е. происходит диффузия). Т.е. присутствие вакансий объясняет возможность диффузии – перемещение атомов на расстояния, превышающие средние межатомные расстояния для данного М. Перемещение атомов осуществляется путём обмена местами с вакансиями. Различают самодиффузию (перемещения атомов не изменяют их концентрацию в отдельных объёмах) и гетеродиффузию (перемещения атомов сопровождаются изменением концентрации; хар-на для сплавов с высоким содержанием примесей). Влияние: Все виды ТД приводят к локальным изменениям межатомных расстояний и искажают крист решётку. При этом сопротивление решётки дальнейшему смещению атомов, что способствует упрочнению кристаллов и их электросопротивление. ТД влияют в определённой мере на физич св-ва. В технически чистых М ТД электрич сопротивление. На механич св-ва ТД влияют мало. |
|
1 |
2. Пространственная кристаллическая решетка. Элементарная кристаллическая ячейка. Параметры ячейки. Строение твёрдых кристаллических тел. В твёрдых кристаллических телах расположение атомов в пространстве повторяется периодически в 3 измерениях. Если ч/з ЦМ атомов провести линии, то образуется пространственная кристаллическая решётка, в кот можно выделить min V, перемещая кот в направлении 3 осей координат, можно построить всю пространственную кристаллическую решетку. Этот min V наз-ся элементарной кристаллической ячейкой. Для описания крист ячейки используют 6 величин: 3 отрезка, равные расстояниям до ближайших элементарных частиц по осям координат a, b, с и 3 угла м/у этими отрезками , , . Соотношения м/у этими величинами определяют форму ячейки. РИС ТЕТР!!! 1) a=b=c, =90 - кубическая решётка; 2) abc, 90 - трёхклинная фигура. Размер элементарной крист решётки оценивают отрезки a, b, с. Их называют периодами решётки. Зная периоды решётки, можно определить ионный или атомный радиус элемента. Он равен половине наименьшего расстояния м/у частицами в решетке.
50. Ti-сплавы. Сюда относятся сплавы, кот кроме Ti содержат (4…6)% Al. Это марка ВТ5. Это сплав нормальной прочности; В=(700…950)МПа, =(10…15)%. Этот сплав не упрочняется термической обработкой, у них высокая термическая стабильность св-в, т.е. механич св-ва в широком интервале t меняются оч мало. Детали из этого сплава могут длительно работать в интервале (-250…+500) С. Ti-сплавы хар-ся невысокой прочностью при комнатной t и не упрочняется при термообработке. Сплавы с цирконием наиболее технологичны, но это самые дорогие из Ti-сплавов. В горячем состоянии сплавы куют, прокатывают и штампуют. Из сплава ПТ7М изготавливают горяче- и холоднокатаные трубы. Сплавы поставляют в виде прутков сортового проката, поковок, труб, проволоки. Они предназначены для изготовления деталей, работающих в широком интервале t: от криогенных до 500С. Недостаток: низкая технологическая пластичность. Достоинство: высокая термическая стабильность свойств, хорошая свариваемость и высокие механич св-ва при криогенных t; обрабатываемость резанием удовлетворительная |
3 |
|
7.
Линейные дефекты (ЛД) кристаллов, их
влияние на свойства кристаллов.
Реальные кристаллы никогда не имеют
идеально правильной кристаллической
решётки. Правильное расположение
атомов в пространстве в той или иной
степени нарушается из-за тепловых
колебаний. В кристаллах всегда имеются
химические нарушения в виде инородных
примесных атомов. Т.о, в реальных
условиях крист решётка никогда не
бывает совершенной, есть всегда
дефекты. Геометрич
признаки классификации дефектов,
по кот дефекты разделяют на: 1) точечные;
2) линейные; 3) поверхностные. Линейные
дефекты имеют размеры, в 2 направлениях
близкие к размерам атомов, а в 3
направлении – размеры, близкие к
размерам кристаллов. Наиболее важный
вид ЛД - дислокации.
Поведение дислокаций определяет
важнейшие механич св-ва: прочность и
пластичность. Проще всего ввести
дислокацию в кристалл можно путём
незавершённого сдвига. РИС!!!
Сдвинем
верхнюю часть кристалла до линии АВ.
АВ – граница сдвига = дислокация. Чтобы
понять, что произошло в кристалле в
рез-те незавершённого сдвига, сделаем
сечение кристалла плоскостью,
линии дислокации. В верхней части
кристалла есть полуплоскость, кот не
имеет продолжения в нижней части
кристалла. Это экстраплоскость.
Вдоль её нижнего края ч/з весь кристалл
тянется область искажения (несовершенства).
Это и есть дислокация. Аннигиляция
– исчезновение дислокаций из-за
«встречи». Плотность
дислокации
– осн хар-ка дислокационной структуры.
Под
дислокации понимают суммарную длину
дислокаций в единице V.
|
8. Поверхностные дефекты (ПД) кристаллов, их влияние на свойства кристаллов. Реальные кристаллы никогда не имеют идеально правильной кристаллической решётки. Правильное расположение атомов в пространстве в той или иной степени нарушается из-за тепловых колебаний. В кристаллах всегда имеются химические нарушения в виде инородных примесных атомов. Т.о, в реальных условиях крист решётка никогда не бывает совершенной, есть всегда дефекты. Геометрич признаки классификации дефектов, по кот дефекты разделяют на: 1) точечные; 2) линейные; 3) поверхностные. Поверхностные дефекты в 1 измерении имеют размер, сопоставимый с размерами атома, в 2 др – размеры кристалла. Если не принять спец мер, кусок М состоит из большого числа кристаллов. Есть поверхность, отделяющая в куске М 1 кристалл от др. Эта граница зёрен представляет собой дефект. РИС!!! 1,2 – зёрна; 3 – граница, в кот расположение атомов нарушено. Влияние: т.к. границы зёрен препятствуют перемещению дислокаций и являются местом повышенной концентрации примесей, то они оказывают существенное влияние на механич св-ва М. |
35. Хрупкость при отпуске стали. При определённых t и медленном охлаждении в сталях появляется отпускная хрупкость. Различают отпускную хрупкость I-го и II-го рода. Отпускная хрупкость I-го рода (необратимая) наблюдается при отпуске как легированных, так и углеродистых сталей при t300С (в интервале 250…400С). Причина возникновения – неравномерность распада мартенсита по границам и внутри зерна при отпуске. Вблизи границ карбиды выделяются интенсивнее, там создаётся концентрация напряжений, что делает границы зёрен более хрупкими. При t отпуска или продолжительности нагрева структура по сечению зерна выравнивается, и отпускная хрупкость I–го рода устраняется. Повторный отпуск при t=(250…400)С не приводит к отпускной хрупкости. Отпускная хрупкость II–го рода (обратимая, т.к. при повторном нагреве, но быстром охлаждении при этой же t он исчезает) наблюдается при медленном охлаждении после отпуска при t=(450…550)С. При медленном охлаждении по границам зёрен успевают выделиться мелкие карбиды, фосфиды и нитриды, кот приводят их к охрупчиванию. При быстром охлаждении эти частицы не выделяются. Этот вид хрупкости характерен для легированных сталей; чаще всего набл в сталях с содержанием Cr и Mn. Введение в сталь небольших количеств Мо (0,2…0,3%) или W (0,6…1%) резко склонность к отпускной хрупкости II–го рода. Способы предотвращения отпускной хрупкости –го рода: охлаждение не на воздухе, а в масле; для крупных деталей – в Н2О; дополнительное легирование МО или W. |
|
9.
Твёрдые растворы (понятие). Твёрдые
растворы замещения и внедрения.
Тв растворами наз-ся фазы, в кот 1 из
компонентов (растворитель) сохраняет
свою крист решётку, а атомы др
(растворяемых) компонентов располагаются
в его решётке, искажая её. Тв р-ры
образуются в том случае, когда атомы
разных эл, смешиваясь в разных
соотношениях, способны образовать
общую кристаллическую решётку. При
этом общей крист решёткой явл решётка
1 из компонентов. Компонент, на основе
крист решётки кот образуется тв р-р,
наз-ся растворителем.
Тв р-ры явл кристаллическими фазами
переменного состава. Виды
тв р-в:
а) замещения; б) внедрения. а)
Тв р-ры замещения
образуются при замещении атомами
растворённого компонента в крист
решётке атомов растворителя. Тв р-ры
замещения могут быть ограниченными
и неограниченными
кол-во замещённых атомов может
изменяться в широких пределах. Неогранич
р-ры образуются в тех случаях, когда
компоненты могут замещать друг друга
в крист решетке в
количественных соотношениях. Образование
неогранич р-в – явление достаточно
нечастое. И это может произойти тлк
при выполнении след условий: 1) оба
компонента должны иметь одинаковый
тип крист решётки; 2) различие в атомных
размерах компонентов не должно
превышать 15%; 3) оба компонента должны
иметь близкие ионизационные св-ва.
Если хотя бы 1 из этих усл не выполняется,
то растворимость будет ограничена.
Кроме того, эти условия необх, но не
всегда достаточны. б)
Тв р-ры внедрения
образуются путём размещения атомов
растворённого компонента м/у узлами
компонента крист решётки растворителя.
Такие тв р-ры возникают при сплавлении
переходных М с неМ, имеющими малые
атомные размеры – Н, N,
C,
B.
|
10.
Промежуточные фазы
(ПФ) образуются при взаимодействии
компонентов в сплавах. Они представляют
собой крист фазы и при образовании
ПФ возникает общая крист решётка.
Однако ПФ отлич от крист решёток
образующих её компонентов. В зависимости
от природы элементов, образующих
промежуточные связи, в них может быть
"
тип связи. Структура ПФ зависит от 3
факторов: 1) от относит размера атомов;
2) от валентности компонентов; 3) от
положения эл в ПСХЭ. В системах,
образованных М и неМ, возможны фазы с
ионным типом связи. К фазам с ионным
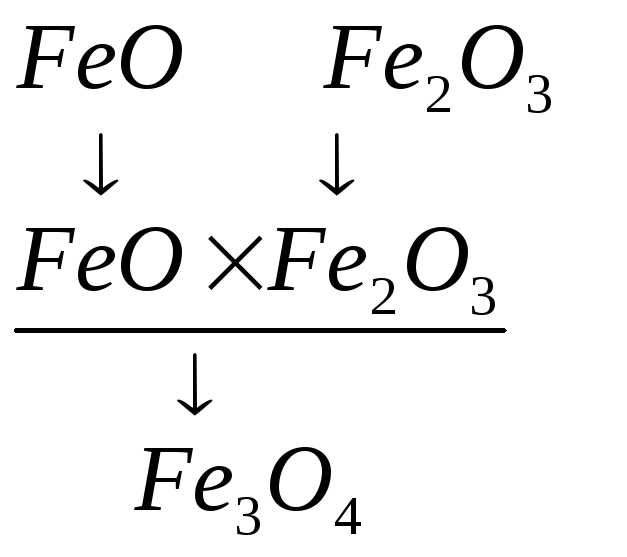
типом связи относятся оксиды:
|
11. Кристаллизация (К) М. Физическая природа К. вещ-во может находиться в 3 агрегатных состояниях. Если взять чистые М, то переход из 1 агрегатного состояния в др происходит при вполне определённых t. В общем случае эти t зависят от давления, т.е. изменение давления влечёт за собой изменения tпл. Если взять все М, то их t занимают широкий интервал: от -38С для ртути до +3410С для вольфрама. Движущие F процесса кристаллизации. При переходе М из одного агрегатного состояния в др меняется уровень свободной энергии в природе все самопроизвольно протекающие процессы происходят потому что новое состояние в новых условиях явл энергетически более устойчивым, т.е. обл меньшим уровнем энергии. Энергетическое состояние хар-ет свободная энергия: F=U-TS. При t F системы . Есть t, при кот тв и Ж состояния нах-ся в равновесии. Это происходит при температуре TS, кот наз-ся равновесной температурой. ТКР<TS чтобы пошла К жидкую фазу надо охладить ниже равновесной температуры. TS–ТКР=Т – степень переохлаждения. TS const, а ТКР и Т меняются. Движущая сила К – стремление Спросить!!! Механизм К складывается из 2 элементарных процессов: 1) зарождение центров К (зародышей); 2) центров К. Структура будет зависеть от внешних условий и соотношения этих 2 элементарных процессов. Кристаллизация сплавов. Переход из Ж состояния в тв в сплавах, как и в чистых М, происходит тлк при наличии переохлаждения. Процесс К сплавов складывается из 2 процессов: 1) зарождение центров К (зародышей); 2) центров К. Особенности К сплавов: тв фазы, образующиеся при К сплавов отличаются по составу от исходной Ж для образования устойчивого зародыша при К сплавов необх колебания (или флуктуация) концентрации. Поэтому роста К в сплавах всегда , чем в чистых М. |
|
12. Механизм и кинетика кристаллизации. К – процесс образования твёрдых кристаллов из Ж или Г. Механизм К складывается из 2 элементарных процессов: 1) зарождение центров К (зародышей); 2) центров К. Экспериментально установлено, что кристалл может расти тлк путём одновременного присоединения определенной группы атомов на какую-л грань. Такая группа атомов наз-ся двумерным зародышем. Следовательно, роста кристаллов определятся вероятностью зарождения двумерного зародыша и вероятностью его присоединения к кристаллу за счёт диффузии. Отсюда следует, что степень переохлаждения влияет на линейную роста (ЛСР) аналогично тому, как она влияет на скорость зарождения центров (СЦЗ). Экспериментально установлено, что максимум ЛСР чаще всего соответствует меньшим степеням переохлаждения, чем максимум СЦЗ, что связано с тем, что вероятность образования плоского зародыша выше, чем вероятность образования объёмного зародыша. РИС 3 СТР 7 ЛАБА №6!!! Кривые на рис наз-ся кривыми Таммана, кот впервые построил их экспериментально. На основе их анализа можно сделать вывод, что ЛСР и СЦЗ явл функцией степени переохлаждения, кот, в свою очередь, зависит от охлаждения – чем больше охлаждения, тем большего переохлаждения можно достигнуть. Следовательно, изменяя условия охлаждения, можно управлять процессом К. Конечный размер зёрен определяется числом центров и роста кристаллов. При переходе М из одного агрегатного состояния в др меняется уровень свободной энергии в природе все самопроизвольно протекающие процессы происходят потому что новое состояние в новых условиях явл энергетически более устойчивым, т.е. обл меньшим уровнем энергии. Энергетическое состояние хар-ет свободная энергия: F=U-TS. При t F системы . Есть t, при кот тв и Ж состояния нах-ся в равновесии. Это происходит при температуре TS, кот наз-ся равновесной температурой. ТКР<TS чтобы пошла К жидкую фазу надо охладить ниже равновесной температуры. TS–ТКР=Т – степень переохлаждения. TS const, а ТКР и Т меняются. Движущая сила К – стремление Спросить!!! |
13. Особенности кристаллизации сплавов. Правило фаз. Кристаллизация сплавов. Переход из Ж состояния в тв в сплавах, как и в чистых М, происходит тлк при наличии переохлаждения. Процесс К сплавов складывается из 2 процессов: 1) зарождение центров К (зародышей); 2) центров К. Особенности К сплавов: тв фазы, образующиеся при К сплавов отличаются по составу от исходной Ж для образования устойчивого зародыша при К сплавов необх колебания (или флуктуация) концентрации. Поэтому роста К в сплавах всегда , чем в чистых М. Общие закономерности сосуществования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в матем форме правил фаз Гиббса: степень свободы системы зависит от концентрации, числа компонентов, фаз и внешних компонентов: С=К-Ф+П, где С – число степеней свободы, К – число компонентов, Ф – число фаз, П внешние переменные (t, давление). Для металлических сплавов правило фаз примет вид С=К-Ф+1, т.к. для них внешним фактором равновесия явл тлк t. Правило фаз, устанавливая количественную зависимость м/у Ф, К и П, даёт возможность предсказать процессы, проходящие в сплавах при нагреве и охлаждении, и определить число фаз при данных условиях. Под числом степеней свободы (или вариантностью системы) понимают число внешних П (t, давление) и внутренних (концентрация) факторов, кот можно изменять без изменения числа фаз, находящихся в равновесии. Вариантность не может быть <0. Независимыми переменными явл конц и t. Изменение степеней свободы однокомпонентной системы (К=1) при К. РИС!!! Если число степеней свободы = 1 (система моновариантная), то процесс идёт при переменной t в определённом t-ом интервале. Двухкомпонентная система, в кот при К образуется: а) 1 тв фаза: К=2, с=2-2+1 процесс К начинается и продолжается в интервале t, причём охлаждения . РИС!!! б) 2 тв фазы: С=2-3+1=0 безвариантная ситуация. РИС!!! ДС строят в координатах t и конц. Если система однокомпонентная, то ДС будет выглядеть так: РИС!!! Если система двухкомпонентная: РИС!!! тчк на ДС показывает состояние конкретного сплава при конкретной t и конц. Изменение фазовых состояний конкретного сплава отмечается на ДС точкой (тчк пл, тчк К). Линии, соединяющие тчк аналогичный превращений разных сплавов, разграничивают на ДС области, аналогичные фазовым превращениям. |
15. Диаграмма состояния системы, в кот компоненты неограниченно растворимы в твёрдом состоянии и образуют эвтектику. См отдельный документ
47. Дуралюмины – наиболее распространённые деформируемые алюминиевые сплавы. Они содержат: (2,5…5)% Cu, (0,4…1,8)% Mg, (0,4…0,9)% Mn. Cu и Mg вводят в сплав для его упрочнения, Mn усиливает упрочняющий эффект и его коррозионную стойкость. Наибольшее упрочнение достигается после старения. Дуралюмин, по составу соответствующий современному сплаву Д1, был изобретён Вильмом. В дуралюминах системы Al-Cu-Mg могут образовываться или двойные соединения CuAl2 и Al3Mg2, или тройные Al2MgCu (S-фаза) и Al6CuMg6 (фаза Т). С содержания Cu в сплавах количество -фазы, оказывающей основное упрочняющее действие (дуралюмин Д1). содержания Mg приводит к кол-ва фазы S и дополнительному прочности (дуралюмин Д16). Достоинства дуралюминов: высокая удельная прочность, благодаря чему они относятся к числу широко применяемых материалов в самолетостроении, для изготовления лопастей воздушных винтов, тяг управления и др. Дуралюмины используют во многих отраслях техники. Их применяют для кузовов грузовых а/м, для строительных конструкций, в пищевой и холодильной промышленности для изготовления ёмкостей, тестомесильных аппаратов, сепараторов, трубопроводов и т.д. Дуралюмины имеют пониженную коррозионную стойкость. Для её листы дуралюмина плакируют, т.е. покрывают слоем чистого Al и производят совместную прокатку листов. Al, толщина кот составляет (2…5)%, сваривается с основным М и защищает его от коррозии. Для коррозионной стойкости деталей из дуралюмина их подвергают анодной поляризации в 10%-м р-ре Н2SO4. Выделяющийся О2 способствует образованию на поверхности дюралюминиевой детали оксидной плёнки, предохраняющей её от окисления.
|

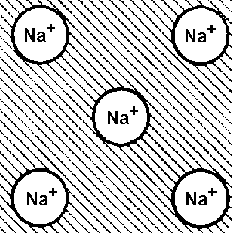 .
Типы металлических связей в твёрдых
телах. Энергия межатомных связей:
ионная, ковалентная, металлическая.
Ковалентная
связь
образуется м/у атомами 1 или нескольких
хим элементов с близкими ионизационными
.
Появление между положительно заряженными
ионами пары отрицательно заряженных
электронов приводит к тому, что оба
иона притягиваются к обобществленным
электронам и, тем самым, притягиваются
друг к другу.
атом взаимодействует с ограниченным
числом соседей, причем число соседей
= числу валентных е атома
КС насыщенна. Атом взаимодействует
тлк с теми соседями, с кот он обменялся
е-
т. е, КС направлена.
Ионная
связь
образуется при взаимодействии атомов
с малым количеством валентных е и
атомов с большим количеством е на
валентных оболочках. При этом наружные
е атомов с низкими
ионизации переходят на валентные
оболочки атомов с высокими ионизационными
.
В результате образуются «+» и «-»
заряженные ионы, взаимно притягивающиеся
электростатическими силами. ИС
ненасыщенна, т.к
из «-» заряженных ионов притягивает
к себе «+» заряженные, а
из «+» заряженных ионов притягивает
к себе все «-» заряженные. ИС направлена,
т.к. ион притягивает к себе разноименно
заряженные ионы и отталкивает одноименно
заряженные.
размера иона и увеличение его q
ведет к
энергии связи
tПЛ
материала,
коэффициента теплового расширения и
к
модуля упругости. Металлическая
связь
образуется м/у атомами 1 или нескольких
химических элементов, у которых
валентные электронные оболочки
застроены меньше чем на половину.
Поскольку энергия иона min
при полностью заполненной внешней
оболочке, атомы отдают внешние валентные
t
и превращаются в «+» заряженные ионы,
м/у кот находятся свободные е (электронный
газ).
из «+» заряженных ионов притягивается
к свободным е, и, тем самым, ионы
притягиваются друг к другу. МС
ненаправленная и ненасыщенна.
.
Типы металлических связей в твёрдых
телах. Энергия межатомных связей:
ионная, ковалентная, металлическая.
Ковалентная
связь
образуется м/у атомами 1 или нескольких
хим элементов с близкими ионизационными
.
Появление между положительно заряженными
ионами пары отрицательно заряженных
электронов приводит к тому, что оба
иона притягиваются к обобществленным
электронам и, тем самым, притягиваются
друг к другу.
атом взаимодействует с ограниченным
числом соседей, причем число соседей
= числу валентных е атома
КС насыщенна. Атом взаимодействует
тлк с теми соседями, с кот он обменялся
е-
т. е, КС направлена.
Ионная
связь
образуется при взаимодействии атомов
с малым количеством валентных е и
атомов с большим количеством е на
валентных оболочках. При этом наружные
е атомов с низкими
ионизации переходят на валентные
оболочки атомов с высокими ионизационными
.
В результате образуются «+» и «-»
заряженные ионы, взаимно притягивающиеся
электростатическими силами. ИС
ненасыщенна, т.к
из «-» заряженных ионов притягивает
к себе «+» заряженные, а
из «+» заряженных ионов притягивает
к себе все «-» заряженные. ИС направлена,
т.к. ион притягивает к себе разноименно
заряженные ионы и отталкивает одноименно
заряженные.
размера иона и увеличение его q
ведет к
энергии связи
tПЛ
материала,
коэффициента теплового расширения и
к
модуля упругости. Металлическая
связь
образуется м/у атомами 1 или нескольких
химических элементов, у которых
валентные электронные оболочки
застроены меньше чем на половину.
Поскольку энергия иона min
при полностью заполненной внешней
оболочке, атомы отдают внешние валентные
t
и превращаются в «+» заряженные ионы,
м/у кот находятся свободные е (электронный
газ).
из «+» заряженных ионов притягивается
к свободным е, и, тем самым, ионы
притягиваются друг к другу. МС
ненаправленная и ненасыщенна.
 .
ПФ с металлическим типом связи
образуется при взаимодействии
переходных М с неМ, имеющими малые
атомные размеры. При этом образуется
новая крист решётка, отличающаяся и
от решётки М, и от решётки неМ. Эти фазы
наз-ся соответственно гидриды
(соединения с Н), нитриды
(с N),
карбиды
(с С) и бориды
(с В). Интерметаллиды
– ПФ, образованные М и М. К этим
соединениям относят: 1)
электронные
соединения
– ПФ, хим состав и структура кот
определяется электронной конфигурацией
(отношение числа валентных е-
в соединении). Известны 3 типа этих
соединений: ,
j,
.
-фазы
имеют электронную конфигурацию
.
ПФ с металлическим типом связи
образуется при взаимодействии
переходных М с неМ, имеющими малые
атомные размеры. При этом образуется
новая крист решётка, отличающаяся и
от решётки М, и от решётки неМ. Эти фазы
наз-ся соответственно гидриды
(соединения с Н), нитриды
(с N),
карбиды
(с С) и бориды
(с В). Интерметаллиды
– ПФ, образованные М и М. К этим
соединениям относят: 1)
электронные
соединения
– ПФ, хим состав и структура кот
определяется электронной конфигурацией
(отношение числа валентных е-
в соединении). Известны 3 типа этих
соединений: ,
j,
.
-фазы
имеют электронную конфигурацию