
Лабораторный практикум / 2-ая физическая лаборатория / Оптика / 73 - Определение энергии диссоциации йода по его спектру поглощения / 73 - Определение энергии диссоциации йода по его спектру поглощения
.pdf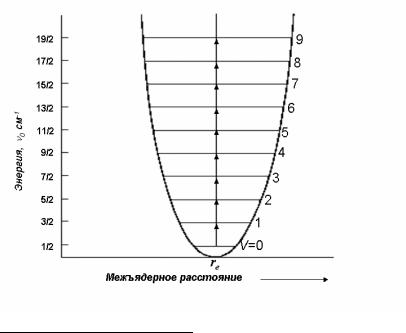
Определение энергии диссоциации йода по его спектру поглощения
Молекулярный спектр в отличие от атомного (линейчатого), состоит из полос, представляющих собой группы близко расположенных линий (полосатые спектры). Причина усложнения — в том, что кроме энергии электронной оболочки (что есть и у атомов), молекула обладает энергией колебания и вращения, и процессы испускания и поглощения света влияют на запасы этих видов энергии, что и проявляется в молекулярных спектрах. Встречаемые в спектрах газов сплошные полосы отражают какие-либо предельные процессы (ионизации, рекомбинации, диссоциации), происходящие с атомом или молекулой. Спектральные характеристики таких полос несут количественную информацию об этих процессах. В настоящей работе по спектру поглощения паров молекулы йода предлагается определить энергию диссоциации молекулы в основном состоянии.
1 |
Молекула, как гармонический осциллятор |
Двухатомная молекула состоит из двух положительных ядер и электронов, образующих около ядер оболочки, в чем-то подобные атомным. Взаимодействие электронов с ядрами удерживает ядра на некотором равновесном расстоянии друг от друга и определяет непосредственно прочность связи атомов в молекуле. Рассмотрим на примере двухатомной молекулы, как зависит сила, удерживающая ядра, от их взаимного расположения. Существование устойчивой молекулы есть следствие равновесия двух сил. С одной стороны, имеется отталкивание между положительно заряженными ядрами обоих атомов и между отрицательными электронными «облаками», с другой – притяжение между ядром одного атома и электронами другого, и наоборот. Два атома располагаются на таком среднем межъядерном расстоянии re, при котором эти силы точно уравновешены и энергия системы минимальна. Межъядерное расстояние re называется равновесным расстоянием или, проще, длиной связи1. При сближении атомов друг с другом быстро растут силы отталкивания, а при удалении — силы притяжения. Сила, возвращающая ядра в положение равновесия, пропорциональна их смещению и равна:
f=-k (r – re), |
(1) |
Где f - сила упругости, k - силовая постоянная, и r – межъядерное расстояние. Система, удовлетворяющая этому условию, называется гармоническим осциллятором. Кривая потенциальной энергии гармонического осциллятора представляет собой параболу и описывается формулой:
E = |
1 |
k(r − re )2 |
(2) |
|
2 |
||||
|
|
|
Иными словами, малые колебания двухатомной молекулы могут рассматриваться как колебания гармонического осциллятора, потенциальная энергия которого квадратично зависит от смещения (рис.1).
Рис.1. Кривая потенциальной энергии двухатомной молекулы, испытывающей чисто гармонические колебания.
1 В спектроскопии принято помечать молекулярные постоянные, вычисленные для равновесных состояний, индексом "e", например, re, De
А А. Загрубский Цыганенко Н.М. А. П. Чернова |
1 |

Заметим, что колебательное движение системы из двух ядер с массами m1 и m2 относительно друг друга можно легко свести к колебанию одной массы M относительно положения равновесия. Масса M называется приведенной массой и определяется соотношением:
M=m1m2/(m1+m2)
В рамках классической механики частота колебаний гармонического осциллятора описывается формулой:
ν0 = |
1 |
k M (Гц) |
(3) |
2π |
Размерность используемых в колебательной спектроскопии единиц – волновых чисел – обратные сантиметры (см-1), а частота в формуле (3) выражена в периодах в секунду: (с-1 или гц). Коэффициентом пропорциональности для перевода одних единиц в другие в этом случае является скорость света c, выраженная в сантиметрах в секунду, то есть:
ν(Гц) = c ~ν (см-1)
Теперь, выражение для частоты колебаний гармонического осциллятора (3) можем записать в таком виде:
~ |
|
1 k |
M (см |
-1 |
) |
(4) |
ν0 |
= |
2πc |
|
Квантовомеханическое рассмотрение задачи о колебаниях двухатомной молекулы дает в приближении гармонического осциллятора следующее выражение для полной энергии:
|
|
Ev= hν0(v+1/2)(Дж) |
(5) |
Где ν0 = |
1 |
k M - классическая колебательная частота, определяемая выражением (3); M - приведенная |
|
2π |
|||
масса молекулы; v - колебательное квантовое число; v=0,1,2….
Видно, что в нулевом колебательном состоянии (при v=0) колебательная энергия двухатомной молекулы не равна нулю, атомы не могут быть неподвижными друг относительно друга. В этом состоит разница между квантовомеханическим и классическим описанием. Классическая механика допускает, что молекула может вообще перестать колебаться.
Решение уравнения Шредингера дает правило отбора для колебательных переходов гармонического осциллятора:
∆v=± 1 |
(6) |
Уровни энергии гармонического осциллятора представляют собой последовательность равноотстоящих уровней с интервалами равными hν. С учетом правила отбора (6), можно показать, что спектр гармонического осциллятора состоит из единственной частоты ν, обусловленной переходом 0-1, 1-2, 2-3 и т.д.(рис.1.).
Отметим, что в используемых в спектроскопии единицах (обратных сантиметрах) допустимые значения энергии гармонического осциллятора (5) имеют вид:
εv= Ev /hc=(v+1/2) ν |
0 (см |
|
) |
(7) |
~ |
|
-1 |
|
|
Однако, при рассмотрении колебаний реальной двухатомной молекулы, приближения гармонического осциллятора недостаточно.
2Ангармоничность.
Сувеличением амплитуды колебаний приближение гармонического осциллятора перестает быть справедливым для молекулы: кривая потенциальной энергии не может иметь параболическую форму на всем своем протяжении, иначе возвращающая сила будет монотонно возрастать до бесконечно больших значений. Реально же, если связь между атомами растягивать, то, в конце концов, она разорвется, то есть молекула диссоциирует на атомы, когда энергия колебаний достигнет значения величины энергии диссоциации D. Для больших амплитуд колебаний (порядка 10% от длины связи) выражение (2) для потенциальной энергии уже не пригодно, поскольку потенциальная энергия зависит от расстояния между атомами более сложным образом. Расхождение между реальной кривой потенциальной энергии и параболой называют ангармоничностью колебаний. Эмпирическое выражение, описывающее реальную кривую потенциальной энергии, было получено Морзе ( Morse ) и называется функцией Морзе:
E=De{1-exp[a(re-r)]}2 |
(8) |
Где a- постоянная, характеризующая конкретные молекулы, De – энергия диссоциации. Видно, что при больших значениях г потенциальная энергия стремится к De, а при малых – формула (8) переходит в выражение
(2) для энергии гармонического осциллятора. Минимум энергии достигается при r=re. (рис.2.).
2 |
А А. Загрубский Цыганенко Н.М. А. П. Чернова |

Рис.2. Уровни колебательной энергии двухатомной молекулы, совершающей ангармонические колебания.
Приближенная формула, учитывающая ангармоничность, дает в общем случае такие значения колебательной энергии:
E v=hν(v+1/2) - hνx(v+1/2)2 |
(9) |
Формула (9) выведена, исходя из разложения потенциальной энергии в степенной ряд вблизи равновесного значения r=re, что имеет смысл для не очень больших амплитуд колебаний, и содержит наряду с основным членом, пропорциональным (v+1/2), поправочный член, обусловленный ангармоничностью и пропорциональный (v+1/2)2. Безразмерная постоянная x характеризует ангармоничность и не превышает нескольких сотых, т.е. не очень велика.
Наличие ангармоничности приводит к тому, что правило отбора (6) ∆v=± 1 становится не строгим, и в реальных системах наряду с переходами ∆v=± 1становятся возможными переходы с ∆v=±2,±3 (первый, второй и т.д. обертоны), хотя и с гораздо меньшей вероятностью.
Положение уровней на реальной кривой потенциальной энергии заметно отличается от положения уровней на параболической кривой. Обозначая входящие в формулу (9), где энергия отсчитывается от минимума потенциальной кривой, значения ν и x как νe, и xe, получим выражение для расстояния между последовательными уровнями энергии ангармонического осциллятора:
∆Ev, v+1= E v+1- Ev=hνe[(1- 2xe (v+1)] |
(10) |
Частота перехода 0-1 равна |
|
ν01=νe(1-2xe) |
(11) |
и не совпадает с частотой гармонического осциллятора, определяемой формулой (3). Для перехода 1-2
частота равна ν12=νe(1-4xe), для перехода 2-3 - ν23=νe(1-6xe), то есть частоты убывают по величине и не совпадают друг с другом. Впрочем, из-за малой заселенности при комнатной температуре колебательных
уровней v=1,2…, частоты ν12 и тем более ν23 наблюдаются редко. Таким образом, наличие ангармоничности проявляется в том, что колебательные уровни реальной молекулы располагаются не на равных расстояниях hν, а сгущаются с ростом колебательного квантового числа v, и сходятся к энергии, равной энергии диссоциации (рис.2.). Существенно, что число колебательных уровней, находящихся ниже границы диссоциации, как правило, конечно.
Таким образом, одной из величин, характеризующих кривую потенциальной энергии реальной молекулы, является величина D - энергия диссоциации. По спектрам оптических переходов ее можно определить как предел (коротковолновый предел дискретного спектра электронно-колебательных переходов, в поглощении), к которому сходятся наблюдаемые линии2. Из теории следует, что зависимость расстояний между соседними колебательными уровнями от колебательного квантового числа v – линейна, так что предельную частоту сходимости можно определить линейной экстраполяцией точек на соответствующем графике.
3 |
Электронные спектры. |
При обычных температурах для возбуждения электронных переходов нужны энергии, значительно превосходящие энергию теплового движения. Электронные переходы могут быть возбуждены при поглощении молекулой световых квантов с частотами, лежащими в видимой и ультрафиолетовой областях, при соударении молекулы с электронами в электрическом разряде, при соударении с другими молекулами, обладающими высокой кинетической энергией, соответствующей высоким температурам. При переходе на более высокий электронный уровень оболочка молекулы меняет свои свойства и строение: в случае двухатомной молекулы это означает изменение вида потенциальной кривой. При этом в возбужденном состоянии может иметь место
2 При дальнейшем увеличении энергий фотонов, когда энергия сообщаемая молекуле, превышает |
энергию |
диссоциации , ее избыток переходит в кинетическую энергию разлетающихся атомов. |
|
А А. Загрубский Цыганенко Н.М. А. П. Чернова |
3 |
увеличение или (чаще) уменьшение энергии диссоциации D, увеличение или уменьшение равновесного расстояния re; наконец, возбужденное состояние может вообще оказаться неустойчивым, то есть обладать потенциальной кривой, не имеющей минимума. Каждой потенциальной кривой соответствует своя колебательная частота ν, следовательно, при переходе в возбужденное состояние эта частота меняется. Меняются и оставленные вне нашего рассмотрения вращательные уровни, так как меняются re и момент инерции молекулы I. Каждой потенциальной кривой, каждому электронному уровню соответствует своя совокупность колебательных и вращательных уровней.
4 |
Принцип Франка-Кондона. |
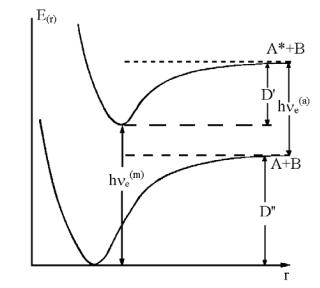
Согласно принципу Франка-Кондона, изменение состояния электронной оболочки молекулы при электронном переходе происходит так быстро по сравнению с колебаниями ядер, что в момент электронного перехода ядра сохраняют как свое положение, так и свои скорости. Идея принципа принадлежит Франку, сформулировавшему его на основе классических представлений, а квантовомеханическое обоснование было дано Кондоном. При электронном переходе ядра оказываются сразу в силовом поле, отличающимся от силового поля исходного состояния, так как вид кривой потенциальной энергии существенно изменился. Чтобы получить значения колебательной энергии молекулы после электронного перехода, необходимо, таким образом, спроектировать точку, описывающую движение ядер, с исходной потенциальной кривой на конечную по вертикальному направлению, т.е. сохраняя ее положение по оси абсцисс (рис.3.).
Рис.3. Уровни энергии и кривые потенциальной энергии двух электронных состояний молекулы (согласно [1]).
При колебании молекула больше всего времени проводит в точках наибольшего отклонения - в точках пересечения потенциальной кривой с колебательными уровнями, поскольку в этих точках скорость движения наименьшая, в них колебательное движение меняет направление на обратное. Поэтому, переходы с нижней кривой на верхнюю под действием внешнего агента (свет, тепло) будут происходить наиболее часто именно из этих двух точек и прилегающих областей. Аналогично происходит процесс испускания света: переходы вниз совершаются по преимуществу из точек поворота на
верхней кривой потенциальной энергии, где ядро задерживается наиболее продолжительное время.
В зависимости от вида и относительного положения кривых потенциальной энергии и получаются наблюдаемые на опыте распределения интенсивности спектральных полос.
5 |
Спектральное определение энергии диссоциации молекулы. |
Постепенное возрастание колебательной энергии ядер приводит в пределе, когда подводится энергия D, к распаду молекулы на атомы, т.е. к ее диссоциации. При сообщении молекуле энергии, превышающей D, избыток переходит в кинетическую энергию разлетающихся атомов. Большие порции колебательной энергии могут быть сообщены молекуле одновременно с возбуждением ее электронной оболочки. Накопляемая таким образом энергия ядер может в предельном случае достичь значения D и привести к распаду возбужденной молекулы. Частота света, вызывающая этот предельный процесс, определяется равенством:
hνпред= Em + D' |
(12) |
где Em - изменение энергии при чисто электронном переходе молекулы; D' - энергия диссоциации возбужденной молекулы. Поглощение света частоты, больше предельной, вызовет распад молекулы на части, обладающие избытком кинетической энергии. Вид получаемого при этом спектра поглощения показан на рисунке 4: полосы сходятся к некоторому пределу, за которым начинается сплошная область поглощения, соответствующая диссоциации молекулы на атомы с любым значением кинетической энергии.
4 |
А А. Загрубский Цыганенко Н.М. А. П. Чернова |
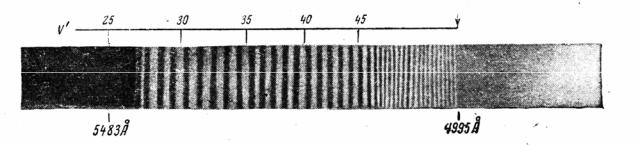
Рис.4. Схождение серии молекулярных полос к пределу: спектрограмма паров иода [2].
С точки зрения принципа Франка-Кондона, это будет иметь место с большой вероятностью тогда, когда потенциальная кривая верхнего состояния смещена настолько вправо по отношению к равновесному положению нижнего состояния, что вертикальная стрелка, исходящая из нижнего нулевого колебательного состояния попадает не на квантованную часть кривой возбужденного электронного состояния, но в точку, лежащую выше энергии диссоциации возбужденной молекулы.
Таким образом, появление в спектре поглощения молекулы сплошных областей поглощения указывает на то, что молекула под влиянием этих частот диссоциирует на атомы, обладающие тем большим запасом кинетической энергии, чем дальше поглощаемая частота отстоит от предельной частоты, определяемой соотношением (12).
В рассмотренном выше процессе диссоциации до сих пор не учитывалось то обстоятельство, что молекула диссоциирует не в нормальном, а в возбужденном состоянии электронной оболочки. Испускания при диссоциации молекулы избыточной энергии в виде кванта соответствующей частоты не наблюдается. Отсюда следует, что энергия возбужденной оболочки молекулы должна перейти в энергию возбуждения электронных оболочек и частично в кинетическую энергию разлетающихся атомов. Непосредственным опытом было показано, что поглощение предельной частоты приводит к распаду молекулы на два атома, из которых, по крайней мере, один находится в возбужденном состоянии. Этот распад молекулы на два атома, из которых один возбужден, может быть формально представлен, как диссоциация нормальной молекулы (энергия D) плюс возбуждение атома (энергия Ea). Затрачиваемая при процессе распада энергия не должна зависеть от пути, по которому этот процесс совершается, поэтому:
Em + D' = D + Ea (13)
где Em - изменение энергии при чисто электронном переходе молекулы.
Соотношение (13) может быть использовано для спектроскопического определения энергии дисоциации D. Из сравнения (12) и (13) видно, что левая часть соотношения (13) представляет собой выражение для предельной колебательной частоты, определяемой из спектра поглощения, как указывалось выше, а величина Ea - определенный уровень энергии атомной системы. Например, в случае молекул галоидов Ea соответствует энергии перехода атома галоида из нормального в ближайшее метастабильное состояние. Требующиеся для этого энергии приведены в таблице:
Атом |
Ea(эВ) |
Ea(ккал/моль) |
Cl |
0.11 |
2.5 |
Br |
0.46 |
10.5 |
J |
0.94 |
21.6 |
6 |
Экспериментальная часть работы. |
|
Задание: Снять спектр поглощения йода и по предельной колебательной частоте определить энергию диссоциации молекул йода.
Литература.
1.А. Н. Теренин "Введение в спектроскопию", Л-1933г., гл. 3, §93, Спектральное определение энергии диссоциации молекулы.
2.М.В. Волькенштейн "Строение молекул", М-Л 1947 г., гл. VII, Спектры молекул.
А А. Загрубский Цыганенко Н.М. А. П. Чернова |
5 |
