
- •Методическое пособие по педиатрии
- •Часть I. Болезни детей младшего и старшего возраста
- •Глава I. Аномалии конституции
- •Глава II. Аллергические заболевания
- •Глава III. Заболевания органов дыхания
- •Таб.1. 23.Этиология внебольничных пневмоний у детей
- •Глава IV. Белково-энергетическая недостаточность
- •Глава V. Рахит, нарушение фосфорно-кальциевого обмена
- •Глава VI. Болезни почек и мочевых путей
- •Чрнс и гзнс
- •Прекратить вводить антибиотики IV поколения. Назначение антибиотиков для орального применения на 1-4 недели. Выписка.
- •Гипотрофия III степени.
- •Классификация дискинезий желчевыделительной системы
- •Глава IX. Заболевания сердечно-сосудистой системы
- •Врожденные пороки сердца бледного типа
- •Врожденные пороки сердца с препятствием к выбросу из желудочков
- •Врожденные пороки сердца с цианозом
- •Часть II. Неонатология
- •Часть II. Неонатология
- •Глава VIII. Болезни системы крови железодефицитные состояния у детей
- •Основные этапы патогенеза
- •Краткая информация о тромбоцитах, дифференцировке мегакариоцитарного ростка
- •Дифференциальный диагноз итп проводят с острым лейкозом, апластическими анемиями, наследственными тромбоцитопатиями, симптоматическими тромбоцитопеническими пурпурами.
- •Задачи лечения:нормализация уровня тромбоцитов в крови, купирование проявлений итп.
- •Спленэктомия показана при итп не поддающейся коррекции базисными препаратами, при угрожающих жизни кровотечениях, хронизации процесса, но не ранее чем через 1 год с момента дебюта заболевания.
- •Прогноз при итПдля жизни благоприятный. Летальность не превышает 2-3%.
- •Часть 2
- •Глава I. Введение в неонатологию
- •Глава II. Организация медицинского обслуживания новорожденных в родильном доме
- •Глава III. Адаптация, пограничные состояния
- •Глава IV. Задержка внутриутробного развития
- •Глава V. Гипоксия плода и асфиксия новорожденного
- •Тактика ведения новорожденных после завершения первичных реанимационных мероприятий
- •Глава VI. Родовая травма. Интранатальные повреждения нервной системы
- •Глава VII. Недоношенные дети
- •Причины рождения недоношенных детей:
- •Энтеральное питание
- •Возможные варианты питания ребенка в зависимости от гестационного возраста и наличия заболеваний:
- •2. Этап полного (сбалансированного) зондового питания
- •3. Этап отмены зондового питания
- •Глава VIII. Гемолитическая болезнь новорожденных
- •Глава IX. Инфекционные заболевания новорожденных
- •Глава IX. Неинфекционные заболевания системы дыхания
- •Глава X. Болезни кожи и пупочной ранки
- •Глава XI. Геморрагическая болезнь новорожденного
Глава IX. Инфекционные заболевания новорожденных
СЕПСИС (С) – Неонатальный С – генерализованное инфекционное заболевание с ациклическим течением, вызванное условно-патогенной бактериальной микрофлорой, в основе которого лежит дисфункция иммунной системы организма с развитием очага (очагов) гнойного воспаления или бактериемии, системной воспалительной реакции и полиорганной недостаточности у детей первого месяца жизни.
Эпидемиология. Данные о распространенности С противоречивые. Считают, что С развивается у 0,1-0,8% новорожденных. Особенно часто С встречается у недоношенных и у детей, находящихся на лечении в реанимационных отделениях – до 14%. Установлено, что один документированный случай сепсиса приходится на 11-23 случаев, когда новорожденным назначают лечение, исходя из подозрения на наличие сепсиса (GerdesJ.S., 1991).
Этиология.В антенатальном период наиболее частыми возбудителями С являются:стрептококки группы В, E. Coli, S. Agalactucae. В интранатальном периоде С вызывают:S. Agalactucae,E. Coli, S. Aureus. Для постнатального периода характерны:S. Aureus, E. Coli, Klebsiella spp., S. Pyogenis и др.
Табл. 2.28. Наиболее вероятные возбудителя сепсиса в зависимости от локализации первичного очага инфекции
|
Локализация первичного очага |
Наиболее вероятные возбудители |
|
Пупочная ранка |
S. Aureus, E. Coli |
|
Легкие. В том числе ИВЛ-ассоциирован-ный сепсис |
S. pneumonie, K. pneumonie, S. Aureus et epidermidis, H. Influenzae тип В, Ps. Aeruginosae (при ИВЛ), Actnetobacter spp (при ИВЛ) |
|
Кишечный |
Enterobacteriocease spp., Enterobacter spp., |
|
Абдоминальный (хирургический) |
Enterobacteriocease spp., Enterobacter spp., Ps. Aeruginosae, Анаэробы |
|
Кожа |
S. Aureus et epidermidis |
|
Риноконъюктивальная область |
S. pyogenis et viridas |
|
Ротоносоглотка |
S. pyogenis et viridas |
|
Среднее ухо |
S. pyogenis et viridas, E. Coli, H. Influenzae |
|
Мочевые пути |
E. Coli, Enterobacteru Enterococcus spp., S. Aureus et epidermidis |
|
Внутривенный катетер |
S. Aureus et epidermidis |
Патогенез. Входными воротами С у новорожденных чаще всего является пупочная ранка. В других случаях инфекция может попадать через кожу, ЖКТ, места инъекций, легкие и др. В месте попадания инфекции развивается первичный гнойный очаг.
Развития бактериемии является важным этапом патогенеза С. Существенным моментом при этом является недостаточная активность иммунной системы новорожденного. Выделяющиеся при развития воспалительного процесса цитокины, катехоламины, кинины и другие биологически активные вещества приводят к формированию системного воспалительного ответа (реакции). На первом этапе этих изменений происходит повышение периферического сопротивления, АД, снижение капиллярной перфузии тканей. В дальнейшем развиваются гиповолемия, нарушение утилизации глюкозы, избыточная активация гипоталамо-гипофизарно-надпочечниковой системы.
Падение уровня СТГ, неадекватный выброс АКТГ,снижение функциональной активности щитовиднойжелезы лежат в основе усугубления системного воспалительного ответа, что приводит к формированию полиорганной недостаточности.
Важным моментом в развитии С является формирование ДВС-синдрома, который присутствует при этом заболевания практически во всех случаях.
ДВС-синдром является одним из основных причин развития гемокоагуляционного и септического шоков.
Полиорганная недостаточность, вторичная иммунная недостаточность, способствуют формированию вторичных гнойныхочагов.






































Рис. 2.3. Схема патогенез сепсиса
Классификация. Единой классификации сепсиса новорожденных в России в настоящее временя нет. Выделяют ранний (врожденный С), при котором проявления заболевания появляются в первые 3 дня жизни ребенка и поздний С, который развивается после 3-го дня жизни.
В зависимости от условий инфицирования выделяют внебольничный и внутрибольничный С. В диагнозе С так же указывают этиологию заболевания, входные ворота (пупочная ранка, кожа, легкие, ЖКТ и др.). По клинической форме выделяют: септицемию и септикопиемию.
Проявлениями полиорганной недостаточности являются: септический шок, острая легочная недостаточность, острая сердечная недостаточность, острая почечная недостаточность, острая кишечная непроходимость, острая надпочечниковая недостаточность, отек мозга, вторичная иммунная дисфункция.
Исследования. Общий анализ крови (с подсчетом тромбоцитов) и анализ мочи, посев крови, а также посевы из гнойных очагов (экссудата, мочи, ликвора и др.); протеинограмма; коагулограмма; общий билирубин, трансаминазы крови; копрограмма; рентгенография органов грудной клетки, УЗИ; уровни мочевины и креатинина в крови; парциальное давление газов крови (РаО2, РаСО2), SaO2; показатели КОС; ЭКГ, ЭхоКГ; уровень кортизола в крови, уровень тиреотропного гормона (ТТГ); С-реактивный белок, иммунограмма, прокальцитонин сыворотки, интерлейкин-8 в сыворотке крови.
Клиника С зависит от формы заболевания, возраста, этиологии, и т.д. Для оценки степени тяжести С целесообразно использование различных шкал.
Характерной клинической картины С у новорожденных нет. Клинику неонатального С можно описать следующим образом: младенец плохо выглядит, плохо дышит и плохо усваивает питание. При раннем неонатальном С отмечают патологические прибавки массы тела, отеки, в том числе плотные (склерема), геморрагический синдром и тромбозы, раннее появление и быстрое прогрессирование желтухи, дыхательные расстройства в отсутствии выраженных рентгенографических изменений, чаще гипотермия, гепатоспленомегалия, срыгивания и рвота, олигурия. В этом случае возможна манифестация септическим шоком. При позднем неонатальном С выявляют более постепенное начало с формированием типичного септического габитуса: серый оттенок кожи, усиление мраморного рисунка, патологические потери массы или плоская весовая кривая, затяжное течение желтухи, диспептические расстройства, неврологические и дыхательные нарушения, геморрагический синдром, нарушения кровообращения.
Первичный септический очаг при раннем неонатальном С как правило отсутствует. Первичный септический очаг у детей позднего неонатального периода чаще всего проявляется поражением пупочных сосудов (<25%), заболеваний легких (20-25%) и кишечника (не менее 20%), другие локализации входных ворот не превышают 2-6%. В некоторых случаях установить входные ворота С не удается (криптогенный С).
Септицемия характеризуется наличием у детей «общих» проявлений заболевания, бактериемией, признаками токсикоза и полиорганной недостаточности, геморрагического синдрома.
Септицемия – форма С с наличием не более одного очага гнойной инфекции (входные ворота). Характерно фульминантное развитие клинических симптомов, системной воспалительной реакции и ПОН при отсутствии метастатических пиемических очагов.
Септикопиемия – форма С с наличием двух (входные ворота и метастатический пиемический очаг) и более очагов гнойной инфекции, с высевом однотипного возбудителя. Септикопиемия проявляется наличием у детей «общих» признаков заболевания, бактериемией, симптомами токсикоза и полиорганной недостаточности, а так же клиникой септикопиемических очагов. Наиболее частыми пиемическими очагами у детей периода новорожденности являются: гнойный менингит, остеомиелит, абсцедирующая пневмония, флегмона новорожденного, абсцессы кожи.
Септический шок – С с гипотензией, сохраняющейся, несмотря на адекватное волемическое возмещение, и нарушением тканевой перфузии, полиорганной недостаточностью.
Клиника раннего С у новорожденных, вызванного -гемолитическим стрептококком группы В:развитие С в первые дни жизни, апноэ, снижение АД, персистирующее фетальное кровообращение, заболевания легких, неотличимые от РДС, масса тела при рождении менее 2500 г, низкая оценка по шкале Апгар, лихорадка у матери, преждевременные роды, длительный безводный период.
Диагностика С включает три этапа.
Первый этап постановки диагноза – предположение о наличии заболевания. Диагностика раннего неонатального С затруднительна из-за отсутствия специфических для этого периода проявлений. В первую очередь необходимо установить наличие инфекционного заболевания вообще и постараться выявить местную воспалительную реакцию (входные ворота) с учетом инфекционного статуса матери.
Второй этап диагностики– выявление дисфункции жизненно важных органов и систем и оценка степень нарушения их функции.
Очень существенным моментом в диагностике С является выявление признаком полиорганной недостаточности (ПОН). Полиорганная недостаточность – характеризуется выраженным нарушением функции не менее чем 2-х органов с учетом возрастных критериев. Синдромы органной недостаточности изложены в табл. 2.29.
Табл.2.29.Клинические и лабораторные критерии органной недостаточности при сепсисе новорождённых(Неонатология. Национальное руководство)
|
Нарушения функций систем органов |
Клинические |
Лабораторные |
|
Дыхательная недостаточность |
Тахипноэ или брадипноэ Цианоз периоральный, общий Аускультативно ослабленное дыхание, возможна крепитация Необходимость в ИВЛ или РЕЕР |
paO2 <60 мм рт. ст. spO2 <90% paO2 /fiO2 <300 Респираторный или смешанный ацидоз |
|
Сердечно-сосудистая недостаточность |
Тахикардия или брадикардия Расширение границ сердца Нарушения ритма Артериальная гипотензия Увеличение печени, отёки Необходимость гемодинамической поддержки |
Изменение центрального венозного давления, давления заклинивания лёгочной артерии Снижение фракции выброса Снижение сердечного выброса Изменения по данным ЭКГ метаболического характера |
|
Почечная недостаточность |
Олигурия Анурия Отёки |
Увеличение в крови уровня креатинина и/или мочевины Снижение диуреза Снижение СКФ и канальцевой реабсорбции воды и натрия, гиперкалиемия Протеинурия |
|
Печёночная недостаточность |
Увеличение печени Желтуха |
Повышение уровня АСТ, АЛТ Нарушение синтетической функции печени Нарушение конъюгации билирубина или синдром холестаза Удлинение ПВ Удлинение АЧТВ |
|
Недостаточность системы гемостаза |
Склонность к спонтанной кровоточивости, кровоточивости из мест инъекций, тромбозы |
Увеличение ПВ или АЧТВ Удлинение тромбинового времени, повышение содержания растворимых комплексов фибрин-фибриноген мономеров, продуктов деградации фибрина, удлинение АКТ, положительный этаноловый тест Депрессия фибринолиза Снижение уровня протеина С Тромбоцитопения Анемия |
|
Недостаточность системы органов пищеварения |
Срыгивания, рвота Застой в желудке, неусвоение ЭП Диарея Парез кишечника Желудочно-кишечные кровотечения Патологические примеси в стуле (слизь, зелень, кровь) Ишемия или инфаркт тонкой кишки |
Рентгенологические признаки пареза кишечника или НЭК Дисбактериоз |
|
Нарушения функций нервной системы |
Синдром угнетения безусловно-рефлекторной деятельности Синдром повышенной нервно-рефлекторной возбудимости Неонатальные судороги Кома |
Ультразвуковые признаки ишемического поражения ЦНС Признаки отёка мозга на НСГ Признаки гипертензионно-гидроцефального синдрома на НСГ УЗ-признаки ВЖК Нарушения биоэлектрической активности коры головного мозга Небольшое повышение уровня белка при нормальном или повышенном цитозе СМЖ |
|
Недостаточность желёз внутренней секреции |
Потеря массы тела Признаки надпочечниковой недостаточности Отёчный синдром Синдром транзиторной недостаточности гормонов щитовидной железы |
Гипогликемия (вначале гипергликемия) Транзиторное снижение уровня кортизола (в начальной фазе шока может быть гиперкортизолемия) Снижение уровня Т3, Т4, особенно при шоке Нормальный или повышенный уровень ТТГ, при шоке — снижение уровня ТТГ Снижение уровня СТГ, особенно при шоке |
Третий этап диагностики — оценка системной воспалительной реакции организма новорождённого. Важным моментом диагностики С на первом этапе является выявление признаков СВР (SIRS).
Системная воспалительная реакция (СВР)– общебиологическая неспецифическая реакция организма человека в ответ на действие повреждающего эндогенного или экзогенного фактора. Признаки СВР: длительная (свыше 3 дней) лихорадка (t>37,5°С) или прогрессирующая гипотермия (t<36,2°С) при соблюдении соответствующего температурного режима; изменения в ОАК (см. табл. 2.30); повышение С-реактивного белка в сыворотке крови > 6 мг/л; повышение уровня прокальцитонина в сыворотке крови >2 нг/мл; повышение уровня интерлейкина-8 в сыворотке крови >100 пг/мл.
Табл. 2.30. Изменения состава периферической крови, характерные для воспалительной реакции у новорождённых
|
Показатель |
Возраст ребёнка |
Значение, при котором правомочно использовать соответствующий показатель (x109/л) |
|
Лейкоцитоз |
1–2 дня |
> 30 000 |
|
3–7 дней |
> 20 000 | |
|
>7 дней |
> 15 000 | |
|
Лейкопения |
|
< 5000 |
|
Нейтрофилёз |
1–2 дня |
> 20 000 |
|
3–7 дней |
> 7000 | |
|
> 7 дней |
> 6000 | |
|
Нейтропения |
1–2 дня |
< 5000 |
|
3–7 дней |
< 2000 | |
|
> 7 дней |
< 1500 | |
|
Увеличение количества юных форм нейтрофилов |
1–2 дня |
> 5000 |
|
с 3-го дня |
> 1500 | |
|
Нейтрофильный индекс (отношение количества юных форм к общему количеству нейтрофилов) |
≥0,2 | |
Этиологическая диагностика С включает бактериологические исследования биологического материала для установления этиологии, т.е. посев крови, СМЖ (по клиническим показаниям), аспирата из трахеи, мочи, отделяемого из гнойных очагов. Следует помнить, что результаты микробиологического исследования мазков из зева, конъюнктивы, кожных покровов, мочи, кала (если они не являются первичными гнойно-воспалительными очагами) не могут использоваться для этиологического диагноза С. С до настоящего времени остается клиническим диагнозом, выделение возбудителя при бакпосевах крови не является абсолютным критерием диагностики С, хотя бактериемия предполагается всегда.
С в неонатальном периоде необходимо предполагать в 2 ситуациях: 1. В первые трое суток жизни наличие тяжелого инфекционного токсикоза и хотя бы трёх из перечисленных признаков СВР. 2. У новорожденных детей старше 3-дневного возраста при наличии первичного инфекционно-воспалительного очага (связанного с окружающей средой) и хотя бы 3 из перечисленных признаков СВР. Предположительный диагноз – показание для немедленного назначения эмпирической антибактериальной терапии, а также проведения всего необходимого объёма лечебных мероприятий.
Целесообразно в течение 5–7 дней либо подтвердить, либо отвергнуть диагноз предполагаемого С. Исчезновение признаков системного воспалительного ответа параллельно с санацией очага инфекции и, тем более, отсутствие связи клинических проявлений системного воспалительного ответа с инфекцией, свидетельствует против диагноза «сепсис».
Диагноз «сепсис» можно установить сразу при наличии первичного септического очага и метастатических пиемических очагов с единым возбудителем.
Дифференциальный диагноз. Гнойно-воспалительные заболевания, протекающими с лихорадкой и интоксикацией при наличии тяжелого состояния, нескольких гнойных очагов, полиорганных поражений, тромбогеморрагического синдрома, прогрессирующего ухудшения состояния требуют исключения сепсиса. Следует иметь в виду, что SIRS развивается параллельно с клиникой этих заболевания и исчезает по мере санации гнойного очага.
Табл. 2.31.Дифференциальный диагноз сепсиса с гнойно-воспалительными заболеваниями
|
Признак |
Сепсис |
Гнойно-воспалительные заболевания |
|
Признаки SIRS |
Характерно наличие 3-х и более из известных признаков |
Не характерны, единичные проявления SIRS |
|
Тяжелое состояние больного |
Характерно |
Не характерно |
|
Бактериемия |
Характерна |
Не характерна, быстро проходящая |
|
Полиорганная недостаточность |
Характерна |
Не характерна |
|
Проявления септического шока |
Характерны |
Не характерны |
|
Геморрагический синдром |
Характерен |
Редко |
|
Желтуха |
Характерна, быстро прогрессирует |
Не характерна |
|
Гипотермия |
Возможна |
Не характерна |
|
Нарушения кровообращения |
Характерны |
Не характерны |
|
Характер пиемических очагов |
Гнойный менингит, остеомиелит, абсцедирующая пневмония, флегмона новорожденного, абсцессы кожи |
Омфалит, конъюнктивит, отит, везикулопустулез, пиодермии и т.д. |
|
Течение заболевания |
Длительное, упорное |
Быстрый эффект от антибактериальной терапии |
Дифференциальный диагноз С и септического эндокардита (тяжелое состояние, лихорадка, появление со стороны сердца шумов органического характера, геморрагические проявления, увеличение печени и селезенки) в первую очередь основывается на выявлении характерных изменений на ЭхоКГ (вегетации).
Большие сложности возникают при дифференциальном диагнозе С и генерализованных внутриутробных инфекций. В основе такого дифдиагноза лежит установление этиологии ВУИ при помощи современных методов (ПЦР, выявление специфических антител класса IgM, исследование авидности антител).
Могут возникнуть сложности при проведении дифференциального диагноза между С и врожденными заболеваниями аминокислотногообмена, для которых характерно наличие SIRS.
Лечение. Задачи лечения: санация первичного септического очага, ликвидация инфекции с помощью адекватной антибактериальной терапии; ликвидация токсикоза и инфекционно-токсического шока; восстановление водных и электролитных нарушений; ликвидация полиорганной недостаточности; лечение вторичных пиемических очагов; коррекция иммунологических нарушений.
Основой лечения С является адекватная антибактериальная терапия
(табл. 2. 32).
Табл. 2. 32.Программа эмпирической антибактериальной терапии сепсиса у детей(Г.А. Самсыгина, 2003)
|
Характеристика сепсиса |
Препараты выбора |
Альтернативные препараты |
|
Ранний сепсис |
Ампициллин + аминогликозиды |
Цефалоспорины III поколения + аминогликозиды |
|
Поздний сепсис |
Цефалоспорины III поколения + аминогликозиды |
Карбоксипенициллины + аминогликозиды, карбопенемы, Гликопептиды, Аминогликозиды |
|
Внебольничный сепсис: - пупочный |
Аминопенициллины + аминогликозиды; Цефалоспорины III поколения (цефтриаксон, цефотаксим) + аминогликозиды |
Гликопептиды, Цефалоспорины IV поколения |
|
-ринофарингеальный, отогенный |
Цефалоспорины III поколения (цефтриаксон, цефотаксим) + аминогликозиды |
Карбопенемы, Цефалоспорины IV поколения |
|
- кишечный |
Цефалоспорины III и IV поколения + аминогликозиды, ингибиторзащищенные карбоксициллины + аминогликозиды |
Карбопенемы, Аминогликозиды |
|
-урогенный |
Цефалоспорины III и IV поколения + аминогликозиды, |
Карбопенемы,
|
|
-госпитальный |
Цефалоспорины III поколения (цефтазидим, цефоперазон сульбактам) + аминогликозиды; ингибиторзащищенные карбоксоциллины + аминогликозиды |
Карбопенемы |
|
-в том числе абдоминальный |
Цефалоспорины III и IV поколения с антисинегнойным эффектом + аминогликозиды; ингибиторзащищенные карбоксоциллины + аминогликозиды |
Карбопенемы Метронидазол Линкозамиды |
|
-посткатетеризационный |
Гликопептиды |
Рифампицин Карбопенемы |
|
-легочный (ИВЛ-ассоциированный) |
Цефалоспорины III поколения (цефоперазон/сульбактам) или IV поколения + аминогликозиды; ингибиторзащищенные карбоксоциллины + аминогликозиды |
|
|
Сепсис на фоне нейтропении |
Цефалоспорины III поколения + аминогликозиды + ванкомицин |
Карбопенемы Гликопептиды |
|
Сепсис на фоне медикаментозной иммуносупрессии |
Цефалоспорины III и IV поколения + аминогликозиды + ванкомицин |
Карбопенемы Ингибиторзащищенные карбоксоциллины
|
Общие принципы антибактериальной терапии при С у детей:
Выбор стартовой антибактериальной терапии осуществляется на основании форм и вариантов С. При уточнении возбудителя следует провести коррекцию лечения – перейти на монотерапию, или препарат более узкого спектра действия.
При выборе препарата предпочтение следует отдавать антибиотикам, проникающим через гематоэнцефалический барьер и обладающих наименьшей токсичностью.
Во всех случаях лечения предпочтение отдают внутривенному пути введения антибиотиков.
Эффективность лечения оценивается через 48-72 часа. При отсутствии эффекта от назначенного лечения производят смену препаратов.
Стартовая антибактериальная терапия раннего (врожденного) Су новорожденных представлена ампициллином в дозе 100-150 мг/кг/сут в 2 введения + амикацин или гентамицин по 5-7 мг/кг/сут в 2 введения; или нетилмицином по 5 мг/кг/сут в 1 введение.
Альтернативными антибиотиками для лечения данного варианта С являются: цефотаксим или цефтриаксон вместе с амикацином или гентамицином, или нетилмицином.
Стартовая антибактериальная терапия позднего Су новорожденных включает следующие схемы: цефотаксим по 100 мг/кг/сут или цефтриаксон по 50-75 мг/кг/сут, или цефоперазон по 100 мг/кг/сут вместе с амикацином, или гентамицином, или нетилмицином.
Лечение пупочного Сстроится в учетом возбудителей, вызывающих воспалительные заболевания пупочной ранки и сосудов (стафилококки, кишечная палочка, энтеробактерии, ассоциации микробов). Стартовыми антибиотиками при этом варианте С являются: амоксициллин/клавуланат по 60-120 мг/кг/сут в 2-3 введения или цефазолин, или цефуроксим вместе с амикацином или гентамицином, или нетилмицином.
Альтернативными препаратами в этом случае являются: ванкомицин по 40 мг/кг/сут в 2 введения или имипенем по 60 мг/кг/сут в 3 введения, или тикарциллин по 50 мг/кг/сут в виде монотерапии или совместно с амикацином или гентамицином, или нетилмицином.
При пупочном С, развившимся в условиях стационара показаноназначение: цефотаксима или цефтриаксона вместе с амикацином или гентамицином, или нетилмицином. К альтернативным препаратам в этом случае относят: цефалоспорины III поколения, ванкомицин, которые применяются или в виде монотерапии, или в сочетании с аминогликозидами.
Лечение С при инфекциях кожи, подкожно-жировой клетчатки, мягких тканей, слизистой оболочки носа, конъюнктивы, отите. Основными возбудителями заболевания в этих случаях являются стафилококки, гемолитические стрептококки группы А, кишечная палочка, клебсиелла. Стартовая антибактериальная терапия у таких детей представлена: ампициллином или амоксициллином/клавуланатом, или цецефазолином в сочетании с амикацином или гентамицином, или нетилмицином.
Лечение С с входными воротами в носоглотке и полости среднего уха начинают с назначения цефалоспоринов III поколения в качестве монотерапии или в сочетании с аминогликозидами. Альтернативными средствами для таких детей считают ванкомицин, защищенные пенициллины, имипенем, линкозамиды и метронидазол.
Антибактериальную терапию легочного Сначинают с ванкомицина в сочетании с гентамицином или амикацином, или нетилмицином. При ИВЛ-ассоциированном легочном С стартовая терапия включает применение пиперациллина по 50 мг/кг/сут в 3 введения или тикарциллин, или цефоперазон, или цефтазидим в сочетании с амикацином или гентамицином, или нетилмицином. Альтернативными препаратами являются карбопенемы в качестве монотерапии или в сочетании с аминогликозидами.
Стартовыми антибиотиками при кишечном и мочевом Сявляются карбенициллин по 200 мг/кг/сут или цефотаксим, или цефтриаксон в виде монотерапии или в сочетании с аминогликозидами.
При абдоминальном (хирургическом) Слечение начинают с цефазидима или цефаперазона в сочетании с аминогликозидами. Альтернативное лечение – защищенные пенициллины, уреидопенициллины, метронидазол в виде монотерапии или в сочетании с аминогликозидами.
Продолжительность антибактериальной терапии при С обусловлена в первую очередь положительной клинической динамикой: исчезновение проявлений гнойных очагов, купирование лихорадки, признаков SIRS, полиорганной недостаточности. Важным является исчезновение проявлений воспаления (анализ крови, показатели активности воспаления).
Учитывая то, что антибактериальная терапия при С носит курсовой и длительный характер, повышается риск развития дисбиозов кишечника и активизации грибковой флоры. Для профилактики дисбиозов применяют пробиотики (линекс, бифидумбактерин, бифиформ и др.). Для профилактики грибковой инфекции применяют флуконазол по 5-7,5 мг/кг/сут в 1 прием.
Патогенетическая терапия С включает: иммунокорригирующую терапию, дезинтоксикационную терапию, лечение септического шока, коррекцию водных и электролитных нарушений, лечение проявлений полиорганной недостаточности.
Иммунокорригирующая терапияпри С показана при развитии нейтропении. В этом случае используют введение взвеси лейкоцитов из расчета 20 мл/кг каждые 12 часов или гранулоцитарно-макрофагальных факторов роста (ГФР и ГМФР).
Эффективными для лечения С оказались препараты, содержащие IgG и IgM (иммуноглобулин для внутривенного введения, пентаглобин). Препараты интерферона (гриппферон, виферон), несмотря на достаточно низкую эффективность, продолжают рекомендоваться для лечения С.
Дезинтоксикационная терапия при С должна проводиться с учетом клиники, степени тяжести состояния, массы тела ребенка. В состав инфузионных сред часто включают свежезамороженную плазму, растворы альбумина, глюкозо-солевые растворы. При необходимости увеличения объема циркулирующей крови используют низкомолекулярные декстраны, солевые растворы.
Лечение септического шока включат адекватную оксигенотерапию, коррекцию гиповолемии, внутривенное назначение препаратов IgG и IgM, глюкокортикоиды в низких дозах. Для коррекции гемостаза используют свежезамороженную плазму в сочетании с гепарином.
Прогноз при С определяется массой тела ребенка, особенностями проявлений заболевания, его течением, этиологией, сопутствующими заболеваниями, адекватностью назначенного лечения. В структуре неонатальной смертности С нанимает 4-5 место.
ПНЕВМОНИИ НОВОРОЖДЕННЫХ (ПН) – острое инфекционное заболевание, вызванное микроорганизмами различной, преимущественно бактериальной этиологии, характеризующееся очаговым поражением респираторных отделов легких, наличием внутриальвеолярной экссудации, выявляемой при физикальном или инструментальном исследовании, и различной степени выраженности симптомами системного воспаления.
Эпидемиология. Заболеваемость ПН составляет около 1% среди доношенных и около 10% среди недоношенных новорожденных. У новорожденных, находящихся на ИВЛ, заболеваемость нозокомеальной пневмонией может достигать 40%.
Факторы риска
- инфекционные заболевания матери;
- угроза прерывания беременности;
- недоношенность;
-внутриутробная гипоксия плоды, асфиксия;
- нарушение процессов неонатальной адаптации;
-реанимационные мероприятия;
- нарушения выхаживания (переохлаждения, перегревания);
-манипуляции, облегчающие инфицирование (ИВЛ, катетеризация сосудов и др.).
Этиология и патогенез. Развитию ПН способствует большое количество неблагоприятных факторов, действующих на организм плода в анте-, интра- и постнатальном периодах. ПН может быть как первичным заболеванием, так и одним из очагов сепсиса или генерализованной вирусной инфекции.
Непосредственными этиологическими агентами ПН являются различные бактерии, вирусы, пневмоцисты, грибы и микоплазмы. До конца 80-х гг. XX века среди возбудителей пневмонии преобладали грамположительные микроорганизмы, в первую очередь золотистый стафилококк. В последнее десятилетие по данным Ставропольских родильных домов в структуре этиологии врожденных пневмоний у новорожденных возросла роль стафилококков, при ИВЛ-ассоциированных пневмониях по-прежнему высок удельный вес грамотрицательных бактерий – кишечной палочки, клебсиелл, синегнойной палочки и др. Отмечаются спорадические случаи хламидийной и микоплазменной ПН. В некоторых случаях ПН имеет смешанную этиологию.
Возбудитель может попадать в организм новорожденного трансплацентарно или при аспирации околоплодных вод, но наиболее частым является воздушно-капельный путь инфицирования. В патогенезе ПН большую роль играют несовершенство центральной регуляции дыхания, незрелость легочной ткани, наиболее выраженные у недоношенных детей, несовершенство иммунной системы.
При развитии ПН в организме формируется «порочный круг»: дыхательные нарушения вызывают нарушения гемостаза, что в свою очередь усугубляет нарушения внешнего дыхания. Обычно ПН характеризуется гипоксией, гиперкапнией, дыхательным или смешанным ацидозом.
По времени возникновения выделяют врожденные (проявившиеся в первые 72 часа после рождения) и постнатальные ПН. Врожденные ПН отмечаются примерно в 10-20% случаев инфекционных поражений легких у новорожденных детей. Вместе с тем относительная доля врожденных ПН у недоношенных детей существенно выше. Врожденные ПН, связаны, как правило, с аспирацией инфицированных околоплодных вод. В ряде случаев врожденные ПН являются компонентом внутриутробных генерализованных инфекций, таких как или цитомегалия, хламидиоз. Основным фактором, предрасполагающим к развитию ПН после рождения ребенка, в настоящее время является аппаратная ИВЛ («вентилятор-ассоциированные» ПН).
Классификация
- по времени возникновения: врожденная (внутриутробная, которая проявилась в первые 72 часа жизни) и постнатальная (ранняя и поздняя неонатальная);
- по этиологии: вирусная, бактериальная, паразитарная, грибковая, смешанная;
- по распространенности процесса: очаговая, сегментарная, долевая, односторонняя, двусторонняя.
-по течению: острая (до 6 недель), подострая ( 1,5-3 мес.), затяжная (более 3 месяцев).
-вентиляционная – развивается у пациентов на ИВЛ: ранняя – в первые 5 суток и поздняя – после 5 суток ИВЛ;
Исследования. Общий анализ крови и мочи, рентгенография органов грудной клетки в ранней стадии с интервалом 24-72 часа до момента стабилизации состояния, УЗИ головного мозга и внутренних органов; допплерометрическое исследование центральной и регионарной гемодинамики в случае проведения ИВЛ; определение показателей КОС, газового состава крови; этиологическая диагностика: бактериологическое исследование (трахеальный и бронхиальный аспират, мокрота, посев крови), определение титров антител к вирусам, микоплазмам, хламидиям, ПЦР.
Неинвазивный мониторинг: ЧСC, ЧДД, АД, температура тела.
Клиника. При врожденной ПН с первых часов жизни отмечаются признаки дыхательной и сердечно-сосудистой недостаточности. Отмечаются склонность к гипотермии, бледность и мраморность кожных покровов, нарушение моторной функции желудочно-кишечного тракта (нередко клиника динамической кишечной непроходимости), гепатолиенальный синдром. Аускультативно над легкими: в первые часы жизни дыхание ослаблено, в последующие часы выслушиваются мелкокалиберные влажные хрипы, локализация и распространенность которых зависит от зрелости легких и характера ПН. При постнатальной ПН в начале заболевания выявляются общие нарушения состояния ребенка (бледность, отказ от груди или снижение толерантности к энтеральному питанию, склонность к гипертермии, дыхательная недостаточность).Через 1-3 суток выявляются физикальные изменения легких, аналогичные тем, которые характерны для врожденной ПН. У доношенных новорожденных заболевание, как правило, развивается более остро, чем у недоношенных детей.
Ранними симптомами ПН являются одышка (изменение частоты, глубины и ритма дыхания), раздувание крыльев носа. Снижение глубины дыхания приводит к уменьшению альвеолярной вентиляции, что ведет к респираторной кислородной недостаточности, накоплению недоокисленных продуктов и развитию ацидоза.Нарушение гомеостаза и кислотно-основного состояния при ПН у недоношенных детей значительно утяжеляет течение основного заболевания. Чаще всего встречается мелкоочаговая ПН, значительно реже – интерстициальная.
Различают несколько периодов развития ПН: начальный, ранний (или предвоспалительный) разгара, стабилизация признаков, обратное развитие процесса (разрешение пневмонии).
ИВЛ - ассоциированные постнатальные пневмонии
ИВЛ-ассоциированные пневмонии у новорожденных детей представляют собой особую сложность для лечения.
Если ИВЛ начата сразу же после госпитализации новорожденного, этиология развившейся пневмонии на протяжении первых 72 часов скорее всего будет представлена аутофлорой больного. Начиная с 4-х суток ИВЛ происходит смена возбудителей пневмонии на граммотрицательных микроорганизмов (псевдомонады, серрации, клебсиеллы и др.). В тех случаях, когда ИВЛ начата через 3-5 дней пребывания ребенка в стационаре риск развития пневмонии возрастает при наличии в аспирате псевдоманад в 12,5 раза, ацинетобактера – в 13,4 раза, неферментирующей грамотрицательной флоры – в 9,3 раза (И.Г. Хамин, 2205). Особое место в развитии поздних ИВЛ-ассоциированных пневмоний занимает синегнойная палочка.
Клинические проявления ИВЛ-ассоциированной пневмонии у новорожденных детей определяются характеров возбудителя, наличием недоношенности и ее степени, характером и особенностями сопутствующих заболеваний.
Диагноз врожденной пневмонии. Используются две группы диагностических критериев: основные и вспомогательные.
Основные:
- очаговые и/или инфильтративные тени на рентгенограмме;
- высев из родовых путей матери и дыхательных путей или крови ребенка идентичной флоры;
- наличие ПН по данным патологоанатомического исследования, в случае смерти ребенка до конца трех суток жизни.
Вспомогательные:
- лейкоцитоз выше 25·109/л, палочкоядерные > 11% (при взятии анализа крови в первые сутки жизни);
- отрицательная динамика в анализе крови на вторые сутки жизни;
- положительный прокальцитониновый тест в первые 48 часов жизни или повышение уровня С-реактивного белка в сыворотке крови в первые 72 часа жизни;
- наличие гнойной мокроты при первой интубации ребенка в 1-3-и сутки жизни (должно быть подтверждено результатом микроскопии мазка);
- усиление бронхо-сосудистого рисунка и/или локальное понижение прозрачности на рентгенограмме;
- жидкость в плевральных полостях с 1-х суток жизни (при отсутствии ГБН);
- гепатомегалия > 2,5 см или пальпируемая селёзенка (при отсутствии ГБН);
- тромбоцитопения < 170 х109/л;
- наличие других гнойно-воспалительных заболеваний в первые трое суток жизни;
- содержание IgM в пуповинной крови > 21 мг%;
- воспалительные изменения в плаценте, обнаруженные при гистологии.
Определенное диагностическое значение имеют указания на инфекционное заболевания в анамнезе матери, осложненная беременность, преждевременное излитие околоплодных вод (>12 часов).
При аспирации мекония появление в течение 72 часов жизни очаговых или инфильтративных теней на рентгенограмме говорит об аспирационной ПН.
Скрининг на ВУИ.
Дифференциальный диагноз ПН необходимо проводить с респираторным дистресс-синдромом новорожденных, синдромом аспирации мекония, синдромом «утечки воздуха», аномалиями бронхолегочной системы, врожденными пороками сердца, нарушениями КОС.
Табл. 2.33. Дифференциальный диагноз пневмоний новорожденных с респираторным дистресс-синдромом
|
Признак |
Пневмония новорожденных |
Респираторный дистресс-синдром |
|
Рентгенологические данные |
Очаговые и/или инфильтративные тени на рентгенограмме |
Воздушные бронхограммы, снижение пневматизации, нечеткие границы легких |
|
Результаты бактериологического обследования |
Выделение возбудителя |
Отрицательные |
|
Гнойная мокрота при первой интубации |
Характерна |
Не характерна |
|
Тромбоцитопения |
Характерна |
Не характерна |
|
Воспалительные изменения в крови |
Характерно (с первых суток жизни) |
Не характерно (в первые сутки жизни) |
|
Повышение уровня IgM в пуповинной крови |
Характерно |
Не характерно |
|
Воспалительные изменения в плаценте |
Возможны |
Не характерны |
Лечение, задачи лечения: эрадикация возбудителя. Купирование основных патологических проявлений заболевания.
Схема лечения: обязательное лечение: терапия дыхательных расстройств, целенаправленная антибактериальная и иммунозаместительная терапия, режим, диета.
Вспомогательное лечение: поддерживающая и посиндромная терапия.
Показания для госпитализации: все новорожденные с ПН или подозрением на нее должны быть госпитализированы.
Режим. Недоношенные и новорожденные в тяжелом состоянии нуждаются в температурной поддержке (кувез, ОРС).
Диета. Характер питания (энтеральное, частично парентеральное, полное парентеральное, минимальное трофическое, зондовое) определяется степенью недоношенности, тяжестью состояния, зрелостью, способностью удерживать энтеральное питание, наличием патологических состояний, требующих изменения питания (парез кишечника, некротический язвенный колит и др.).
Оксигенотерапия – ингаляция увлажненной, подогретой (до 34 0С) воздушно-кислородной смеси (40-50%) под контролем сатурации O2 в крови. При прогрессировании ДН показан перевод ребенка на ИВЛ.
Антибактериальная терапия – основа лечения ПН. До получения результатов микробиологического исследования крови и эндотрахеального аспирата эмпирическая антибактериальная терапия в первые 3 суток проводится комбинацией беталактамов и аминогликозидов III поколения.
Табл. 2.34 Антибиотики при пневмонии новорожденных (Клинические рекомендации по пневмонии, 2009)
|
Форма пневмонии |
Этиология |
Препараты выбора |
Альтернативные препараты |
|
Врожденная. Ранняя (0-3 день) ассоциированная с ИВЛ) |
Стрептококк группы В, реже энтерококки, K. pneumoniae, листерии, стафилококк |
Ампициллин или амоксициллин/клавуланат + аминогликозид |
Цнфотаксим или ванкомицин + аминогликозид, меропенем |
|
Бледная спирохета |
Пенициллин |
| |
|
Поздняя (>4 дней), ассоциированная с ИВЛ) |
Pseudomonas, Serratia, K. pneumoniae, грибы Candida, стафилококки |
Цефтозидим, цефеперазон + аминогликозид |
Карбопенем, ванкомицин, флуканазол |
При ПН, вызванной метициллин-резистентным штаммом грамположительных кокков назначают ванкомицин. В качестве альтернативы используют линезолид. Все антибиотики лучше вводить внутривенно.
При хламидиозе и микоплазмозе назначают внутривенное введение эритромицина.
По жизненным показаниям используют сочетания: имипенем + циластатин или меропенем + ванкомицин.
Продолжительность антибактериальной терапии определяется динамикой клинических проявлений, ликвидацией рентгенологических признаков ПН и восстановлением гематологических нарушений. При неосложненных ПН продолжительность антибактериальной терапии составляет 2 недели, а при осложненных ее вариантах – до 3-4-х недель и более. Длительная и массивная антибактериальная терапия должна сочетаться с применение пробиотиков и противогрибковых препаратов (дифлюкан).
Иммунокорригирующая терапия: иммуноглобулин, специфические (антистафилококковый), иммуноглобулины. При грамотрицательных возбудителях ПН показано введение пентаглобина. Некоторые авторы рекомендуют применение виферона-1.
Коррекция КОС при ПН без лабораторного определения показателей КОС может проводиться только при наличии тяжелой гипоксии, терминального состояния, длительного приступа апноэ, остановки сердца. В этих случаях внутривенно водят 2% раствор гидрокарбоната натрия из расчета 4% 4 мл/кг. До введения соды необходимо обеспечить адекватное дыхание (ИВЛ).
Инфузионная терапия при ПН представляет собой сложную проблему. Объем внутривенно вводимой жидкости рассчитывается на основе суточной потребности организма в жидкости, которую определяют по специальным таблицам или номограмме Абердина. Из рассчитанного объема вычитают питание и выпитую часть жидкости. Для новорожденных детей особую опасность представляют: быстрое внутривенное введение больших объемов жидкости, что приводит к появлению отеков, недостаточности кровообращения, электролитным расстройствам. Рассчитанный суточный объем должен вводиться на протяжении 24 часов, скорость инфузии, а следовательно и суточный объем, могут изменяться с учетом переносимости капельного введения.
Профилактика ПН заключается в своевременном выявлении и лечении инфекционных заболеваний у матери во время беременности.
Успех в предотвращении нозокомеальной ПН зависит от строгого соблюдения санитарно-эпидемиологического режима, использования одноразового расходного материала, оптимизации работы среднего медперсонала и сокращения случаев необоснованного эмпирического назначения антибиотиков.
Прогноз. Летальность при ПН составляет 5-10%. Прогноз у доношенных детей, перенесших бактериальную ПН, благоприятный. У глубоконедоношенных детей – риск развития бронхолегочной дисплазии. Развитие госпитальной инфекции в условиях отделения интенсивной терапии ухудшает исход и прогноз основного заболевания.
Вопросы
к экзамену. Пневмонии
новорожденных. Этиология. Патогенез.
Классификация. Клиническая картина.
Особенности врожденной и постнатальной
пневмоний. ИВЛ - ассоциированные
постнатальные пневмонии. Диагностика.
Дифференциальный диагноз. Лечение.
Профилактика.
ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ (ВУИ) - группа инфекционно-воспалительных заболеваний плода и новорождённого, вызванных различными возбудителями, при которых инфицирование плода произошло в анте- или интранатальный период.
Термин «внутриутробная инфекция» при использовании в клинической практике в качестве диагноза должен быть конкретизирован не только по этиологии, но и по периоду инфицирования, особенностям поражения тех или иных внутренних органов.
Для обозначения ВУИ также может быть использован термин «TORCH-синдром», этим термином обозначают врожденные инфекционные заболевания, этиология которых остается нерасшифрованной. Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых ВУИ: Т - токсоплазмоз (Toxoplasmosis), R - краснуха (Rubella), С - цитомегалия (Cytomegalia), H - герпес (Herpes) и О - другие инфекции (Other). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекцию, микоплазмоз и др.
Эпидемиология. Истинная частота ВУИ до настоящего времени не установлена, однако по данным ряда авторов ее распространённость среди новорожденных и детей первых месяцев жизни может достигать 10-15%.
Этиология и патогенез. ВУИ возникают в результате внутриутробного (антенатального или интранатального) инфицирования плода. В подавляющем большинстве случаев источником инфекции для плода является мать. Использование инвазивных методов пренатальной диагностики и лечения (амниоцентез, пунктирование сосудов пуповины и др.) и внутриматочного введения препаратов крови через сосуды пуповины (переливание эритроцитарной массы плоду при гемолитической болезни) при несоблюдении правил асептики, а также пролонгирование беременности при преждевременном разрыве околоплодных оболочек предрасполагают к ятрогенному внутриутробному инфицированию плода. Антенатальное инфицирование в большей степени характерно для вирусов (ЦМВ, краснухи, Коксаки и др.), токсоплазмы и микоплазмы, при этом вертикальная передача инфекции может быть осуществлена трансовариальным, трансплацентарным и восходящими путями. Интранатальная контаминация более характерна для бактерий, грибов и во многом зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, энтеробактерии, эшерихии коли, а также вирусы простого герпеса, ВИЧ, микоплазмы, уреаплазмы, хламидии и др.
Риск инфицирования значительно возрастает при наличии воспалительных заболеваний урогенитального тракта у матери, неблагоприятном течение беременности (тяжелые гестозы, угроза прерывания, патологическое состояние маточно-плацентарного барьера, инфекционные заболевания), недоношенности, ЗВУР, перинатальном поражении ЦНС, патологическом течении интранатального или раннего неонатального периода.
Инфекция называется первичной, если организм матери инфицируется данным возбудителем впервые во время беременности, т.е. специфические AT (IgM, IgG) обнаруживаются у ранее серонегативной женщины. Вторичная инфекция развивается в результате активизации возбудителя, находившегося до этого в организме матери в латентном состоянии (реактивация), или из-за повторного инфицирования (реинфекция). Наиболее часто инфицирование плода и развитие тяжёлых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
Проникновение возбудителя в организм плода в период эмбриогенеза, чаще приводит к самопроизвольным выкидышам и развитию тяжёлых пороков развития несовместимым с жизнью.
Инфицирование плода в ранний фетальный период приводит к развитию инфекционно-воспалительного процесса, который характеризует преобладание альтеративного компонента воспаления и формирование в повреждённых органах фиброзно-склеротических деформаций, а также нередкое возникновение первичной плацентарной недостаточности, сопровождающейся хронической внутриутробной гипоксией плода и развитием симметричной ЗВУР. Инфекционный процесс, развивающийся в поздний фетальный период, сопровождается как воспалительным повреждением отдельных органов и систем (гепатит, кардит, менингит или менингоэнцефалит, хориоретинит, поражение кроветворных органов с развитием тромбоцитопении, анемии и др.), так и генерализованным поражением органов.


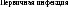
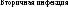










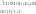






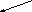






Рис. 2.4. Схема взаимоотношений инфекции и последствий инфицирования плода (на примере ЦМВИ)
Клиника. При антенатальном инфицировании плода беременность, как правило, заканчивается преждевременными родами, а клинические симптомы инфекционного заболевания проявляются уже при рождении (врожденная инфекция). При интранатальном заражении плода манифестация внутриутробной инфекции может произойти не только в первые недели жизни (в большинстве случаев), но даже и в постнеонатальный период.Крайне важно проводить дифференциальную диагностику между внутриутробной инфекцией, которая развилась в результате интранатального инфицирования, и нозокомиальной инфекцией.
TORCH-инфекции различной этиологии в подавляющем большинстве случаев имеют сходные клинические проявления: ЗВУР, гепатоспленомегалия, желтуха, экзантема, дыхательные расстройства, сердечно-сосудистая недостаточность, тяжёлые неврологические нарушения, тромбоцитопения, анемия и гипербилирубинемия с первых дней жизни.
Диагноз. Достоверность этиологической диагностики TORCH-инфекций только по клиническим данным не превышает 10% (Базаламах А.Г., Серебур Ф.Е., 1988). При наличии клинико-анамнестических данных, указывающих на вероятность ВУИ у новорождённого, верификацию заболевания необходимо проводить с использованием «прямых» и «непрямых» методов исследования. К «прямым» методам диагностики относят вирусологический, бактериологический и молекулярно-биологический методы (ПЦР, ДНК-гибридизация) и иммунофлюоресценцию. Из «непрямых» методов диагностики наиболее широко используют ИФА.
В последнее время для выявления возбудителя в биологическом материале всё чаще используют метод ПЦР. Материалом для исследования может служить любая биологическая среда организма (пуповинная кровь, слюна, моча, смывы трахеи, ротоглотки, мазки конъюнктивы, из уретры и т.д.). Подтверждением активного периода ВУИ служит выявление специфических IgM и низкоавидных специфических AT IgG с нарастанием их титров в динамике. При этом обязательно сопоставление полученных данных с результатами параллельного серологического обследования матери. Следует помнить, что выявление специфических IgM или повышение титра низкоавидных AT в пуповинной крови свидетельствует о внутриутробном контакте плода с соответствующим микроорганизмом, но не доказывает того, что данный микроорганизм - причина инфекционного заболевания.
Для уточнения фазы и остроты инфекционного процесса показано проведение серологического исследования методом ИФА с количественным определением специфических AT классов IgM, IgG и оценкой уровня их авидности. Авидность - понятие, характеризующее скорость и прочность связывания Аг с AT, косвенный признак функциональной активности AT. В остром периоде развития инфекции сначала происходит образование специфических Ат к IgM, а затем - специфических низкоавидных AT к IgG. Таким образом, эти антитела можно считать маркёром активного периода заболевания. По мере стихания остроты процесса авидность AT к IgG нарастает, возникают высокоавидные иммуноглобулины, которые практически полностью заменяют синтез IgM.
Таким образом, роль серологических маркёров острой фазы инфекционного процесса играют IgM и низкоавидные IgG. Если титры специфических AT к IgG у ребёнка при рождении равны материнским, а при повторном обследовании отмечают их снижение, то высока вероятность, что они имеют материнское происхождение.
Табл. 2.35. Интерпретация результатов лабораторного обследования матери и ребенка при подозрении на ВУИ (А.А. Кишкун, 2007)
|
Результат исследования |
Оценка и рекомендации |
|
Выявление АТ у матери и ребенка к одному и тому же возбудителю |
Наличие АТ IgM указывает на врожденную инфекцию. Если повышен титр АТ IgG, необходимо провести исследование АТ в динамике через 1-2 месяца. При необходимости следует использовать методы прямого обнаружения возбудителя (ПЦР, обнаружение АГ методом РИФ или ИФА) |
|
Обнаружение АТ у матери и их отсутствие у новорожденного при наличии у него клинической картины заболевания, а также при обследовании ребенка, родившегося от инфицированной матери |
Использовать методы прямого обнаружения возбудителя (ПЦР, обнаружение АГ методом РИФ или ИФА) у ребенка или исследовать титр АТ в динамике в течение первого года жизни, так как инфицирование исключить нельзя (может быть иммунологическая толерантность, когда не происходит синтез АТ) |
|
Обнаружение высоких титров АТ IgG у ребенка вскоре после рождения |
Повышенное содержание АТ IgG свидетельствует скорее о пассивном иммунитете, полученном от матери, чем о врожденной инфекции. Для уточнения ситуации необходимо исследовать титр АТ IgM или следить за динамикой АТ IgG (если ребенок не инфицирован, их титр к возрасту 4-6 месяцев резко снижается). |
|
Обнаружение у ребенка АТ и/или возбудителей (AГ) при отсутствии АТ у матери |
Внутриутробное инфицирование или инфицирование во время родов; возможно заражение ребенка через молоко матери или при переливании крови ее компонентов, в отдельных случаях не исключается инфицирование медперсоналом. Ситуация возможна у женщин, лечившихся по поводу инфекции, в случае наступления беременности на фоне лечения или в первые месяцы после лечения |
|
Титр специфических АТ IgG в сыворотке крови ребенка превышает титр аналогичных АТ у матери (при отсутствии IgM и IgA) |
Результаты исследования не могут свидетельствовать об инфицировании ребенка. Необходимо исследовать титр АТ в динамике и использовать методы прямого обнаружения возбудителя (ПЦР, обнаружение АГ методом РИФ или ИФА) |
|
Наличие АТ IgM и/или IgA (для хламидиоза) |
Свидетельствует об инфицировании ребенка (АТ IgM через плаценту не проникают) |
|
Появление АТ IgM и/или IgA (для хламидиоза) наряду с АТ IgG или только IgG у ранее серонегативного ребенка (сероконверсия) |
Свидетельствует о первичной инфекции |
Лечение. При ВУИ используют следующие виды терапии (табл. 2.35).
Табл. 2.36. Лечение при внутриутробных инфекциях
(Баранов А.А., 2007)
|
Виды терапии |
Примечание |
|
Иммунотерапия: - Ig поливалентные |
Иммуноглобулин человеческий нормальный («Интраглобин», «Сандоглобулин», «Октагам»), иммуноглобулин человеческий нормальный (IgG + IgA +IgM) –«Пентаглобин» |
|
- Ig специфические |
Иммуноглобулин против цитомегаловируса («Цитотект») |
|
Иммуномодуляторы (интерфероны) |
Неспецифичны |
|
Противовирусная терапия (препаратами направленного действия) |
Ацикловир, Ганцикловир |
|
Антибактериальная терапия: -антибиотики широкого спектра действия -макролиды (при хламидийной и микоплазменной инфекции |
Цефалоспорины III поколения, аминогликозиды, карбопенемы Азитромицин, рокситромицин, мидекамицин, кларитромицин, спирамицин, эритромицин в/в |
Дифференциальный диагноз ВУИ проводят между собой, с неинфекционными эмбрио- и фетопатиями, гипоксически-ишемической энцефалопатией, наследственной патологией, желтухами различного происхождения, синдромом дыхательных расстройств, внутричерепными родовыми травмами, постнатальными инфекциями, сепсисом.
Вопросы
к экзамену. Врожденные
инфекции. Понятие об инфекционных
эмбрио- и фетопатиях. Понятие о врожденной
инфекции (TORCH-синдром), анте- и интранатальном
инфицировании.
Цитомегаловирусная инфекция (ЦМВИ) является одной из вариантов ВУИ и встречается у 0,2% новорожденных детей (предполагаемая частота 2 : 1000). В разных странах удельный вес серопозитивного населения к ЦМВ составляет от 20 до 95%.
Этиология. Возбудитель – цитомегаловирус, относится в β-герпесвирусам.
Патогенез. Внутриутробная ЦМВИ развивается в результате пренатального (трансплацентарный путь) или интранатального (за счет аспирации или заглатывания инфицированных околоплодных вод и/или инфицированных секретов родовых путей матери) инфицирования плода.
Источником внутриутробного инфицирования практически всегда является мать, за исключением тех редких случаев, когда имеет место трансфузионная передача ЦМВ при внутриутробном введении плоду препаратов крови, инфицированных вирусом цитомегалии.
Примерно в 50% случаев инфицирование плода происходит от матери с первичной ЦМВИ, причем в 10% случаев речь идет о рецидиве или обострении инфекции у матери во время беременности. У 5-18% инфицированных детей отмечается манифестная форма ЦМВИ, которая характеризующаяся тяжелым течением и нередко летальным исходом. При развитии вторичной ЦМВИ во время беременности факторы специфического иммунитета матери (анти-ЦМВ-АТ и анти-ЦМВ-Т-(СВ8)-лимфоциты) обеспечивают действенную защиту плода от инфицирования и развития тяжелой ЦМВИ. В результате врожденная ЦМВИ протекает преимущественно бессимптомно.
Во время беременности происходит физиологическая перестройка иммунитета - снижение функций клеточного звена и постепенное нарастание активности гуморального, что способствует более интенсивной репликации вируса цитомегалии при первичной или при реактивации вторичной ЦМВИ. Активная репликация ЦМВ сопровождается виремией, приводящей к нарушению плацентарного барьера и трансплацентарной передаче инфекции.
В организме плода вирус активно реплицируется и распространяется, т.к. не встречает должного иммунного сопротивления из-за отсутствия трансплацентарных материнских анти-ЦМВ-АТ (т.к. на ранних этапах заболевания мать продолжает оставаться серонегативной) и незрелости иммунитета плода. Степень поражения плода при этом зависит от интенсивности размножения вируса и от периода гестации, в который происходит развитие инфекции. При этом возможны как минимальные проявления заболевания (бессимптомные, субклинические формы), так и тяжелые поражения - эмбрио- и фетопатии, генерализованные воспалительные изменения.
Репликация ЦМВ при вторичной инфекции происходит в условиях «иммунологического пресса», так как в организме серопозитивной беременной в момент заражения новым штаммом ЦМВ имеются видо- и типоспецифические анти-ЦМВ-АТ, что значительно снижает интенсивность вирусной репликации и степень виремии. Это и определяет значительно меньший риск передачи инфекции плоду при вторичной инфекции.
В тех редких случаях, когда вторичная ЦМВИ у беременных все же сопровождается внутриутробным инфицированием, заболевание у плода и новорожденного протекает легко, без клинической манифестации. Это связано с тем, что инфицированый плод одновременно с ЦМВ получает от серопозитивной матери и анти-ЦМВ-АТ, которые препятствуют активной репликации вируса и ограничивают его распространение. Все это сдерживает интенсивность инфекционного процесса и переводит ЦМВ в латентное или латентно-персистирующее состояние.
Классификация:
латентная; 2. манифестная.
По тяжести: легкая форма, среднетяжелая форма, тяжелая форма.
По течению: острое (до 3 мес.); затяжное (до 2 лет); хроническое (более 2 лет).
По характеру течения: а) гладкое; б) негладкое:
- с осложнениями; с обострениями; с наслоением вторичной инфекции; с обострение хронических заболеваний.
Исследования. Вирусологическое исследование (моча); ПЦР (обнаружение ДНК возбудителей); энзимный иммуносорбентный анализ (обнаружение ДНК возбудителей); выявление специфических антител IgM, IgG (у матери и ребенка) в динамике (иммуносорбентная энзимная методика. Определение авидности выявляемых антител. Исследования, направленные на выявление поражения отдельных органов и степени нарушений функций органов.
Клиника. В зависимости от сроков гестации, на которых произошло инфицирование вирусом цитомегалии, различают инфекционные бластопатии, эмбриопатии и фетопатии.
В большинстве случаев инфекция протекает бессимптомно. Поздние проявления ЦМВИ (сенсорная глухота, трудности в обучении, минимальные мозговые дисфункции) развиваются в 10-15% случаев клинически не выраженной инфекции.
Рождение ребенка с клиническими проявлениями ЦМВИ указывает на пренатальный характер инфицирования и практически всегда свидетельствует о перенесенной матерью во время беременности первичной ЦМВ-инфекции.
Для синдрома врожденной ЦМВИ типична низкая масса тела при рождении, геморрагическая сыпь, тромбоцитопения, анемия, желтуха, гепатоспленомегалия и хориоретинит. Наиболее типичным симптомокомплексом считают сочетание низкой массы тела при рождении с гепатоспленомегалией и персистирующей желтухой.
Интранатальное или постнатальное заражение обычно приводит к латентной инфекции, которая клинически манифестирует на фоне снижения иммунитета. Инкубационный период составляет 3 недели и более. По истечении данного срока у новорожденного возможно возникновение гепатоспленомегалии, лимфаденопатии, пневмонии, затяжной желтухи, анемии и других гематологических состояний.
Диагноз ЦМВИ основывается на клинико-анамнестических данных, результатах вирусологического исследования (выделение ЦМВ), ПЦР (обнаружение ДНК вируса), ИФА (определение специфических IgM к ЦМВ). См. также табл. 2.34.
Основными клиническими признаками ЦМВИ являются: интоксикация, сиалоаденит, полиморфизм клинической симптоматики.
В связи с возможностью генерализованного течения заболевания обследования таких детей сопряжено со значительными сложностями т.к. приходится проводит многочисленные клинические, биохимические и инструментальные исследования для уточнения характера поражения отдельных органов и их функционального состояния.
Дифференциальный диагноз ЦМВИ проводят с другими ВУИ, а также с РДСН, сепсисом, внутричерепными родовыми травмами, постасфиксическими состояниями.
Табл. 2.37. Дифференциальный диагноз ЦМВИ и РДСН
|
Признак |
ЦМВИ |
РДСН |
|
Факторы риска |
Характерные для ВУИ |
Характерные для РДСН |
|
Сиалоаденит |
Характерен |
Не характерен |
|
Повышение активности трансаминаз |
Часто |
Не характерно |
|
Тромбоцитопения |
Характерна |
Нет |
|
Повышение уровня прямого билирубина |
Часто |
Повышение непрямого билирубина |
|
Повышение уровня белка в ликворе |
Часто |
Не характерно |
|
Поражение зрения, слуха |
Часто |
Не характерно |
|
Воспалительные изменения в органах |
Характерно |
Не характерно |
|
Врожденные пороки |
Часто |
Не характерно |
|
Рентгенография органов грудной клетки |
Признаки интерстициальной пневмонии |
Воздушная бронхограмма, снижение пневматизации легких |
Лечение
Препаратом выбора для лечения ЦМВИ является НеоЦитотект - специфический гипериммунный антицитомегаловирусный иммуноглобулин для внутривенного введения. Действие препарата основано на нейтрализации вируса цитомегалии специфическими анти-ЦМВ-АТ класса IgG, содержащимися в препарате. Новорожденным НеоЦитотект назначается в дозе 1 мл/кг (100 МЕ/кг) и вводится внутривенно со скоростью не более 5-7 мл/час с интервалом 48 ч. В некоторых случаях назначается Ганцикловир, который считают «терапией отчаяния».
Для лечения больных с генерализованными формами ЦМВИ используют преднизолон по 2-5 мг/кг/сут. При наслоении вторичной инфекции используют антибиотики. Некоторые авторы рекомендуют использование циклоферона.
Поддержание жизненно важных функций организма ребенка при генерализованной форме ЦМВИ проводится в соответствии с общими принципами интенсивной терапии.
Профилактика. Дети с врожденной ЦМВИ могут являться источником инфекции, поэтому не рекомендуется допускать к уходу за ним беременных женщин.
В случае развития ЦМВИ у серопозитивной лактирующей женщины, грудное кормление ребенка не должно прекращаться. Это обусловлено тем, что возможное инфицирование ребенка ЦМВ происходит на фоне анти-ЦМВ-АТ, трансплацентарно переданных ему от серопозитивной матери. Кроме этого, при грудном вскармливании ребенок получает с молоком анти-ЦМВ-АТ. Таким образом, пассивная специфическая анти-ЦМВ иммунизация новорожденного (анти-ЦМВ-АТ переданные матерью трансплацентарно и с грудным молоком) препятствует активной репликации вируса и способствует развитию бессимптомной формы заболевания, не сопровождающейся осложнениями.
Не допускается кормление серонегативного новорожденного донорским молоком от серопозитивной женщины.
Вопросы
к экзамену.
Врожденная цитомегаловирусная инфекция.
Эпидемиология. Патогенез. Классификация.
Клиническая картина. Диагностика (ИФА,
ПЦР). Дифференциальный диагноз. Лечение.
Герпетическая инфекция (ГИ) - это группа инфекционных заболеваний, вызываемых вирусами семейства Herpesvirida.
Эпидемиология. Частота неонатальной ГИ по разным данным составляет от 1:2500 до 1: 60000 живорожденных детей. Предполагаемая заболеваемость в России – 1 случай на 2000–3000 живорождённых.
Этиология. В развитии неонатального герпеса играют роль два серотипа вируса простого герпеса (ВПГ). У новорожденных тяжелое генерализованное заболевание с высоким уровнем летальности чаще вызывает вирус простого герпеса 2-го типа, изолированные герпетические энцефалиты чаще обусловлены вирусом простого герпеса I типа.
Патогенез. Риск герпетической инфекции у ребёнка при родах через естественные родовые пути матери с первичной генитальной инфекцией составляет 33–50%. Риск для ребёнка, рождённого матерью, выделяющей вирус простого герпеса в результате реактивированной инфекции, значительно ниже – до 5%. В связи с этим основное значение имеет возникновение или обострение генитального герпеса у матери на последнем месяце беременности. Не исключена возможность постнатального инфицирования при наличии у людей, ухаживающих за ребенком, герпетических проявлений на коже и слизистых оболочках.
Вирусы простого герпеса, являясь внутриклеточными паразитами, начинают размножаться после попадания внутрь клетки-мишени. Через 18 часов вновь образовавшиеся вирионы покидают клетку. Вирион является инфекционной формой ВПГ, обнаруживаемой внеклеточно. В инфицированных клетках вирус образует внутриядерные включения, вызывает слияние клеток, оказывает выраженное цитопатическое действие, проявляющееся в округлении и образовании многоядерных клеток. Вирусы простого герпеса могут трансформироваться в безоболочечные частицы и в таком виде длительное время (иногда пожизненно) персистировать в нервных клетках.
В случае инфицирования ГИ при нормально функционирующей иммунной системе формируется длительный иммунитет к конкретному типу вируса. У новорожденных детей иммунный ответ на ВПГ может быть замедлен или нарушен.
Несмотря на то, что антитела к ВПГ с высокой частотой выявляются у новорожденных детей, в большинстве случаев они являются отражением наличия инфекции у матери, а не у новорожденного ребенка. В то же время у новорожденных с генерализованной ГИ инфекцией специфические антитела в первую неделю заболевания часто отсутствуют.
Классификация.
1. Врожденный герпес (антенатальное инфицирование);
2. Диссеминированный неонатальный герпес (интранатальное инфицирование);
3. Церебральный герпес;
4. Кожно-слизистая форма.
Исследования. Вирусологическое исследование (смыв носоглотки, содержимого везикул, кров, спинномозговая жидкость); ПЦР (обнаружение ДНК возбудителей); энзимный иммуносорбентный анализ (обнаружение ДНК возбудителей); выявление специфических антител IgM, IgG (у матери и ребенка) в динамике (иммуносорбентная энзимная методика. Определение авидности выявляемых антител. Исследования, направленные на выявление поражения отдельных органов и степени нарушений функций органов.
Клиника. Бессимптомное течение ГИ встречается редко. Выделяют 3 клинические формы неонатальной ГИ:
1). Локализованная форма с поражением кожи и слизистых рта или глаз, которая характеризуется наличием единичных или множественных везикулярных элементов на различных участках тела при отсутствии признаков системной воспалительной реакции. Это сгруппированные полусферической формы пузырьки размером 1,5-2 мм на фоне эритемы и отека. При их разрыве образуются эрозии с гладким дном. На месте эрозий остается постепенно исчезающая эритема с буроватым оттенком и нестойкая пигментация. Чаще всего высыпания появляются на 5-14 дни жизни (при антенатальном инфицировании эти элементы могут быть выявлены при рождении). Процесс заживления в среднем длится 10-14 дней.
Герпетические поражения глаз проявляются в виде кератоконъюнктивита, увеита, хориоретинита. Осложнениями ГИ глаза является язва роговицы, атрофия зрительного нерва, слепота.
При отсутствии специфического лечения у 50-70% новорожденных локализованная кожная форма ГИ может привести к генерализации процесса или поражению ЦНС.
2). Генерализованная форма ГИ манифестирует признаками, характерными для сепсиса: прогрессирующее ухудшение клинического состояния ребенка (вялое сосание, срыгивания, повышение или снижение температуры тела, апноэ), нарушение микроциркуляции, вовлечение в патологический процесс печени и надпочечников, увеличение селезенки, гипогликемия, гипербилирубинемия, ДВС-синдром. У 50-65% больных отмечаются симптомы герпетического менингоэнцефалита. Начало болезни обычно проявляется на 5-10 день жизни, однако возможна манифестация ГИ сразу после рождения. Специфические высыпания на коже и слизистых появляются на 2-8 дни от начала заболевания, однако у 20% новорожденных с генерализованной формой ГИ кожные элементы не выявляются.
3). Изолированное поражение ЦНС (герпетический менингоэнцефалит) протекает с лихорадкой, вялостью вплоть до развития комы, плохим аппетитом, гипогликемией, ДВС-синдромом или синдромом повышенной нервно-рефлекторной возбудимости, за которым следуют с трудом купируемые фокальные или генерализованные судороги. Ликвор в начале может быть нормальным, затем обнаруживается увеличение уровня белка и цитоз (лимфоцитарный или смешанный). У 40-60% больных отсутствуют специфические герпетические высыпания на коже и слизистых.
Диагноз ГИ основывается на:
а) клинико-анамнестических данных (характерный эпиданамнез, наличие интоксикации, лихорадка, типичные везикулезные высыпания на коже и слизистых оболочках);
б) результатах соскоба стенки везикул для обнаружения Аг ВПГ (исследуют с помощью микроскопии или прямым иммунофлюоресцентным методом);
в) результатах исследования крови, спинномозговой жидкости, содержимого везикул, а также мазков из зева и глаз методом ПЦР или ИФА;
г) обследовании матери на наличие вагинальных, цервикальных или других герпетических повреждений;
д) для установления степени тяжести ГИ необходимо провести дополнительные методы исследования, включающие: ОАК, ОАМ, биохимическое исследование крови и мочи, НСГ, КТ.
Дифференциальный диагноз врожденной ГИ в первую очередь проводят с сепсисом.
Табл. 2.38. Дифференциальный диагноз герпетический инфекции и ЦМВИ
|
Признак |
Герпетическая инфекция |
ЦМВИ |
|
Везикулярные высыпания на коже |
Характерны |
Нет |
|
Рецидивирующие кожные высыпания |
Возможны |
Не характерно |
|
Врожденные пороки |
Часто |
Редко |
|
Тромбоцитопения |
Да |
Да |
|
Геморрагический синдром |
Характерен |
Характерен |
|
Воспалительные поражения внутренних органов |
Характерно |
Характерно |
|
Поздние осложнение |
Поражение слуха, зрения, задержка психомоторного развития | |
|
Сиалоаденит |
Характерен |
Не характерен |
|
Этиологическая диагностика |
Выделение вирусов герпесе |
Выделение ЦМВ |
|
Серологическая диагностика |
Антитела к вируса герпеса IgM |
Антитела к ЦМВ IgM |
Лечение. Учитывая тяжелые последствия ГИ, при подозрении на неонатальный герпес, а также при высоком риске его развития (рождение через естественные родовые пути матери с генитальным герпесом, выявленным во время родов или за несколько недель до них) показана специфическая противовирусная терапия. При локализованных формах заболевания применяют ацикловир внутривенно в дозе 45 мг/кг/сут в течение 10-14 дней, при генерализованной инфекции и менингоэнцефалите - 60 мг/кг/сут не менее 21 дня.
При офтальмогерпесе целесообразно одновременно использовать глазную мазь, содержащую ацикловир.
 При
генерализованной форме ГИ в комплексной
терапии новорожденных могут
быть использованы стандартные внутривенные
иммуноглобулины и иммуноглобулины
с высоким титром антител к вирусу
простого
герпеса, а также виферон в свечах в дозе
150000 МЕ 2 раз в сутки в течение
5 дней.
При
генерализованной форме ГИ в комплексной
терапии новорожденных могут
быть использованы стандартные внутривенные
иммуноглобулины и иммуноглобулины
с высоким титром антител к вирусу
простого
герпеса, а также виферон в свечах в дозе
150000 МЕ 2 раз в сутки в течение
5 дней.
Поддержание жизненно важных функций организма ребенка при генерализованной форме ГИ проводится в соответствии с общими принципами интенсивной терапии. Важное место в лечении герпетического менингоэнцефалита занимает адекватная противосудорожная терапия.
Прекращать вскармливание ребенка грудным молоком не имеет смысла, так как проникновение ВПГ в молоко матери маловероятно. Исключение составляют случаи, когда у матери герпетические высыпания располагаются на груди.
Профилактика. Наиболее эффективным методом профилактики ГИ у новорожденных считают родоразрешение путем кесарева сечения до момента разрыва околоплодных оболочек женщин с первичным клиническим эпизодом ГИ менее чем за 6 недель до родов. В случае преждевременного разрыва околоплодных оболочек данная операция эффективна, если выполнена не позднее чем через 4 часа после излития околоплодных вод. Диссеминированная и тяжелая первичная материнская инфекция требуют терапии ацикловиром вне зависимости от срока беременности. Ребенка с любой формой ГИ или с подозрением на герпес необходимо изолировать от других новорожденных.
Вопросы
к экзамену. Врожденная
герпесвирусная инфекция. Эпидемиология.
Роль герпесвируса I типа (HVI) и II типа
(HVII). Классификация. Патогенез. Клиническая
картина. Течение. Диагностика.
Дифференциальный диагноз. Лечение.
Специфическая и иммунокорригирующая
терапия.
Токсоплазмоз (Т) характеризуется высокой инфицированностью населения - от 10-37% в возрасте 10-20 лет до 60-80% к 50-60-летнему возрасту. Если инфицирование у большинства людей не приводит к заболеванию, то инфицирование плода, а также детей и взрослых с недостаточностью иммунитета, может вызвать генерализованный или локальный процесс с необратимыми последствиями.
Этиология. Toxoplasma goridii – облигатный внутриклеточный паразит, поражающий птиц и млекопитающих. Промежуточный хозяин – представители семейства кошачьих. В клетках кишечника кошек происходит половое размножение паразита с образованием ооцист, которые после созревания в земле (около недели) попадают алиментарным путем в кишечник различных млекопитающих, в том числе человека. В результате неполового деления образуется тахизоит - паразит размером 4-7 микрон, способный мигрировать и размножаться в клетках различных органов (ЦНС, лимфоидных, мышечных и др.), где быстро формируются псевдоцисты и цисты. В цистах паразит в форме брадизоита может находиться пожизненно в состоянии vita minima, активируясь в случае значительного снижения иммунитета.
Патогенез. Внутриутробное заражение Т происходит гематогенным путем. Из первичных очагов тахизоиды попадают в лимфатические узлы, где размножаются. Затем с током лимфы попадают в кровь и разносятся в различные внутренние органы. По мере формирования иммунитета размножение паразитов прекращается, образуются цисты, которые могут находится в организме десятки лет.
Классификация
Табл. 2.39. Классификация токсоплазмоза
|
Возраст больных |
Форма |
Течение |
|
Новорожденные дети и дети первых трех месяцев жизни |
Генерализованная Менингоэнце-фалическая Энцефалическая Резидуальная |
Острое Острое и подострое Подострое и хроническое |
|
Дети грудного и раннего возраста (от 4-5 мес до 3 лет) |
Энцефалическая Резидуальная |
Подострое и хроническое |
|
Дети дошкольного и школьного возраста |
Энцефалическая Резидуальная |
Хроническое |
Исследования. Выделение токсоплазм при посеве спинномозговой жидкости; серологическое исследование в динамике; ПЦР (обнаружение ДНК возбудителей); энзимный иммуносорбентный анализ (обнаружение ДНК возбудителей); выявление специфических антител IgM, IgG (у матери и ребенка) в динамике (иммуносорбентная энзимная методика. Определение авидности выявляемых антител. Исследования, направленные на выявление поражения отдельных органов и степени нарушений функций органов.
Клиника. Эмбриопатия при Т маловероятна. Частым исходом Т плода в ранний период фетального развития (от 9 недели) часто является выкидыш, гидроцефалия и недоношенность. С тропизмом паразита к ЦНС связаны поражения мозга (менингоэнцефалит) и глаз (хориоретинит). Возможен генерализованный Т и поражение отдельных паренхиматозных органов (гепатит, миокардит). Если воспалительный процесс не приводит к выкидышу, то при рождении наблюдают остаточные явления Т: фиброзно-склеротические изменения в органах с их деформацией и нарушением функции - так называемые ложные пороки развития.
Поздняя фетопатия может проявляться широким спектром клинических проявлений - от легких до крайне тяжелых вариантов.
Клинически выраженные формы Т характеризуются лихорадкой, лимфаденитом, гепатоспленомегалией, желтухой, судорогами, анемией, тромбоцитопенией, экзантемой. Манифестный процесс часто сочетается с фиброзом, кальцификацией органов. По мере исчезновения признаков генерализованного процесса на первый план выступают проявления менингоэнцефалита. Поздними проявления врожденного Т являются: задержка психомоторного развития, слабоумие, поражения глаз, судороги, гидроцефалия.
Диагноз при Т в основном базируется на выявлении характерных клинических проявлений Т и подтверждается серологическими методами - определение титра антител против Т с помощью РСК (реакции связывания комплемента), РНИФ (реакции непрямой иммунофлюоресценции), ИФА (иммуноферментного анализа) (табл. 2.40).
Табл. 2.40. Диагностические значения титров антител против антигенов токсоплазмы
|
|
Низкий уровень (ед. оптич. плот.) |
Средний уровень (ед. оптич. плот.) |
Высокий уровень (ед. оптич. плот.) |
|
РСК |
1:5-1:20 |
1:40-1:80 |
1:160-1:640 |
|
РНИФ |
1:20-1:80 |
1:160-1:640 |
1:1280 и > |
|
ИФА |
0,5-1 |
1,0-1,5 |
1,5 |
В последнее время в диагностике Т используют полимеразную цепную реакцию (ПЦР).
Дифференциальный диагноз врожденного Т необходимо проводить с другими ВУИ, последствиями внутричерепных родовых травм, гипоксически-ишемическими поражениями ЦНС, приобретенными менингоэнцефалитами.
Табл. 2.41. Дифференциальный диагноз врожденного токсоплазмоза и гипоксически-ишемического поражения ЦНС
|
Признак |
Врожденные токсоплазмоз |
Гипоксически-ишемическое поражение ЦНС |
|
Кальцификаты в мозге |
Характерны |
Возможны |
|
Хореоретинит |
Характерен |
Не характерен |
|
Гидроцефалия |
Часто встречается |
Возможна |
|
Атрофия зрительных нервов |
Возможна |
Возможна |
|
Результаты серологической диагностики |
Выявление диагностических уровней титров АТ |
Отрицательные |
|
Спинномозговая жидкость |
Повышенный уровень белка, лимфоцитарный цитоз |
Повышение или снижение уровня белка |
|
Макулопапулярная экзантема |
Возможна |
Нет |
|
Лимфаденопатия |
Характерна |
Не характерна |
|
Задержка психомоторного развития |
Часто |
Встречается в зависимости от степени тяжести |
Лечение. Наиболее эффективны при Т препараты пириметамина в комбинации с сульфаниламидами, которые блокируют функцию ферментов (редуктазы и синтетазы), участвующих в синтезе фолиевой кислоты паразита. Суточная доза пириметамина составляет 1 мг/кг в 2 приема, а сульфаниламидов короткого действия – 0,1 мг/кг в 3-4 приема. Возможно применение препаратов циклами: пириметамин – 5 дней, сульфаниламид – 7 дней (3 цикла с интервалами 7-14 дней). Такой курс терапии при хронической форме, при иммунодефицитном состоянии, обострение хориоретинита и др. повторяют через 1-2 месяца. При непереносимости сульфаниламидов возможна терапия пириметамином в комбинации с клиндамицином по 10-40 мг/кг/сут в 3 введения.
Противопаразитарный эффект препаратов ко-тримоксазола также обусловлен действием на метаболизм фолиевой кислоты возбудителя. Побочные эффекты всех антифолатов устраняют назначением кальция фолинат по 1-5 мг 1 раз в 3 дня в течение всего курса терапии.
На втором месте по эффективности стоят макролиды, тормозящие синтез белка на рибосомах возбудителя. Спирамицин назначают по 150000-300000 Ед/кг/сут в 2 приема в течение 10 дней, рокситромицин – по 5-8 мг/кг/сут, азитромицин – по 5 мг/кг/сут в течение 7-10 дней.
Профилактика. Методы профилактики подразделяют на санитарные и специальные. Первые включают информацию о предупреждении первичной инфекции путем соблюдения следующих правил: не пробовать сырой фарш, употреблять только термически хорошо обработанное мясо, тщательно вымытые фрукты и овощи, санировать кошачьи испражнения, следить за чистотой рук, работая в саду.
Специальные методы состоят в обследовании с использованием диагностического алгоритма всех женщин перед и во время беременности. Группу риска составляют неиммуные женщины. Женщинам, инфицированным во время беременности, назначают терапию.
Вопросы
к экзамену. Врожденный
токсоплазмоз. Пути инфицирования.
Классификация. Патогенез. Клиническая
картина. Течение. Диагностика.
Дифференциальный диагноз. Лечение.
Врожденный листериоз (ВЛ) относят к более редким вариантам ВУИ. Около 10% всей акушерской патологии связывают с ВЛ, 30% взрослого населения являются носителями данной инфекции.
Этиология. Возбудителем ВЛ являются грамположительные палочковидные бактерии Listeria monoсytogenes, которые содержаться во многих продуктах питания, особенно не подвергшихся термической обработке (мясо, мясные продукты, молоко, мягкий сыр, колбасы, овощи и др.). Из желудочно-кишечного тракта они проникают во все органы и ткани.Диссеминирование зависит от дозы и вирулентности бактерий, а также от состояния защитных сил организма человека. Считается, что при беременности снижается клеточный иммунитет и чувствительность организма к данной инфекции повышается.
В организм новорожденного листерии могут проникнуть внутриутробно, в родах и после рождения (через ЖКТ, пупочную ранку и аэробронхогенно). Были сообщения о нозокомиальном инфицировании новорожденных через руки обслуживающего персонала, термометры, средства реанимации: маски, электро- и вакуумные отсосы. Описаны групповые заболевания новорожденных, имевших контакт с больным внутриутробным листериозным сепсисом в родильном зале и в палате новорожденных.
Патогенез. Развитие ЛИ в организме ребенка сопровождается бактериемией, причем бактерии попадают в плаценту. Инвазия может происходить двояко: либо возбудитель, преодолев клеточный барьер, попадает из материнского в плодовый кровоток, либо в результате возникшего плацентита происходит вторичное заражение спустя несколько дней. Инфицирование ребенка может происходить и интранатально, когда контаминированы родовые пути.
Исследования. Общий анализ крови и мочи, протеинограмма, С-реактивный белок (и другие белки острой фазы воспаления), коагулограмма, определение уровней трансаминаз, КФК, ЛДГ, мочевины, креатинина, электролитов крови, показателей КОС, иммунограмма, микроскопия желудочного содержимого и содержимого наружного слухового прохода, рентгенография органов грудной клетки, ликворологическое исследование (по показаниям), нейросонография, КТ, МРТ, ЭКГ, ЭХО КГ, выделение возбудителей из крови и других биологических жидкостей. Консультации специалистов: офтальмолог, невролог, кардиолог, нефролог.
Клиника. Заболевание протекает в виде септицемии или септикопиемии (гарнуломатозный сепсис). У новорожденных детей характерным является образование специфических мелких гранулем видных невооруженным глазом и располагающихся на коже, в зеве (обнаруживают крайне редко). Такие же высыпания выявляют и в различных органах при патоморфологическом исследовании, в случае смерти ребенка. Частый симптом заболевания - лихорадка. Очагами инфекции являются: аспирационная пневмония, гнойный менингит. Часто наблюдается одышка, цианоз, желтуха, бледность, увеличение печени, у части больных развиваются конъюнктивит, ринит.
Симптомы ранней формы ВЛ проявляются в первые 36 часов жизни. В этом случае диагностируют генерализованную инфекцию, которая обычно заканчивается летально. На аутопсии обнаруживают гистиоцитарные гранулемы в печени, селезенке, почках, поджелудочной железе, надпочечниках, мягких мозговых оболочках и в слизистой кишечника. При микроскопическом исследовании гранулем определяются листерии.
При поздней форме ВЛ , проявляющейся на 2-4-й неделе жизни, диагностируют менингит, менингоэнцефалит. В разгар болезни превалируют неврологическая симптоматика (тремор, гиперестезии, судороги), инфекционный токсикоз, может выявляться гепатолиенальный синдром. Постнатальный листериоз чаще протекает в виде локализованного гнойно-воспалительного заболевания - энтерита, энтероколита, пневмонии, менингита. Возможно развитие сепсиса, особенно у недоношенных детей, хотя и значительно реже, чем при внутриутробном заражении. При позднем развитии инфекции прогноз более благоприятен. Однако возможны неврологические нарушения, в том числе и гидроцефалия. В целом при врожденном ЛИ, который встречается не часто, летальность новорожденных достигает 30-50%.
Диагноз. Листериоз у беременных женщин диагностируется редко из-за отсутствия специфических симптомов. Настораживать в отношении ЛИ могут мекониальные околоплодные воды, макроскопическое обнаружение на плаценте абсцессов и некротических очагов, при микроскопическом исследовании - наличие грампозитивных палочковидных бактерий. Прямым доказательством ЛИ является выявление возбудителей в культуре ликвора, крови и мекония новорожденного.
Дифференциальный диагноз ВЛ проводят с врожденной цитомегалией, токсоплазмозом, сифилисом, стафилококковым сепсисом, гемолитической болезнью новорожденных, внутричерепной травмой и др.
Табл. 2.42. Дифференциальный диагноз врожденного листериоза и ЦМВИ
|
Признак |
Врожденный листериоз |
ЦМВИ |
|
Лихорадка |
Характерна |
Возможна |
|
Розеоло-папулезная сыпь |
Характерна |
Не характерна |
|
Мелкие узелки на миндалинах, в глотке, конъюнктиве |
Характерно |
Не характерно |
|
Увеличение шейных лимфатических узлов |
Характерно |
Не характерно |
|
Генерализованный характер течения |
При раннем начале |
Характерно |
|
Обнаружение на плаценте абсцессов и некротических очагов |
Характерно |
Возможно |
|
Геморрагический синдром |
Характерен при раннем начале |
Характерен |
|
Поздние осложнения |
Гидроцефалия, энцефалопатия |
Поражение слуха, зрения, задержка психомоторного развития |
|
Сиалоаденит |
Не характерен |
Характерен |
|
Врожденные пороки |
Не характерны |
Характерны |
|
Этиологическая диагностика |
Выделение листерий |
Выделение ЦМВ |
|
Серологическая диагностика |
Не разработана |
Антитела к ЦМВ IgM |
Лечение: антибактериальная терапия – комбинация ампициллина по 100-200 мг/кг/сут с амикацином 15 мг/кг/сут в течение 3-4 недель. Несмотря на антимикробную терапию, летальность новорожденных остается высокой.
Профилактика сводится к гигиеническим рекомендациям. Прививки против листериоза не существует.
Вопросы
к экзамену. Врожденный
листериоз. Эпидемиология. Патогенез.
Клиническая картина. Течение. Диагностика.
Дифференциальный диагноз. Лечение.
Хламидийная инфекция (ХИ) приобретает все большее значение в структуре патологии новорожденных и детей раннего возраста в связи с ростом частоты урогенитальных хламидиозов у беременных. Частота врожденной ХИ в последние годы увеличилась. Основным и существенным фактором риска реализации ХИ у новорожденных является хламидиоз мочеполовых органов у беременных женщин в стадии обострения. При рождении хламидиями инфицируются 6-7% детей.
Этиология. Хламидии представляют собой мелкие грамотрицательные кокки. Подобно вирусам, они являются облигатными внутриклеточными паразитами, не способными существовать на неживых бактериологических средах, однако отличаются от вирусов наличием как РНК, так и ДНК в своем геноме, а также строением стенки, которая по своему составу соответствует бактериальной.
Патогенез. Плод инфицируется не только во время родов при контакте с инфицированными родовыми путями или при заглатывании и аспирации околоплодных вод, но и антенатально. При этом заболевание протекает особенно тяжело, чаще с генерализацией процесса. При локализации воспалительного процесса в области шейки матки заражение плода происходит, как правило, интранатально, а при поражении эндометрия, децидуальной и плодных оболочек - антенатально. Дети могут также инфицироваться через руки персонала или матери, предметы обихода, бельё, игрушки, а также воздушно-капельным путём.
Время заражения, массивность инфицирования, гестационный возраст и условия внутриутробного развития определяют тяжесть и характер клинических проявлений ХИ в раннем неонатальном периоде. В основе наблюдаемых расстройств лежит усиленное размножение микроорганизмов, способных выделять тумор-некротизирующий фактор и разрушение пораженных эпителиальных клеток хозяина, что ведет к активации процессов перекисного окисления липидов. Происходящие на первых этапах развития ХИ усиление метаболизма арахидоновой кислоты и изменение синтеза простагландинов в свою очередь способствуют возникновению нарушений микроциркуляции в мозге, легких и др. органах, повышению сосудистого тонуса, возникновению выраженных расстройств гемодинамики малого и большого круга кровообращения. В силу особенностей биологического цикла хламидии и морфофункциональной зрелости новорожденного ребенка развитие локальной воспалительной реакции происходит медленно и выявляется обычно лишь на 2-4 неделе жизни.
Классификация хламидийной инфекции (Евсюкова И.И., 1996)
Генерализованная инфекция с тяжелым поражением легких, сердца, желудочно-кишечного тракта, печени и других органов, заканчивающихся смертью ребенка в первые часы и дни после рождения;
Менингоэнцефалит с неоднократно повторяющимися приступами клонико-тонических судорог и апноэ;
Внутриутробная пневмония;
Синдром дыхательных расстройств;
Гастроэнтеропатии;
Конъюнктивит.
Исследования. Обнаружение хламидий в мазках-отпечатках из глаз; ПЦР; определение ДНК хламидий при помощи энзимного иммуносорбентного анализа; РИФ; ИФА. Исследования, направленные на выявление поражения отдельных органов и степени нарушений функций органов.
Клиника. У всех инфицированных хламидиями детей уже в первые часы и дни жизни наблюдаются неспецифические признаки заболевания, свидетельствующие о нарушении микроциркуляции и гемодинамики (они часто расцениваются как следствие гипоксического поражения ЦНС). В первые 12 ч. жизни, как у детей, перенесших интранатальную гипоксию, так и у родившихся в удовлетворительном состоянии, отмечается повышенное беспокойство, расстройство сна, повышенная реактивность, изменение мышечного тонуса, угнетение физиологических рефлексов, тремор конечностей. Дети склонны к быстрому охлаждению или перегреванию, у них длительно сохраняются локальный цианоз, мраморность кожи. В последующие дни жизни, несмотря на проводимую терапию, нарушения функционального состояния ЦНС приобретают устойчивый характер, а в ряде случаев наблюдается нарастание неврологических симптомов, присоединяется упорное срыгивание, нередко рвота.
Наряду с неврологическими симптомами при ХИ уже в первые часы и дни жизни отмечены приглушенность сердечных тонов, нечистый 1 тон сердца или систолический шум. На ЭКГ выявляются признаки перегрузки правых отделов сердца, на рентгенограмме органов грудной клетки определяются симптомы нарушения гемодинамики малого круга кровообращения - усиление прикорневого рисунка («влажные» легкие), а у ряда детей, увеличение размеров сердца за счет правых отделов (легочная гипертензия). При ЭХО КГ нередко выявляются изменения эндокарда и клапанного аппарата сердца в виде повышения акустической плотности створок, пролапса митрального и трикуспидального клапанов. У детей, аспирировавших околоплодные воды и у глубоконедоношенных на первый план выступают дыхательные расстройства. Воспалительная инфильтрация в легких чаще выявлялась к концу 1-й недели, у остальных - на 2-3 неделе жизни. У наименее зрелых детей заболевание протекает по типу синдрома дыхательных расстройств. Течение заболевания нередко осложняется длительным сохранением фетальных шунтов и нарастанием недостаточности кровообращения. В наиболее тяжелых случаях присоединяются геморрагические явления по типу ДВС-синдрома.
Выраженная желтуха, наблюдается преимущественно у недоношенных, у которых гипербилирубинемия нередко требует заменного переливания крови. Увеличение размеров печени и селезенки выявляется у каждого третьего ребенка.
Генерализованную ХИ у новорожденного можно заподозрить на основании наличия у матери цервицита, и септического состояния у ребенка с признаками тяжелой пневмонии (или РДСН) и наличием конъюнктивита, ДВС-синдрома. При рентгенологическом исследовании выявляют грубые перибронхиальные изменения, перекрывающие тень сердца, обусловленные преимущественным поражением верхних дыхательных путей и бронхов.
В крови наблюдается снижение уровней Hb и эритроцитов, длительно сохраняющийся относительный нейтрофилез, увеличение к концу 1-2 недели жизни числа эозинофилов и моноцитов. У детей с выраженными изменениями со стороны ЦНС, сердечно-сосудистой и дыхательной систем в крови может определяться высокий титр антихламидийных антител - 1:64 и более. У глубоко недоношенных новорожденных специфические антитела в раннем неонатальном периоде отсутствуют.
Одной из наиболее часто встречающихся форм ХИ является конъюнктивит. По данным ВОЗ. (1987), он встречается у 14 на 1000 новорожденных. Конъюнктивит развивается после 4-го дня жизни, чаще через 1-2 недели после рождения и характеризуется торпидным течением. Отмечается диффузная гиперемия конъюнктивы, особенно в хрящевом отделе, без перехода на роговицу. Склеивание век после сна, псевдомембранозные образования, отсутствие обильного гнойного отделяемого - характерны для хламидийного конъюнктивита. Продолжительность заболевания 3-4 недели без ухудшения зрения. Поражение двустороннее. Лечение длительное. В стационарах возможны вспышки хламидийного конъюнктивита.
При ХИ часто развиваются пневмонии. Интерстициальные пневмонии нередко проявляются в сроки от 2 недель до 4 мес. после рождения. Дети, заболевшие хламидийной пневмонией, чаще рождаются с оценкой по шкале Апгар менее 6 баллов. У них отмечается РДСН, около 30% из них нуждается в проведении ИВЛ. У большинства больных выявляется гепатоспленомегалия, у 50% выраженные отеки. В половине случаев регистрируется патологическая первоначальная убыль массы тела. У многих выявляются признаки морфофункциональной незрелости к сроку гестации. У всех детей с первых дней жизни в мазках соскобов из ВДП и в легочных аспиратах определяется хламидийный антиген.
В отличие от детей более старшего возраста хламидийная пневмония у недоношенных проявляется на 5-7 день жизни, протекает па фоне тяжелого токсикоза, что сочетается с обнаружением хламидийного антигена в крови, трахеальном аспирате. Отмечается бледный и «мраморный» рисунок кожи, угнетенное функциональное состояние ЦНС, вздутие живота, срыгивания. Часто обнаруживается увеличение лимфатических узлов, иногда кратковременная точечная сыпь. Аускультативно - дыхание пуэрильное или несколько ослабленное, рассеянные хрипы. Имеется диссоциация между выраженной одышкой и относительно скудными физикальными и рентгенологическими данными.
Рентгенологически выявляется интерстициальная пневмония, усиление сосудистого рисунка, понижение пневматизации легочных полей, больше справа. В остром периоде характерна перегрузка правых отделов сердца. На 2-3 неделе присоединяется кашель - приступообразный, влажный, с отхождением мокроты. Гемограмма - лейкоцитоз до 17-23 тыс. со сдвигом формулы влево до миелоцитов, эозинофилия. У старших детей - гиперкапния и гипоксия (рСО2 более 50 мм рт. ст., рО2 < 60 мм рт. ст.).
Заболеванию свойственно затяжное течение. Прогноз у недоношенных детей в связи с иммунодефицитным состоянием более серьезный.
Из других проявлений ХИ для недоношенных свойственны: хламидийный хориоретинит, средний отит, тубоотит, назофарингит, миокардит, бронхит.
На первом году жизни у таких детей выявляется высокий процент ослабленных детей, часто страдающих респираторными заболеваниями. Часты нарушения функции ЖКТ в виде срыгиваний, снижения аппетита, неустойчивого с гула. Девочки страдают вульвитом. При отсутствии специфического лечения отмечена персистенция хламидий. Излечение возможно при комплексной длительной терапии в условиях стационара (эритромицин в сочетании с антиоксидантами, интерфероном, иммуноглобулинами в течение 21 дня).
Диагноз. Показания к обследованию беременных: а) наличии воспалительных заболеваний гениталий, б) наличие бесплодия, в) беременные с отягощенным акушерским анамнезом (самопроизвольные выкидыши, невынашивание, рождение маловесных детей, отягощенное течение беременности, многоводие, неясные лихорадки). У женщин основное значение имеет лабораторная диагностика, т.к. урогенитальный хламидиоз протекает бессимптомно (малосимптомно).
Наиболее объективный метод исследования ХИ (золотой стандарт) - культуральный. Весьма информативен метод гибридизации ДНК (использование ДНК-зонда, меченного биотином). В настоящее время очень широко используется метод ПЦР, иммуноферментный анализ, методы непрямой и прямой иммунофлюоресценции с использованием тест систем иммунохроматографии (методы простые, но точность результатов ниже, чем при использовании ПЦР, метода гибридизации ДНК). Серологические методы являются дополнительными при диагностике ХИ. На текущий и манифестный процесс указывают антитела IgA.
Диагноз ХИ у новорожденных следует заподозрить при:
1. Наличии у матери частых выкидышей, трубного бесплодия, хронического вялотекущего сальпингоофорита, эндометрита, повышения количества лейкоцитов в мазках отделяемого из половых путей и, особенно, при развитии хориоамнионита;
2. Обнаружении цитоплазматических включений или элементарных телец в соскобе из цервикального канала, уретры у беременных, мазках из родовых путей и периферической крови у рожениц и родильниц методом молекулярной гибридизации, ELISA-YICTOJJOM с использованием моноклональных антител, микроиммунофлюоресцентным метолом.
Диагноз ХИ у новорожденных устанавливается при наличии соответствующих проявлений заболевания, а также на основании результатов клинических анализов крови и результатов исследования иммуноглобулинов в динамике, плаценты, рентгенографического и эхокардиографического обследования, УЗИ мозга.
У детей показано проведение микробиологического обследования при рождении и на 5-6 день жизни. При этом наибольшая частота выделения возбудителя наблюдается при исследовании материала с задней стенки глотки.
Окончательный диагноз ХИ устанавливают после обнаружения возбудителя и серологического исследования.
Лечение. Новорожденным с ХИ назначают эритромицин по 40 мг/кг/сут в течение 3 недель. Для лечения используют также: кларитромицин, азитромицин, рокситромицин. Имеются сообщения о целесообразности сочетания перечисленных антибиотиков с курсами виферона. При отсутствии специфического лечения или при назначении эритромицина в течение 7-10 дней отмечена персистенция хламидий у новорожденных. Излечение возможно при комплексной, длительной терапии (21 день) в условиях стационара.
При конъюнктивите применяют 0,5% эритромициновую мазь с частотой 5-6 раз в сутки в течение 14 дней.

Микоплазменные инфекции (МИ) - острые инфекционные заболевания человека и животных, вызываемые микоплазмами. У женщин с микоплазменной инфекцией внутриутробное инфицирование плода происходит в 96% случаев.
Этиология. Большинство микоплазм являются условно- патогенными микроорганизмами. В настоящее время их принято относить к бактериям. Микоплазмы способны как к внутриклеточному, так и внеклеточному размножению. Патогенность микоплазм определяется большой их подвижностью и способностью прикрепляться к различным клеткам хозяина, оказывая токсическое и деструктивное действие.
Патогенез. Уникальные биологические свойства микоплазм позволяют им персистировать в организме хозяина, вызывая хронические воспалительные процессы и аутоиммунные патологические состояния.
В зависимости от периода внутриутробного развития плода под воздействием микоплазм могут возникать эмбриопатии, фетопатии и генерализованный инфекционный процесс. Эмбриопатии приводят к формированию пороков развития и нередко являются причиной спонтанных абортов. При фетопатиях микоплазменной этиологии возможно возникновение пороков развития, которые являются результатом пролиферативных и альтеративных процессов, приводящих к сужению каналов и отверстий. Инфицированные околоплодные воды вызывают спазм сосудов плаценты, что приводит к уменьшению кровоснабжения плода, развитию внутриутробной гипоксии, задержке развития и гибели плода.
При заражении плода после 27 недель гестационного периода плод приобретает способность к специфической реакции на внедрение возбудителя инфекции в виде лейкоцитарной инфильтрации, тканевых и гуморальных изменений.
Для гематогенного (трансплацентарного) пути инфицирования характерна полиорганность поражения (печени, легких, ЦНС, перикарда, кожи), которая обусловлена как вегетацией самого возбудителя, так и воздействием продуцируемого экзотоксина. Развитие генерализованного инфекционного процесса происходит под влиянием таких провоцирующих факторов, как внутриутробная гипоксия, асфиксия, родовая травма и т.д.
Инфицирование плода может возникать и во время прохождения плода по родовым путям. Входными воротами инфекции чаще всего является слизистая глаз, половых органов (у девочек) и дыхательных путей. Наиболее выраженные изменения отмечаются в органах дыхания.
При инфицировании микоплазмой вначале наблюдается интенсивное размножение микоплазмы, без поражения клеток организма. В дальнейшем происходит внедрение микоплазмы в клетку, что ведет к ее деструкции и гибели.
Классификация:
По форме: локализованная, генерализованная, резидуальная;
По течению: острое, подострое, латентное.
Исследования. Выявление микоплазм при бак исследовании мочи, ликвора, гноя, фарингеальной слизи; серологическое исследование (РПГА, РСК, РНГА, определение холодовых агглютининов), метод прямой и непрямой иммунофлюоресценции, иммуноферментного анализа (в качестве скрининга), ПЦР, ДНК-диагностика; рентгенография органов грудной клетки; исследования направленные на выявление поражения внутренних органов.
Клиника. Заболевание начинается остро с повышения температуры тела до 38-39 °С в течение 4-5 дней, повторной рвоты (температурная реакция для недоношенных не характерна). В 50% случаев регистрируются симптомы поражения респираторного тракта: одышка, незначительный непродуктивный кашель, пневмония. Состояние чаще тяжелое или среднетяжелое, выражена общемозговая и менингеальная симптоматика (судороги, потеря сознания, возбуждение, очаговые симптомы в виде гиперкинезов, атаксии, пирамидной недостаточности, пареза глазодвигательных нервов, лицевого нерва и т.д.). Церебральная форма МИ у детей в 45% случаев протекает в виде менингита, в 33% - менингоэнцефалита и энцефалита. Параллельно со снижением температуры тела уменьшается выраженность общемозговых и менингеальных симптомов, которые сохраняются на протяжении 2-3 недель. В ликворе отмечается повышение давления и белка, преимущественно лимфоцитарный плеоцитоз (в 25% случаев – нейтрофильный плеоцитоз). Санация ликвора происходит через 3-5 недели.
У детей, родившихся в удовлетворительном состоянии после непродолжительного «светлого промежутка», появляются дыхательные расстройства, двигательное беспокойство, повышение возбудимости, тремор, постанывание, судороги, угнетение физиологических рефлексов. Одним из первых проявлений МИ у части детей является острая гидроцефалия, развивающаяся на первой неделе жизни.
У недоношенных детей кроме синдрома дыхательных расстройств регистрируются склерема, геморрагический синдром, желтуха, гепато- и спленомегалия.
В 25-50% случаев МИ выявляются пороки развития ЦНС, формирование которых происходит на 3-6-й неделе внутриутробного развития. Возможно формирование окклюзионной гидроцефалии, с гипоплазией височных долей обоих полушарий.
При интранатальном инфицировании в первые дни жизни может развиться менингеальная симптоматика. Возможно латентное течение с манифестацией клинических проявлений менингита или энцефалита спустя несколько недель с развитием в дальнейшем гидроцефалии, абсцессов мозга с задержкой нервно-психического развития ребенка. Возможно развитие полирадикулоневрита, энцефалопатии, поражение глаз, почек, перикарда, плевры, лимфатических узлов, костей (остеомиелит), гепатомегалии, реже спленомегалии.
Внутриутробная микоплазменная пневмония, как правило, протекает с клинической картиной интерстициальной пневмонии при выраженной дыхательной недостаточности, в динамике в легких начинают выслушиваться влажные хрипы. У недоношенных детей в клинической картине с первых минут жизни выявляются респираторные нарушения с признаками дыхательной недостаточности (тахипноэ, поверхностное дыхание, цианоз, усиливающийся при крике, участие вспомогательной мускулатуры в акте дыхания, пенисто-кровянистые выделения изо рта). Аускультативно выслушиваются мелкопузырчатые и крепитирующие хрипы. У большинства детей имеются признаки сердечной недостаточности по правожелудочковому типу, геморрагический синдром. Рентгенологически отмечаются расширения корней легких, эмфизема.
Диагноз МИ основывается на клинико-анамнестических данных, а также на результатах исследования: микробиологического, серологического (РПГА, РСК, РНГА, определение холодовых агглютининов), прямой и непрямой иммунофлюоресценции, иммуноферментного анализа (в качестве скрининга), полимеразной цепной реакции, ДНК-диагностики. Серологические методы диагностики низкоинформативны, так как к микоплазмам не развивается стойкого иммунитета и существует большое количество серотипов возбудителя.
В общем анализе крови у новорожденных при МИ выявляется анемия, тромбоцитопения, моноцитоз, возможен умеренный лейкоцитоз со сдвигом формулы влево (у недоношенных иногда имеется выраженный лейкоцитоз.
Табл. 2. 43. Дифференциальный диагноз врожденного микоплазмоза и хламидиоза
|
Признак |
Врожденный микоплазмоз |
Врожденный хламидиоз |
|
РДСН при рождении |
Часто |
Характерно |
|
Поражение ЦНС |
Менингоэнцефалит |
Не характерно |
|
Конъюнктивит |
Не характерен |
Характерен |
|
Этиологическая диагностика |
Выделение микоплазм из фарингеальной слизи, мокроты и гноя |
Выявление хламидий культуральным методом, ПЦР и др. |
|
Серологическая диагностика |
Нарастание титра антител в реакции связывания комплемента и реакции непрямой гемагглютинации, и др. |
Титр антихламидийных АТ 1: 64 и выше; Наличие специфических АТ IgA и IgM |
|
Врожденные пороки развития |
Характерных пороков нет (у 15% детей) |
Не характерны |
|
Поражение органов дыхания |
Врожденная пневмония |
Упорная интерстициальная пневмония |
|
Отеки |
Редко |
У 50%, выраженные |
|
Поражение печени |
Конъюгационная затянувшаяся желтуха |
Гепатоспленомегалия, конъюгационная желтуха |
|
Наличие у матери вялотекущего сальпингоофорита, эндометрита, цервицита |
Не характерно |
Характерно |
|
Эозинофилия, моноцитоз |
Не характерно |
Характерно |
Лечение. Для профилактики антенатального инфицирования плода беременным назначается антибактериальная терапия (эритромицин, клиндамицин в течение 7 дней) и местное лечение - присыпки шейки матки тетрациклином в комбинации с леворином, обработка влагалища ацидофильной культурой в течение 10 дней.
Для лечения МИ преимущественно используют препараты группы макролидов: эритромицин (50 мг/кг/сутки) или вильпрофен (джозамицин) - 30-40 мг/кг, или азитромицин (5 мг/кг) 1 раз в сутки внутрь, но в 1-й день - 2 раза в сутки в течение 10-14 дней в сочетании с вифероном -1 по 150 000 ЕД ректально 2 раза в день в течение 5 дней с 5-дневными перерывами (2-3 курса). Детям с массой тела до 1500г виферон вводят ректально 3 раза в сутки.
По жизненным показаниям возможно использование препаратов тетрациклинового ряда.
Профилактика: предохранение беременных от инфицирования, своевременное выявление микоплазмоза и проведение специфической терапии. Все беременные женщины с неблагоприятным акушерско-гинекологическим анамнезом подлежат обследованию на микоплазмоз.
Вопросы
к экзамену.
Врожденный микоплазмоз. Эпидемиология.
Классификация. Патогенез. Клиническая
картина. Локальные и генерализованные
формы Течение. Методы диагностики.
Дифференциальный диагноз. Лечение.
Краснуха (К), перенесенная матерью во время беременности, часто приводит к повреждению эмбриона или плода. Симптомокомплекс, наблюдаемый у новорожденных, объединяется термином «краснушная эмбриопатия» и включает в себя аномалии развития головного мозга, врожденные пороки сердца, дефекты зрения и слуха. Обнаруживаемые изменения бывают настолько тяжелы, что они приводят к инвалидности с детства. Рубеолярная эмбриопатия развивается при инфицировании в I триместре беременности.
Частота и специфичность врожденных пороков развития (ВПР) зависят от времени инфицирования. Впервые 4 нед. гестации ВПР наблюдаются у 90-100% плодов. На 4-8-й нед. — у 50%, на 8-12-я нед. — у 10-15%. Рубеолярная фетопатия возникает при инфицировании плода в II-III триместрах беременности. Она характеризуется отчетливой гипотрофией плода, тромбоцитопенической пурпурой, поражением печени, легких, головного мозга, костей.
Этиология и патогенез. К распространяется воздушно-капельным путем или трансплацентарно. К менее контагиозна, чем корь или ветряная оспа и, следовательно, циркуляция вируса более ограничена. В связи с тем, что во многих странах широко проводится вакцинация против кори, эпидемического паротита и при К К, заболеваемость К резко снизилась. Частота серонегативных молодых женщин составляем приблизительно от 9 до 20-40%. Кроме того, существует проблема субклинически протекающих реинфекций во время беременности у ранее привитых женщин.
Инкубационный период при К составляет 2-3 недели. На 7-9 день развивается выраженная виремия при которой вирусы проникают в лимфоидную ткань, кожу, слизистые оболочки, в головной мозг, а у беременных женщин - в плаценту и, минуя плацентарный барьер - к плоду. Контагиозность больных сохраняется приблизительно в течение 7 дней и примерно 4-х дней после появления сыпи. В сыворотке крови спустя 2-4 дня от начала появления симптомов определяются IgM и IgA, а затем IgG. Очень долго персистирует IgA, a IgG остается в течение всей жизни. К, возникающая во время беременности, в большинстве случаев протекает легко, с появлением неярко выраженной розовой сыпи на коже и с увеличением подчелюстных и шейных лимфоузлов. Реинфекции, как правило, асимптоматичны и могут привести к инфицированию плода, но только в редких случаях дело доходит до эмбриопатий. Вирус может инфицировать эпителий хориона, капиллярный эндотелий кровеносных сосудов плаценты, эндокард плода и через кровоток распространяется во многие органы. Иммунная защита со стороны В-клеток с продукцией вирусоспецифических IgM-антител наступает на 10-13 неделях гестации, IgG - с 16 недели, а IgA-антител - с 30-й недели гестации. К моменту рождения у 98% новорожденных с эмбриопатией могут определяться самостоятельно выработанные IgM-антитела. IgG-антитела являются преимущественно материнскими. Продукция IgM-антител сохраняется после рождения 6-8 месяцев.
Время развития К определяет исход беременности и характер повреждений у плода и новорожденных. В ряде случаев беременность прерывается спонтанным абортом или мертворождениями. При К перед зачатием до 10-го дня после последней менструации не возникает детских инфекций и повреждений. Если инфицирование происходит в первые недели беременности (до 8 недель) в 40% случаев наступает спонтанный аборт, а в остальных 60% случаев - пороки развития плода. При инфицировании на 2-3 месяце беременности риск для плода достигает 30-35%. Возникновение К на 4 месяце создает угрозу для плода в 8-10% случаев.
К, возникающая на поздних стадиях беременности, как правило, не нарушает процессы эмбриогенеза и приводит к фетопатиям в виде увеличения печени и селезенки. В случаях поздней манифестации К наиболее частой патологией является: нарушения слуха, сахарный диабет, судороги и прогрессирующий панэнцефалит. Большая часть этих симптомов появляется у детей, матери которых заболели острой К до 32 недель беременности, в то время как изолированные нарушения слуха связаны с К на 13-17 неделях беременности.
Классификация: 1. «Малый» краснушный синдром (поражение органов зрения, слуха, сердца); 2. «Большой» краснушный синдром (поражение различных органов и систем).
Исследования. Вирусологическое исследование (кал, моча); ИФА; исследования, направленные на выявление поражения внутренних органов.
Клиника. В классическую триаду (триада Грегга) при К входят - пороки развития сердца (ОАП, стеноз легочной артерии, ДМЖП или ДМПП), поражения глаз (глаукома, катаракты, хориоретинит) и нарушения слуха (поражение слухового нерва). Следствием персистирующей К может стать ЗВУР, поражение ЦНС (менингоэнцефалит), нарушение функции печени (гепатит), тромбоцитопения, анемия, интерстициальная пневмония, остеиты, иммунодефицит и дисплазия зубов.
Диагноз. Диагноз ВК основывается на выявлении двух любых основных симптомов (катаракта или врожденная глаукома, врожденный порок сердца, глухота, пигментная ретинопатия) или сочетания одного из указанных основных симптомов и еще одного из дополнительных симптомов (пурпура, спленомегалия, желтуха, микроцефалия, менингоэнцефалит, изменения костей и отставание в умственном развитии).
Лабораторная диагностика.
У новорожденных детей вирус К обнаруживается в кале и моче в течение месяца, в связи, с чем таких детей следует изолировать. Основой диагноза К служит наличие специфических IgM-антител. Обнаружение их до 2-х лет является доказательством перенесенного заболевания. У неинфицированных новорожденных в это время краснушные антитела не обнаруживаются, т.к. прекращается пассивный перенос материнских антител.
Табл. 2.44. Дифференциальный диагноз врожденной краснухи и врожденного микоплазмоза
|
Признак |
Врожденная краснуха |
Врожденный микоплазмоз |
|
РДСН при рождении |
Не характерен |
Часто |
|
Поражение ЦНС |
Часто (до 82%) Менингоэнцефалит |
Менингоэнцефалит |
|
Этиологическая диагностика |
Выделение вируса краснухи в первом полугодии жизни |
Выделение микоплазм из фарингеальной слизи, мокроты и гноя |
|
Серологическая диагностика |
Обнаружение специфических IgM; Обнаружение специфических IgG во втором полугодии жизни |
Нарастание титра антител в реакции связывания комплемента и реакции непрямой гемагглютинации, и др. |
|
Врожденные пороки развития |
Характерны пороки: глаукома, микрофтальмия, ВПС, пороки ЖКТ |
Характерных пороков нет |
|
Поражение зрения |
Катаракты |
Не характерна |
|
Поражение слуха |
Глухота |
Не характерно |
|
Поражение печени |
Гепатит, повышение прямого билирубина |
Конъюгационная затянувшаяся желтуха |
|
Сахарный диабет |
У 20% детей |
Не характерно |
Лечение врожденной К не разработано. Рекомендуют использование виферона 1, интрона, роферона.
Профилактика. Важнейшим средством предупреждения возникновения краснушной эмбриофетопатии являются прививки, которые создают у большинства прививаемых детей устойчивый иммунитет. С течением времени у привитых снижается титр специфических антител и возрастает угроза инфицирования женщин репродуктивного возраста. Поэтому вторым обязательным условием профилактики является введение в существующую схему обследования беременных женщин лабораторной диагностики на К. Существующая практика прерывания беременности при контакте беременной женщины с К не может быть правильной, т.к. не учитывает уровень у нее противокраснушного иммунитета. Согласно современным представлениям в этих ситуациях должна быть определена направленность гуморального иммунного ответа к антигенам вируса К. С этой целью используют реакции бластной трансформации лимфоцитов (РБТЛ), обнаружение в крови антител к вирусу К, относящихся к классу IgM, что свидетельствует о краснушной инфекции.
Появление клинически выраженной краснухи и IgM-антител свидетельствует о свежеперенесенной К и служит показанием для прерывания беременности (I-II триместр).
За беременными женщинами, имевшими контакт с К, но без клинических симптомов заболевания и отсутствием противокраснушных антител, рекомендуется вести диспансерное наблюдение. В программу обследования включается иммунологическое и ультразвуковое исследование. При отсутствии IgM-антител делается вывод о возможности сохранения беременности. Ультразвуковой контроль за состоянием плода проводится на 16-22 неделях гестации, а повторно - на 25-28 неделях. Серонегативные или беременные с неизвестным иммунологическим статусом после контакта с К в первые 16 недель беременности тотчас должны получить краснушный иммуноглобулин (0,3 мл/кг, т.e. в среднем 15 мл). Если спустя 4-6 недель титр IgM повышается, рекомендуется прервать беременность из-за высокого риска краснушной эмбриопатии.
Вопросы
к экзамену. Врожденная
краснуха. Классификация. Патогенез.
Клиническая картина. Течение. Диагностика.
Дифференциальный диагноз. Профилактика.
