
- •от 20 ноября 2008 года МГУП
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •ISBN 978-5-7262-1073-5 (т. 6, ч. 1)
- •Глава 23. КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ
- •Глава 23. КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ
- •Основа
- •Сплав
- •Содержание элементов, мас. %
- •Сплав
- •Содержание элементов, мас. %
- •Другие
- •Деформируемые сплавы
- •23.3. Конструкционные материалы на основе железа

23.3. Конструкционные материалы на основе железа
23.3.1.Железо и взаимодействие его
сдругими элементами
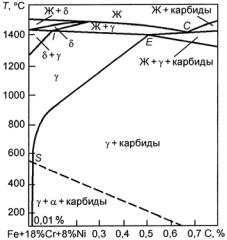
Сплавы на основе железа, именуемые сталями, играют огромную роль в машиностроении, строительстве, металлургии и других отраслях народного хозяйства. В ядерной энергетике широко применяются различные низко-, средне- и высоколегированные стали. Из них изготавливают оболочки твэлов, трубы первого и второго контуров, пароперегреватели, теплообменники, корпуса и другие детали ядерных реакторов. На сегодняшний день стали рассматриваются в качестве основного конструкционного материала и для термоядерных реакторов будущего. В отличие от обычной техники, учитывая сложные условия работы различных деталей и узлов ядерных и термоядерных реакторов, к конструкционным сталям и сплавам для них предъявляют комплекс повышенных требований.
Добыча железа из руд началось более 4000 лет назад, а методы массового производства стали были открыты в середине XIX века.
Железо − элемент VIII группы таблицы Д.И. Менделеева с атомным номером 26 − относится к переходным металлам (см. табл. 23.1). Электронная структура атома Fe имеет недостроенную
d-оболочку − 3p63d664s2. Природное железо состоит из изотопов
54Fe − 5,84 %; 56Fe − 91,68 %; 57Fe − 2,17 % и 58Fe − 0,31 %.
Железо существует в виде двух кристаллических модификаций:
α-Fe 910 °C |
γ-Fe 1392 °C |
δ-Fe 1539 ± 3 °С жидкая фаза. |
(ОЦК) |
(ГЦК) |
(ОЦК) |
Такая особенность аллотропических превращений, когда при низкой и высокой температуре устойчива ОЦК структура, а в интервале 910−1392 °С − ГЦК структура, свойственна только железу.
Часто это объясняется тем, что свободная энергия α-Fe меньше свободной энергии γ-Fe при температурах ниже 910 °С и выше
1392 °С (рис. 23.103).
В интервале 910−1392 °С меньшей свободной энергией обладает ГЦК упаковка атомов железа. Высокотемпературная модификация
216
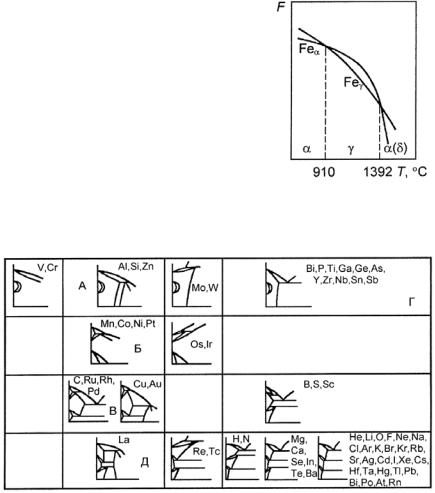
ОЦК структуры (иногда называемая δ-Fe) не представляет собой новой аллотропической формы, т.е. она тоже α-Fe.
В связи с большой распространенностью в практике сплавов железа его диаграммы состояний с другими элементами Периодической системы Д.И. Менделеева являются наиболее изученными. Анализ большого количества известных двойных диаграмм состояния сплавов Fe с другими элементами показывает, что их можно разделить на несколько классов, например, по Б.Б. Гуляеву − на пять классов (рис. 23.104).
Рис. 23.103. Изменение свободных энергий
α- и β-модификаций железа при изменениях температуры
Рис. 23.104. Классификация начальных участков диаграмм состояния двойных систем сплавов железа (Б.Б. Гуляев)
Класс А. Сплавы Fe с элементами, расширяющими концентрационную и температурную область существования α-Fe. Такие легирующие элементы называют ферритостабилизирующими (V, Cr, Al, Si, Zn, Mo, W). Для сплавов этого класса характерно наличие неограниченных (Сr, V) или ограниченных (Al, Si, Mo, W) твердых
217
растворов в железе. Ферритостабилизирующие элементы на диаграмме состояний существенно сокращают площадь существования области γ-твердых сплавов − выклинивают γ-область (см. рис. 23.104). Сплавы класса А являются основой для создания коррози- онно-стойких жаропрочных сталей ферритного класса.
Класс Б. Сплавы Fe с элементами, расширяющими концентрационную и температурную области существования γ-Fe. Такие ле-
гирующие элементы называют аустенитостабилизирующими (Ni, Mn, Co, Pt, Os, Ir, С, N). Для сплавов этого класса характерно наличие широких областей существования аустенита, причем при количестве легирующего элемента выше определенного аустенит существует при комнатной температуре, а ниже этого количества − присутствуют двухфазные (α + γ)- и однофазные α-сплавы. Сплавы этого класса служат основой для создания коррозионно-стойких жаропрочных сталей аустенитного класса.
Класс В. Эвтектоидные сплавы Fe с ограниченной растворимостью легирующих элементов в α- и γ-фазах (С, Ru, Rh, Pd, Сu, Аu). Эвтектоидное превращение в системе Fe−С используется для разработки широкого класса углеродистых сталей. Эвтектоид имеет различную структуру в зависимости от условий охлаждения. При малых скоростях (~1 °С/мин) охлаждения образуется перлит, при быстрых − мартенсит. Наличие перлитного превращения и склонности сплавов к переохлаждению при закалке дают широкие возможности для изменения структурно-фазового состояния сталей.
Класс Г. Эвтектоидные и перитектоидные сплавы Fe с элементами, образующими весьма ограниченные твердые растворы в δ-, γ- и α-модификациях железа. Для этих систем характерно наличие эвтектик (Bi, P, Ti, Y, Zr, Nb, Sn, Sb, Ge, As); эвтектик и перитек-
тоидов (В, S, Se); эвтектик, перитектоидов и эвтектоидов (Н, N, Mg, Са и др.); эвтектик и двух эвтектоидов (Li, К, Na, О, F, C1 и др.). Из-за ограниченной растворимости элементов данного класса часть из них используется в качестве модификаторов (В, Ti, Y, Zr, Nb, N), а часть, no-существу, является вредной примесью (P, S, О, Н, Sn).
Класс Д. Перитектоидные сплавы с элементами, образующими ограниченные твердые растворы в δ-, γ- и α-модификациях железа.
218
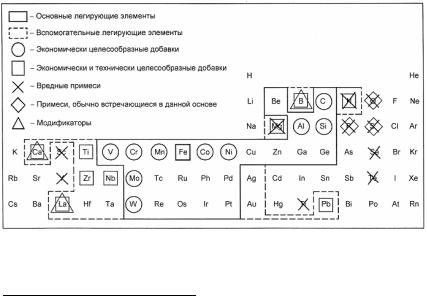
Для этих систем характерно наличие перитектик (La, Re, Те). Эти легирующие элементы могут быть использованы модификаторами железа.
С позиций создания прочных сталей основную массу легирующих элементов по величине растворимости в железе α(α-Fe) и коэффициенту распределения между фазами ω(δ-Fe) можно разделить на основные и вспомогательные легирующие элементы, отметить вредные примеси1.
Условиями выбора основных легирующих элементов являются:
α(α-Fe) > 1; ω(δ-Fe) > 0,5.
Этим условиям удовлетворяют 23 элемента (рис. 23.105), из них можно исключить весьма дорогие 11 элементов и слишком легкоплавкий Zn (Тпл = 419 °С). Хотя углерод имеет малую растворимость в α-Fe и низкий коэффициент распределения в δ-Fe
(α(α-Fe) = 0,1; ω(δ-Fe) = 0,2), он также входит в группу основных как легирующий элемент, воздействие которого на сталь основано не
на растворном упрочнении, а на обеспечении возможности термообработки.
Рис. 23.105. Выбор легирующих добавок и определение вредных примесей для сплавов железа (Б.Б. Гуляев)
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 16.2.3.
219
Кроме того, в сталь всегда входят технологические добавки Si, Мn и часто Аl, обеспечивающие ее раскисление. То есть, в отличие от цветных сплавов, где исходным материалом для легирования является чистый металл, в стали всегда имеется легирующий ис-
ходный комплекс (< 2 % С + 0,8 % Мn + < 0,5 % Si).
Железо, содержащее такой комплекс, называется углеродистой сталью и является основой для получения легированных сталей.
Таким образом, основными легирующими элементами в стали являются 11 элементов: С, Мn, Si, Сr, Ni, Mo, W, V, Al, Co, Cu. Из них дешевые − С, Мn, Si, Cr, Al, Cu; дорогие − Ni, Mo, W, V, Co. По разным причинам Al, Co и Сu малоприменимы: Al − из-за склонности создавать плены; Со − дорог, легированные им стали особых преимуществ не имеют; Сu − также не имеет особой специфичности, а в жаропрочных сталях часто нежелательна.
В коррозионно-стойких и жаропрочных сталях углерод нежелательный элемент из-за склонности к дендритной ликвации и образования по границам зерен высокохромистых карбидов Сr23С6, что вызывает межкристаллитную коррозию вследствие снижения концентрации Сr в приграничных областях. Поэтому в таких сталях содержание углерода сильно ограничивают, а для связывания его в стабильные карбиды вводят Ti, V и Nb.
Вспомогательные легирующие элементы должны удовлетворять условиям
α(α-Fe) < 1; ω(δ-Fe) > 0,5.
Таких элементов 13, из них не могут быть использованы дорогие Hf, Та, Ag и Аu (см. рис. 23.105). Остаются 9 элементов − В, N, Са, Ti, Zr, Nb, Pb, Mg и La. Лантан и лантаноиды привлекательны как модификаторы и пластификаторы, но дороги.
Имеющие низкие критерии распределения и небольшую растворимость В, Са и Mg образуют сегрегации по границам растущих первичных кристаллов. Они могут быть использованы в качестве модификаторов железа, причем наиболее эффективен бор. Кроме того, бор существенно увеличивает прокаливаемость стали.
220

Азот значительно повышает прочность стали при термообработке не ухудшая вязкости разрушения и трещиностойкости1, поэтому его используют как упрочнитель в тех видах сталей, в которых углерод − нежелательная примесь.
Титан, цирконий и ниобий образуют с углеродом устойчивые карбиды, например первичные TiC, NbC, Ti(C, N) и др., и являются дополнительными упрочнителями.
Свинец в конструкционных сталях обычно не рассматривают в качестве легирующей добавки. Однако он привлекателен как элемент, улучшающий антифрикционные свойства и обрабатываемость сталей, так же как и S, P, Se, Те. Вместе с тем именно эти элементы в обычных конструкционных сталях являются вредными примесями.
Условиями, при которых элемент может быть причислен к вредным, являются
α(α-Fe) < 0,01; ω(δ-Fe) < 0,25.
Этим условиям отвечают (см. рис. 23.82) S, Р, О, N, H, Se, Те, Tl, Sc, Y, из них S и Р обязательно контролируются, а О и Н контролируются неявно.
По влиянию легирующих добавок на технологические свойства (жидкотекучесть, усадочную пористость, трещинообразование) элементы можно разделить на несколько групп.
Жидкотекучесть повышают С, Si, Сu и особенно Р, которые резко снижают ликвидус и не способствуют окислению; не влияют − Mn, Ni, Со; снижают − Сr, V, Mo, W, Al, Ti, так как способствуют пленообразованию.
Усадочную пористость сильно повышают S и Р, но содержание в сталях этих элементов строго лимитируется. Существенно повышает усадочную пористость С, однако изыскивают способы нейтрализации этого действия. Незначительно повышают усадочную пористость Ti и Мn и не влияют − Сu, Si, Ni, Al, Mo, Co, Cr, W.
Склонность к трещинам повышают S, P, О, С. Не влияют или влияют незначительно другие элементы.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 16.2.3.
221
При выборе легирующих комплексов кроме назначения стали и условий ее эксплуатации (температура, агрессивные среды, облучение и т.д.) следует учитывать и взаимную растворимость основных легирующих элементов. Из рассмотренных выше элементов большинство основных легирующих добавок в стали обладают хорошей взаимной растворимостью. Наилучшими из них являются Cr, Ni, Mo, W и V; менее эффективны как составляющие легирующих комплексов Si, Mn и Сu. На практике широко применяют высокоэффективные легирующие комплексы: Cr + Ni + Mo; Cr + Si + + Mn; Cr + Ni + Mn.
Кроме того, весьма эффективны, но дороги как комплексные легирующие добавки V и W. Поэтому при разработке конструкционных материалов их используют для создания высокопрочных и жаропрочных сталей для деталей и ответственных узлов современных машин и механизмов.
Таким образом, подводя итог рассмотрению основных подходов к выбору легирующих элементов и комплексов для создания сталей, следует отметить, что в зависимости от конкретных условий эксплуатации и требований к материалам состав сталей может быть самым разнообразным и соответственно иметь самые различные структурно-фазовые состояния.
При выборе сталей конструкционного применения основным критерием в большинстве случаев являются их механические свойства и коррозионная стойкость. К реакторным сталям предъявляются более высокие требования, вызванные спецификой условий их работы под облучением. В соответствии с этим выбор основы и легирующих добавок реакторных сталей диктуется обеспечением в первую очередь физических и механических свойств, коррозионной и радиационной стойкости на достаточном уровне в течение всего запланированного периода их эксплуатации.
23.3.2.Классификация и маркировка сталей
Втехнике используются самые разнообразные материалы: теплоустойчивые, жаропрочные и жаростойкие, коррозионно-стойкие (нержавеющие), радиационно-стойкие и т.д. Среди них по объему использования на первом месте находятся конструкционные стали
222
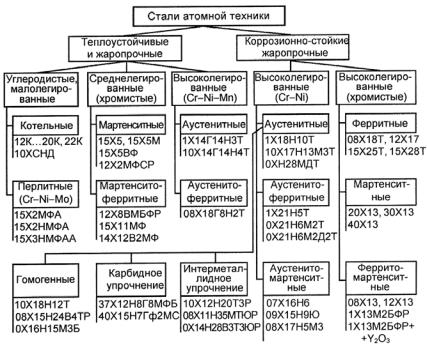
различного класса (рис. 23.106). Выбор стали для конкретного узла сооружения или механизма определяется условиями работы и требованиями, предъявляемыми к свойствам материала конструкции. Целесообразно применять наиболее дешевые и технологичные материалы, обеспечивающие гарантированную конструктивную прочность данного узла или детали.
Существуют разные способы классификации конструкционных сталей.
1. По равновесной структуре: доэвтектоидные (в структуре избыточный феррит), эвтектоидные (в структуре перлит), заэвтектоидные (в структуре − избыточные вторичные карбиды), ледебуритные (в структуре − первичные карбиды).
Рис. 23.106. Схема классификации сталей для атомной техники
2. По структуре, получаемой при охлаждении на воздухе: пер-
литные (малое содержание легирующих элементов), мартенситные
223
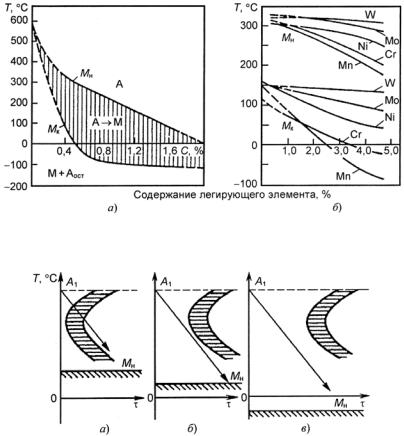
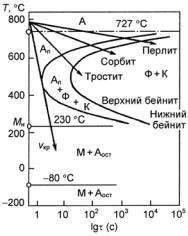
(значительное количество легирующих элементов), аустенитные (высокое содержание легирующих элементов). Получение трех классов стали обусловлено тем, что по мере увеличения содержания легирующих элементов температурная область мартенситного превращения понижается (рис. 23.107), устойчивость аустенита в перлитной области возрастает (С-образная кривая распада аустенита смещается вправо по шкале времени) (рис. 23.108). В результате при одинаковой скорости охлаждения получаем три класса сталей.
Рис. 23.107. Зависимость мартснситных точек Мн и Мк от содержания легирующих элементов: С (а) и Сr, Ni, Mn, Mo, W (б)
Рис. 23.108. Диаграмма изотермического распада аустенита для сталей перлитного (а), мартенситного (б) и аустенитного (в) классов
224

При большой концентрации ферритостабилизирующих элементов превращение γ ' α отсутствует, и получаются ферритные стали. Могут быть и смешанные по структуре классы (иногда называемые полуферритными): ферритно-перлитный, ферритномартенситный, аустенитно-ферритный, аустенитно-мартенситный.
3.По составу основы: хромистые, хромоникелевые, хромоникельмолибденовые, марганцовистые, хромоникельмарганцовистые, никелевые и т.п.
4.По химическому составу: углеродистые (нелегированные)
(Fe−Mn−Si−С), низколегированные (Fe−С + до 2,5 % М, где М − сумма легирующих элементов), среднелегированные [Fe−C + + (2,5−10) % М], высоколегированные (Fe−С + более 10 % М), сплавы на основе железа (стали) (содержание Fe ≥ 45 %).
5.По назначению: конструкционные (детали машин, механизмов, конструкций и т.д.), инструментальные (режущий, штамповый, измерительный и прочий инструмент), с особыми физическими свойствами (магнитные, с высоким электросопротивлением и т.д.).
6.По качеству: обыкновенные, качественные, высококачественные, особовысококачественные.
Классификация сталей определенным образом связана с содержанием таких вредных примесей, как сера и фосфор. Так, стали общего назначения меньше очищаются от примесей (менее 0,05 % S и 0 ,04% Р) и наиболее дешевы; в качественных сталях примесей меньше (менее 0,04 % S и 0,035 % Р); высококачественные и особовысококачественные стали дорогостоящие, содержание примесей в них ограничено ниже 0,015 % S и 0,025 % Р.
Углеродистые стали маркируются по содержанию углерода. Марка легированной стали состоит из сочетания букв и цифр, обозначающих ее химический состав.
Стали обыкновенного качества (Ст0, Ст2, Ст3, Ст4, Ст5, Ст6).
Чем больше цифра после Ст, тем больше в стали углерода, следова-
тельно, выше прочность и ниже пластичность. В зависимости от условий и степени раскисления различают1 спокойные стали (например, Ст6сп), кипящие стали (например, Ст2кп) и полуспокойные
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 18.1.2.
225
стали (например, Ст3пс). Кроме того, в зависимости от назначения, гарантированных свойств и состава эти стали делятся на три группы.
Группа А. Химический состав не уточняется, поставляется по механическим свойствам. Сталь используется в состоянии постав-
ки (Ст0, Ст1,..., Ст6).
Группа Б. Химический состав гарантирован (БСт0, БСт1,..., БСт6).
Группа В. Гарантированы химический состав и механические свойства (ВСт1, ВСт2,..., ВСт5).
Стали групп Б и В подвергают термической обработке для обеспечения требуемого уровня свойств.
Полуспокойная сталь с номерами 1−5 производится как с обычным, так и с повышенным содержанием Мn (Ст1Гпс, Ст2Гпс,..., Ст5Гпс).
Обыкновенные стали применяют в строительстве (балки, швеллеры, уголки и т.д.) и в машиностроении для изготовления малоответственных деталей (болты, гайки, прутки и т.д.), работающих при низких напряжениях и температуре.
Углеродистые качественные конструкционные стали марки-
руют двухзначными цифрами (08, 10,..., 85), которые указывают среднее содержание углерода в сотых долях процента.
Низкоуглеродистые стали (08÷25) относятся к мягким сталям, применяют в отожженном виде для изготовления деталей штамповкой, глубокой вытяжкой (прокат, проволока, листы и т.д.).
Среднеуглеродистые стали (30÷50) применяют после нормализации, улучшения (закалка от 820−880 °С и высокий отпуск при 550−650 °С) или закалки с низким отпуском для самых разнообразных деталей и узлов (различные валы, шестерни, фрикционные диски и т.д.).
Высокоуглеродистые стали применяют после закалки и отпуска для изготовления пружин, рессор, высокопрочной проволоки и т.д.
Высококачественные углеродистые стали могут быть с повышенным содержанием Мn − до 0,7−1,0 % (15Г, 20Г,..., 50Г и др.). Марганец повышает прокаливаемость стали, σв и σ02, но несколько снижает δ и ак по сравнению со сталями с нормальным содержани-
ем Мn (0,25−0,7 %).
226
Легированные конструкционные стали маркируют буквами и цифрами, указывающими примерный состав. Каждый элемент (кроме углерода и железа) обозначают буквами:
А − азот (N) (если А стоит в начале марки, то она означает, что сталь автоматная, например А40Г; в конце марки − высококачественная сталь, например 30ХГСА, или особовысококачественная сталь, например 15Х2МФАА);
Б − ниобий (Nb);
В − вольфрам (W);
Г− марганец (Мn); Д − медь (Сu);
Е − селен (Se); К − кобальт (Со);
М − молибден (Мо); П − фосфор (Р);
Р− бор (В);
С − кремний (Si); Т − титан (Ti); Ф − ванадий (V); X − хром (Сr);
Ц — цирконий (Zr);
Ч− редкоземельные металлы (РЗМ);
Ю− алюминий (А1).
Впоследние годы наблюдается тенденция использования тантала (Та) при создании реакторных сталей с быстрым спадом наведенной активности (Мо и Nb, образующие долгоживущие изотопы при облучении, заменяют на W и Та соответственно), однако буквенного обозначения для Та нет и в маркировке стали тантал обозначают химическим символом, например, 16Х12В2ФТаР.
Цифра перед маркой означает среднее содержание углерода в
сотых долях процента; цифры, идущие после букв, − примерное количество данного элемента, округленное до целого числа. При содержании менее 1,5 % элемента цифру не приводят. Так, 45ХН2МФ − конструкционная сталь с содержанием примерно 0,45 % С, около 1 % Сr, примерно 2 % Ni, до 1 % Мо и до 1 % V.
227
На практике иногда для сокращения числа знаков в обозначении несколько отступают от точного соблюдения принятой системы ГОСТ, особенно при маркировке сложнолегированных сплавов. Например: 1) при содержании углерода более 0,1 % цифры перед обозначением могут опустить (Х12М, по ГОСТ 16Х12М), а при концентрации С менее 0,1 % вместо цифр иногда пишут 0 (0Х16Н15МЗБ, по ГОСТ 07Х16Н15МЗБ); 2) при содержании менее 50 % Fe и большом количестве различных легирующих элементов все они перечисляются буквами без цифр, а цифрой указывается только содержание Ni (ХН77ТЮР, по ГОСТ 07Х20Н77Т3ЮР).
Нестандартные стали обозначают различными способами. Так, опытные марки, выплавленные на заводе «Электросталь», обозначают ЭИ (электросталь, исследовательская), ЭП (электросталь, пробная); на Челябинском заводе − ЧС (челябинская сталь) и порядковыми номерами: ЭИ-847 (0Х16Н15МЗБ), ЭП-172 (0Х16Н15МЗБР), ЭП-150 (04X15Н35М2БТЮР), ЭП-450 (Х13М2БФР), ЧС-42 (0Х20Н45М4БЧ) и т.д.
В других странах приняты другие системы маркировки сталей, которые являются гораздо менее информативными (см.
пп. 23.3.5−23.3.7, 23.4.3).
23.3.3. Влияние легирования на структуру и механические свойства сталей
Главными компонентами конструкционных сталей различного класса являются Fe, система Fe−Сr или Fe−Cr−Ni. Обязательной легирующей составляющей сталей выступает углерод, который имеет большое значение в углеродистых и малолегированных сталях и относительно меньшее − в высоколегированных жаропрочных и коррозионно-стойких сталях. Кроме того, для повышения прочности и жаропрочности стали легируют тугоплавкими металлами, такими, как Mo, Nb, Ti, V и др.
Сплавы системы Fe−С
Диаграмма состояния системы Fe−С (Fe−Fe3C) хорошо изучена и все точки этой диаграммы в представляющем для практики интерес интервале концентраций углерода (от 0 до 6,67 %) определены
228
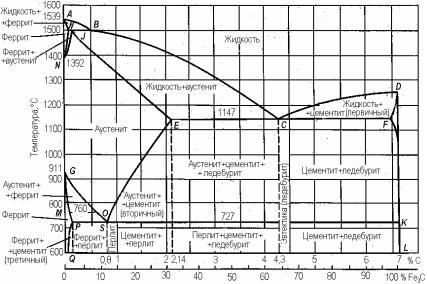
достаточно точно (рис. 23.109; табл. 23.39). Поэтому ограничимся лишь ее краткой характеристикой и определением основных видов структуры, которые можно получить, выбирая концентрацию углерода и вид термообработки.
Рис. 23.109. Равновесная диаграмма состояния системы Fe С (Fe Fe3C)
|
|
|
|
|
|
|
|
Таблица 23.39 |
|
|
|
|
|
Точки диаграммы системы Fe С |
|
|
|||
|
|
|
|
|
|
|
|
||
Обоз- |
|
|
Концентрация С, % |
Обоз- |
|
Концентрация С, % |
|||
наче- |
Т, С |
(в скобках атомная |
наче- |
Т, С |
(в скобках атомная |
|
|||
ние |
концентрация, %) |
ние |
концентрация, %) |
|
|||||
точки |
|
|
|
|
|
точки |
|
|
|
А |
1539 |
± 3 |
0(0) |
|
|
D |
Точно не |
6,67 (24,94) |
|
В |
1498 |
± 3 |
0,50 |
± 0,05 (2,28) |
|
установлена |
|
|
|
|
|
|
|
||||||
Н |
1498 |
±3 |
0,10 |
± 0,05 |
(0,46) |
G |
910 ± 2 |
0(0) |
|
J |
1498 |
±3 |
0,16 |
± 0,05 |
(0,74) |
Р |
723 ± 5 |
0,022 ± 0,005 (0,10) |
|
N |
1392 |
± 3 |
0(0) |
|
|
S |
723 ± 5 |
0,80 ± 0,025 (3,61) |
|
Е |
1146 |
± 2 |
2,14 |
± 0,05 |
(9,23) |
К |
723 ± 5 |
6,67 (24,94) |
|
С |
1146 |
± 2 |
4,30 |
± 0,05 |
(17,28) |
Q |
20 500 |
< 0,02 (< 0,09) |
|
F |
1146 |
± 2 |
6,67 (24,94) |
L |
20 500 |
6,67 (24,94) |
|
||
229
Система Fe−С характеризуется наличием следующих реакций:
перитектической (при 1498 °С): δ (0,46 % С) + Ж (2,28 % С) ' ' γ (0,74 % С) (здесь приведено атомное содержание С, %); эвтектической (при 1146 °С): Ж ' γ + Fe3C (С); эвтектоидной (при
723 °С): γ ' α +Fe3C (С).
Растворимость углерода в α-Fe при равновесии с Fe3C в диапа-
зоне 300−700 °С описывается выражениями: |
|
для атомного содержания, % |
|
lgC = −0,92 − 2121/Т, |
(23.33) |
для массового содержания, % |
|
lgC = 0,41 − 2121/Т. |
(23.34) |
Рассмотрим основные структуры системы Fe−С. |
|
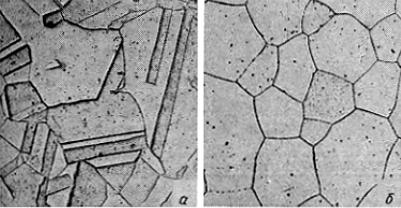
Феррит − твердый раствор углерода (и других элементов) в α-Fe (обозначают α или Ф) (23.110, а). Различают низкотемпературный α-феррит или просто феррит с растворимостью углерода до 0,02 % (точка Q на рис. 23.109) и высокотемпературный δ-феррит с растворимостью углерода 0,1 % (точка Н).
а) |
|
б) |
|
|
|
Рис. 23.110. Типичные микрофотографии структуры сплавов системы Fe−С: а − феррит; б − аустенит (×400)
Главным фактором, определяющим возможность растворения путем внедрения, является размерный фактор, т.е. определенное
230
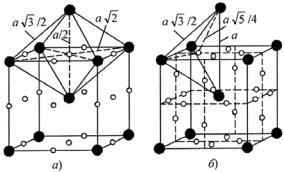
соотношение между размером пустот в кристаллической решетке и размером внедряющегося атома. В ОЦК решетке α-Fe имеются три октаэдрические пустоты в серединах граней (1/2×6) и еще три октаэдрические пустоты (1/4×12) в серединах ребер, куда можно вписать шар радиусом октаэдрической пустоты всего rо.п. ≈ 0,154rFe
(рис. 23.111, а).
Октаэдрические пустоты в середине ребер элементарной ячейки эквивалентны пустотам в центре граней. Тетраэдрические пустоты в ОЦК решетке окружены четырьмя атомами: двумя на ребре куба и двумя в центре объема смежных ячеек (рис. 23.111, б).
Рис. 23.111. Положение октаэдрических (а) и тетраэлрических (б) пустот в ОЦК решетке ({ − пустота; z − атом металла)
Тетраэдрическая пустота в ОЦК решетке больше, чем октаэдрическая, − в нее можно вписать шар радиусом тетраэдрической пустоты rт.п. ≈ 0,291rFe. В элементарной ячейке таких пустот 12 (2×6). Таким образом, на каждый атом железа в ОЦК решетке (в элементарной ячейке два атома Fe) приходится три октаэдрические и шесть тетраэдрических пустот.
Если внедряется атом с размером, превышающим размеры пустоты, то он должен раздвинуть соседние атомы. При этом вокруг тетраэдрической пустоты сразу смещаются четыре атома в направлениях довольно плотной упаковки, что вызывает значительное перекрытие взаимноотталкивающихся электронных облаков. Вокруг же октаэдрической пустоты из-за сильной его неравноосности смещаются всего два атома вдоль ребра куба, т.е. вдоль направле-
231
ния <100> с малой плотностью упаковки атомов. Это придает решетке тетрагональность. Поэтому примесным атомам внедрения в ОЦК решетках энергетически более выгодным может оказаться размещение в меньших по размерам октаэдрических пустотах, однако все будет определяться отношением размера атома легирующего элемента (примеси) к атому металла. Так, атомы углерода в ОЦК решетке α-Fe размещаются в октаэдрических пустотах, в то время как в ОЦК решетке Мо занимают тетраэдрические пустоты.
Диаметр атома углерода rС = 0,077 нм, а железа rFe = 0,127 нм, следовательно, в ОЦК решетке α-Fe rо.п ≈ 0,020 нм, rт.п ≈ 0,037 нм. Такие объемы пор недостаточны для помещения в него атома (иона) углерода. Поэтому даже чисто геометрические соображения подсказывают, что α-Fe не растворяет углерод. Однако наблюдаемая незначительная растворимость (менее 0,02 % С) обусловлена, по-видимому, тем, что в реальной решетке железа имеются дефекты, особенно многочисленные по границам зерен, вакансии, дислокации и т.д.
Аустенит − твердый раствор углерода (и других элементов) в γ-Fe (обозначают γ или А) (рис. 23.110, б). Предельная растворимость углерода в γ-Fe 2,14 % (см. рис. 23.109, точка Е).
В элементарной ГЦК решетке γ-Fe имеются восемь тетраэдрических пустот размером rт.п. ≈ 0,22rFe, расположенных на пространственных диагоналях куба на расстоянии одной четверти диагонали от вершины ячейки (рис. 23.112, а), и четыре октаэдрические пустоты [одна − в центре куба, три (1/4×12) – посередине ребер] (рис. 23.112, б) размером rо.п ≈ 0,41rFe. Очевидно, что по объему вписываемых шаров и геометрии образования октаэдрические пустоты в центре и на ребрах куба эквиваленты. Следовательно, на каждый атом железа в ГЦК решетке (в элементарной ячейке четыре атома Fe) приходятся две тетраэдрические и одна октаэдрическая пустоты. Диаметр вписываемых в решетку γ-Fe октаэдрических пустот (rт.п. ≈ 0,028 нм, rо.п. ≈ 0,052 нм) значительно превышает диаметры пустот в α-Fe. Это и предопределило большую растворимость углерода в γ-Fe по сравнению с α-Fe (см.
рис. 23.109).
232
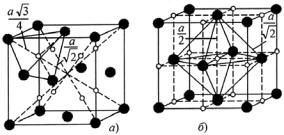
Рис. 23.112. Положение октаэдрических (а) и тетраэдрических (б) пустот в ГЦК решетке ({ − пустота; z − атом металла)
Отдельный вопрос: в каком виде растворяется углерод в железе (и в других металлах)? Например, даже в октаэдрическую пустоту γ-Fe он может поместиться лишь раздвигая атомы железа (действительно, наблюдается почти линейное увеличение параметра решетки аустенита с изменением концентрации углерода от 0 до 2 %). Другой путь − уменьшение размера самого атома углерода. Многочисленные данные свидетельствуют о том, что при растворении углерод отдает свои валентные электроны, т.е. превращается в положительный ион С4+. Есть и предположения, допускающие перекрытие электронных орбит железа и углерода.
Однако коэффициент ионизации атомов углерода в твердом растворе нельзя считать точно установленным.
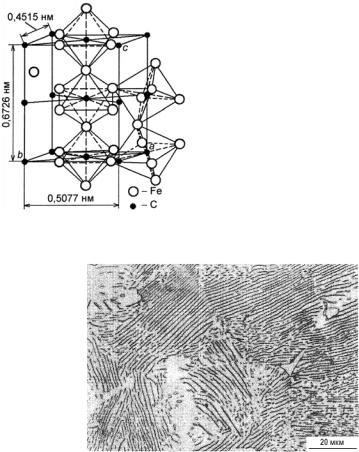
Цементит − химическое соединение Fe3C − карбид железа (обозначают К или Ц), содержит 6,67 % (атомное содержание около 25 %) углерода (точка L на рис. 23.109). Цементит имеет очень сложную орторомбическую кристаллическую решетку с плотной упаковкой атомов (а = 0,5090 нм, b = 0,6748 нм, с = 0,4523 нм) (рис. 23.113). Температура плавления цементита и, следовательно, кривая ликвидус CD точно не определена в связи с возможностью его распада (Fe3C → Fe + графит) при нагреве еще до достижения температуры плавления. По некоторым расчетным данным температура плавления цементита оценивается равной 1200−1550 °С. Возможно, цементит испытывает разложение при 1250−1300 °С. К характерным особенностям цементита относится очень высокая твердость (НV ≈ 1000) и очень малая пластичность.
233
Кроме карбида Fe3C в системе возможно образование метастабильных карбидов: ε-карбида (Fe2C) с гексагональной структурой, выделяющегося при отпуске закаленной стали (150−200 °С), и карбида FeC. Карбид Fe7C3 с гексагональной структурой типа Сr7С3 получен только при высоких давлениях.
Перлит (а также сорбит и тро-
стит) − эвтектоидная смесь феррита и цементита, которые обознача-
ют П, С, Т (рис. 23.114).
Рис. 23.113. Кристаллическая структура цементита
Рис. 23.114. Типичный вид структуры перлита (грубопластинчатый перлит): отчетливо видны чередующиеся участки цементита (темные) и феррита (светлые). Эвтектоидная сталь после термообработки по режиму: 985 °С, 35 мин + 675 °С, 30 мин; охлаждение на воздухе
В эвтектоидной стали при распаде аустенита (А → Фр + Ц) в области температур от Ac1 примерно до 680 °С (переохлаждение
Т ≤ 40 °С) расстояние между пластинками в колониях составляет от 0,5 до 1 мкм. Это − перлит.
234
Винтервале 680−600 °С ( Т ≤ 100 °С) межпластиночное расстояние 0,2−0,4 мкм. Это − сорбит.
Винтервале 600−500 °С ( Т > 100 °С) очень тонкая эвтектоидная смесь с межпластиночным расстоянием ≤ 0,1 мкм. Это − тро-
стит.
Зависимость межпластиночного расстояния (l, нм) от степени
переохлаждения ( Т) эвтектоидной стали (0,8% С) можно представить как
lgl = 3 − 9 10-3 Т. |
(23.35) |
При непрерывном охлаждении углеродистой эвтектоидной стали указанные структуры образуются в следующих условиях
(рис. 23.115):
перлит − при охлаждении с печью со скоростью несколько градусов в минуту;
сорбит − при охлаждении на воздухе со скоростью несколько десятков градусов в минуту;
тростит − при охлаждении в масле со скоростью несколько десятков градусов в секунду.
Рис. 23.115. С-диаграмма
смартенситными точками для стали
ссодержанием углерода 0,8 %:
А − устойчивый аустенит; Ап − переохлажденный аустенит;
Аост − остаточный аустенит;
М− мартенсит; Ф − феррит;
К− карбид (Fe3С)
Перлитное превращение в эвтектоидной стали протекает при диффузионном распаде аустенита в интервале от Ac1 до темпера-
тур вблизи изгиба («носа») С-образной кривой (см. рис. 23.115).
235

Ниже изгиба в интервале примерно 500−250 °С ( Т > 200 °С) характер превращения изменяется и в результате изотермического распада образуются уже не перлитоподобные структуры, а промежуточная (между перлитным и мартенситным превращениями) структура, которая представляет собой игольчатый тростит (бей-
нит).
Бейнит (различают верхний Т > 350°С и нижний Т < 350°С бейнит) представляет собой также ферритно-цементитную смесь, но в отличие от пластинчатого перлита (сорбита, тростита) его структура характеризуется перистым (цементит в виде изолированных узких частиц) или игольчатым (цементит очень тонкий и ориентированный) видом.
При еще больших скоростях (v > vкр) охлаждения аустенита, когда Т ≥ 500°С и диффузионное перераспределение компонентов стали не успевает осуществляться, аустенит не распадается, а испытывает сдвиговое аллотропическое превращение без изменения состава, так называемое мартенситное превращение (см.
рис. 23.115).
Мартенсит − пересыщенный твердый раствор углерода в α-Fe, который обозначают α′ или М (рис. 23.116). Превращение γ ' α′ протекает бездиффузионно. Предельная концентрация углерода в мартенсите может достигать 2,14 %.
20 мкм
Рис. 23.116. Типичный вид структуры мартенсита (сталь 30ХН5М), полученный после выдержки при температуре 1100 °С в течение 4 ч и охлаждения на воздухе
236
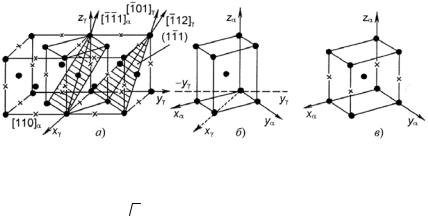
Решетка α′ близка к решетке α-Fe, но представляет собой объемно центрированный тетраэдр (ОЦТ). В структуре мартенсита атомы углерода занимают октаэдрические поры в решетке γ-Fe (в твердых растворах внедрения углерода в α-Fe атомы С занимают тетраэдрические поры) и сильно ее искажают (рис. 23.117). Следовательно, чем больше углерода в мартенсите, тем больше тетрагональность решетки, т.е. отношение осей с/а > 1. Практически изменение с/а от концентрации углерода (С, %) в мартенсите подчиняется закону
с/а = 1 + 0,046С. |
(23.36) |
Рис. 23.117. Деформация Бейна при перестройке решетки ГЦК ' ОЦК: а − сдвоенная обычная элементарная ячейка в ГЦК решетке (атомы С находятся в октаэдрических междоузлиях); б − выделенная ОЦТ решетка
с отношением с/а =  2 ≈ 1,41; в − ОЦТ решетка мартенсита (атомы углерода занимают только октаэдрические междоузлия по оси с || [001]), возникающая
2 ≈ 1,41; в − ОЦТ решетка мартенсита (атомы углерода занимают только октаэдрические междоузлия по оси с || [001]), возникающая
врезультате деформации решетки, показанной на (б): сжатия по оси с
ирастяжения по осям а и b до с/а ≈ 1,08
Кристаллы мартенсита ориентационно связаны с решеткой аустенита, из которого они и образуются путем небольшого коллективного сдвига атомов на расстояния, не превышающие межатомные, поэтому скорость их роста в разных кристаллографических направлениях неодинакова. По этой же причине кристаллы α′ имеют форму пластин (на самом деле − это вытянутые линзообразные выделения, однако на шлифах они выглядят как пластины или тонкие иглы).
237

С помощью дифракционных методов1 удается найти близкие или почти совпадающие кристаллографические направления плоскостей решеток аустенита и формирующегося мартенсита. Так, исходя из рис. 23.117 ориентационную связь между решетками γ и α′
можно записать в виде |
|
(001)α′ || (001)γ; [110]α′ || [100]γ. |
(23.37) |
Такое ориентационное соотношение наблюдалось в очень тонких пленках (фольгах) и известно как соотношение Бейна.
В массивных образцах стали с содержанием 0,5−1,4 % С мартенситные пластины находятся в следующем ориентационном соотношении с аустенитом, известном как соотношение Курдю-
мова−Закса: |
|
|
(101) )α′ || (1 11)γ; |
[11 1]α′ || [ 101]γ. |
(23.38) |
В сплаве Fe−30 % Ni установлено соотношение вида |
|
|
(101)α′ || (1 11)γ; |
[10 1]α′ || [ 112]γ. |
(23.39) |
Это соотношение, известное как соотношение Нишиямы, как и соотношение (23.37), связано с деформацией Бейна (см. рис. 23.117) и отличается от соотношения (23.38) не очень сильно.
В целом совпадающие направления плоскостей аустенита и выделяющегося из него мартенсита зависят от многих факторов, но, в первую очередь, от состава аустенита и деформации.
Мартенситное превращение происходит в определенном интервале температур: оно начинается при охлаждении до температуры
Мн (температура начала превращения) и заканчивается при температуре Мк (температура конца превращения) (см. рис. 23.115). По-
ложения точек Мн и Мк не зависят от скорости охлаждения и обусловлены химическим составом аустенита: чем больше в аустените углерода, тем ниже Мн и Мк (см. рис. 23.107, а). Все легирующие элементы, кроме Со и Аl, также понижают мартенситные точки: Мn и Сr сильно, Мо и W − незначительно, a Ni занимает промежуточное положение (рис. 23.107, б). Отсюда следует, что выбором состава легирующих элементов можно до такого уровня понизить температуру Мн, что при комнатной температуре удается зафиксировать аустенитную структуру. Этот принцип и используется для получения аустенитных сталей.
1 Физическое материаловедение. Т. 1. − М.: МИФИ, 2007. П. 1.8.
238

Мартенситное превращение часто не протекает до конца и в структуре стали при комнатной температуре имеется остаточный аустенит. Поэтому в закаленных сталях, имеющих точку Мк ниже 20 °С, всегда присутствует остаточный аустенит. Например, в сплавах Fe−С, не содержащих других легирующих элементов, при концентрации С менее 0,6 % весь аустенит превращается в мартенсит, а при концентрации С более 0,6 % часть аустенита остается, причем в стали с 0,6−1,0 % С количество остаточного аустенита не превышает 10 %, а в стали с 1,3−1,5 % С оно достигает 30−50 %. Если в сталях содержатся другие легирующие элементы, понижающие мартенситные точки (например, как в стали 10X18Н8), количество остаточного аустенита может достигать 80−100 %. Типичная структура аустенитно-мартенситной стали приведена на рис. 23.118, где в микроструктуре закаленной стали в виде светлых полей между темными иглами мартенсита присутствует остаточный аустенит.
Рис. 23.118. Микроструктура высокоуглеродистой стали после выдержки при температуре 1100 °С в течение 30 мин и охлаждения (закалки) в ледяной соленой воде.
Превращение не закончено: между выделениями пластинчатого мартенсита (темный) находятся большие области остаточного аустенита (светлый)
20 мкм
Характерной особенностью мартенсита является его высокая твердость и прочность. Например, твердость мартенсита с содержанием 0,6−0,8 % С НV ≈ 960 МПа, что в 6 раз выше твердости
239
феррита, а σв ≈ 2600÷2800 МПа, что на порядок превышает предел прочности феррита. Вместе с тем мартенсит обладает низкой пластичностью, поэтому при высоком содержании углерода (более 0,35−0,4 %) мартенситная сталь разрушается хрупко.
Таблица 23.40
Процессы, идущие при нагреве в закаленной стали
Температура, °С
Ниже 150
150−300
300−400
400−500
500−680
727 ( Ac1 )
Процесс М → Мотп + ε-карбид; уменьшается тетрагональность, из мар-
тенсита закалки выделяется ε-карбид железа (FeхC, вероятно, по составу близок к Fe2C), формируется мартенсит отпуска (Мотп) с несколько меньшей концентрацией углерода. Выделяющиеся карбидные частицы имеют форму тонких пластинок толщиной всего в несколько атомных слоев и длиной в несколько десятков нанометров.
1. Выделяются ε-карбиды из М, происходит укрупнение карбидов за счет притока атомов С. Частицы карбидов когерентны с матрицей. Мартенсит еще больше обедняется углеродом. Образующуюся структуру называют отпущенным мартенситом. На верхней границе температурного интервала отношение с/а → 1.
2. Распадается остаточный аустснит Аост → Мотп + ε, происходит, по-существу, бейнитное превращение.
1. Завершается выделение углерода из мартенсита, происходит нарушение когерентности и обособление решеток феррита и карбидов. Одновременно протекает карбидное превращение, которое завершается образованием цементита (ε-FeхC → Fe3C) и сфероидизацией карбидов.
2. Происходит снятие (релаксация) внутренних напряжений, возникающих при закалке в результате мартенситного превращения. Формирующуюся в результате структуру называют троститом отпуска (тонкая Ф−Ц-смесь).
Коагуляция и сфероидизация карбидов, d 10 нм. Продолжается коагуляция и сфероидизация карбидов,
d 100 нм.
Образуется грубая Ф−Ц структура (диаметр карбидных частиц d 300 нм), называемая зернистым перлитом.
Как и все пересыщенные твердые растворы, мартенсит неустойчив (метастабилен) и распадается даже при небольшом нагреве
240
(Т < 200 °С). Остаточный аустенит также метастабилен, его распад идет при Т ≥ 200 °С. При нагреве (отпуске) закаленной стали в интервале температур до Ac1 происходит распад М и Аост с образова-
нием при полном их распаде ферритно-цементитной смеси, т.е. М + Аост отпуск→Ф + Ц. При этом с ростом температуры идут процессы, приведенные в табл. 23.40.
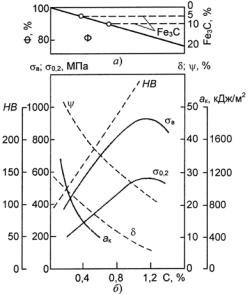
После очень меделенного охлаждения структура стали состоит из двух фаз − феррита и цементита (см. рис. 23.109). Количество цементита возрастает, а феррита уменьшается прорпорционально содержанию углерода (рис. 23.119, а). С увеличением содержания углерода возрастают твердость, пределы прочности и текучести и уменьшаются пластичность и ударная вязкость (рис. 23.119, б). Кроме того, повышение концентрации углерода приводит к возрастанию хладноломкости стали и расширяет переходный интервал от вязкого к хрупкому состоянию (см. рис. 23.119).
Рис. 23.119. Влияние концентрации углерода на количество присутствующих в стали фаз (а) и на механические свойства стали (б)
241
Влияние углерода на структуру Fe−Сr и Fe−Cr−Ni сталей
Концентрация углерода в хромистом феррите (α-твердом растворе Сr в Fe) невелика − примерно такая же, как и в α-Fe; в γ-Fe растворимость достигает значительной величины (см. рис. 23.109). Однако в хромоникелевом γ-твердом растворе (аустените) растворимость углерода существенно снижается (рис. 23.120); особенно мала растворимость углерода при температуре ниже 600−700 °С − по данным последних работ ее можно принять равной 0,01 %.
Рис. 23.120. Растворимость углерода в хромоникелевой стали с 18 % Сr и 8 % Ni
Важное значение углерода для металлических сплавов состоит в том, что с большинством металлов он образует карбиды − химические соединения, обладающие в той или иной степени металлическими свойствами. Количество карбидов, а также их дисперсность поддаются регулированию путем изменения состава сплава и термической обработки, что существенно влияет на механические свойства. На основании этого широко применяется так называемое карбидное упрочнение сталей и сплавов. В углеродистых сталях, содержащих углерода более 0,02 %, появляется карбидная фаза Fe3C (цементит) со сложной тетрагональной кристаллической ре-
242
шеткой, элементарная ячейка которой включает 16 атомов. Карбид железа способен образовывать твердые растворы, так как атомы С могут частично замещаться атомами неметаллов: N, О (оксикарбонитриды, оксикарбиды); в сложнолегированных сталях атомы железа в карбиде Fe3C частично замещаются атомами Сr, Мо, W и другими легирующими элементами. В последнем случае легированный карбид в общем виде обозначают формулой М3С и называют карбидом цементитного типа. В хромистых сталях карбид цементитного типа может включать до 20 % атомов Сr [карбид (Fe, Cr)3C]. Он образуется, как правило, в сталях с содержанием Сr не выше 2 % и называется легированным цементитом. При повышенном содержании Сr (примерно от 2 до 10 %) образуется специальный карбид (Сr, Fe)7C3. При еще больших содержаниях Сr (бо-
лее 10 %) образуется карбид (Cr, Fe)23C6 (рис. 23.121 и 23.122, а).
Рис. 23.121. Политермический разрез системы Fe−Cr при содержании 0,1 % С: Кс − карбид цементитного типа (Fe, Cr)3C, растворяющий до 20 % хрома; К1 − карбид с ГЦК решеткой (Cr, Fe)23C6 (в равновесии с α-твердым раствором, содержащим 6,5 % Сr, карбид имеет состав 34,4 % Fe +60,1% Cr + 5,5% С); К2 − карбид с ГПУ кристаллической решеткой (Cr, Fe)7C3 (в равновесии
сα-твердым раствором, содержащим 6,5% Сr, карбид имеет состав 27,3% Fe +
+63,8% Сr + 8,9% С, а с α-твердым раствором, содержащим 0,75 %Сr,
состав карбида 53,8% Fe + 37,6% Cr + 8,8% С)
243
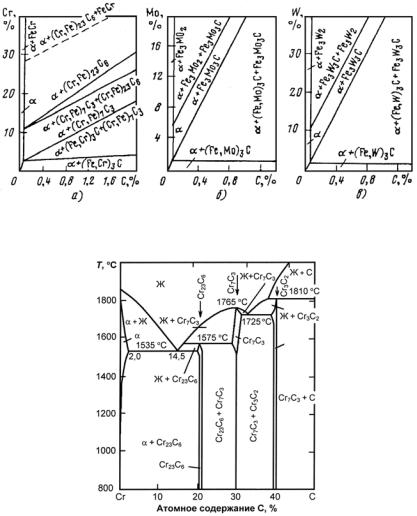
Рис. 23.122. Изотермические сечения (при 20 °С) диаграмм состояния:
а − Fe−C−Cr; б − Fe−C−Mo; в − Fe−C−W
Рис. 23.123. Диаграмма состояния системы Сr−С
Диаграмма состояния системы Сr−С (рис. 23.123) характеризуется ограниченной растворимостью углерода в хроме (в твердом состоянии). Максимальная растворимость достигает порядка 0,4 % при эвтектической температуре 1535 °С и резко уменьшается с по-
244
нижением температуры − при 900 °С она не превышает 0,003 %. В диапазоне 900−1500 °С растворимость углерода в твердом Сr описывается выражением lgC = 3,55 − 6060/T, где С − атомная концентрация углерода, %; Т − температура, К.
Надежно установлено существование трех карбидов хрома: Сr23С6 со сложной ГЦК решеткой с 116 атомами в элементарной ячейке (а = 1,065 нм); Сr7С3 с гексагональной кристаллической решеткой с 80 атомами в элементарной ячейке (а = 1,401 нм, с =
= 0,452 нм) и Сr3С2 с орторомбической (а =1,147 нм, b = 0,554 нм,
с= 0,283 нм) решеткой. Соединение Сr7С3 плавится конгруэнтно при 1765 °С, а карбиды Сr23С6 и Сr3С2 образуются по перитектическим реакциям соответственно при 1775 и 1810 °С. Карбид Сr23С6 и
α-твердый раствор (см. рис. 23.123) образуют эвтектику при
1535 °С, а Сr7С3 и Сr3С2 − при 1725 °С.
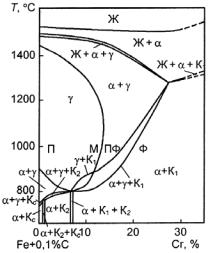
Из рис. 23.121 следует, что введение 0,1 % С в систему Fe−Сr, кроме образования карбидных фаз, приводит к расширению области существования γ-фазы до 14% Сr, а двухфазной (α + γ)-области примерно до 25 % Сr. Хорошо известно, что при содержании 0,4 % С однофазная γ-область расширяется до 18 % Сr, а двухфазная − до 28 % Сr. Таким образом, введение углерода в железохромистые сплавы расширяет области составов мартенситных и полуферритных (двухили трехфазных, например, аустенитно-фер- ритных, ферритно-мартенситных и др.) сталей и увеличивает возможность изменения их свойств путем термической обработки.
Вхромоникелевом аустените практически весь углерод идет на образование карбидных фаз. Благодаря высокому содержанию Сr (около 18 %) и небольшому количеству С (обычно примерно 0,1 %) карбидные фазы имеют структуру карбидов типа М23С6.
Всталях, содержащих значительное количество углерода (до 0,5 %), легирование хромом способствует увеличению температу-
ры эвтектоидного превращения (точка Ac1 ) − при содержании
12−14 % Сr она равна 820−850 °С. Одновременно в эвтектоиде (перлите) уменьшается содержание углерода. В стали с 12−14 % Сr перлит содержит до 4 % С.
245
246
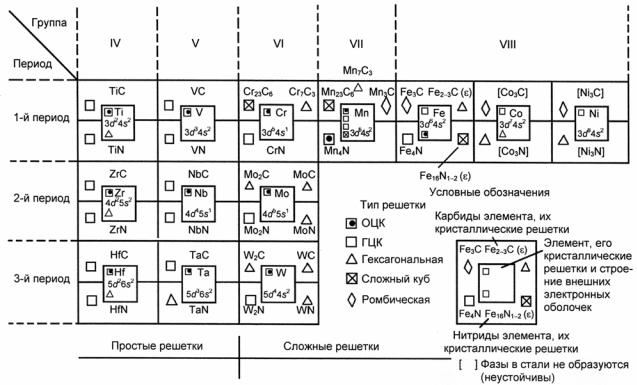
Рис. 23.124. Структура d-переходных металлов, а также карбидов и нитридов, образуемых ими в сталях (М.И. Гольдштейн)
При легировании хромистых и хромоникелевых сталей другими карбидообразующими элементами (Ti, Nb, V, Mo, W и др.) кроме сложных карбидов типа М23С6 и М7С3 могут также появляться карбиды типа МС (TiC, VC и др.).
В сталях устойчивые карбиды (и нитриды) образуются только металлами, расположенными в Периодической системе элементов левее Fe (рис. 23.124). Эти металлы относятся к элементам переходных групп и имеют недостроенную d-электронную полосу, заполненную меньше, чем у Fe, причем чем левее расположены элементы, тем менее достроены их d-оболочки и тем более устойчивы образуемые ими карбиды и нитриды. Это означает, например, что при наличии в стали Сr и V, прежде всего, следует ожидать присутствия карбидов ванадия (в равновесных условиях). Полагают, что в процессе карбидообразования углерод отдает свои электроны на заполнение d-электронной полосы атомам металла, тогда как у металла валентные электроны образуют металлическую связь, обусловливающую металлические свойства карбидов. Однако в сложнолегированных сталях карбиды (и нитриды) отдельных металлов наблюдаются не всегда. Большинство карбидов растворяет другие элементы, образуя ограниченные твердые растворы.
При введении вольфрама и молибдена в сталь в количестве, превышающем предел насыщения цементита этими элементами, образуются сложные карбиды Fe3Mo3C (Fe2Mo2C) и Fe3W3C (Fe2W2C) (см. рис. 23.122, б и в).
Наиболее распространенный в жаропрочных хромистых и хромоникелевых сталях карбид Сr23С6 растворяет в себе другие легирующие элементы в довольно широком интервале концентраций и поэтому часто имеет переменный состав (Fe, Cr, Mo, W, V)23C6. Количество дополнительных легирующих элементов и Сr, входящих в состав карбида типа М23С6, может изменяться в зависимости от условий термической обработки и длительности работы стальных деталей при высокой температуре.
Такие металлы, как Ti и Nb, в карбидах типа М23С6 не растворяются. Карбиды переходных металлов − Мо2С, VC, NbC, ZrC, TiC и др. − имеют структуру фаз внедрения, для которых характерно образование металлическими атомами простой решетки (но отличной по типу от решетки чистого металла), чаще всего кубической гра-
247
нецентрированной или плотноупакованной гексагональной1 (см. рис. 23.124). При этом исходя из геометрических соображений принимают, что атомы углерода размещаются либо в октаэдрических, либо в тетраэдрических пустотах. Поэтому критерием воз-
можности образования фазы внедрения считают отношение атом-
ного радиуса углерода к атомному радиусу металла: rC/rMe < 0,59. При большем значении этого отношения образование фаз внедрения мало вероятно и соединение имеет сложную кристаллическую решетку.
Большинство карбидов, кристаллизующихся по типу фаз внедрения, растворимы друг в друге. Например, неограниченную растворимость имеют карбиды TiC−VC; NbC−TiC и др. В итоге образуются карбиды типа (Ti, V)C, (Ti, Nb)C и т.п.
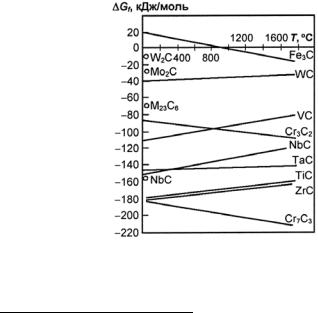
Фазы внедрения в отличие от хромистых карбидов и других упрочняющихся фаз стали обладают более высокой термической стойкостью, о чем можно судить по их температуре плавления и свободной энергии образования (рис. 23.125 и 23.126; табл. 23.41).
Рис. 23.125. Свободная энергия образования карбидов в зависимости от температуры
1 Физическое материаловедение. Т. 1. − М.: МИФИ, 2007. П. 3.3.3.
248
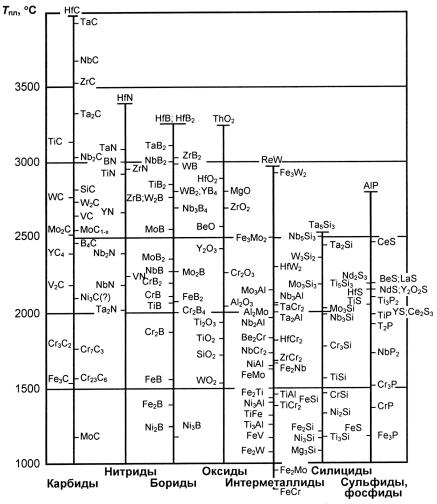
Рис. 23.126. Температура плавления некоторых упрочняющих фаз, встречающихся в конструкционных материалах
Таким образом, карбиды, образующиеся в легированных сталях, можно разделить на две группы:
1) карбиды, имеющие сложные кристаллические решетки [типа М3С, М7С3, М23С6 (М4С)]. Эти карбиды сравнительно легко раство-
249
ряются в аустените при нагреве (например, при температурах аустенизации);
2) карбиды, относящиеся к фазам внедрения [типа МС, имеющие ГЦК (VC, TiC, NbC, TaC, ZrC) или гексагональные (WC, МоС) решетки]. В отличие от первой группы фазы внедрения в реальных условиях нагрева стали почти не растворяются в аустените.
Таблица 23.41
Тип, параметры решетки, упругие характеристики и микротвердость некоторых упрочняющих фаз
|
Тип и параметры |
|
Е, |
G, |
Коэффи- |
Нμ, |
Фаза |
Тпл, °С |
циент Пу- |
||||
|
решетки, нм |
|
ГПа |
ГПа |
ассона ν |
ГПа |
|
|
|
|
|
|
|
|
|
Карбиды |
|
|
|
|
Fe3C |
Орторомбическая; |
1250 |
− |
− |
− |
8 |
|
а = 0,3573; b = 0,6748; |
(1540) |
|
|
|
|
|
с = 0,4523 |
(1650) |
|
|
|
|
Cr 23C6 |
Сложная ГЦК; а = 1,065 |
1575 (темпера- |
− |
− |
− |
10 |
|
|
тура распада) |
|
|
|
|
|
|
(1567) |
|
|
|
|
Cr7C3 |
Гексагональная; а = 1,401; |
1765 (1665) |
− |
− |
− |
15 |
|
с = 0,4525 |
|
|
|
|
|
VC |
ГЦК типа NaCl; |
2648 (2830) |
430 |
160 |
0,32 |
23 |
|
а = 0,4131 ÷ 0,4166 |
|
(320) |
|
|
|
WC |
Гексагональная; |
2676 (темпера- |
640 |
270 |
0,18 |
21 |
|
а = 0,2906; с = 0,2839 |
тура распада) |
(720) |
|
|
|
|
|
(2770) |
|
|
|
|
TiC |
ГЦК типа NaCl; |
3067 (3140) |
460 |
190 |
0,17 |
28 |
|
а = 0,4313 ÷ 0,4331 |
|
(500) |
|
|
|
ZrC |
ГЦК типа NaCl; |
3540 (3530) |
390 |
165 |
0,19 |
26 |
|
а = 0,4693 |
|
(445) |
|
|
|
NbC |
ГЦК типа NaCl; |
3613 |
505 |
205 |
0,22 |
17 |
|
а = 0,4471 |
(3678) (3480) |
(580) |
|
|
|
TaC |
ГЦК типа NaCl; |
3985 |
515 |
245 |
0,21 |
18 |
|
а = 0,4421 ÷ 0,4456 |
(3920) (3880) |
|
|
|
|
HfC |
ГЦК типа NaCl; |
3930 (3970) |
440 |
− |
− |
− |
|
а = 0,4268 ÷ 0,4619 |
|
|
|
|
|
MoC |
Гексагональная типа WC |
1190 (темпера- |
200 |
− |
− |
− |
|
|
тура распада) |
|
|
|
|
|
|
(2545) |
|
|
|
|
250
Продолжение табл. 23.41
Фаза |
Тип и параметры |
Тпл, °С |
Е, |
G, |
Коэффи- |
Нμ, |
|
решетки, нм |
|
ГПа |
Гпа |
циент |
Гпа |
|
|
|
|
|
Пуассона |
|
|
|
|
|
|
ν |
|
Mo2C |
α-Ромбическая; |
− |
− |
− |
− |
15 |
|
a = 0,4720; b = 0,6004; |
|
|
|
|
|
|
с = 0,4734 |
|
|
|
|
|
|
β-Гексагональная; |
2522 (2410) |
− |
− |
− |
− |
|
а = 0,3008 ÷ 0,3014; |
|
|
|
|
|
|
b = 0,4776 ÷ 0,4741 |
|
|
|
|
|
|
|
Нитриды |
|
|
|
|
|
|
|
|
|
|
|
VN |
ГЦК типа NaCl; |
2245 |
− |
− |
− |
15 |
|
а = 0,4140 ÷ 0,4066 |
(2356) (2050) |
|
|
|
|
NbN |
ГЦК типа NaCl; |
2178 |
505 |
− |
− |
14 |
|
а = 0,4373 ÷ 0,4393 |
(2292) (2050) |
|
|
|
|
TiN |
ГЦК типа NaCl; |
2930 (2950) |
440 |
− |
− |
19 |
|
а = 0,4220 ÷ 0.4243 |
|
(255) |
|
|
|
ZrN |
ГЦК типа NaCl; |
2960 (2980) |
400 |
− |
− |
15 |
|
а = 0,4572 ÷ 0,4576 |
|
(395) |
|
|
|
TaN |
Гексагональная типа |
2085 |
470 |
− |
− |
11 |
|
CoSn; |
(2090) (3090) |
|
|
|
|
|
а = 0,5181; с = 0,2905 |
|
|
|
|
|
HfN |
ГЦК типа NaCl; |
3387 |
530 |
− |
− |
− |
|
а = 0,4524 ÷ 0,4515 |
|
|
|
|
|
|
|
Бориды |
|
|
|
|
|
|
|
|
|
|
|
CrB |
Орторомбическая; |
2100 |
− |
− |
− |
− |
|
а = 1,476; b = 0,7428; |
|
|
|
|
|
|
с = 0,4287 |
|
|
|
|
|
Mo2B |
ОЦТ типа СиАl2; |
2270 (темпера- |
− |
− |
− |
− |
|
а = 0,5547; b = 0,4740 |
тура распада) |
|
|
|
|
NbB |
Ромбическая; а = 0,3297; |
2270 |
− |
− |
− |
− |
|
b = 0,8717; с = 0,3166 |
|
|
|
|
|
NbB2 |
Гссагональная; |
3000 |
− |
− |
− |
− |
|
а = 0,3095 ÷ 0,3105; |
|
|
|
|
|
|
с = 0,3284 ÷ 0,3259 |
|
|
|
|
|
TiB |
Ромбическая типа FeB; |
2060 (темпера- |
− |
− |
− |
− |
|
а = 0,7103; b = 0,3049; |
тура распада) |
|
|
|
|
|
с = 0,4551 |
|
|
|
|
|
TiB2 |
Гексагональная типа АlВ2; |
2980 (2850) |
− |
− |
− |
− |
|
а = 0,3030; с = 0,3228 |
|
|
|
|
|
251
Окончание табл. 23.41
|
Тип и параметры |
|
Е, |
G, |
Коэффи- |
Нμ, |
Фаза |
Тпл, °С |
циент Пу- |
||||
|
решетки, нм |
|
ГПа |
ГПа |
ассона ν |
ГПа |
|
|
|
|
|
|
|
|
|
Оксиды |
|
|
|
|
Al2O3 |
Ромбоэдрическая; |
2040 |
405 |
− |
− |
− |
|
а = 0,513; α = 55°17′ |
|
|
|
|
|
Cr2O3 |
Ромбоэдрическая типа α- |
2425 (2268) |
330 |
− |
− |
− |
|
Al2O3; в гексагональных |
|
|
|
|
|
|
осях а = 0,4607; с = 1,3599 |
|
|
|
|
|
Y2O3 |
ОЦК типа Мn2O2; |
2415 |
180 |
− |
− |
− |
|
а = 1,0605 |
|
|
|
|
|
ВеО |
α-Гексагональная типа |
2300−2570 |
385 |
− |
− |
− |
|
ZnS; |
|
|
|
|
|
|
а = 0,2698; |
|
|
|
|
|
|
с = 0,4377; |
|
|
|
|
|
|
β-тетрагональная; |
|
|
|
|
|
|
а = 0,475; с = 0,274 |
|
|
|
|
|
MgO |
ГЦК типа NaCl; |
2852 (2808) |
305 |
− |
− |
− |
|
а = 0,4213 |
|
|
|
|
|
НfО2 |
α-Моноклинная типа |
2900 |
285 |
− |
− |
− |
|
Zr02; |
|
|
|
|
|
|
а = 0,5116; b = 0,5172; |
|
|
|
|
|
|
с = 0,5295 |
|
|
|
|
|
|
β-тетрагональная; |
|
|
|
|
|
|
а = 0,514; с = 0,525 |
|
|
|
|
|
|
Интермсталлиды |
|
|
|
|
|
Fe2Mo |
Гексагональная типа |
950 (темпера- |
− |
− |
− |
− |
|
MgZn2; |
тура распада) |
|
|
|
|
|
а = 0,4745; с = 0,7734 |
|
|
|
|
|
NiTi |
α-Гексагональная; |
1240 |
− |
− |
− |
− |
|
а = 0,4572; с = 0,4660; |
|
|
|
|
|
|
β-кубическая типа CsCl; |
|
|
|
|
|
|
а = 0,3075 |
|
|
|
|
|
Ni3Ti |
Гексагональная; |
1378 |
− |
− |
− |
− |
|
а = 0,5101; с = 0,8307 |
|
|
|
|
|
N3Al |
ГЦК типа Cu3AI; |
1395 (темпера- |
200 |
− |
− |
− |
|
а = 0,356 |
тура распада) |
|
|
|
|
NiAl |
ОЦК типа CsCl; а = 0,2887 |
1638 |
185 |
− |
− |
− |
Fe2Nb |
Гексагональная типа |
1665 |
− |
− |
− |
− |
|
MgZn2; |
|
|
|
|
|
|
с = 0,4811; с = 0,7857 |
|
|
|
|
|
Примечание. В скобках − данные разных авторов.
252
Структура стали
Повышение механических свойств и коррозионной стойкости сталей достигается в результате усложнения состава. Легирующие элементы, растворяясь в твердом растворе (α или γ), влияют на условия равновесия и кинетику (γ ' α)-превращения. В связи с этим легирующие элементы можно разделить на две категории в соответствии с двойными диаграммами состояния «железолегирующий элемент» (см. п. 23.3.1):
1)ферритостабализирующие (способствуют γ → α-превраще-
нию) Cr, Mo, W, Ti, Nb, Та, Si, V, Al;
2)аустенитостабилизирующие (способствуют α → γ-превраще-
нию) С, N, Mn, Ni, Co, Сu.
Ферритостабилизирующие элементы, растворяясь в α-фазе, расширяют область ее существования и одновременно уменьшают область γ-фазы (рис. 23.127). Их влияние на характер образования структуры аналогично влиянию Cr. Поэтому если в хромистые стали введен ферритостабилизирующий элемент, то в связи с увеличением общего количества ферритостабилизирующих элементов есть опасность появления в структуре избыточного количества α-фазы (δ-фазы) и исчезновения (частичного или полного) (α ' γ)- превращения, в результате чего происходит переход стали в двухили трехфазный или ферритный класс. Об интенсивности влияния тех или иных ферритостабилизирующих элементов на свойства хромистых сталей можно судить по данным, приведенным в табл. 23.42. При этом необходимо иметь в виду, что это влияние зависит как от сочетания легирующих элементов и их количества, так и от содержания в стали углерода.
Таблица 23.42
Сравнительная интенсивность ферритостабилизирующего действия элементов по отношению к Сr в хромистых коррозионно-стойких сталях
Легирующий элемент |
Сr |
Al |
V |
Ti |
Si |
Nb |
Mo |
W |
Относительное леги- |
1 |
12 |
11 |
7,2 |
5,2 |
4,5 |
4,2 |
2,1 |
рующее действие эле- |
|
|
|
|
|
|
|
|
ментов |
|
|
|
|
|
|
|
|
253
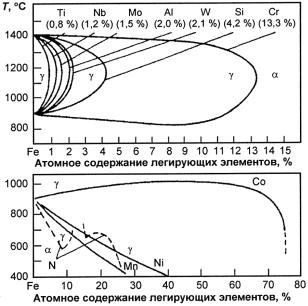
Рис. 23.127. Влияние легирующих элементов на размеры - и -областей в сплавах железа
Для стабилизации аустенитной фазы в широком интервале температуры необходимо уменьшать количество ферритостабилизирующих элементов и для компенсации их влияния увеличивать содержание аустенитостабилизирующих элементов. Это необходимо не только для полного или частичного предотвращения появления-фазы, но и для предупреждения образования -фазы, особенно в условиях длительной работы при высокой температуре.
Легирующие элементы влияют на устойчивость структуры в различной степени. Поэтому для оценки их относительного ферритостабилизирующего или аустенитостабилизирующего действия введены понятия эквивалентов Сr и Ni соответственно следующим образом:
Сrэкв (%) = [Сr] + 5,5[А1] + 5[V] + 2[Si] + 1,75[Nb] +
+ 1,5[Mo]+ 1,5[Ti] + 0,75[W]; |
(23.40) |
Niэкв (%) = [Ni] + 30[C] + 25[N] + [Co] + 0,5[Mn] + 0,3[Cu], (23.41)
254
где в квадратных скобках − процентное содержание элемента, т.е. влияние каждого элемента приводится к влиянию Сr и Ni с соответствующим коэффициентом. Как видно из этих формул, Аl и V, как ферритостабилизирующие элементы, имеют весьма высокие коэффициенты эквивалентности к Сr (соответственно 5,5 и 5), W − слабый ферритостабилизирующий элемент; сильнейшими аустенитостабилизирующими элементами с коэффициентами эквивалентности к Ni, равными соответственно 30 и 25, являются С и N.
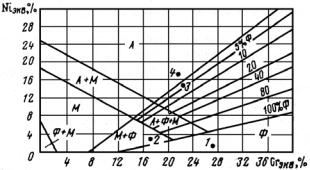
Пользуясь величинами Сrэкв и Niэкв по структурной диаграмме для коррозионно-стойких сталей (диаграмма Шеффлера), можно определить класс стали (рис. 23.128). Например, для следующих сталей в соответствии с выражениями (25.8) и (25.9) имеем:
03Х23БЮ: Сrэкв ≈ 27,7; Niэкв ≈ 0,9;
10Х13М2БФР: Сrэкв ≈ 17,6; Niэкв ≈ 3,0;
02Х17Н13МЗ: Сrэкв ≈ 22,8; Niэкв ≈ 14,6;
07Х17Н12М2: Сrэкв ≈ 21,0; Niэкв ≈ 15,2.
Рис. 23.128. Структурная диаграмма сталей (диаграмма Шеффлера). Точками отмечены стали:
1 − 03Х23БЮ; 2 − 10Х13М2БФР; 3 − 02Х17Н13МЗ; 4 − 07Х17Н12М2
Из диаграммы Шеффлера следует, что сталь 03X23БЮ − чисто ферритная; 10Х13М2БФР − двухфазная ферритно-мартенситная; 02Х17Н13М3 − двухфазная аустенитно-ферритная, причем количество ферритной составляющей не превышает 5 %; 07Х17Н12М2 − аустенитная (см. рис. 23.128).
255
Из этого примера видно, как сильно влияет даже небольшое изменение концентрации легирующих элементов на структурнофазовый состав сталей, особенно вблизи границы, разделяющей фазы. Так, близкие по основным компонентам (Fe, Cr, Ni) стали 02Х17Н13М3 (точка 3) и 07Х17Н12М2 (точка 4) являются сталями различного класса вследствие пониженного содержания углерода (0,02% по сравнению с 0,07%) и повышенного содержания Мо (2,7% по сравнению с 2,1%) в первой стали.
Следует подчеркнуть, что по диаграмме Шеффлера можно определять класс стали лишь приблизительно, особенно вблизи границ с другой фазой, так как она не учитывает ряд факторов, влияющих на структуру и превращения сталей. Например, в сталях, выплавляемых на воздухе, всегда присутствует небольшое количество азота, который является сильнейшим аустенитостабилизирующим элементом.
Упрочняющие фазы в сталях и сплавах
Степень упрочнения металлов и сплавов во многом зависит от характеристик самих упрочняющих частиц. Дисперсионное упрочнение наиболее эффективно в том случае, когда упрочняющая фаза способна к растворению в матрице, выделению при специальных термообработках и сохранению дисперсности и когерентности при рабочих температурах в течение длительного времени. Например, в стали нельзя использовать в качестве дисперсных упрочняющих выделений цементит Fe3C из-за быстрой коагуляции при нагревах; нитрид титана TiN − из-за трудности растворения частиц первичного нитрида и, следовательно, затруднительно получить пересыщение матрицы титаном.
Здесь нельзя путать температуру плавления и температуру, при которой происходит растворение частицы в матрице. Так, карбид NbC имеет очень высокую температуру плавления − более 3600 °С, однако он относительно легко растворяется в аустените и выделяется при старении в виде дисперсных частиц. Поэтому этот карбид используют для дисперсионного упрочнения стали. Кроме того, степень упрочнения зависит от механических свойств упрочняющей фазы − она тем выше, чем прочнее сама упрочняющая частица.
256
В зависимости от состава стали могут быть использованы различные упрочняющие фазы. Дать обзор всех таких фаз затруднительно вследствие большого их разнообразия. Некоторые свойства упрочняющих химических соединений, встречающихся в конструкционных сталях и сплавах, были представлены на рис. 23.125 и в табл. 23.41. В легированных сталях и сплавах на основе Fe и Сr наиболее часто встречающимися упрочняющими фазами могут быть:
1)карбиды Fe3C; (Fe, Cr)7C3; (Fe, Cr)23C6; Mo2C; MoC; WC; (Fe, Mo, W)6C; VC; NbC; ZrC; TiC и др.;
2)нитриды: Fe16N1−2; Fe4N; CrN; MoN; VN; NbN; ZrN; TiN; AlN
идр.;
3)интерметаллиды: NiAl; TiAl; Ni3Al; Ni3Ti; Ni3(Ti, Al); Fe2Mo; Fe2W; FeCr; FeV и др.
В сталях, изготовленных по традиционной технологии, как правило, образуются первичные карбонитриды, например V(C, N); Ti(C, N); Nb(C, N); (V, Nb)(C, N) и др.
Как видно из табл. 23.41, карбиды, нитриды и бориды обладают
высокими упругими свойствами − модулем сдвига G, модулем упругости Е, а также высокой твердостью, намного превышающими соответствующие свойства для стали (например, карбид NbC име-
ет: G = 205 ГПа, Е = 505 ГПа, ν = 0,22 и Hμ = 16 ГПа, а Fe (стали) G = 81÷83 ГПа, Е= 186÷223 ГПа, ν = 0,23÷0,31 и Hμ = 0,6÷0,7 ГПа).
Наиболее высокие значения указанных свойств имеют карбиды и нитриды элементов IV и V групп. В соответствии с этими признаками переходные металлы по их сродству к углероду и азоту, прочности и стойкости карбидов и нитридов, их устойчивости к распаду можно расположить в следующий ряд (по убыванию свойств):
Hf − Zr −Ti −Ta − Nb −V − W −Mo −Cr −Mn − Fe
14243 14243 14243 { {
IV группа |
V группа |
VI группа |
VII |
VIII |
Важной особенностью формирования карбидов (и нитридов) является то, что во всех случаях кристаллические решетки фаз отличаются от решеток соответствующих металлов (см. рис. 23.124): при движении в периоде слева направо (от Ti к Ni), т. е. по мере
257
заполнения внешних d- и s-электронных оболочек, происходит переход от ОЦК к ГЦК и ГПУ решеткам.
Другим видом упрочняющей фазы в сталях являются интерметаллические соединения, которые можно разделить по ряду схожих признаков на следующие группы: электронные соединения (FeAl, NiAl и др.); σ-фазы, которые образуются при относительно небольшом (менее 8%) различии атомных радиусов (типа FeCr и др.);
фазы Лавеса (типа А2В: Fe2Mo, Fe2W и др.); геометрически плот-
ноупакованные фазы (типа А3В), представляющие собой выделения упорядоченных ГЦК (γ′), ОЦК (γ′′) и ГПУ (η) фаз из аустенитной матрицы. Последние − одни из наиболее благоприятных выделений, так как позволяют достичь существенного дисперсионного упрочнения, стабильного при рабочих температурах, без охрупчивания сплавов. В соединениях типа А3В более электроотрицательные элементы (Fe, Ni, Co) соответствуют элементу А, а такие, как
Al, Ti, Nb, — элементу В.
Формирование структуры стали путем термической обработки
Применительно к сталям широко применяется термическая обработка как промежуточная или конечная стадия формирования заданной структуры. Основные виды, режимы и применение термообработки, а также получаемые структуры приведены в табл. 23.43 и на рис. 23.129−23.132. Вид термической обработки выбирается с учетом ее назначения, а конкретные режимы определяются составом сталей. Так, температура на 50 °С выше Ac3 дос-
таточна для закалки доэвтектоидных сталей (рис. 23.131), но в легированных сталях (например, высокохромистых коррозионностойких сталях) при этой температуре ( 900 °С) остаются нерастворившиеся карбиды М23С6, поэтому для их растворения температуру закалки выбирают на 150−250 °С выше Ac3 , т.е. порядка
1000−1150 °С. Если в структуре сталей присутствуют интерметаллиды, то для их полного растворения температура нагрева под закалку должна быть еще выше (до 1250 °С). Температура старения также определяется составом стали и типом вторичной фазы, кото-
258
рую требуется получить. В аустенитных жаропрочных сталях и сплавах оптимальная температура старения для образования фазы Лавеса Fe2Mo 800 900 °С. При высокотемпературных отжигах на-
чало растворения Fe2Mo 900 950 °С, Fe2W 1000 1050 °С; полное растворение наступает при температуре 1200 1300 °С. Оптимальная температура старения для образования -фаз составляет 750 800 °С. При повышении температуры эта фаза начинает в первую очередь переходить в твердый раствор (полное растворение происходит уже при Т 900 °С). Затем растворяются (частично) карбиды тугоплавких металлов (NbC, TiC и др.).
Таблица 23.43
Основные виды термообработки, применяемые к сталям и сплавам
Вид термообработки |
Режим |
|
Основные процессы, образующаяся |
||||
термообработки |
|
структура, применение |
|||||
|
|
|
|||||
Отжиг I |
а) Гомогениза- |
Нагрев до 1100 |
Главный процесс устранение по- |
||||
рода |
ционный (диф- |
1200 С, выдержка |
следствий дендритной ликвации |
||||
|
фузионный) |
10 24 ч + медлен- |
|
|
|
|
|
|
|
ное охлаждение |
|
|
|
|
|
|
б) Рекристалли- |
Т = 650 700 °С, |
|
Главный процесс рекристаллизация |
|||
|
зационный |
выдержка 0,5 1 ч |
деформированного металла. Приме- |
||||
|
|
|
|
няют |
перед холодной |
обработкой |
|
|
|
|
|
давлением и между операциями хо- |
|||
|
|
|
|
лодного деформирования для снятия |
|||
|
|
|
|
наклепа |
|
|
|
|
в) Отжиг для |
Т = 200 700 °С, |
Главный процесс полная или час- |
||||
|
снятия остаточ- |
чаще 350 600 °С, |
тичная релаксация зональных оста- |
||||
|
ных напряже- |
выдержка не- |
|
точных |
напряжений. |
Применяют |
|
|
ний |
сколько часов |
|
после обработки давлением, резани- |
|||
|
|
|
|
ем, литья, сварки, шлифования |
|||
Отжиг II |
а) Полный (до- |
Нагрев выше тем- |
Структура стали имеет мелкие рав- |
||||
рода (фазо- |
эвтектоидная |
пературы Ac3 на |
новесные зерна, состоит из избыточ- |
||||
вая пере- |
сталь) |
20 50 °С, выдерж- |
ного феррита и перлита. Используют |
||||
кристалли- |
|
для сортового проката, |
поковки фа- |
||||
зация)(см. |
|
ка + медленное |
|
сонных отливок |
|
||
|
охлаждение со |
|
|
||||
рис. 23.129 |
|
|
|
|
|
|
|
|
скоростью |
|
|
|
|
|
|
и 23.130) |
|
|
|
|
|
|
|
|
10 100 °С/ч |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) Неполный |
Нагрев выше A |
, |
Образуется мягкий перлит. Исполь- |
|||
|
(доэвтектоидная |
c |
зуют |
для |
смягчения сталей перед |
||
|
но ниже A |
1 |
|||||
|
сталь) |
|
обработкой резанием |
|
|||
|
c3 |
|
|
||||
259
Продолжение табл. 23.43
Вид термообработки |
|
|
Режим |
|
|
Основные процессы, |
образующаяся |
||||||||
термообработки |
|
структура, применение |
|
||||||||||||
|
|
|
|
||||||||||||
|
в) Сфероидизи- |
Нагрев выше |
|
|
Происходит |
полная перекристалли- |
|||||||||
|
рующий (заэв- |
A |
|
на 10 30 °С, |
зация. Структура стали имеет зерни- |
||||||||||
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
||
|
тектоидная |
|
1 |
|
|
|
|
стую форму перлита, вместо пла- |
|||||||
|
выдержка + мед- |
||||||||||||||
|
сталь) |
стинчатой в доэвтектоидной и эвтек- |
|||||||||||||
|
|
ленное охлажде- |
тоидных сталях |
|
|
|
|
||||||||
|
|
ние |
|
|
|
|
|
|
|
|
|
|
|
||
|
г) Изотермиче- |
Нагрев выше |
|
|
Получается |
однородная |
структура, |
||||||||
|
ский |
A |
|
+ ускоренное |
улучшается |
обрабатываемость реза- |
|||||||||
|
|
c3 |
|
|
|
|
нием. |
Используют |
для поковок |
и |
|||||
|
|
охлаждение до |
|
других заготовок небольших разме- |
|||||||||||
|
|
температуры на |
|
||||||||||||
|
|
|
ров из легированной стали |
|
|
||||||||||
|
|
30 150 °С ниже |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
A |
|
+ изотермиче- |
|
|
|
|
|
|
|
||||
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ская выдержка до |
|
|
|
|
|
|
|
||||||
|
|
полного распада |
|
|
|
|
|
|
|
||||||
|
|
аустенита + бы- |
|
|
|
|
|
|
|
|
|||||
|
|
строе охлаждение |
|
|
|
|
|
|
|
||||||
|
д) Высокий |
Нагрев до |
|
|
Происходит распад остаточного мар- |
||||||||||
|
отпуск («низ- |
650 680 °С (не- |
|
тенсита, коагуляция карбидов. Ис- |
|||||||||||
|
кий отжиг») |
сколько ниже A |
) |
пользуют для сортового проката для |
|||||||||||
|
|
|
|
|
|
c |
снижения твердости сталей |
|
|||||||
|
|
|
|
|
|
|
1 |
|
|||||||
Нормализация (нормализа- |
Нагрев выше |
Ac3 |
К низкоуглеродистым сталям приме- |
||||||||||||
ционный отжиг) |
|
|
|
|
няют вместо смягчающего отжига; в |
||||||||||
(см. рис. 23.129 и 23.130) |
или выше Аст на |
средне- и высоколегированных ста- |
|||||||||||||
30 50 °С, выдерж- |
|||||||||||||||
|
|
лях может |
образоваться |
мартенсит |
|||||||||||
|
|
ка до 1 ч + охлаж- |
(т. е. происходит воздушная закалка); |
||||||||||||
|
|
дение на воздухе |
|||||||||||||
|
|
|
|
|
|
|
|
высокоуглеродистые стали ощутимо |
|||||||
|
|
|
|
|
|
|
|
упрочняются |
|
|
|
|
|||
Патентирование (разновид- |
Нагрев до |
|
|
При выходе из ванны сталь имеет |
|||||||||||
ность изотермической обра- |
870 920 °С (на |
|
ферритно-перлитную |
|
структуру. |
||||||||||
ботки) |
|
150 200 °С выше |
Используют для получения высоко- |
||||||||||||
(см. рис. 23.129) |
A |
|
) + свинцовая |
прочной проволоки из углеродистой |
|||||||||||
|
|
c3 |
|
|
|
|
стали |
|
|
|
|
|
|
||
|
|
или соляная ванна |
|
|
|
|
|
|
|||||||
|
|
Т = 450 550 °С + |
|
|
|
|
|
|
|
||||||
|
|
охлаждение |
|
|
|
|
|
|
|
|
|
||||
Закалка |
а) Без поли- |
Нагрев выше |
Ac3 |
Главный процесс |
|
формирование |
|||||||||
(рис. |
морфного пре- |
|
|
|
|
неравновесной структуры |
во время |
||||||||
23.131) |
вращения |
на 30 50 °С (доэв- |
ускоренного охлаждения. При низ- |
||||||||||||
|
|
тектоидные стали) |
кой |
температуре |
фиксируется |
со- |
|||||||||
|
|
или |
A |
(заэвтек- |
стояние сплава, свойственное ему |
||||||||||
|
|
|
|
c1 |
|
|
|||||||||
|
|
тоидные стали), |
|
при |
более |
высокой |
температуре. |
||||||||
|
|
выдержка для |
|
|
Например, в сплаве С1 фиксируется |
||||||||||
|
|
завершения фазо- |
|||||||||||||
|
|
вых превращений |
-твердый раствор |
состава п пере- |
|||||||||||
|
|
+ ускоренное |
|
|
сыщенный твердый раствор В в А; в |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
260
|
|
|
|
Окончание табл. 23.43 |
||||
|
|
|
|
|||||
Вид термообработки |
Режим термообра- |
Основные процессы, образующаяся |
||||||
ботки |
структура, применение |
|||||||
|
|
|||||||
|
|
охлаждение со |
сплаве С2 (α + β)-твердый раствор, |
|||||
|
|
скоростью выше |
причем α-состава m (рис. 23.132) |
|||||
|
|
vкр (см. рис. 23.115) |
|
|
|
|
|
|
|
б) С полиморф- |
|
Главное − мартенситное превраще- |
|||||
|
ным превраще- |
|
ние высокотемпературной фазы |
|||||
|
нием (закалка |
|
|
|
|
|
|
|
|
на мартенсит) |
|
|
|
|
|
|
|
|
в) С плавлением |
Лазерная, плаз- |
Главное − |
быстрое |
затвердевание |
|||
|
поверхности |
менная и другие |
поверхностного слоя с образованием |
|||||
|
|
виды обработки |
метастабильной структуры |
|
||||
|
|
поверхности |
|
|
|
|
|
|
Старение |
|
В зависимости от |
Главный процесс − распад пересы- |
|||||
|
|
состава стали |
щенного твердого раствора с образо- |
|||||
|
|
Т = 550÷850 °С, |
ванием новой фазы, отличающейся |
|||||
|
|
время выдержки |
от матрицы и химическим составом, |
|||||
|
|
определяется тре- |
и структурой. Используют для по- |
|||||
|
|
бованиями к по- |
вышения прочности и жаропрочно- |
|||||
|
|
лучаемой структу- |
сти дисперсионно-твердеющих спла- |
|||||
|
|
ре |
вов. В некоторых сплавах возможно |
|||||
|
|
|
и естественное старение, старение |
|||||
|
|
|
при длительной |
эксплуатации при |
||||
|
|
|
повышенной температуре, динамиче- |
|||||
|
|
|
ское старение (при воздействии на- |
|||||
|
|
|
пряжений), старение при воздейст- |
|||||
|
|
|
вии внешней среды |
|
|
|||
Отпуск |
Для углеродис- |
|
Главный процесс − распад и (или) |
|||||
|
тых сталей раз- |
|
возврат и рекристаллизация мартен- |
|||||
|
личают: |
|
сита |
|
|
|
|
|
|
а) низкий отпуск |
Т = 120÷150° С, |
Основные |
процессы |
− уменьшение |
|||
|
(на отпущенный |
выдержка 1−3 ч |
остаточных закалочных напряжений |
|||||
|
мартенсит) |
|
|
|
|
|
|
|
|
б) средний от- |
Т = 350÷450 °С |
Основные |
процессы |
− |
сочетание |
||
|
пуск |
|
высокой прочности, упругости с |
|||||
|
|
|
достаточной вязкостью |
|
||||
|
в) высокий от- |
Т = 450÷650 °С, |
Основные |
процессы |
− |
сочетание |
||
|
пуск (на сорбит) |
выдержка не- |
высокой прочности с хорошей со- |
|||||
|
|
сколько часов |
противляемостью |
ударным нагруз- |
||||
|
|
|
кам. Наиболее широко применяют к |
|||||
|
|
|
конструкционным сталям |
|
||||
Улучшение |
Двойная опера- |
То же |
Основные процессы − те же |
|||||
|
ция получения |
|
|
|
|
|
|
|
|
сорбита − за- |
|
|
|
|
|
|
|
|
калка + высокий |
|
|
|
|
|
|
|
|
отпуск |
|
|
|
|
|
|
|
261
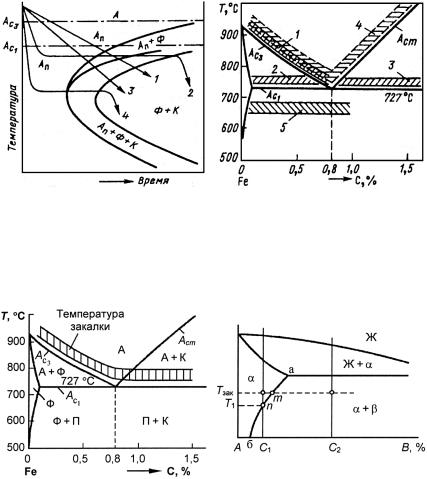
Рис. 23.129. Основные разновидности |
Рис. 23.130. Температура нагрева ста- |
отжига 2-го рода доэвтектоидной |
лей для отжига 2-го рода: |
стали: |
1 полный; 2 неполный; |
1 полный; 2 изотермический; |
3 сфероидизирующий отжиг; |
3 нормализационный отжиг |
4 нормализация; |
(нормализация); 4 патентирование |
5 высокий отпуск |
Рис. 23.131. Температура нагрева |
Рис. 23.132. Схема закалки без |
сталей для закалки |
полиморфного превращения |
Старение один из основных способов повышения прочности и жаропрочности дисперсионно-упрочняемых сплавов. При старении различают непрерывный и прерывистый распад. При непрерывном распаде образуются и растут отдельные выделения избыточной фазы, размер r которых возрастает со временем старения приблизительно по закону
262
r = (Dτ)n, |
(23.42) |
где D − коэффициент объемной диффузии компонента, которым обогащено выделение; п лежит в пределах от 1/3 до 1/2. арактерная особенность − непрерывное по всему объему исходных зерен уменьшение концентрации легирующего элемента.
При прерывистом распаде в зернах исходного пересыщенного раствора αп зарождаются и растут ячейки (колонии) двухфазной смеси α1 + β, имеющие перлитообразное строение. У α1 фазы внутри ячеек − та же решетка, что и у исходной фазы αп, но состав ее является равновесным при данной температуре. Рассматриваемое
превращение можно записать в виде: |
|
αп → α1 + β. |
(23.43) |
Средний состав в двухфазной смеси α1 + β внутри ячейки такой же, как состав исходного раствора αп. Характерная особенность − на границе ячейки и исходного раствора в узкой зоне происходит резкий скачок концентрации − от исходной в растворе αп до концентрации раствора α1 внутри ячейки. Поэтому распад называют прерывистым.
23.3.4. Теплоустойчивые и жаропрочные стали
Стали и сплавы, предназначенные для работы при повышенных и высоких температурах, можно разделить на группы: теплоустойчивые, работающие в нагруженном состоянии при повышенных температурах с максимальной рабочей температурой до 600−650 °С в течение длительного времени; жаропрочные, работающие в нагруженном состоянии при высоких температурах в течение определенного времени и имеющие при этом достаточную жаростойкость; жаростойкие (окалиностойкие), работающие в ненагруженном и слабонагруженном состоянии при температурах выше 550 °С и обладающие стойкостью против химического разрушения поверхности в газовых средах, включая воздух.
Теплоустойчивые и жаропрочные стали по количеству легирующих элементов и получаемой структуре разделяют (условно) на несколько групп (см. рис. 23.106). В группу теплоустойчивых сталей входят: углеродистые, низколегированные, хромистые средне-
263
легированные, высоколегированные хромистые, хромоникелевые и другие стали. Структура их зависит от степени легирования и режима термообработки. После нормализации стали имеют ферритную или ферритно-карбидную структуру разной дисперсности (перлит, сорбит, тростит, бейнит) (см. п. 23.3.3). К жаропрочным относят стали аустенитного класса на хромоникелевой и хромоникельмарганцевои основе с различным дополнительным легированием. Структура таких сталей − растворно-упрочненный аустенит (гомогенные стали), аустенит с карбидным или интерметаллидным упрочнением (дисперсионно-упрочненные стали). Жаростойкие стали бывают хромистыми ферритного, ферритно-мартенситного или мартенситного класса; хромоникелевыми аустенитными сталями и сплавами.
Рис. 23.133. Зависимость длительной прочности различных сплавов от температуры:
1 − патронная латунь (Cu-Zn-сплавы); 2, 3 − алюминиевые сплавы (2 − САП, 3 − А1-сплав); 4 − литейный Mg-сплав; 5 − Ti-сплав; 6 − углеродистая сталь; 7, 8 − теплоустойчивые малолегированные стали (7 − Х5М; 8 − ХМ);
9−11 − коррозионно-стойкие стали (9 − A1SI304, 10 − AISI316, 11 − литейная высокотемпературная сталь); 12 − Ni-сплавы; 13 − термообработанные стали на основе железа (Cr, Ni, Co); 14 − сплавы на основе Fe после обработки давлением; 15 − сплавы на основе Со; 16 − Мо-сплавы; 17 − металлокерамика К-161–В
264
По жаропрочности, одним из критериев которой является длительная прочность, теплоустойчивые стали среди реакторных конструкционных материалов занимают невысокое место (после сплавов Mg, Al, Ti и углеродистых сталей) (рис. 23.133), однако по комплексу физико-механических свойств при низких и умеренных температурах (рис. 23.134), технологичности и стоимости использование их часто оказывается экономически целесообразным.
Рис. 23.134. Предел прочности различных материалов в зависимости от температуры:
1 − простые конструкционные стали (углеродистые улучшаемые, слаболегированные Cr-Ni-стали); 2 − сравнительно слаболегированные стали перлитного и ферритного классов (теплоустойчивые стали); 3 − аустенитные жаропрочные стали; 4 − высоколегированные жаропрочные стали со специальным упрочнением и никелевые сплавы
Основной задачей при выборе системы легирования для стали является создание термодинамически устойчивого (при температуре технологических отпусков) структурно-фазового состояния, обеспечивающего требуемый уровень прочности (длительной прочности) при рабочих условиях, технологичности (свариваемости), коррозионной (и радиационной − в ядерных и термоядерных реакторах) стойкости. В ряде случаев важным является обеспечение прокаливаемости полуфабрикатов, которой обеспечивается однородность СФС и механических свойств по сечению изделия.
265
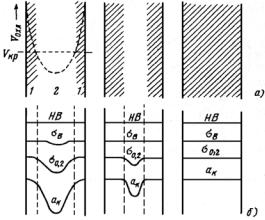
Под прокаливаемостью массивных заготовок подразумевают глубину проникновения закаленной зоны в объем заготовки. Несквозная прокаливаемость объясняется тем, что при закалке деталь охлаждается быстрее с поверхности и медленнее − в середине. На рис. 23.135 дана схема, показывающая несквозную прокаливаемость и влияние глубины закалки на механические свойства стали. Если критическая скорость закалки (зависящая от вида охлаждающей среды, состава стали и величины сечения детали) равна vкр, то деталь не прокаливается насквозь и глубина закалки будет равна заштрихованному слою (рис. 23.135, а).
Рис. 23.135. Схемы, показывающие несквозную прокаливаемость (а) и влияние глубины закалки на механические свойства стали (б):
1 − закаленная; 2 − незакаленная зона
Несквозная прокаливаемость приводит к тому, что на поверхности стали образуется мартенсит, глубже − мартенситно-троститная структура, глубже − тростит, а центре детали − перлит. Соответственно в сердцевине изделия наблюдается снижение прочности и ударной вязкости (рис. 23.135, б). При сквозной прокаливаемости формируется относительно однородное СФС, в результате которого свойства будут одинаковы в каждом сечении.
Прокаливаемость, как и vкр, тесно связана со скоростью превращения аустенита в перлит и, следовательно, с расположением кри-
266
вой начала превращения на С-диаграмме. Легирующие элементы, сдвигающие линии начала превращения вправо на диаграмме изотермического распада аустенита, что равносильно замедлению скорости распада аустенита, способствуют более глубокой прокаливаемости детали. Такими являются элементы (за исключением Со), растворенные в аустените.
Накопленный опыт применения сталей, из которых изготавливают различные детали и узлы ответственного назначения в машиностроении, энергетике и других областях техники, показал перспективность использования для теплоустойчивых сталей на основе феррита, легированного одним или несколькими элементами из таких, как Сr, Ni, Si, Mn, Mo, W, V, Ti, Nb, В. Легированные стали обладают лучшими механическими свойствами после термообработки (закалка + отпуск) в изделиях более крупных сечений по сравнению с углеродистыми сталями из-за улучшения прокаливаемости при введении легирующих элементов. Обычно для достижения высокой прокаливаемости сталь легируют, прежде всего, более дешевыми элементами − Сr, Мn, В, но для крупногабаритных деталей и более дорогими элементами − Ni, Mo и др.
Наиболее эффективно повышает прокаливаемость стали комплексное легирование типа Сr + Mo, Cr +Ni, Сr + Ni + Mo и др. При этом высокие механические свойства можно получить практически в любом сечении изделия. Однако чрезмерно высокое содержание некоторых легирующих элементов может привести к повышению порога хладноломкости (Тх) и снижению запаса вязкости (работы разрушения − ак). Так, увеличение в стали содержания Сr или Мn до 1−1,5 % практически не влияет на Тх, однако при больших их концентрациях Тх повышается, а ак резко падает. Весьма полезным является введение Ni, который наиболее сильно понижает Тх, увеличивает прочность (НВ) и ударную вязкость (рис. 23.136). Повышая запас вязкости, Ni увеличивает сопротивление распространению трещины. Все остальные элементы, кроме небольших добавок Сr, Мn и Мо, повышая прочность увеличивают и Тх.
Чрезмерное легирование (за исключением Ni и Мо) ухудшает и технологичность стали (обработку резанием, свариваемость и т. д.). Несмотря на высокую эффективность для улучшения многих
267
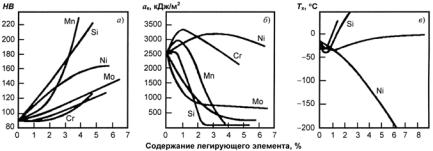
свойств стали, Ni вводят в предельно минимальном количестве вследствие высокой его стоимости.
Рис. 23.136. Влияние легирующих элементов на твердость (а), ударную вязкость (б) и температуру хрупко-вязкого перехода (в) феррита
Тугоплавкие карбидообразующие элементы (V, Ti, Nb, Zr), вводимые в сталь в небольшом количестве (до 0,15%), образуют труднорастворимые в аустените карбиды, измельчают зерно, что понижает Тх, повышают работу распространения трещины и уменьшают чувствительность к концентраторам напряжений. Однако при большом содержании этих элементов сопротивление стали хрупкому разрушению уменьшается.
Особо сильное влияние на увеличение прокаливаемости сталей оказывают малые добавки бора (0,002−0,006 %). По этому критерию микролегирование бором эквивалентно введению 1 % Ni; 0,5 % Мn; 0,2 % Мо. Содержание бора более 0,01 % нежелательно из-за сильной горячеломкости стали; при содержании менее 0,001 % В его влияние незначительно. Механизм влияния бора заключается в том, что, являясь поверхностно-активным элементом, он концентрируется на границах зерен аустенита и препятствует здесь зарождению феррита при (γ → α)-превращении (известно, что зародыши перлита образуются главным образом на границах аустенитных зерен, затем превращение распространяется в тело зерна).
Легирующие элементы повышают устойчивость мартенсита против отпуска и задерживают коагуляцию карбидов. Поэтому для получения требуемой прочности и твердости легированные стали
268

подвергают отпуску при более высокой температуре, чем углеродистые стали. Это позволяет полностью снять закалочные напряжения, а также получить лучшее сочетание прочности и вязкости разрушения.
23.3.5. Углеродистые и низколегированные стали перлитного класса
Углеродистые и низкоуглеродистые стали имеют перлитную структуру и поэтому относятся к сталям перлитного класса. Эти стали подвержены природному тепловому охрупчиванию, т. е. снижению пластичности при нагревании1.
Напомним, что в интервале температур 250−400 °С наблюдается так называемая необратимая хрупкость стали или отпускная хрупкость I рода, свойственная всем сталям. Охрупчивание обусловлено
неравномерностью распада мартенсита по границам и в теле зерна. По границам идет полный (более полный, чем в зерне) распад, сопровождающийся возникновением значительных концентраций напряжений в приграничных областях, вызывающих их разрушение. В качестве способа устранения этого вида хрупкости рекомендуют подвергать сталь длительному высокотемпературному отпуску.
В интервале температур от 600 °С до Ac1 наблюдается необра-
тимая высокотемпературная отпускная хрупкость стали после очень длительных (сотни−тысячи) часов выдержки. Характерными особенностями высокотемпературной отпускной хрупкости являются ее нечувствительность к скорости охлаждения, усиление хрупкости с повышением температуры и сохранение при отжиге в ферритной области. Основной причиной хрупкости этого рода является коагуляция карбидной фазы до микронных размеров, например, на границах зерен. В качестве метода борьбы с высокотемпературной отпускной хрупкостью рекомендуют легировать сталь карбидообразующими элементами, связывающими углерод в теле зерна.
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. П. 6.5.2.
269
В интервале температур от 400 до 600 °С (700 °С) наблюдается явление обратимой отпускной хрупкости как при кратковремен-
ном отпуске стали, так и при длительной эксплуатации даже при температурах несколько ниже 400 °С. Основной причиной этого вида хрупкости является ослабление прочности зернограничного сцепления вследствие сегрегации примесей и особенно фосфора, или совместной сегрегации Р (его аналогов Sb, Sn) и легирующих элементов. В частности, установлено конкурентное влияние сегрегации Р и С на границах: Р − ослабляет границу, С − усиливает межзеренное сцепление. Легирующие некарбидообразующие элементы вытесняют углерод на границы (снижают хрупкость), а карбидообразователи − наоборот. В качестве мер борьбы с обратимой отпускной хрупкостью рекомендуют рафинирование (очистка) стали по примесям Р (Sb, Sn), нагрев выше интервала охрупчивания с последующим быстрым охлаждением.
Химический состав и структура перлитных сталей
Структура перлитных сталей в равновесном состоянии представляет собой перлитно-ферритную смесь (рис. 23.137, а). Обобщенные данные по использованию перлитных сталей приведены в табл. 24.44, а их составы, режимы термообработки и механические свойства − в табл. 23.45 и 23.46.
|
|
|
Таблица 23.44 |
|
Использование углеродистых и низколегированных сталей |
||
|
|
для разных условий работы |
|
|
|
|
|
Т, °С |
р, МПа |
Применяемая |
Структура |
|
|
сталь |
|
≤ 120 |
≤ 0,8 |
Ст2, СтЗ |
Ф + П (после охлаждения на воздухе) |
≤ 400 |
≤ 6 |
Углеродистые |
Ф + П (после охлаждения на воздухе). При |
|
|
котельные |
длительной эксплуатации может происхо- |
|
|
12К, ... , 22К |
дить сфероидизация и коагуляция карбидов |
≤ 585 |
≤ 25,5 |
Низколегиро- |
В зависимости от режима ТО: Ф + П; Ф + Б; |
|
|
ванные стали |
Б; М. При длительной эксплуатации воз- |
|
|
|
можно: возрастание размера блоков; укруп- |
|
|
|
нение карбидов типа МС и образование но- |
|
|
|
вых карбидов (М23С6, М2С); обеднение твер- |
|
|
|
дого раствора легирующими элементами, |
|
|
|
особенно молибденом |
270
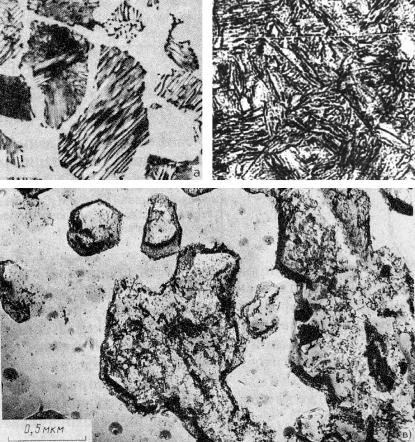
|
20 мкм |
|
|
|
|
|
30 мкм |
|
|
|
|
|
|
а) |
|
|
|
б) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,5 мкм |
|
|
|
в) |
||||
|
|
|
|
|
|
|
|
|
|
Рис. 23.137. Микроструктура сталей различных классов:
а − сталь перлитного класса 15Х2МФБ (0,15 % С; 1,4 % Сr; 0,5 % Мо; 0,3 % V; 0,3 % Nb) после выдержки при температуре 980 °С в течение 30 мин
иохлаждения на воздухе (перлит + феррит);
б− сталь мартенситного класса 15X13 (0,15 % С; 13 % Сr) после выдержки при температуре 1050 °С в течение 30 мин и охлаждения на воздухе (мартенсит);
в− сталь полуферритного класса 10Х13МБФ (0,1 % С; 13 % Сr; 1,2 % Мо; 0,9 % Nb; 0,2 % V) после выдержки при температуре 1050 °С в течение 30 мин
иохлаждения на воздухе (мартенсит + феррит)
271

Таблица 23.45
Химический состав реакторных конструкционных сталей перлитного класса и зарубежные аналога
Марка |
|
|
Химический состав, % |
|
|
|||
|
|
|
|
|
|
|
|
|
стали |
|
|
|
|
|
|
|
|
|
|
С |
Сr |
Ni |
Mo |
|
V |
Дру- |
|
|
|
гие* |
|||||
|
|
|
|
|
|
|
|
|
22К |
0,19−0,26 |
≤ 0,4 |
≤ 0,3 |
− |
|
− |
− |
|
15М |
0,10−0,18 |
− |
− |
0,4−0,7 |
|
− |
− |
|
12ХМ |
0,9−0,15 |
0,4−0,6 |
≤ 0,25 |
0,4−0,6 |
|
− |
− |
|
15ХМ |
0,11−0,18 |
0,8−1,1 |
≤ 0,25 |
0,4−0,55 |
|
− |
− |
|
12Х1МФ |
0,08−0,15 |
0,9−1,2 |
≤ 0,25 |
0,25−0,35 |
|
0,15−0,30 |
− |
|
12Х2МФБ |
0,08−0,12 |
2,1−2,6 |
≤ 0,25 |
0,5−0,7 |
|
0,2−0,35 |
0,5− |
|
15Х2МФА |
0,11−0,21 |
2,0−3,0 |
≤ 0,4 |
0,6−0,8 |
|
0,25−0,35 |
0,8Nb |
|
|
− |
|||||||
15Х2В2ФА |
0,18 |
2,4 |
− |
− |
|
0,24 |
1,3W |
|
25Х3МФА |
0,22−0,27 |
2,5−3,3 |
≤ 0,4 |
0,6−0,8 |
|
0,25−0,35 |
− |
|
10ХСНД |
< 0,12 |
0,6−0,9 |
0,5−0,8 |
− |
|
− |
− |
|
15ГНМ |
0,13−0,18 |
− |
1,0−1,3 |
0,4−0,55 |
|
− |
− |
|
10ХН1М |
0,08−0,12 |
0,7−1,0 |
1,1−1,4 |
0,4−0,6 |
|
− |
− |
|
10ХН2МА |
0,08−0,12 |
0,6−0,9 |
1,4−1,8 |
0,4−0,6 |
|
− |
− |
|
10Н3МФА |
0,08−0,12 |
≤ 0,3 |
2,8−3,7 |
0,4−0,6 |
|
0,03−0,08 |
− |
|
10ГН2МФА |
0,08−0,12 |
≤ 0,3 |
1,7−2,7 |
0,4−0,7 |
|
0,03−0,07 |
− |
|
15Х2НМФА |
0,13−0,18 |
1,8−2,3 |
1,0−1,5 |
0,5−0,7 |
|
0,10−0,12 |
− |
|
15Х2НМФАА |
0,13−0,18 |
1,8−2,3 |
1,0−1,5 |
0,5−0,7 |
|
0,10−0,12 |
− |
|
15Х3НМФА |
0,12−0,16 |
2,2−2,7 |
0,8−1,3 |
0,5−0,8 |
|
0,08−0,15 |
− |
|
15Х3НМФАА |
0,12−0,16 |
2,2−2,7 |
0,8−1,3 |
0,5−0,8 |
|
0,08−0,15 |
− |
|
___________
Аналоги в других странах**
А212В А533С
А1
А302А А302В
−
−
−
−
А542
−
−
−
А302С А302D А533В А502-2
−
−
−
−
−
−
−
* В сталях содержание Si и Мn менее 1 %; S и Р − менее 0,035 %; Сu − менее 0,3 %. В сталях 15Х2НМФАА и 15Х3НМФАА (особовысококачественные стали) для повышения их радиационной стойкости ограничено содержание примесей:
Р ≤ 0,010 %; Сu ≤ 0,10 %; Sb ≤ 0,005 %; Sn ≤ 0,005 %. ** Сталь А1 − Чехословакия; остальные стали − США.
272
Таблица 23.46
Механические свойства*, критические температуры хрупкости и области применения сталей перлитного класса
|
Марка стали |
Термическая |
Т, °С |
σ , МПа |
σ0,2, |
δ, % |
ψ, % |
а |
, кДж/м2 |
Т , °С |
Применение |
|
|
обработка |
|
в |
МПа |
|
|
к |
|
х |
|
|
22К |
Нормализация |
20 |
430−520 |
215−300 |
21 |
45−50 |
600−850 |
≤ +40−50 |
Сосуды давления, |
|
|
|
(900 °С) + отпуск |
350 |
350 |
185−210 |
18 |
45 |
|
− |
− |
корпуса ВВЭР ма- |
|
|
(660 °С) |
500 |
290 |
200 |
19 |
60 |
|
− |
− |
лой и средней мощ- |
|
|
|
|
|
|
|
|
|
|
|
ности, корпуса па- |
|
|
|
|
|
|
|
|
|
|
|
рогенератора, ком- |
|
|
|
|
|
|
|
|
|
|
|
пенсаторов объема, |
273 |
|
|
|
|
|
|
|
|
|
|
емкостей САОЗ и |
|
|
|
|
|
|
|
|
|
|
другого вспомога- |
|
|
|
|
|
|
|
|
|
|
|
|
тельного оборудо- |
|
|
|
|
|
|
|
|
|
|
|
вания |
|
15М |
Нормализация |
20 |
550 |
− |
24 |
− |
|
− |
− |
То же |
|
|
(900−950 °С) |
500 |
400 |
− |
23 |
− |
|
− |
− |
|
|
|
|
550 |
330 |
− |
22 |
− |
|
− |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16ХМ |
Нормализация |
20 |
460−540 |
290−350 |
21−25 |
55−67 |
1200−2700 |
− |
Трубы перегревате- |
|
|
|
(900−920 °С) + |
400 |
500 |
250 |
23 |
69 |
|
1600 |
|
лей, паропроводов, |
|
|
от-пуск (630−650 |
500 |
450 |
270 |
20 |
75 |
|
− |
|
коллекторов, флан- |
|
|
°С) |
|
|
|
|
|
|
|
|
цы для длительной |
|
|
|
|
|
|
|
|
|
|
|
работы (до 500 °С) |
________
* Разбросы значений механических характеристик, а также Тх обусловлены различиями видов и сечений образцов для испытаний, условий испытания, содержания примесей (номера плавки).
273
Продолжение таблицы 23.46
|
Марка стали |
Термическая |
Т, °С |
σ , МПа |
σ0,2, |
δ, % |
ψ, % |
а |
, кДж/м2 |
Т , °С |
Применение |
|
|
обработка |
|
в |
МПа |
|
|
к |
|
х |
|
|
12Х1МФ |
Нормализация |
20 |
520 |
330 |
25 |
67 |
|
150 |
− |
Трубы пароперегре- |
|
|
или |
520 |
440 |
320 |
22 |
75 |
|
110 |
|
вателей, трубопро- |
|
|
закалка (950− |
580 |
300 |
210 |
25 |
66 |
|
− |
|
воды высокого и |
|
|
980 °С) + отпуск |
|
|
|
|
|
|
|
|
сверхвысокого дав- |
|
|
(720−760 °С) |
|
|
|
|
|
|
|
|
ления для длитель- |
|
|
|
|
|
|
|
|
|
|
|
ной службы (до |
|
|
|
|
|
|
|
|
|
|
|
585 °С). |
|
12Х2МФБ |
Закалка (1060− |
20 |
507 |
302 |
36 |
78 |
|
1400 |
− |
Трубы котельных |
|
|
1080 °С) + |
550 |
355 |
230 |
31 |
78 |
|
1790 |
|
установок, паропе- |
274 |
|
ОТПУСК (840−860 |
580 |
320 |
220 |
33 |
81 |
|
− |
|
регреватели, паро- |
|
°С) |
620 |
275 |
200 |
34 |
85 |
|
− |
|
проводы для дли- |
|
|
|
|
|
|
|
|
|
|
|
|
тельной работы (до |
|
|
|
|
|
|
|
|
|
|
|
570°С) |
|
15Х2МФА |
Закалка (920 °С ) |
20 |
570 |
490 |
15−23 |
55−75 |
|
2100 |
≤ −10÷+5 |
Корпусные свари- |
|
|
+ высокий отпуск |
350 |
495 |
410 |
14 |
71 |
|
2660 |
|
ваемые конструкции, |
|
|
(650 °С) |
|
|
|
|
|
|
|
|
обечайки, днище |
|
|
|
|
|
|
|
|
|
|
|
корпуса ВВЭР мощ- |
|
|
|
|
|
|
|
|
|
|
|
ностью до 440 МВт |
|
25Х3МФА |
Закалка + высо- |
20 |
750−950 |
630 |
16 |
70 |
1600−2300 |
− |
Несвариваемые де- |
|
|
|
кий отпуск |
350 |
660 |
600 |
16 |
65 |
|
− |
|
тали корпуса (флан- |
|
|
|
|
|
|
|
|
|
|
|
цы, крепеж и др.) |
|
|
|
|
|
|
|
|
|
|
|
ВВЭР |
|
10ХСНД |
Закалка + отпуск |
20 |
395−550 |
≥ 400−530 |
16−19 |
− |
|
≥ 490 |
−10 |
Металлоконструк- |
|
|
|
|
|
|
|
|
(800-1800) |
|
ции канальных ки- |
|
|
|
|
350 |
− |
350 |
− |
− |
|
− |
|
пящих реакторов |
|
|
|
|
|
|
|
|
|
|
|
|
274
275
Марка стали |
Термическая |
Т, °С |
σв, МПа |
σ0,2, |
δ, % |
ψ, % |
|
обработка |
МПа |
||||||
|
|
|
|
|
|||
|
Закалка (890− |
|
|
|
|
|
|
|
920 °С) + отпуск |
|
|
|
|
|
|
10ХН1М |
(680−700 °С) |
20 |
550 |
450 |
16 |
− |
|
|
|||||||
|
350 |
450 |
360 |
15 |
− |
||
|
|
||||||
|
|
|
|
|
|
− |
|
10ХН2МА |
Закалка (920 °С) |
20 |
530 |
400 |
− |
||
|
+ отпуск (660 °С) |
350 |
500 |
300 |
− |
− |
|
|
|
|
|
|
|
50 |
|
10Н3МФА |
Нормализация |
20 |
500−650 |
350−540 |
18 |
||
|
− |
350 |
400−580 |
330−450 |
17 |
50 |
|
|
или закалка (900 |
400 |
− |
− |
|||
|
920 °С) + отпуск |
≤ 525 |
≤ 390 |
||||
|
(645−660 °С) |
500 |
≤ 510 |
≤ 370 |
− |
− |
|
|
|
|
|
|
|
55 |
|
10ГН2МФА |
Закалка (920 °С) |
20 |
550 |
350 |
16 |
||
|
+ отпуск (650− |
350 |
500 |
300 |
14 |
50 |
|
|
670 °С) |
|
|
|
|
|
|
|
|
|
|
|
|
55 |
|
15Х2НМФА |
Закалка (920 °С) |
20 |
560−620 |
450−550 |
15−20 |
||
(15Х2НМФАА) |
+ отпуск (650 °С) |
350 |
|
|
18 |
− |
|
|
|
500−550 |
400−450 |
||||
|
|
|
48 50 |
||||
|
|
|
|
|
|
60 |
|
15Х3НМФА |
Закалка (920 °С) |
20 |
600−750 |
500 |
14 |
||
(15Х3НМФАА) |
+ отпуск (645 °С) |
350 |
500 |
450 |
12 |
50 |
|
|
|
||||||
|
|
|
|
|
|
|
Окончание таблицы 23.46
а |
, кДж/м2 |
Т , °С |
Применение |
к |
|
х |
|
Сосуды высокого давления ВВЭР,
−металлоконструк- −10÷+10 ции канальных ки-
−пящих реакторов (взамен сталей 22К и 10ХСНД)
≥800 ≤ −20÷0 Свариваемые детали
1500−2600 корпуса, обечайки
980−1460 ≤ −30÷+20 Взамен стали 22К
−
−
−
≥ 400 ≤ +15 Взамен стали 22К (400−2300
) |
|
≥ 400−600 ≤ −10÷0 |
Массивные узлы |
(1500−2900) |
деталей корпусов |
−ВВЭР, фланцы, обечайки
≥ 600 |
≤ −10 То же |
(1500−2900) |
|
− |
|
275
Анализ состава перлитных сталей показывает, что они представляют собой систему Fe−С, легированную Cr, Ni, Mo и V.
Хром вводится с целью повышения сопротивления стали окислению (коррозии). Наряду с этим добавка хрома способствует улучшению прокаливаемости стали в массивных заготовках, обеспечению высокого отпуска (Т > 650 °С) сварных швов с целью уст-
ранения остаточных напряжений (Сr повышает Ac1 ), обеспечению
высоких механических свойств в зоне термического влияния сварных соединений вследствие ускорения карбидообразования при отпуске. Однако при увеличении содержания хрома в стали более 2 % снижается ее ударная вязкость, а также настолько значительно снижается критическая скорость закалки, что, например, сталь с 2÷2,5 % Сr, содержащая около 1 % Мо, при охлаждении на воздухе приобретает склонность к образованию хрупкой мартенситной структуры, что создает значительные технологические трудности при деформации (обработке давлением), сварке и других операциях в процессе изготовления трубопроводов, различных изделий и конструкций.
Никель улучшает прокаливаемость перлитной стали путем замедления распада аустенита, повышает прочность стали вследствие упрочнения ферритной составляющей перлитной структуры. При определенных условиях Ni несколько снижает Тх. Однако при содержании Ni более 1,5−2 % повышается чувствительность стали к отпускной хрупкости вследствие вытеснения углерода на границы зерен и образования там легкокоагулирующих карбидов хрома. При содержании Ni более 3 % повышается Тх. Особенно сильно Ni охрупчивает сталь совместно марганцем.
Молибден является одним из упрочнителей ферритной фазы. Растворяясь в феррите, Мо увеличивает энергию связи атомов и энергию активации самодиффузии Fe и, следовательно, упрочняет ферритную фазу, повышает температуру рекристаллизации, увеличивает длительную прочность. Так, длительная прочность стали 15М при 500 °С за 105 ч равна 90 МПа, что в 2,5 раза больше длительной прочности нелегированной стали Ст15. Феррит, легированный молибденом, сохраняет прочность до 450 °С (рис. 23.138).
276
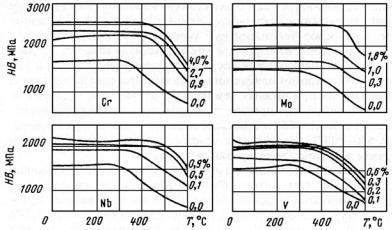
Рис. 23.138. Зависимость твердости феррита от температуры испытания при различной концентрации легирующего элемента
(после закалки в воду от 1200 °С)
При повышенных температурах происходит частичное перераспределение Мо из феррита в карбидную фазу, при этом повышается устойчивость сложных карбидов, но несколько снижается длительная прочность. Например, σдл стали с 0,17 % С и 0,55 % Мо в исходном состоянии при 500 °С на базе 104 ч составляет 185 МПа, а скорость ползучести при σ = 60 МПа примерно равна 0,5 10-5 %/ч. После эксплуатации при 510 °С и давлении 13 МПа в течение 2,5 104 ч длительная прочность снижается (до 120 МПа), а скорость ползучести возрастает (примерно до 10-5 %/ч).
При добавке до 0,6 % Мо повышается устойчивость стали к тепловой хрупкости. Совместно с Сr молибден способствует соз-
данию волокнистой морфологии карбидов, повышающих проч-
ность стали.
Однако при содержании Мо более 1% снижается ударная вязкость, усиливается обратимая тепловая хрупкость и, как будет показано ниже, снижается коррозионная стойкость стали. Кроме того, у молибденовых сталей есть еще одна опасная форма нестабильности СФС. Карбиды цементитного типа М3С в процессе длительной эксплуатации при высоком давлении и температуре
277
450−500 °С склонны к диссоциации с выделением свободного углерода в виде графита, особенно в зонах вблизи сварного шва. В результате интенсивного выделения графита по границам зерен возможно хрупкое разрушение изделия. Явлению графитизации, как правило, предшествует интенсивная сфероидизация карбидов перлита.
Упрочнение феррита, а также повышение структурной стабильности молибденовой стали достигается дополнительным легированием хромом в количестве 0,5−1 %, способствующим образованию термодинамически более стойких карбидов (Fe, Cr)3C. При таком легировании исключается процесс графитизации и, кроме того, возникают благоприятные условия для сохранения Мо в твердом растворе. В результате этого снижается скорость диффузии углерода, наблюдается рост структурной стабильности и жаропрочности хромомолибденовых сталей, что дает возможность применять их при рабочей температуре до 480−540 °С. Дальнейшее повышение жаропрочности малолегированных хромомолибденовых сталей, обеспечивающее надежную работу при температуре 530−580° С, достигается усложнением их состава главным образом в результате легирования ванадием.
Ванадий обеспечивает упрочнение стали за счет образования карбидов. Совместно с Cr, Ni и Мо, ванадий способствует образованию волокнистого перлита, что также повышает прочность стали. Однако при повышении содержания V сверх 0,35 % (допустимое отношение V:C < 3÷4) усиливается склонность стали к растрескиванию в процессе сварки и снижается ее корозионная стойкость. Роль V состоит в том, что он, являясь основным карбидообразующим элементом, приводит к выделению дисперсных упрочняющих матрицу частиц − фаз внедрения VC, имеющих по сравнению с карбидами хрома более низкие значения свободной энергии образования (см. рис. 23.126). В составе карбида ванадия (VC) соотношение масс С и V примерно равно четырем.
Таким образом, практически весь углерод, имеющийся в стали (см. табл. 23.45), идет на образование карбидов типа МС, а Сr остается преимущественно в твердом растворе. Наличие в структуре высокодисперсных карбидов VC, образующихся за счет других,
278
менее стабильных карбидов, обеспечивает существенное увеличение жаропрочности.
Содержание углерода в большинстве перлитных сталей, применяемых в ядерном реакторостроении при повышенной температуре (до 600 °С) и большом давлении, ограничено (0,08−0,15 %). В результате этого уменьшается количество карбидной фазы и достигается более высокая стабильность СФС, поскольку менее интенсивно развиваются процессы сфероидизации и коагуляции карбидных фаз. Повышение содержания углерода выше указанного уровня приводит к ускоренной коалесценции карбидов и обеднению твердого раствора главным образом молибденом. Уход Мо из твердого раствора вызывает снижение прочностных свойств сталей. В сталях, используемых для изготовления корпусов и крышек реакторов, а также для крепежных изделий, содержание углерода выше (0,22−0,47 %) и, следовательно, карбидное упрочнение более эффективно. Детали из этих сталей обычно работают при более низкой температуре, и в этом случае опасность разупрочнения в результате коагуляции карбидных фаз минимальна. Кроме того, при разработке сталей учитывается также и то, что все трубные стали должны хорошо свариваться и, следовательно, иметь ограниченное содержание углерода. Например, сталь с повышенным содержанием углерода (25Х3МФА) предназначается для несвариваемых деталей (фланцы, крепеж и др.); из сталей 15Х2МФА и 12Х2МФА с меньшим содержанием углерода изготавливались обечайки, днище корпуса и другие свариваемые детали реакторов ВВЭР первого поколения.
В настоящее время для корпусов реакторов ВВЭР-440 используется сталь 15Х2МФАА. Вторая буква А означает что эта сталь повышенной чистоты. Необходимость повышения чистоты стали возникла в связи с тем, что в стали 15Х2МФА было повышенное содержание Cu и P, в особенности − в сварных швах, где содержание фосфора в некоторых случаях достигало 0,04−0,05 %, а содержание меди > 0,2 %. Это приводило к ухудшению радиационной стойкости сварных швов, росту Тх. Повышенная чистота стали была достигнута за счет применения для выплавки стали только первородной шихты, а также строгого ограничения содержания P и Cu в сварочных материалах. В настоящее время техническими
279
условиями содержание фосфора ограничено 0,01 %, содержание меди 0,1 %. Реально содержание Cu и P в сварном шве корпусов реакторов второго поколения еще меньше: фосфора – до 0,006 %, меди – до 0,08–0,04 %. Подобная чистота предусмотрена и для стали 15Х2МФАА, о которой речь пойдет ниже. Такая же чистота предусмотрена и для вновь разрабатываемых сталей нового поколения, рассчитанных на время эксплуатации в течение 60 лет.
Рис. 23.139. Эволюция химического состава сталей для корпусов энергетических ядерных реакторов (Г.П. Гарзов, В.А. Николаев, Г.Н. Филимонов)
280
Схема на рис. 23.139 иллюстрирует общую тенденцию снижения примесей и изменения химического состава современных реакторных корпусных сталей.
Поскольку обеспечение заданного ресурса корпуса реактора определяется абсолютным значением Тх в конце проектного срока эксплуатации, важно получать сталь не только с низким темпом радиационного охрупчивания, но и с исходной низкой критической температурой вязко-хрупкого перехода. Для этого необходимо производить быстрое охлаждение металла в центральной зоне заготовок. Вследствие этого для увеличения прокаливаемости заготовок крупных сечений было принято решение увеличить содержание хрома с 2,5 до 2,7 % и дополнительно легировать сталь никелем в таком количестве, которое, повышая прокаливаемость, не приводит к увеличению радиационного охрупчивания. В результате были созданы две модификации стали: 15Х3МФА мод. А с содержанием 0,2−0,4 % Ni и 15Х3МФА мод. Б с содержанием 0,6−0,8 % Ni. Первая рекомендуется для изготовления поковок поперечным сечением до 450 мм, вторая − до 540 мм.
Основными факторами упрочнения ферритно-перлитных сталей являются твердорастворное и зернограничное упрочнения. Как правило, доля других компонентов упрочнения не превышает в сумме 20 %, т. е. они не вносят существенного вклада в предел текучести низколегированной стали. На практике наиболее целесообразно использовать дисперсионное упрочнение, так как карбонитридные фазы вызывают упрочнение не только вследствие собственного вклада, но и косвенного воздействия на зернограничное упрочнение вследствие измельчения зерна.
Оценка предела текучести низколегированных ферритноперлитных сталей показала, что доля отдельных компонентов упрочнения в общем пределе текучести сталей разная. Ориентировочно σт может быть представлена формулой
σт = σ0 + Δσт.р + Δσп + Δσд + Δσд.у + Δσз (или Δσс), (24.44)
где учет вклада каждой компоненты приведен в табл. 23.47.
281
Таблица 23.47
Характеристика предела текучести низколегированных ферритно-перлитных сталей
|
|
|
|
|
|
Ориентиро- |
Элементы, уве- |
||||
|
|
|
|
|
|
вочная доля |
личивающие |
||||
Компоненты |
Расчетная формула |
компонента |
данный компо- |
||||||||
упрочнения |
упрочнения* |
упрочнения в |
нент упрочне- |
||||||||
|
|
|
|
|
|
пределе теку- |
ния |
||||
|
|
|
|
|
|
чести, % |
|
||||
Напряжение трения |
|
|
|
|
-4 |
5 |
|
10 |
|
||
решетки 0 |
0 = 2G 10 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
Легирование -твердого |
т.р = |
KiCi |
25 40 |
Mn, Si, Ni, P |
|||||||
раствора т.р |
|
|
|
|
|
|
|||||
|
|
|
1 |
|
|
|
|
|
|
|
|
Перлит П |
П = 2,4 % П |
5 15 |
С, Mn, Ni, Сr, |
||||||||
|
|
|
|
|
|
|
|
|
|
|
Мо |
Деформационное |
|
= |
|
1/2 |
3 |
|
5 |
|
|||
упрочнение д |
д |
|
дMG |
д |
|
|
|||||
Дисперсионное |
|
д.у = |
|
20 25 |
V, Nb, Ti (Al, N |
||||||
упрочнение д.у |
= 0,85M(Gb/2 ) |
|
|
|
|
|
в нитридах) |
||||
|
Фln( /2b) |
|
|
|
|
|
|
||||
Зернограничное упроч- |
з = Kуd-1/2 |
30 40 |
V, Nb, Ti (Al, N |
||||||||
нение з (или суб- |
( с = Kсl-1) |
|
|
|
|
|
в нитридах) |
||||
структурное упрочне- |
|
|
|
|
|
|
|
|
|
|
|
ние с) |
|
|
|
|
|
|
|
|
|
|
|
______
*Здесь 0 теоретически рассчитанное значение напряжения Пайерлса Набарро; G модуль сдвига металла ( -Fe ); Ki коэффициент упрочнения феррита, представляющий собой прирост предела текучести при растворении в нем 1 % i-го легирующего элемента (табл. 23.48); Сi концентраия i-го легирующего элемента, растворенного в феррите (а не в стали в целом); П упрочнение за счет перлита, которое определяется его содержанием и дисперсностью перлитной составляющей в структуре стали; 2,4 эмпирический коэффициент с размерностью МПа / % П; д коэффициент, зависящий от характера взаимодействия дислокаций; М ориентационный множитель (для -Fe М = 2,75, дМ 0,5), b вектор Бюргерса (b 0,25); д плотность дислокаций; среднее расстояние между центрами частиц; Ф коэффициент, характеризующий тип взаимодействующих с частицами дислокаций (для сталей Ф = 1,25); Kу коэффициент, МПа м1/2 (для Ф П сталей Kу = 0,57 0,73); d размер зерна феррита; при субструктурном упрочнении Kc коэффициент, характеризующий строение субструктурных границ с размерностью МПа м (для Ф П сталей Kс = 1,5 10-4); l размер субзерен.
282
Таблица 23.48
Значения Ki (МПа/1%) для легирующих элементов, входящих в состав феррита
Элемент |
C + N |
Р |
Si |
Ti |
Al |
Сu |
Mn |
Cr |
Ni |
Mo |
V |
Ki |
4670 |
690 |
85 |
80 |
60 |
40 |
35 |
30 |
30 |
10 |
3 |
Термическая обработка перлитных сталей
Методами термической обработки можно существенно изменить структурное состояние и свойства перлитной стали (табл. 23.49; рис. 23.140).
Таблица 23.49
Зависимость предела текучести и температуры хрупко-вязкого перехода перлитных сталей от режима термообработки
Марка ста- |
Вид по- |
Режим термообработки |
Микрострук- |
0,2, |
Тх, °С |
луфабри- |
|||||
ли |
ката |
|
тура |
МПа |
|
|
|
|
|
|
|
15Х2МФА |
Плита |
Закалка (990 1000 °С), |
Сорбит отпус- |
640 |
10 |
|
толщиной |
масло + отпуск(690 |
ка |
|
|
|
120 мм |
710 °С, 10 ч), воздух |
|
|
|
|
|
Нормализация |
Феррит + пер- |
350 |
5 |
|
|
(990 1000 °С), воздух |
лит (1:1) |
|
|
|
|
+отпуск (700 °С, 10 ч), |
|
|
|
|
|
воздух |
|
|
|
|
Обечайка |
Закалка (1000 °С), мас- |
Сорбит отпус- |
490 |
40 |
|
толщиной |
ло + отпуск (700 °С, 18 |
ка |
|
|
|
180 мм |
ч), воздух |
|
|
|
|
|
Нормализация |
То же |
560 |
30 |
|
|
(1120 °С), воздух + от- |
|
|
|
|
|
пуск (690 °С), воздух |
|
|
|
15Х2НМФА |
Плита |
Закалка (890 °С), вода + |
Сорбит отпус- |
730 |
+20 |
|
толщиной |
отпуск (630 °С, 20 ч), |
ка (мелкодис- |
|
|
|
200 мм |
воздух |
персный) |
|
|
|
|
|
Сорбит отпус- |
630 |
+10 |
|
|
|
ка (грубый) |
|
|
283
Рис. 23.140. Влияние температуры отпуска на механические свойства (а) и температуру хрупко-вязкого перехода (б) закаленных сталей марок 15Х2МФА (1) и 15Х2НМФА (2)
Обычно для сталей перлитного класса применяют закалку с 900−1000 °С. При этом перлитное превращение задерживается настолько, что представляется возможным осуществлять охлаждение деталей с большим сечением на воздухе.
Закалка дает высокую твердость, низкую пластичность и большие внутренние напряжения детали. После закалки микроструктура стали (например, 15Х2МФА) представляет собой мартенсит, раздробленный в пределах больших аустенитных зерен на отдельные колонии, внутри которых группируются рейки шириной по-
рядка 0,3 мкм с разориентировкой 1−2° и плотностью дислокаций около 1015 м-2.
В температурном интервале отпуска примерно до 600 °С общий характер микроструктуры не изменяется, однако становится заметным выделение карбидных фаз. Так, после отпуска при 600 °С частицы с размерами 15−20 нм и средней объемной плотностью около 1021 м-3, располагающиеся на дислокациях, равномерно распределены по объему мартенситных реек. Более крупные выделения, имеющие форму игл с поперечным размером примерно 25 и длиной 200 нм, располагаются вблизи сильно разориентированных границ или на этих границах. Выделения данного типа идентифицированы как карбиды типа М7С3.
Последующий высокий отпуск восстанавливает пластичность, упругую вязкость и снижает прочность. Началу разупрочнения
284
стали при отпуске отвечает формирование структуры сорбита. Изменяется и морфология карбидных фаз: мелкодисперсные частицы округлой формы размерами около 25 нм располагаются преимущественно в узлах дислокационной сетки, а имеющиеся более крупные выделения диаметром порядка 200 нм − на стыках границ ячеек.
Физико-химический анализ выявил в перлитной стали 15Х2МФА наличие ряда карбидов, эффективность действия которых на структурные изменения возрастает в последовательности:
Fe3C → (Fe, Cr)3C → (Fe, Cr, Mo)7C3 → VC.
Перлитные стали типа 15Х2МФА подвержены отпускной хрупкости, которая проявляется в виде максимума на кривой зависимости Тх от Тотп (рис. 23.140, б). Склонность к отпускной хрупкости существенно снижена в стали 15Х2НМФА. Вероятной причиной повышенной хрупкости стали 15Х2МФА может быть наличие повышенной концентрации ванадия − сильного карбидообразователя, связывающего углерод. Косвенно это представляется сравнением содержания ванадия и Тх в сталях 5Х2НМФА и 15Х2МФА (см.
рис. 23.140, б и табл. 23.45).
Оптимальное сочетание прочностных свойств с пластичностью, ударной вязкостью при относительно низкой Тх обеспечивает лишь высокий отпуск (см. рис. 23.140), при котором формируется структура, близкая к зернистому сорбиту. Для достижения максимально возможного низкого значения Тх сталей 15Х2МФА и 15Х2НМФА при сохранении высокого уровня σ0,2 температуру отпуска сталей выбирают выше 650 °С (см. табл. 23.46 и 23.49, рис. 23.140).
Чем выше планируемая рабочая температура стали, тем сложнее ее состав по легирующим добавкам. При этом важным является поиск оптимального сочетания карбидообразующих элементов (С, Сr, Мо, V и др.) с элементами, упрочняющими твердый раствор
(Ni, Mn и др.).
Поскольку перлитные стали предназначены для длительной работы (более 30 лет), а это связано с сохранением стабильности СФС, их обычно используют или в отожженном состоянии, или после нормализации (при 1000 °С) с последующим высоким отпуском (650−750 °С). В зависимости от состава и термической обра-
285
ботки стали перлитного класса могут иметь структуру от феррит- но-перлитной до сорбитной.
Коррозионная стойкость перлитных сталей
Работоспособность корпусов реакторов типа ВВЭР первого поколения, не имеющих защитной аустенитной наплавки, в значительной степени определяется сопротивлением стали окислению на воздухе и коррозии в воде в условиях высокого давления и нейтронного облучения. Прежде чем рассмотреть меры повышения коррозийной стойкости стали, проведем анализ взаимодействия железа с кислородом и стадий формирования окалины, особенностей ее роста. Процесс окисления зависит от температуры и происходит многостадийно. На начальных стадиях − это чисто химический процесс, т. е. соединение кислорода и железа, а в дальнейшем включается диффузия атомов кислорода и металла через многофазный оксидный слой.
Железо образует три устойчивых оксида (рис. 23.141).
1. Вюстит FeO − проводник р-типа с кристаллической решеткой типа NaCl. Этот оксид имеет необычайно большую концентрацию катионных дефектов решетки (избыток кислорода), через которые со сравнительно высокой скоростью диффундируют преимущественно катионы железа. Закись железа при температуре ниже 570 °С нестабильна и распадается на магнетит и Fe согласно реакции
4FeO → Fe3O4 + Fe.
2.Магнетит Fe3O4 также имеет избыток кислорода, но меньший, чем вюстит, поэтому в нем ниже и концентрация дефектов. В магнетите происходит диффузия как катионов, так и анионов. Кристаллическая структура магнетита изоморфна структуре шпинели.
3.Гематит Fe2O3 является полупроводником n-типа. В нем диффундируют преимущественно анионы. Оксид Fe2O3 обладает ромбоэдрической структурой с минимальной концентрацией дефектов и поэтому в наибольшей степени препятствует дальнейшему окислению железа.
286
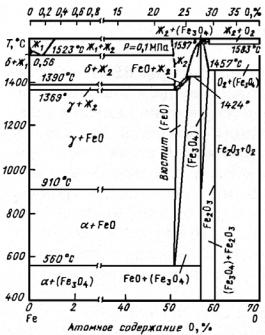
Рис. 23.141. Диаграмма состояния системы Fe−О
При температуре до 200−250 °С и нормальном давлении воздуха на поверхности железа образуются тонкие пленки оксида Fe2O3; при температуре до 570°С (эвтектоидная точка на диаграмме Fe−О) пленка оксидов состоит из Fe3O4 и Fe2O3; при температуре выше 570 °С окалина включает в себя все три оксида с преимущественным содержанием закиси железа FeO (ориентировочное соотноше-
ние оксидов FeO:Fe3O4:Fe2O3= 100:10:1).
Образование значительного количества вюстита в оксидных пленках при температуре выше 570 °С способствует существенному снижению их защитных свойств, и при нагреве даже в течение сравнительно малого времени на поверхности железа образуется толстый слой окалины. Во влажном воздухе в результате электрохимической коррозии поверхность железа покрывается слоем гидроокислов Fe(OH)3, Fe(OH)2, т. е. образуется ржавчина.
287
Повышение сопротивляемости сталей окислению в кислородо-
содержащих средах заключается, в основном, в строгом соблюдение принятых норм водоподготовки ВВЭР.
В деаэрированной среде при температуре до 300 °С стационарный потенциал перлитной стали отвечает области пассивации на поверхности образуется защитная оксидная пленка, замедляющая коррозию. Переход от кислых сред к нейтральным и щелочным значительно замедляет коррозионные процессы. При температуре 300 С и рН = 11 12 скорость коррозии низколегированной стали минимальна, при больших и меньших значениях рН она возрастает. Скорость коррозии перлитных сталей возрастает при увеличении в воде содержания кислорода, при наличии ионов хлора и углекислоты, которая уменьшает рН. Увеличение скорости потока теплоносителя до 10 12 м/с также приводит к увеличению скорости коррозии при повышенной температуре, что связано, по-видимому, с улучшением доставки кислорода к поверхности металла и частичным разрушением пленки магнетита Fe3O4.
Для создания на перлитных сталях защитной пленки применяется также обработка специальными веществами так называемыми комплексонами, например трилоном Б (комплексон III, C10H18O10N2Na2). При такой обработке при соответствующих температурах на поверхности труб образуется прочно сцепленная с металлом равномерная пленка магнетита Fe3O4, обладающая высокими защитными свойствами.
Легирование является эффективным средством повышения коррозионной стойкости металлов. Наиболее важным легирующим элементом, увеличивающим сопротивление окислению железа и сталей при повышенной температуре, является Сr (рис. 23.142). Хромистые стали благодаря образованию плотной и прочной защитной пленки оксидов относятся к категории лучших технических сплавов с повышенным сопротивлением окислению в газовой и паро-водяной средах. На первых этапах окисления на поверхности образцов хромистых сталей окисляются и Fe, и Сr с образованием оксидов Сr2О3 и FeO, причем в начале процесса окисления в поверхностном слое преобладают оксиды железа.
288
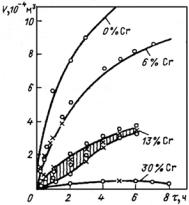
До |
настоящего |
времени |
нет |
|
|
полной ясности, в каком виде на- |
|
||||
ходится Сr в защитной пленке при |
|
||||
длительном |
окислении, поскольку |
|
|||
состав и структура оксидных пле- |
|
||||
нок зависят от многих факторов − |
|
||||
концентрации легирующих элемен- |
|
||||
тов, температуры и времени окис- |
|
||||
ления. При длительном окислении |
|
||||
наблюдается |
общая |
закономер- |
|
||
ность − обогащение железом внеш- |
|
||||
него слоя окалины и обогащение |
|
||||
легирующим |
элементом внутрен- |
Рис. 23.142. Кинетика окисления |
|||
него слоя, прилегающего к метал- |
сплавов Fe−Cr при 1000 °С |
||||
лической подложке. В связи с этим |
(зависимость объема |
||||
во внешних слоях защитного слоя |
поглощенного кислорода |
||||
часто |
наблюдается |
преимущест- |
от времени выдержки) |
||
венное присутствие твердых |
рас- |
|
|||
творов |
в оксидах железа типа (Fe, Cr)2O3; в более глубоких сло- |
||||
ях преимущественное присутствие соединения FeO Cr2O3.
При повышении температуры окисления различие в составе оксидных пленок увеличивается: поверхностный слой пленки значительно обогащается оксидами железа. Защитные свойства пленки оксидов улучшаются при увеличении содержания в ней Сr2О3. Поскольку плотности оксидов Fe2O3 и Сr2О3 близки (соответственно 5100÷5200 кг/м3 и 5210 кг/м3), обогащение защитных пленок оксидом не приводит к дополнительным обьемным изменениям и напряжениям, которые могли бы вызывать их разрушение.
На рис. 23.143 приведены концентрации Сr, обеспечивающие высокое сопротивление окислению в зависимости от рабочей температуры. Достаточная жаростойкость при рабочей температуре 700 °С обеспечивается содержанием в стали 5 % Сr. При рабочей температуре 1000−1100 °С содержание Сr в стали необходимо увеличить до 15−25 %.
289
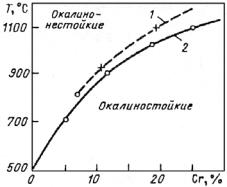
Жаростойкость сталей повышает легирование Si и Аl, которые образуют первичные оксиды SiO2 и Аl2О3 со свободными энергиями их образования более низкими, чем у Сr2О3 (см. рис. 23.8).
Рис. 23.143. Влияние концентрации Сr на сопротивление окислению хромоникелевых (1) и хромистых (2) сталей
Взависимости от температуры окисления и состава сплава SiO2
иАl2О3 взаимодействуют с оксидами железа, и в пленке возникают
как твердые растворы, так и соединения FeO SiO2 и FeO Al2O3. Более высокое сопротивление окислению сталей, легированных Аl и Si, можно объяснить снижением диффузионной подвижности ионов Fe в указанных фазах.
По сравнению с оксидами Fe и Сr оксиды Si и Аl имеют более низкую плотность ( ρSiO2 = 3960 кг/м3, ρAl2O3 = 2200 кг/м3). Поэтому совместное присутствие в оксидных пленках железа оксидов Si или Аl может привести к значительным объемным изменениям, возникновению напряжений и разрушению защитных пленок. Повидимому, это одна из причин того, что легирование сталей значительным количеством только Si или Аl не дает желаемого эффекта: оксидные пленки обладают низкой прочностью. К этому необходимо добавить, что повышенная концентрация в стали Si (более 4 %) и Аl (выше 1,0−1,5 %) отрицательно сказывается на технологических свойствах − стали становятся малопластичными и склонными к хрупкому разрушению.
290
Максимальное повышение жаростойкости дает одновременное легирование несколькими элементами: Сr и Si, Сr и Аl или Cr, Si и Аl. При этом легирование Сr повышает сопротивление окислению в наибольшей степени, Si и Аl только усиливают действие Сr и в качестве элементов, увеличивающих сопротивление окислению сталей, не имеют самостоятельного значения. Другие легирующие элементы играют второстепенную роль в процессах окисления.
Никель в небольших количествах (2−3 %) практически не оказывает положительного влияния на подавление окисления стали. Поэтому стали, легированные одновременно Сr и Ni, окисляются подобно сплаву Fe−Сr.
Введение в перлитные стали в небольших количествах Мо (0,5−0,7 %) и V (0,1−0,35 %) может оказать положительное влияние на торможение окисления из-за торможения диффузионного массопереноса атомов в стали. Однако при превышении указанных количеств Мо и V возможна интенсификация окисления вследствие возможного образования низкоплавких рыхлых оксидов V2O5
(Тпл = 660 °С) и МоО3 (Тпл = 795 °С).
Применение перлитных сталей в атомной технике
В связи с высокими требованиями, предъявляемыми к конструкционным материалам ядерных реакторов, среди которых важное место занимают пределы прочности и текучести, малая чувствительность к концентраторам напряжений, высокая прокаливаемость и малая чувствительность к отпускной хрупкости, углеродистые стали находят ограниченное применение в реакторостроении. Для изделий более крупного сечения нашли широкое применение хорошо освоенные промышленностью перлитные и легированные стали, обладающие большей прокаливаемостью и лучшими механическими свойствами (табл. 23.50).
По мере накопления опыта реакторостроения выяснилась целесообразность замены в ряде случаев хромоникелевой коррозионностойкой стали на стали перлитного класса. Это не только снижает стоимость атомных электростанций, но и технически оправдано. Например, перлитные стали не подвержены межкристаллитной коррозии и коррозионному растрескиванию. В настоящее время
291

перлитные стали применяются в ядерных реакторах для изготовления трубопроводов, парогенераторов, корпусов и крышек реакторов, теплообменников и других узлов, работающих в контакте с водой, паром или жидкими металлами (например, Na или системой Na−K) в интервале температур 250−580 °С (см. табл. 23.46).
Таблица 23.50
Условия эксплуатации оборудования АЭС и используемые материалы1
|
Оборудование первого контура |
Условия |
|
||
Реактор |
эксплуатации |
Сталь |
|||
Тип |
Габариты2, |
р, |
Т, °С |
||
|
|
мм |
МПа |
|
|
ВВЭР-440 |
Корпус реактора |
3840/140 |
12,2 |
265−295 |
15Х2МФА |
|
Парогенератор |
3260/120 |
5,7 |
273 |
22К |
|
Главный |
560/32 |
12,2 |
265−295 |
08Х18Н10Т |
|
циркуляционный |
|
|
|
|
|
трубопровод |
|
|
|
|
ВВЭР-1000 |
Корпус реактора |
4535/190 |
15,7 |
290−320 |
15Х2НМФА |
|
Парогенератор |
4290/145 |
6,3 |
279 |
10ГН2МФА |
|
Главный |
290/55 |
15,7 |
290−320 |
10ГН2МФА |
|
циркуляционный |
|
|
|
|
|
трубопровод |
|
|
|
|
|
Паропровод |
630/25 |
6,4 |
287 |
16ГС |
|
Трубопровод |
159/6 |
5,7 |
180 |
08Х18Н10Т |
|
питательной воды |
|
|
|
|
РБМК-1000 |
Сепаратор |
2300/105 |
7,6 |
260−275 |
22К+сплав |
|
|
|
|
|
ЭИ898 |
|
Напорный |
1040/70 |
8,5 |
260−275 |
22К+сплав |
|
коллектор |
|
|
|
ЭИ898 |
|
Высасывающий |
1020/70 |
7,6 |
260−275 |
22К+сплав |
|
коллектор |
|
|
|
ЭИ898 |
|
Трубопровод |
828/38 |
8,5 |
260−275 |
22К+сплав |
|
Ду800 |
|
|
|
ЭИ898 |
|
Опускной |
325/16 |
7,6 |
270−290 |
08Х18Н10Т |
|
трубопровод |
|
|
|
|
|
Трубопровод |
426/24 |
5,7 |
177−190 |
Ст20 |
|
питательной воды |
|
|
|
|
1Г.П. Карзов и др. // Вопросы материаловедения, 2005. № 2(42). С. 92.
2В числителе − диаметр, в знаменателе − толщина.
292
Стали перлитного класса по сравнению с хромоникелевыми коррозионно-стойкими сталями обладают более высокой теплопроводностью [33,5−50,2 Вт/(м К) вместо 12,6−16,7 Вт/(м К)] и одновременно более низким коэффициентом линейного термического расширения [(12,3−13,4) 10-6 К-1 по сравнению с (15−17) 10-6 К-1], что очень важно для снижения термических напряжений в изделиях. Перлитные стали, кроме того, обладают хорошими технологическими свойствами − способностью к деформации и сварке, что имеет существенное значение при изготовлении различных деталей и узлов реактора.
Испытания и накопленный опыт применения сталей показывают перспективность применения теплоустойчивых композиций Fe−Cr−Mo−V, Fe−Cr−Ni−Мо−V и некоторых других в атомной энергетике.
Стали Fe−Cr−Mo и Fe−Cr−Mo−V применяют для корпусов водоводяных реакторов под давлением до мощности 440 МВт, для энергетических транспортных реакторов (например, для ледоколов). Изготовление металлоконструкций канальных кипящих реакторов (РБМК), условия работы и требования к материалам которых менее жесткие, чем для корпусов ВВЭР, первоначально осуществлялось из низколегированной стали 10ХСНД.
В настоящее время вместо стали 10ХСНД применяется более прочная и высокотехнологичная сталь 10ХН1М, а для массивных узлов и деталей корпусов реакторов типа ВВЭР созданы стали 15Х2МФАА, 15Х2НМФАА и 15Х3НМФАА. Все разработанные стали отличаются от ранее применявшихся в отечественном реакторостроении и от сталей, используемых за рубежом для аналогичного оборудования, более высокой прочностью в сочетании с повышенной вязкостью и технологичностью при сварке. Сталь марки 10ХН1М практически не склонна к тепловой хрупкости в интервале температур 340−450 °С, однако обеспечивает полную прокаливаемость лишь при толщине до 50 мм. Поэтому для изделий толщиной 200 мм и более применяют сталь аналогичного состава, но с более высоким содержанием Ni (см. табл. 23.45), который увеличивает прокаливаемость. Кроме того, Ni благоприятно влияет и на
293
повышение сопротивления хрупкому разрушению стали (см. табл. 23.46). Для изготовления деталей большой толщины (до 600 мм) применяют стали Cr−Ni−Mo−V с содержанием Сr до 3 %. Для корпуса ВВЭР-1000 была впервые применена сталь 15Х2НМФАА с σ0,2 > 450 МПа при 350 °С. Вначале предполагалось для этой цели использовать сталь 15Х2НМФА, но затем было принято решение использовать сталь повышенной чистоты по причине, о которой говорилось выше. Сталь 15Х2НМФА была использована только в одном корпусе (5-й блок НВАЭС) для опорной обечайки, где нейтронный поток существенно ниже, чем на обечайки активной зоны.
По сравнению с аналогичной сталью 15Х2МФАА без никеля сталь 15Х2НМФАА имеет преимущества по прочности, пластичности, вязкости и лучшую прокаливаемость. Вместе с тем повышение содержания никеля выше определенного предела (≈1,3 %) существенно ухудшает радиационную стойкость стали. Поэтому содержание никеля в стали ограничено величиной 1,3%. Кроме того, никель способствует сегрегации фосфора на границах зерен, увеличивая долю межзеренного разрушения при облучении. Поэтому для корпусов нового поколения была предложена сталь с содержанием никеля не более 0,68 %. (В американской стали типа А-533В, используемой для корпусов реакторов за рубежом, содержание никеля ограничено 0,8 %). Эта сталь должна обеспечить безопасную эксплуатацию корпусов в течение 60 лет. Однако в виду того, что в настоящее время как за рубежом, так и в России ставится вопрос о сроке службы АЭС с реакторами PWR и ВВЭР до 100 лет, существуют предложения о разработке безникелевой стали типа 15Х2МФАА и технологии изготовления из нее обечаек необходимого для ВВЭР-1000 (ВВЭР-1200) размера, которая могла бы обеспечить такой срок службы и имела бы при этом предел текучести σ0,2 > 450 МПа. За рубежом (в Европе) разработки ведутся в этом же направлении.
Помимо указанных сталей для корпусов реакторов в настоящее время ведется разработка и промышленное освоение малоактивируемых сталей типа 15Х2В2ФАА, в которых молибден заменен на вольфрам. Имея близкие (или даже несколько превосходящие) ха-
294
рактеристики радиационной стойкости стали 15Х2МФАА, сталь типа 15Х2В2ФАА в зависимости от чистоты исходных материалов имеет после выдержки 100 лет от двух до нескольких порядков величины более низкую удельную радиоактивность, что будет иметь большое значение в период утилизации выведенных из эксплуатации реакторов.
Для замены ранее применявшейся при изготовлении оборудования энергетических установок стали 22К разработаны и освоены промышленностью новые стали 10Н3МФА и 10ГН2МФА с повышенной прочностью и свариваемостью не хуже углеродистой стали 22К. Сталь 10ГН2МФА, применяемая в ВВЭР-1000 для корпусов парогенераторов, главных трубопроводов внутренним диаметром 850 мм, компенсаторов объема, коллекторов, емкостей системы аварийного охлаждения и защиты (САОЗ), наряду с более высокой прочностью по сравнению с обычными котельными сталями типа 22К обеспечивает и высокое сопротивление хрупкому разрушению
(см. табл. 23.46).
Взаимодействие перлитных реакторных сталей
сводородом
ВСоветском Союзе пуском в 1969 году энергетического реактора В-3М (НВАЭС-2) мощностью 365 МВт был начат беспрецедентный для гражданского реакторостроения эксперимент по эксплуатации корпусов без общепринятой в мировой практике антикоррозионной наплавки (плакировки) из коррозионно-стойкой стали. Из 16 блоков ВВЭР 440/230 десять были изготовлены без антикоррозионного покрытия, к настоящему времени 7 из них находятся в эксплуатации.
Впроцессе длительной эксплуатации ядерных реакторов корпусная сталь испытывает радиационно-термическое старение, в результате которого значительно повышается температура хрупковязкого перехода. Выяснению роли водорода в этом процессе охрупчивания корпусной стали посвящены работы сотрудников ЦНИИКМ «Прометей» и ИАЭ им. И.В. Курчатова, причем значительный вклад в эти исследования внесли П.А. Платонов,
295
А.Д. Амаев, Е.А. Красиков и др. Основным мотивом проведения исследований влияния водорода на охрупчивание корпусных сталей ядерных реакторов явились известные данные о непосредственной связи повреждений элементов оборудования тепловых электростанций с процессами водородного охрупчивания.
Развитие радиационно-водородного охрупчивания потенциально возможно только для корпусов без антикоррозионного покрытия. Однако в мировой практике отмечаются случаи появления трещин и других дефектов в элементах оборудования реакторных контуров, изготовленных из коррозионно-стойких сталей, в том числе на трубопроводах большого диаметра и в плакировке. Отмечается, что по мере старения оборудования при накоплении флюенса быстрых нейтронов порядка 5 1024 м−2 (Е > 1 МэВ) аустенитная коррозионно-стойкая сталь становится склонной к межкристаллитному разрушению. Более того, оказалось, что плакирующее покрытие в результате нейтронного воздействия может приобретать свойство хладноломкости.
В Японии в плакировке кипящего реактора JPDR были обнаружены многочисленные трещины, некоторые из них достигли корпусного металла и внедрились в него. Из этих фактов следует, что анализ надежности как неплакированных, так и плакированных корпусов необходимо проводить с учетом возможного радиацион- но-водородного повреждения сталей.
Источниками водорода в реакторных системах являются радиолиз воды; окисление циркония (см. п. 24.3); добавки водорода в теплоноситель; разложение аммиака и гидразин нитрата, используемых на отечественных АЭС для обеспечения необходимого качества теплоносителя; диссоциация водорода, содержащегося в металле в молекулярном виде или в виде метана (СН4); ядерные реакции типа (n, p); коррозия корпуса и других материалов первого контура реактора, как основного источника водорода по реакции 3Fe + 4H2O=Fe3O4 + 4H2. Например, после облучения зарубежных корпусных сталей А302В, А542 и А543 в реакторе количество экстрагируемого из стали водорода увеличивается с ростом экспозиции и уменьшением температуры стали (табл. 23.51), причем оно превышает количество трансмутационного водорода, составляю-
щего ~0,1 ppm.
296
|
|
Таблица 23.51 |
Накопление водорода в образцах при облучении |
||
|
|
|
Флюенс быстрых |
Температура |
Средняя концентрация |
нейтронов, м−2 |
облучения, °С |
водорода, ppm |
Необлученная сталь |
− |
0−0,2 |
7 1022 |
300 |
0,9 |
2 1024 |
225 |
1,7 |
4 1024 |
225 |
2,1 |
Следует отметить, что рабочая температура внутренней поверхности корпуса определяется температурой водяного теплоносителя и может иметь значения в зависимости от типа реактора в интервале 250−290 °С, а флюенс быстрых нейтронов до (2−5) 1024 см−2.
Для выявления закономерностей поведения водорода и выяснения его влияния на механические свойства корпусных сталей в ИАЭ им. И.В. Курчатова предприняты имитационные (лабораторные и петлевые) и натурные исследования. Образцы облучались при 50 °С в контакте с водой бассейна реактора, при 280 °С в каналах с теплоносителем, при температурах 100−180 °С и 340 °С в герметичных ампулах. В составе двух петлевых установок в активной зоне реактора МР в течение 15680 ч при температурах 50−285 °С и 22380 ч при температурах 100−300 °С облучались, а после вырезки исследовались две петлевые трубы из стали 15Х2МФА. Комплекты экспериментальных образцов облучались в реакторах АЭС как в контакте с теплоносителем, так и изолированно от него: в течение 15300 ч в каналах для образцов-свидетелей корпуса реактора НВАЭС-2 при 250 °С, в течение 7700 ч в реакторе Армянской АЭС-2 при 270 °С, а также в течение одной кампании − в реакторе Ровенской АЭС-1.
Результаты этих обстоятельных исследований позволили сделать ряд важных выводов.
Заметное выделение водорода из стали начинается при нагреве в интервале температуры (125−145) °С, причем, чем ниже температура облучения, тем большее количество водорода сохраняется в стали (и выделяется при последующем нагреве).
297
Поставленный эксперимент по изучению термодесорбции водорода из облученной стали и электролитически наводороживанной облученной стали показал, что водород, накопленный в процессе облучения («радиационный»), менее подвижен, чем водород, электролитически введенный в облученный образец.
Облучение стали в воде при низких температурах (50−180 °С) значительно увеличивает, а послерадиационный отжиг − уменьшает способность стали к накоплению водорода, что свидетельствует о захвате водорода радиационными дефектами. Радиационные повреждения, созданные в стали при низкотемпературном облучении (100 °С) до флюенса 1 1024 м−2, практически на порядок замедляют диффузию водорода по сравнению с необлученной сталью, причем дальнейшее увеличение флюенса до 5 1024 м−2 понижает диффузию незначительно.
Облучение стали при высоких температурах (340 °С) не привело к заметному поглощению водорода в сравнении со сталью в исходном состоянии, что свидетельствует о высокой подвижности водорода при этой температуре.
Механические свойства стали при наводороживании, в том числе и при поглощении коррозионного водорода, могут снижаться практически до нуля. Параметры ударной вязкости стали, облученной при низких (по сравнению с рабочей) температурах, например, при 140−180 °С, очень чувствительны к присутствию водорода (14 ppm). Положительным является тот факт, что свойства стали, облученной при 340 °С, или отожженной (300 °С) после облучения при 140 °С до флюенса 4,5 1023 м-2, не чувствительны к водороду, так как при этих температурах он полностью десорбирует из стали.
Совокупность изложенных выше данных подтверждает мнение о том, что водород в стали может находиться в двух различных состояниях. Эти состояния названы: остаточный (решеточный) и диффузионно-подвижный водород. Остаточный водород – это водород в связанном виде, например, как ранее считалось, в виде молекул Н2О (восстановление внутренних оксидов) или СН4. На самом деле состояние водорода и его связь с атомами металла зависят от его зарядности и места расположения в пустотах кристаллической ОЦК решетки стали. В ОЦК сталях остаточный (в нашем
298
случае – радиационный) водород занимает наименьшие по размеру междоузлия − октоэдрические поры (rо.п. ≈ 0,154rFe) и находится в виде Н+-иона (протона), а диффузионно-подвижный (в нашем случае – электролитический) занимает междоузлия большего размера
− тетраэдрические поры (rт.п. ≈ 0,291rFe) и существует он в виде Н–-иона.
Наиболее опасным с точки зрения изменения свойств материала является более подвижный водород – Н–. Он имеет устойчивую электронную (двух электронную) оболочку (как гелий). Распределение электронной плотности имеет форму гантели, легко «перетекающей» даже через сравнительно высокие потенциальные барьеры. Наличие в металле свободного электронного газа обеспечивает этому иону длительное существование. По-видимому, как и в сплавах циркония, в сталях водород диффундирует в области растягивающих напряжений и пониженных температур.
Водород взаимодействует с радиационными дефектами и стабилизирует их, т.е. препятствует отжигу радиационных дефектов. Это означает, что циклическая термоводородная обработка облученных образцов стали может приводить к необратимому изменению комплекса механических свойств: заметному снижению относительного удлинения, микротвердости и прочностных характеристик.
Фрактографические исследования показали, что облученная сталь после наводороживания разрушается по границам зерен, причем доля межзеренного разрушения зависит от температуры послерадиационного отжига.
Весьма важным является вопрос о синергетическом влиянии примесей (фосфора, меди и никеля) и водорода. Этим исследованиям уделено значительное внимание за рубежом, в ИАЭ им. И.В. Курчатова, ФГУП Прометей, ЦНИИТМАШ. Комплекс работ, выполненный на различных корпусных сталях, в облученном, отожженном и наводороженном состояниях, показал следующее. При концентрации водорода 4,9−5,1 ppm наблюдали резкое снижение пределов прочности и текучести, и катастрофическое снижение общего и равномерного удлинения на сталях 15Х2МФА и 15Х2НМФА. Влияние водорода в сталях, отожженных после облучения, существенно слабее по сравнению с облученными. В стали 15Х2НМФА, предварительно переведенной в состояние отпускной
299
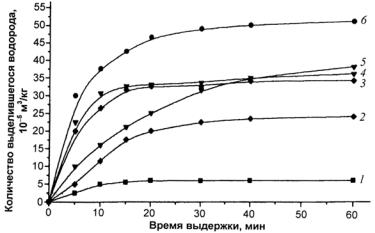
хрупкости, отмечено значительное деградирующее влияние водорода на механические свойства как облученных, так и необлученных образцов.
В порядке заключения необходимо отметить, что радиацион- но-водородное охрупчивание перлитных сталей наблюдали при температурах облучения менее 200 °С и при концентрациях водо-
рода более 4,5 ppm. Рабочие температуры корпусных сталей реакторов ВВЭР и др. лежат в интервале 250−340 °С. При этих температурах водород в основном десорбирует из стали (рис. 23.144).
Рис. 23.144. Кинетика выхода водорода при 300 °С (кривая 5 – при 250 °С) из облученных в воде при 50 °С бассейна реактора МР (кривые 3, 5, 6)
ипри 100 °С, в герметичных ампулах (кривые 2, 4):
1– исходный образец + Н2 (1 ч); 2 – облучение до 1,0 1024 м-2 + Н2 (1 ч); 3 – облучение до 1,0 1024 м-2; 4 – облучение до 1,0 1024 м-2 +Н2 (3 ч); 5 и 6 – облучение до 5 1024 м-2
Тем не менее, открытой остается проблема влияния водорода на протекание процессов радиационно-стимулированной сегрегации фосфора и никеля на границах зерен. Связывая углерод, как конкурента зернограничной адсорбции фосфора, в стали в соединения типа СmHn, водород облегчает сорбцию фосфора и никеля на границах зерен.
300
Радиационная стойкость перлитных сталей
Прежде чем перейти к рассмотрению действия облучения на механические свойства перлитных сталей, в частности, сталей для корпусов реакторов, следует кратко остановится на условиях безопасной эксплуатации корпусов.
Эти условия можно сформулировать следующим образом: в условиях нормальной эксплуатации и при проверке (гидроопрессовке) корпус должен находиться при температуре выше температуры хрупко-вязкого перехода (Тх) и во всех условиях, включая аварийные, должно выполняться условие
KI < k KIС, (23.45)
где KI − коэффициент интенсивности напряжения, k − коэффициент запаса и KIС − критический коэффициент интенсивности напряжения (вязкость разрушения).
Температуру хрупко-вязкого перехода принято определять по соотношению
Тх = T 0 |
+ Tст + Tф + Tм, |
(23.46) |
х |
|
|
где Tх0 − температура хрупко-вязкого перехода необлученного ма-
териала, Tст − ожидаемое изменение Тх от старения стали при рабочей температуре, Tф − сдвиг температуры хрупкости под действием реакторного облучения, Tм − так называемый температурный запас вязкости, принимаемый обычно равным 30 °С.
Определение температуры хрупкости производится обычно с помощью сериальных испытаний на ударную вязкость, и температурный запас Tм учитывает тот факт, что температура хрупкости Тх материала толстостенного сосуда может быть выше, чем Тх, определенная по ударным испытаниям.
Определение KIС для облученных образцов является методически довольно сложным вследствие больших размеров испытываемых образцов, поэтому принимают, что сдвиг температурной зависимости KIС под действием облучения равен сдвигу Tф для ударных образцов.
Таким образом, для ферритно-перлитных сталей наиболее важным эффектом облучения в реакторе является сдвиг критической
301
температуры хрупкости, хотя облучение приводит к изменению и обычно определяемых свойств: предела текучести, временного сопротивления разрушению и удлинения.
Применительно к корпусам водо-водяных реакторов, выполненных из перлитной стали, проектный ресурс по флюенсу быстрых нейтронов (Е > 0,1 МэВ) составляет для ВВЭР-440 ~ 3 1024 м−2, для ВВЭР-1000 ~ 5 1023 м−2. Температура облучения в рабочем ре-
жиме оценивается То6л < 300 °С, а плотность потока нейтронов − около 3 1015 нейтр./(м2 с) (ВВЭР-440) и около 7 1014 нейтр./(м2 с) (ВВЭР-1000). Нейтронное облучение, увеличивая прочностные характеристики, вместе с тем резко уменьшает различие между σв и σ0,2 (табл. 23.52). С этим фактом непосредственно связано и малое равномерное удлинение δр облученной стали. Можно полагать, что уменьшение δр вносит основной вклад в снижение полного удлинения (δ5), поскольку относительное сужение (ψ) изменяется слабо. Истинное сопротивление разрыву (Sк), так же как и ψ, отражающее свойство материала на стадии разрушения, менее чувствительно к облучению по сравнению с другими характеристиками прочности. Уменьшение δр и сближение значений σв и σ0,2 обычно рассматриваются как свидетельство пониженного деформационного упрочнения. При То6л > 250 °С радиационное повреждение не оказывает заметного влияния на способность перлитных сталей к деформационному упрочнению, хотя значения прочностных характеристик заметно выше (см. табл. 23.52).
Таблица 23.52
Механические свойства стали 15Х2МФА после облучения нейтронами до флюенса Фн = 1024 м-2 (Тисп = 20 °С)
Способ обработки |
σв, |
σ0,2, |
σв−σ0,2, |
σ |
σ |
δ |
δ |
ψ |
Sк, |
|
МПа |
МПа |
МПа |
0,2/ |
в |
р, % |
5, % |
, % |
МПа |
Эталон (закалка + |
690 |
520 |
170 |
0,75 |
8,0 |
21 |
78 |
150 |
|
+ высокий отпуск) |
|
|
|
|
|
|
|
|
|
Облучение при |
880 |
860 |
20 |
0,98 |
0,7 |
11 |
69 |
155 |
|
Т ≈ 150 °С |
|
|
|
|
|
|
|
|
|
Облучение при |
910 |
760 |
150 |
0,83 |
7,0 |
17 |
− |
− |
|
Т ≈ 260÷280 °С |
|
|
|
|
|
|
|
|
|
302

Влияние легирования на степень радиационного упрочнения и охрупчивания проявляется главным образом при относительно низких значениях флюенсов (Фн ≤ 1022 ÷ 1023 м−2); при больших флюенсах (Фн ≥ 1024 м−2) изменение свойств большинства легированных перлитных сталей практически такое же, как и нелегированных.
Изменение предела текучести происходит обычно по степенному закону от флюенса:
Δσ0,2 = ВФ(Фн)n, |
(23.47) |
где ВФ − постоянный коэффициент, зависящий от температуры; Фн − флюенс нейтронов с Е > 0,5 МэВ (измеряемый обычно в единицах 1022 м−2), п − постоянный коэффициент, имеющий значение от 1/2 до 1/3. Чаще всего экспериментальные результаты описываются функцией ~ Ф1н/ 3 . Это можно видеть на рис. 23.145, где показано изменение предела текучести стали 15Х2МФА в зависиости от флюенса. Зависимость Ф1н/ 3 принята в нормах прочности для всех отечественных сталей.
Рис. 23.145. Зависимость радиационного упрочнения стали 15Х2МФА (U)
иметалла сварного шва (|) от флюенса нейтронов
при Тобл = 270 °С
Котреллом было показано существование линейной корреляции между изменением предела текучести и сдвигом температуры хрупкости, т. е.
Тх ~ Δσ0,2. |
(23.48) |
Это приводит к зависимости сдвига температуры хрупкости от
флюенса: |
|
Тх = АФ(Фн)1/3. |
(23.49) |
303
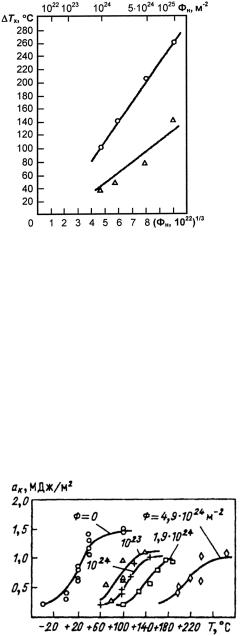
|
Коэффициент АФ, зависящий |
|
|
от температуры |
облучения, |
|
структуры и состава стали, при- |
|
|
нято называть коэффициентом |
|
|
радиационного охрупчивания. В |
|
|
этом уравнении так же, как и в |
|
|
уравнении (23.47), |
флюенс |
|
обычно выражают в единицах |
|
|
1022 м 2. |
|
|
На рис. 23.146 приведена за- |
|
|
висимость Тх от флюенса для |
|
|
стали 15Х2МФА, показываю- |
|
|
щая соответствие характера из- |
|
Рис. 23.146. Зависимость сдвига |
менений формуле (23.49). |
|
критической температуры хрупкости |
Сдвиг температуры хрупко- |
|
стали 15Х2МФА () и металла |
сти чаще всего определяют по |
|
сварного шва () от флюенса |
кривым ударной вязкости, при |
|
нейтронов при Тобл = 270 С |
этом в качестве критерия пере- |
|
хода от вязкого в хрупкое состояние принимают значение ударной вязкости 0,6 МДж/м2.
На рис. 23.147 показаны типичные кривые ударной вязкости стали 15Х2МФА в необлученном состоянии и после облучения при температуре 270 °С. Можно видеть, что облучение приводит к сдвигу кривых в область более высокой температуры, при этом уровень ударной вязкости в области вязкого разрушения («полка», «шельф») понижается. Определяемый таким способом сдвиг принимается равным сдвигу кривой KIС(Т).
Рис. 23.147. Температурная зависимость ударной вязкости для необлученного () и
облученного (Тобл = 270 С) до разных флюенсов металла
сварного шва стали 15Х2МФА
304
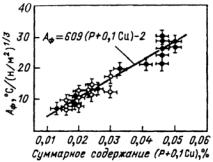
Упрочнение сталей ферритно-перлитного класса под облучением, а следовательно, и сдвиг температуры хрупкости сильно зависят от количества свободного феррита. Чем больше свободного феррита, т. е. чем ниже содержание углерода, тем больше упрочнение и сдвиг температуры хрупкости.
Марганец и никель, способствующие стабилизации вакансионных скоплений, вызывают увеличение радиационного упрочнения и охрупчивания сталей. Особенно существенно в этом отношении влияние никеля, который добавляется в сталь для улучшения ее технологических свойств.
Так, сталь 15Х2НМФАА, отличающаяся от стали 15Х2МФАА главным образом тем, что дополнительно содержит около 1,5 % Ni, имеет АФ = 23 против АФ = 12 для стали 15Х2МФАА.
Наиболее сильно на радиационное охрупчивание оказывают влияние фосфор и медь.
На рис. 23.148 показано влияние суммарного содержания меди и фосфора на коэффициент радиационного охрупчивания стали 15Х2МФА и ее сварного шва. Как следует из рис. 23.148, АФ меняется линейно, возрастая в 4 раза, при изменении относительно небольших количеств примесей, которые для условий без облучения не имеют существенного значения.
Полагают, что влияние этих примесей связано с процессами сегрегации примесных атомов, стимулированных облучением.
Рис. 23.148. Зависимость коэффициента радиационного охрупчивания АФ от содержания в основном металле (|) стали 15Х2МФА и металле его сварного
шва (•) фосфора и меди
Тобл = 270 °С
В настоящее время для обеспечения необходимой радиационной стойкости содержание Сu и Р строго регламентировано как для ос-
305

новного металла, так и для сварочных металлов и составляет для меди 0,1 % и фосфора меньше 0,012 %.
Для количественного выражения влияния вредных примесей на коэффициент радиационного охрупчивания ферритно-перлитных сталей предложены формулы, используемые при оценке ресурса материала корпусов реакторов. Для стали 15Х2МФА коэффициент радиационного охрупчивания может быть выражен следующими формулами:
АФ = [1310(Р + 0,1Сu) − 21] при Т = 250 °С;
АФ = [609(Р + 0,1Сu) − 2] при Т = 270 °С. |
(23.14) |
|
Для сталей, содержащих Ni, например для американской стали А533, предлагают использовать уравнение, содержащее так называемый химический фактор-функцию, зависящую от содержания меди и никеля.
Это уравнение выглядит следующим образом:
СФ = 624Сu − 33/ CuNi + 251Ni. |
(23.51) |
С учетом этого фактора зависимость сдвига критической температуры хрупкости от флюенса может быть выражена уравнением
Тх = СФ Фн(0,28−lg Фн ) , |
(23.52) |
где Фн − флюенс в единицах 1019 см−2 (Е > МэВ).
Обращает на себя внимание в уравнении (23.51) наличие члена, в который входит произведение концентраций никеля и меди, что указывает на синергизм влияния Ni и Сu, взаимно усиливающих действие друг друга. Это можно видеть на рис. 23.149 (зависимости
4 и 5).
Полагают, что аналогичное влияние на радиационную стойкость оказывает и Мn, содержащийся в значительных количествах в американских конструкционных нелегированных сталях (например, в корпусной стали А533В содержится около 1% Мn).
Для отечественной стали с никелем (15Х2НМФАА) ввиду высокой чистоты основы стали (АА) зависимость от примесей практически не прослеживается и при наличии ограничения по никелю (не более 1,5 %) для расчета используется уравнение (23.49) с коэффициентом АФ = 23 для основного металла и (23.50) для сварного шва.
306
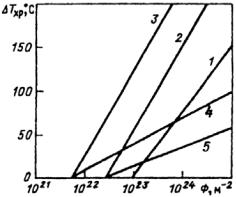
Рис. 23.149. Влияние флюенса нейтронов на сдвиг критической температуры хрупкости американских сталей А302В (≤ 0,25 % С; 0,5 % Мо; 1,3 % Мn)
и A533B (≤ 0,25 % С; ~ 0,5 % Мо; 0,5 % Ni; 1,3 % Мn) (1−3),
отечественных сталей 15Х2МФА (4) и 15Х2НМФАА (5) с различным содержанием меди и фосфора:
1 − Тобл = 288 °С, низкое содержание Сu; 2 − Тобл = 232÷288 °С, повышенное илипромежуточное содержание Сu; 3 − Тобл < 232 °С, повышенное содержание Сu;
4 − Тобл = 270÷320 °С, Сu ≤ 0,17%, Р ≤ 0,012%; 5 − Тобл = 270÷320 °С, Сu ≤ 0,10%, Р ≤ 0,010%
Учитывая, что в современной металлургии происходит постоянное «отравление» сталей медью и другими примесями из-за использования металлолома, стали для корпусов реакторов выплавляются только из чистой «первородной» шихты, что отражено в марочном обозначении индексом АА; только в этом случае обеспечивается необходимая радиационная стойкость стали.
Учитывая более высокую стоимость стали повышенной чистоты и ограниченные возможности производства первородной шихты, из стали с индексом АА обычно изготавливают только части корпуса (обечайки), подвергающиеся интенсивному облучению, а верхние и нижние обечайки − из стали на обычной шихте, хотя и с ограниченным содержанием Сu и Р, обозначаемой 15Х2НМФА.
Для этой стали зависимость АФ от содержания меди и фосфора выражают формулой
АФ = 575(Р + 0, Сu) + 11. |
(23.53) |
307
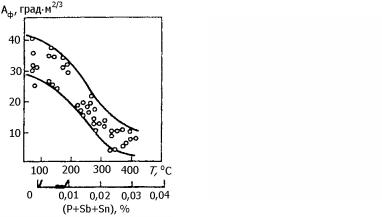
Помимо Сu и Р вредное влияние оказывают и некоторые другие примеси, например As, Sb, Sn (рис. 23.150), однако количественных выражений влияния других примесей пока не получено.
Рис. 23.150. Влияние суммы примесей (Р + Sb + Sn ) на коэффициент охрупчивания АФ стали типа
15Х3НМФА с 0,1−0,2% Сu
(Тобл = 300÷350 °С) (Ю.Ф. Баландин и др.)
Рис. 23.151. Зависимость коэффициента радиационного охрупчивания стали 15Х2МФА от температуры облучения
Кроме металлургических факторов, на охрупчивание сталей для корпусов реакторов оказывают влияния условия облучения: температура среды и интенсивность нейтронного потока.
Приблизительно до температуры 250 °С температурная зависимость радиационного охрупчивания довольно слабая. Начиная с этой температуры, как это видно на рис. 23.151, наблюдается резкое уменьшение охрупчивания с повышением температуры облучения, что связано с отжигом радиационных дефектов, и при температуре около 500 °С облучение уже не вызывает заметных изме нений в сталях.
Охрупчивание перлитных сталей, используемых для корпусов реакторов, возможно не только под действием нейтронного облучения, но также, как показано выше, и в результате наводороживания (рис. 23.152). Как отмечено, этот процесс может быть особенно заметным для корпусов без защитной плакировки из коррозионностойкой стали (некоторые корпуса реакторов ВВЭР-440).
308
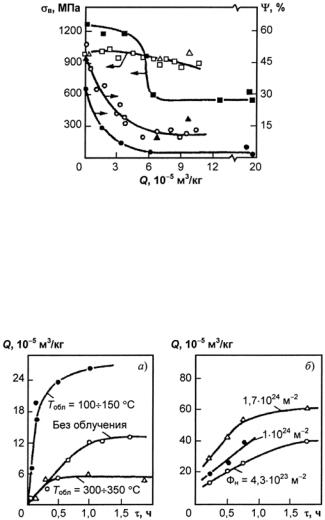
Рис. 23.152. Влияние температуры нейтронного облучения и содержания водорода на прочность ( , , U) и пластичность (|, z, S) стали 15Х2МФА:
|, − без облучения; z, − Тобл = 100÷150 °С, Фн = 2,5 1024,м−2; U, S − Тобл = 300÷350 °С, Фн = 1,5 1024 м−2 (И.В. Горынин)
Количество водорода, поглощаемого сталью, зависит от температуры облучения и возрастает с увеличением флюенса нейтронов
(рис. 23.153, см. также табл. 23.51).
Рис. 23.153. Влияние температуры облучения (а) и флюенса нейтронов (б) на количество поглощаемого сталью 15Х2МФАА водорода
при различной длительности наводороживания:
а − Фн = 8 1024 м−2; б − Тобл = 100÷180 °С
Как было отмечено выше, точный механизм водородного охрупчивания в условиях облучения пока не определен. Полагают,
309
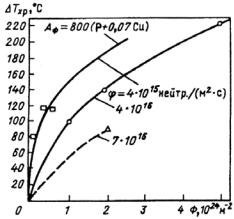
что взаимодействие водорода с радиационными дефектами понижает подвижность водорода, что приводит к повышению его концентрации, что, в свою очередь, вызывает ослабление межатомных связей и понижение энергии, необходимой для распространения трещины.
До недавнего времени считали, что радиационное охрупчивание сталей не зависит от интенсивности облучения. В настоящее время вполне достоверно известно, что облучение малыми потоками нейтронов, например, вблизи стенки корпуса 1014−1015 нейтр./(м2 с), вызывает существенно большее радиационное охрупчивание при одинаковых флюенсах, чем облучение большими потоками, характерными для исследовательских реакторов 1017−1018 нейтр./(м2 с).
На рис. 23.154 показаны кривые изменения температуры хрупкости образцов, облученных в различных потоках нейтронов, подтверждающие сказанное выше. Однако пока имеются данные только для относительно небольших флюенсов (вследствие длительности процесса накопления флюенса при малых потоках), и дальнейший возможный ход кривых показан пунктиром. Вследствие этого пока следует ориентироваться на наихудшую кинетику, иначе ошибка в оценке безопасности корпуса может стать весьма существенной и опасной.
Рис. 23.154. Зависимость изменения температуры хрупкости стали 15Х2МФА (0,028 % Р; 0,18 % Сu) при Тобл = 270 °С от плотности потока нейтронов
310
Рассмотренные выше результаты действия облучения показывают, что в отсутствии длительного опыта работы атомных реакторов мы можем с течением времени встречаться с явлениями, которые ранее не прогнозировали. К числу таких не прогнозированных заранее явлений относятся описанные выше эффекты примесей и интенсивности потока нейтронов.
Для того чтобы избежать катастрофических последствий таких проявлений, во всех странах организовано наблюдение за состоянием материала корпусов с помощью образцов − свидетелей, устанавливаемых вблизи корпуса и периодически извлекаемых в течение всего срока службы реактора.
Реализация такой программы позволяет вовремя принять меры либо для остановки реактора и вывода его из эксплуатации, либо для принятия мер к восстановлению свойств металла корпуса.
Исследования показали, что свойства облученных сталей корпусов реакторов можно восстановить путем нагрева до некоторой температуры, тем самым восстановить работоспособность корпусов. Радиационное охрупчивание корпусов, таким образом, не является фатальным фактором. При этом температура отжига должна быть выбрана оптимальной, чтобы в достаточной степени восстановить свойства, вместе с тем избежать так называемой отпускной хрупкости, вызываемой зернограничной сегрегацией вредных примесей при нагреве сталей в области 500 °С.
Степень восстановления свойств ферритно-перлитных сталей тем выше, чем больше разница между температурой облучения и температурой отжига Т = Тотж−Тобл.
На рис. 23.155 показана зависимость между Т и степенью восстановления свойств стали 15Х2МФА при отжиге. Данные, изображенные на графике, получены при времени отжига около 100 ч. Это время, по видимому, является оптимальным, так как позволяет получить наибольшее для данной температуры восстановление; дальнейшее увеличение времени отжига не дает дополнительного эффекта.
Степень восстановления свойств ферритно-перлитных сталей при отжиге так же, как и охрупчивание, зависит от содержания вредных примесей; с увеличением содержания фосфора, например,
311
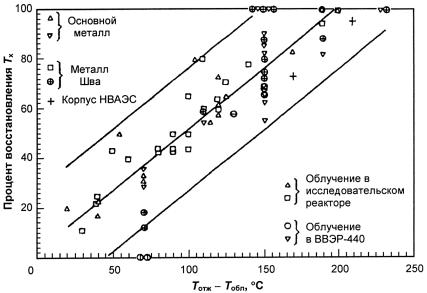
при прочих равных условиях степень восстановления уменьшается, или, в другой терминологии, увеличивается остаточное охрупчивание после отжига.
Рис. 23.155. Зависимости степени восстановления критической температуры хрупко-вязкого перехода (Тх) от разности температур отжига и облучения
Полагают, что повышение «стойкости» радиационных дефектов обусловлено декорированием их атомами фосфора. Возможно, однако, что в стали при облучении происходит стимулированное облучением формирование очень мелких выделений, представляющих собой железо-фосфорные соединения.
Тормозящее отжиг действие вредных примесей может быть скомпенсировано повышением температуры. Сказанное иллюстрируется рис. 23.156, где показана зависимость остаточного охрупчивания от температуры отжига и содержания фосфора.
Таким образом, путем выбора оптимальной температуры и времени отжига корпуса можно практически полностью восстановить его работоспособность.
312
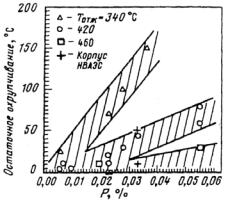
Рис. 23.156. Зависимость остаточного охрупчивания корпусной стали от содержания фосфора в металле при различных температурах отжига
23.3.6. Хромистые стали
Стали, легированные хромом, находят широкое применение в технике, что связано в первую очередь с благоприятным влиянием его на коррозионную стойкость при высокой температуре. В зависимости от содержания хрома и вида термообработки стали приобретают различную структуру.
Сплавы системы Fe−Cr
Решетка Сr (ОЦК) изоморфна решетке α-Fe, атомы Fe и Cr имеют близкие размеры (rFe ≈ 0,126 нм, rCr ≈ 0,127 нм). Это способствует тому, что система Fe−Cr характеризуется наличием непрерывной растворимости на основе твердых растворов с ОЦК решеткой (рис. 23.157). Хром снижает обе точки аллотропического (α'γ)-превращения железа, но так как точка Ac4 снижается быст-
рее, чем Ac3 , то в конце концов обе точки сливаются, область за-
мыкается при концентрации около 13 % Cr. В зависимости от содержания примесей в сплавах (например, даже в технически чистых металлах содержание С и N может колебаться в пределах
313
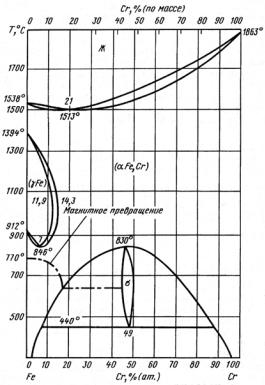
0,0025÷0,001 % С и 0,005÷0,002 % N) положения границ между об-
ластями γ/(γ + α) и α/(α + γ) могут смещаться в сторону больших концентраций хрома. Высокочистые по примесям сплавы системы Fe−Cr, содержащие менее 12−14 % хрома, претерпевают полные превращения α ' γ, что дает возможность применять к этим сплавам термическую обработку. Такие стали в зависимости от концентрации легирующих элементов относятся к классу перлитных или мартенситных. При содержании Cr примерно до 10 % точка Ac3 снижается примерно до 850 °С, а при дальнейшем увеличении
концентрации Cr быстро поднимается до температуры 1000−1100 °С. В связи с этим закалка указанных хромистых сталей должна проводиться с высоких температур.
Рис. 23.157. Диаграмма состояния системы Fe−Сr
314
В узкой области составов (в пределах около 12−14 % Cr) находится область, состоящая из двух фаз α и γ. При любом варианте нагрева и охлаждения в этой области не представляется возможным осуществить полное превращение α ' γ. Фазовое превращение имеет место только в той части объема, которая состоит из γ-фазы. Такие стали относят к ферритно-мартенситному классу.
При содержании Cr более 13−15 % во всем интервале температуры, вплоть до температуры плавления, сохраняется α-фаза. Такие сплавы относят к сталям ферритного класса. Отсутствие фазовых превращений исключает возможность применения для этих сплавов термической обработки. При содержании около 50 % Cr (точнее, 42−49 % Cr по данным разных исследователей) из α-твердого раствора при температурах ниже 830 °С (820 °С − по другим данным) выделяется σ-фаза (неустойчивое химическое соединение FeCr), которая около 440 °С (520 °С − по другим данным) эвтектоидно распадается на твердые растворы α (αFе − твердый раствор Cr в α-Fe) и α′′ (αCr − твердый раствор Fe в Cr). Реакция α → σ протекает очень медленно, и необходимы продолжительные выдержки для ее завершения. Имеются данные, что в интервале концентраций 70−90 ат.% Cr твердый раствор α распадается по монотектоидной реакции α ' σ + α′′ около 595 °С. Температурный интервал существования σ-фазы в системе Fe−Cr простирается примерно от 440 (520) до 830 (820) °С.
Фаза σ имеет сложную тетрагональную решетку типа β-U (а = 0,881 нм, с = 0,458 нм) с 30 атомами в элементарной ячейке, выделяется преимущественно по границам зерен и имеет достаточно широкую область гомогенности. Она создает значительные напряжения, вызванные большими объемными изменениями. Это обстоятельство, усиленное малой способностью к пластической деформации соединения FeCr, является причиной исключительной хрупкости сплавов, содержащих σ-фазу.
Твердая и хрупкая σ-фаза, впервые обнаруженная в системе Fe−Cr, оказалась довольно распространенной; σ-фаза существует более чем в 20 системах: Fe−V, Fe−Mo, Fe−W, Ni−V и др.
315
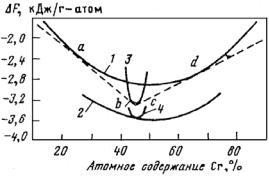
На рис. 23.158 приведены рассчитанные теоретически кривые изменения свободной энергии в сплавах системы Fe−Cr в зависимости от состава при 700 и 800 °С, из которых следует, что сила межатомной связи в α-твердых растворах возрастает при увеличении концентрации Cr, т.е., казалось бы, жаропрочность сплавов должна возрастать. В то же время известно, что жаропрочность α-твердого раствора с увеличением концентрации Cr существенно снижается. По-видимому, это связано с тенденцией к расслоению твердых железо-хромистых растворов, обнаруженной при повышенной температуре с помощью ядерного гамма-резонанса.
Рис. 23.158. Изменение свободной энергии в сплавах системы Fe−Сr в зависимости от состава:
1 − α-фаза при 700 °С; 2 − α-фаза при 800 °С; 3 − α-фаза при 700 °С; 4 − α-фаза при 800 °С
Кривая свободной энергии σ-фазы при 700 °С на участке атомных концентраций 43−46% Cr ниже кривой свободной энергии α-фазы для той же температуры (см. рис. 23.158). В области составов 25−43 % (имеется в виду атомное содержание Cr) и 45−65 % Cr между точками а−b и с−d система не может существовать в виде однородного раствора, так как происходит распад с выделением σ-фазы переменного состава (43−46 % Cr). При 800 °С кривая свободной энергии α-фазы огибает кривую свободной энергии σ-фазы с точкой касания при 44% Cr, т.е. при температуре выше 800 °С твердые растворы существуют только в α-состоянии.
316
Механические свойства хромистого феррита во многом определяются скоростью охлаждения. В отожженном состоянии (930 °С, медленное охлаждение) твердость феррита при 20 °С с увеличением концентрации хрома немного возрастает (чистое железо имеет НВ ≈ 700 МПа, у сплава Fe−4 % Cr НВ ≈ 1050 МПа). Легирование хромом способствует значительному повышению стабильности свойств. При температуре испытания до 400 °С твердость легированного феррита остается практически неизменной, разупрочнение наступает только при более высокой температуре.
После закалки феррит, содержащий Cr меньше, чем нужно для исключения γ-области (менее 12 %), приобретает более мелкозернистую структуру или даже структуру игольчатого мартенсита, в результате чего значительно возрастает твердость (после закалки сплава Fe−4 % Cr от 930 °С НВ ≈ 2800 МПа). Повышенная твердость сохраняется до температуры 450 °С.
Хромистый феррит, в котором отсутствуют фазовые превращения (содержащий более 13−15 % Cr), термической обработкой не упрочняется, и его твердость соответствует твердости отожженного легированного феррита.
Влияние легирования на структуру и свойства хромистых сталей
В качестве легирующих элементов хромистых сталей применяют в основном те же элементы, что и для сталей перлитного класса (см. п. 23.3.5). Их влияние на структуру и свойства хромистых сталей аналогично влиянию на перлитные стали. Различие заключается в количестве и соотношении хрома и углерода, что, в свою очередь, вызывает качественное изменение структуры и свойств стали.
Хром увеличивает устойчивость аустенита по сравнению с низколегированными (до 2,5 % Cr) сталями перлитного класса так, что мартенситные превращения наблюдаются при охлаждении сталей из γ-области на воздухе. При этом в сталях, содержащих до 8% Cr, превращение аустенита наблюдается лишь в одной низкотемпературной области; в сталях, содержащих 8−12 % Cr, − в двух областях. Первая область − высокотемпературная, в которой выделяется феррит, вторая − низкотемпературная, отвечающая мартенситному
317
превращению. При этом следует отметить, что мартенситное превращение в стали с 12 % Cr протекает при температуре на 100 °С ниже, чем в стали с 8 % Cr, благодаря чему структура в первом случае имеет больше дефектов и более упрочнена. В структуре сталей, охлажденных на воздухе, всегда присутсвуют карбиды хрома. Стали с мартенситно-ферритной структурой имеют оптимальные свойства, когда содержание феррита не превышает 15 %.
Легирование хромом повышает коррозионную стойкость сталей, причем она увеличивается не монотонно − при количестве Cr более 12−13 % происходит скачкообразное увеличение коррозионной стойкости, что связано с переходом электрохимического потенциала хромистых сталей от отрицательных значений к положительным (рис. 23.159). Сплавы с содержанием менее 12 % Cr практически также корродируют, как и Fe, а сплавы, содержащие более 12−14 % Cr, ведут себя как благородные металлы: обладая положительным
электрохимическим потенциалом, они при комнатной и близкой к ней температуре не окисляются во влажной атмосфере, в воде, в растворах кислот, щелочей, солей и в других электролитах и поэтому на-
Рис. 23.159. Электродный
зываются коррозионно-стойкими
потенциал сплавов Fe−Сr (или нержавеющими по старым ГОСТ).
Углерод сдвигает кривые распада аустенита вправо (рис. 23.160) и в зависимости от концентрации переводит сталь в разные структурные классы.
Равновесная структурная диаграмма системы Fe−Cr−С и положение на ней составов хромистых коррозионно-стойких сталей разных марок приведены на рис. 23.161. Как видно, в зависимости от содержания углерода стали с одинаковым содержанием Cr (например, типа X13) принадлежат разным структурным классам: сталь 08XI3 в равновесном состоянии ферритная; 12X13 − полуферритная, после закалки в масле или на воздухе с высоких температур имеет структуру М + Ф; стали 20X13 и 30X13 в равновесном состоянии доэвтектоидные, а 40X13 − заэвтектоидная, испыты-
318
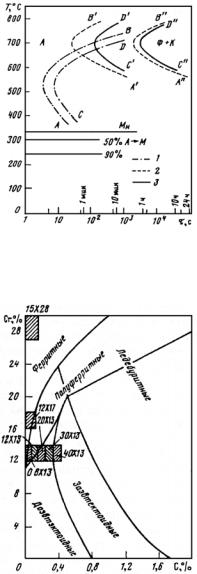
вающие полное (γ ' α)-превращение. После охлаждения на воздухе стали 20X13, 30X13 и 40X13 имеют структуру мартенсита.
Рис. 23.160. С-образные кривые изотермического распада аустенита в углеродистой стали 20 (1), хромистых сталях 12X13 (2) и 20X13 (3):
АВ, А'В', А"В" − начало распада аустенита А → Ф + К; CD, C'D',
C"D" − конец распада аустенита
Рис. 23.161. Система Fe−С−Сr и положение в ней промышленных хромистых коррозионно-стойких сталей
319
Кремний и алюминий вводят в хромистые стали для увеличения сопротивления окислению (жаростойкости). Стали, содержащие от 6 до 10 % Cr и легированные Si в количестве 2−3 % (Х6С, Х9С2, Х10С2М и др.), известны под названием сильхромов. Однако Si является сильным феррито-стабилизирующим элементом (полное замыкание γ-области происходит при наличии в железе 1,8 % Si) и при концентрации 2−3 % переводит сталь в ферритный класс, исключающий возможность проведения термической обработки. Для восстановления способности к закалке в сильхромы вводят углерод в количестве до 0,4 %, который расширяет γ-область и переводит сильхромы в группу мартенситных сталей с полным превращением α ' γ. Сильхромы обычно применяются для изготовления арматуры и других деталей различных устройств и механизмов, которые должны обладать повышенной твердостью и сопротивлением износу.
Молибден, вольфрам и ванадий используют для повышения жа-
ропрочности (15Х5М, 15Х5МВ, 15Х9С2М, 14Х12В2МФ и др.),
снижения склонности к тепловой и отпускной хрупкости хромистых сталей.
Титан, ниобий, тантал и, иногда, азот вводят с целью уменьшения склонности хромистых сталей к росту зерна при нагреве, устранения склонности к закаливанию при охлаждении на воздухе благодаря связыванию углерода в специальные карбиды (TiС, NbC). Механические свойства ферритных сталей с Nb и Та при высокой температуре выше, чем у сталей без дополнительного легирования. Легирование ниобием обеспечивает относительную стойкость сварных соединений против межкристаллитной коррозии (например, сталь 15Х18М2Б).
Никель в хромистых сталях заметно повышает прокаливаемость, улучшает фазовый состав стали, поскольку снижает содержание δ-феррита, хотя приводит к уменьшению критических точек:
Ac1 (680−700 °С), Ac3 (820−840 °С), Мн (160−180 °С). Последнее об-
стоятельство серьезно затрудняет смягчающую термообработку. Никель в количестве не более 2÷4 % благоприятно влияет на жаропрочность мартенситных и мартенситно-ферритных сталей.
320
Хромистые стали мартенситного класса
Благоприятное влияние, оказываемое хромом на коррозионную стойкость, является причиной его максимального использования в сталях, предназначенных для работы при высокой температуре. Однако увеличение концентрации Cr более 2−3 % значительно сдвигает кривую изотермического распада аустенита вправо (см. рис. 23.108), в результате чего даже при медленном охлаждении стали могут приобретать мартенситную структуру (переходят в мартенситный класс).
В зависимости от содержания Cr и С мартенситные стали условно делят на несколько групп (табл. 23.53). В пределах каждой группы более высокому содержанию углерода обычно соответствует и более высокая концентрация хрома, так как увеличение содержания углерода, приводящее к образованию хромистых карбидов, создает двухфазную структуру, уменьшает количество Cr в твердом растворе ниже 13 % и поэтому понижает коррозионную стойкость стали.
|
|
|
|
|
Таблица 23.53 |
|
|
Группы хромистых сталей мартенситного класса |
|||
|
|
|
|
|
|
Группа |
Структура |
Содержание легирующих элементов, % |
|||
|
|
после |
|
|
|
|
|
|
С |
Сr |
|
|
|
закалки |
|
||
|
|
|
|
|
|
I |
|
М |
|
0,15−0,25 |
5−10 |
II |
|
М + Ф |
0,1−0,4 |
10−13 |
|
III |
|
Ф + М |
Около 0,1 |
Более 13 (16−18 в сочетании с 2−4 % Ni) |
|
IV |
|
М |
0,6−1,0 |
Более 13 (14−16) |
|
К первой группе относятся стали, содержащие до 10 % Cr. Эти стали закаливаются на мартенсит. Стали, содержащие 10−13 % Cr, помимо мартенсита, имеют в своей структуре феррит. Стали с содержанием Cr более 13 % не претерпевают фазовых превращений и относятся к сталям ферритного класса (см. рис. 23.157).
Стали, принадлежащие к группе I, относятся к теплоустойчивым сталям (см. рис. 23.106 и табл. 23.54). Они могут применяться для изготовления трубопроводов, паронагревателей, теплообменников
321
и различных деталей арматуры, если требуется более высокое сопротивление окислению по сравнению со сталями перлитного класса.
Стали, содержащие от 5 до 7 % Cr, обладают повышенным сопротивлением окислению. Дальнейшее увеличение сопротивления окислению осуществляется путем введения в сталь Si и Аl (см.
табл. 23.54).
Мартенсит хромистых сталей обладает достаточно высокой стабильностью, однако при нагреве до 600−750 °С он превращается в дисперсные карбидно-ферритные смеси (сорбитообразные структуры), которые обладают более низкими прочностными характеристиками и, соответственно, более высокой пластичностью.
Накопленный опыт применения мартенситных сталей показывает, что они склонны к хрупкому разрушению. Хрупкое разрушение проявляется при отпуске с последующим медленным охлаждением
(отпускная хрупкость). Однако существует также тепловая хруп-
кость, которая проявляется в процессе длительного нагрева в области температуры 450−600 °С. Снижение склонности к тепловой и отпускной хрупкости достигается путем легирования Мо и W (0,4−0,7 %). Оно одновременно способствует и повышению жаропрочных свойств сильхромов (стали Х9С2М, Х10С2М и др.).
Возможность образования мартенситных структур при охлаждении на воздухе вносит ряд особенностей в технологию изготовления деталей из таких сталей. После каждой технологической операции (ковки, прокатки, сварки и т.д.), связанной с нагревом выше критической температуры, стали подвергаются повторному нагреву. Хрупкое состояние устраняется при высокотемпературном отпуске (650−700 °С) и при нагреве до температуры, приближающейся к критической (~ 850 °С) с последующим медленным охлаждением.
Для длительной работы при повышенных температурах эти стали применяют, как правило, после отжига при 840−870 °С, что связано со стремлением получать возможно более стабильную структуру, состоящую из легированной ферритной основы и сравнительно дисперсных карбидов, в основном специальных карбидов ванадия VC или V(С, N).
322
Таблица 23.54
Состав и механические свойства некоторых хромистых теплоустойчивых сталей
|
Марка |
Содержание основных легирующих |
Режим термической |
Тисп, |
σв, |
σ0,2, |
δ, % |
ψ, |
ак, |
σдл, МПа, |
|||||
|
|
элементов, % |
|
|
за время, ч |
||||||||||
|
стали |
|
|
|
|
|
обработки |
°С |
МПа |
МПа |
|
% |
кДж/м2 |
||
|
С |
Сr |
Мо |
|
Другие |
|
104 |
105 |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
15X5 |
≤ 0,15 |
4,5−6,0 |
− |
|
− |
Нормализация |
20 |
440 |
226 |
31 |
80 |
− |
− |
− |
|
|
|
|
|
|
|
(850−870 °С) |
500 |
274 |
102 |
27 |
80 |
− |
− |
− |
|
|
|
|
|
|
|
|
600 |
162 |
83 |
36 |
85 |
− |
− |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отжиг (840−860 °С), |
20 |
400 |
170 |
24(δ5) |
50 |
≥ 1000 |
− |
− |
|
|
|
|
|
|
|
охлаждение с печью |
|
|
|
|
|
|
|
|
|
15Х5М |
≤ 0,15 |
4,5−6,0 |
0,4−0,6 |
|
− |
Нормализация |
20 |
524 |
234 |
31 |
77 |
− |
− |
− |
323 |
|
|
|
|
|
|
(950−980 °С) |
550 |
319 |
153 |
37 |
83 |
− |
− |
− |
|
|
|
|
|
|
|
600 |
246 |
122 |
42 |
90 |
− |
− |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нормализация + от- |
480 |
− |
− |
− |
− |
− |
180 |
150 |
|
|
|
|
|
|
|
пуск (840−880 °С) |
540 |
− |
− |
− |
− |
− |
100 |
75 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15Х5ВФ |
≤ 0,15 |
4,5−6,0 |
− |
|
0,4−0,6 V; |
Отжиг (840−860 °С), |
20 |
400 |
220 |
22(δ5) |
50 |
≥ 1200 |
− |
− |
|
|
|
|
|
|
0,4−0,7 W |
охлаждение с печью |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отжиг (850 °С) |
500 |
− |
− |
− |
− |
− |
120 |
92 |
|
|
|
|
|
|
|
Отжиг (870 °С) |
550 |
− |
− |
− |
− |
− |
89 |
70 |
|
15Х6СЮ |
≤ 0,15 |
5,5−7,0 |
− |
|
0,7−1,1 А1; |
Отжиг (750−800 °С), |
20 |
450 |
250 |
20 |
40 |
− |
− |
− |
|
|
|
|
|
|
1,2−1,8 Si |
воздух или масло |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40Х10С2М |
≤ 0,40 |
9,5−10,5 |
~1 |
|
~2 Si |
Закалка (1010− |
20 |
950 |
750 |
10 |
35 |
≥ 200 |
− |
− |
|
|
|
|
|
|
|
−1050 °С), воздух или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
масло + отпуск |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(720−780 °С), масло |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
323
На примере сталей с 12 % Cr можно проследить, как усложнением состава сталей благодаря введению дополнительных легирующих элементов в оптимальных количествах можно повысить их жаропрочность (табл. 23.55). Улучшение свариваемости этих сталей достигается посредством снижения содержания углерода, что сопровождается увеличением количества феррита и образованием более пластичного мартенсита.
Таблица 23.55
Влияние легирующих элементов на сопротивление ползучести 12 %-ной хромистой стали
(ТО: аустенизация 1250 °С + старение 650 °С)
|
|
Деформация ползучести |
Относительное |
|
|
|
(σ =125 МПа, Т = 600 °C), |
сопротивление |
|
|
Легирующий |
%, в течение, ч |
ползучести, %, |
|
|
комплекс |
|
|
при 600 °С |
|
|
300 |
1000 |
(σ = 125 МПа, |
|
|
|
|
τ = 300 ч) |
|
Сr−Мо |
3,34 |
− |
4 |
|
Cr−Mo−V |
0,5 |
− |
26 |
|
Cr−Mo−V−Nb |
0,13 |
0,23 |
100 |
|
Cr−Mo−V−Nb−N |
0,081 |
0,137 |
160 |
|
Cr−Mo−V−Nb−N−B |
0,067 |
− |
194 |
|
Cr−Mo−V−Nb−Ti−N |
0,065 |
0,080 |
200 |
|
Cr−Mo−V−Nb−Ti−N−B |
0,053 |
0,078 |
243 |
Химический состав и механические свойства некоторых отечественных и зарубежных хромистых сталей, принадлежащих к II и
IIIгруппам, представлены в табл. 23.56−23.58.
Характерной особенностью 13 %-ных хромистых сталей являет-
ся их способность закаливаться при охлаждении на воздухе даже в том случае, когда содержание углерода сравнительно невелико (0,05 %). Обусловлено это высокой стабильностью хромистого аустенита, приводящей к значительному снижению критических скоростей охлаждения для формирования мартенситной структуры.
324

Таблица 23.56
Химический состав некоторых отечественных коррозионно-стойких хромистых сталей мартенситного и ферритно-мартенситно класса, применяемых и предполагаемых для использования в реакторостроении
325
Марка стали |
Структурный |
|
Содержание основных легирующих элементов, % |
|
||||||
класс стали |
С |
Сr |
Мо |
V |
W |
Nb |
В |
Другие |
||
|
||||||||||
08X13 |
Ф (или Ф−М) |
≤ 0,08 |
12−14 |
− |
− |
− |
− |
− |
− |
|
12X13 |
М−Ф |
0,09−0,15 |
12−14 |
− |
− |
− |
− |
− |
− |
|
20X13 |
М (или М−Ф) |
0,16−0,25 |
12−14 |
− |
− |
− |
− |
− |
− |
|
30X13 |
М |
0,26−0,35 |
12−14 |
− |
− |
− |
− |
− |
− |
|
15Х11МФ |
М |
0,12−0,19 |
10,0−11,5 |
0,6−0,8 |
0,25−0,40 |
− |
− |
− |
− |
|
14Х12В2МФ |
М−Ф |
0,10−0,17 |
11−13 |
0,6−0,9 |
0,15−0,30 |
1,7−2,2 |
− |
− |
− |
|
14Х12МВБФ |
М−Ф |
0,14 |
11,6 |
0,7 |
0,42 |
0,3 |
0,3 |
− |
− |
|
12Х12МВБФР |
М−Ф |
0,10−0,15 |
11−13 |
0,7−1,0 |
0,15−0,30 |
0,6−0,9 |
0,15−0,3 |
≤0,08 |
− |
|
18Х12МВБФР |
М−Ф |
0,15−0,22 |
11−13 |
0,4−0,6 |
0,15−0,18 |
0,4−0,7 |
0,2−0,4 |
≤0,003 |
− |
|
12Х13М2БФР |
М−Ф |
0,10−0,15 |
12−14 |
1,2−1,8 |
0,1−0,3 |
− |
0,2−0,4 |
0,004 |
≤0,3Ni |
|
(ЭП-450) |
|
|
|
|
|
|
|
|
|
|
16Х11НМВСБФР |
М−Ф |
0,14−0,18 |
10,0−12,0 |
0,6−0,9 |
0,2−0,4 |
0,7 |
0,2−0,4 |
0,006 |
0,5−0,8Ni; |
|
(ЭП823) |
|
|
|
|
|
|
|
|
1,1−1,3Si |
|
15Х12В2ФТаP |
М−Ф |
0,10−0,20 |
10,0−12,0 |
<0,01 |
0,2−1,0 |
1,5 |
<0,01 |
0,0045 |
0,17Та; |
|
(ЭК181) |
|
|
|
|
|
|
|
|
0,044N |
|
16Х12НМВ2БФР |
М−Ф |
0,18−0,20 |
11,0−12,5 |
0,4−0,6 |
0,2−0,3 |
1,5 |
0,2−0,3 |
0,0045 |
0,5−0,8Ni |
|
(ЧС139) |
|
|
|
|
|
|
|
|
|
|
15Х12ВНМФ |
М−Ф |
0,12−0,18 |
11−13 |
0,5−0,7 |
0,15−0,30 |
0,7−1,1 |
− |
− |
0,4−0,8 Ni |
|
13Х12В2Н2МФ |
М |
0,10−0,16 |
10,5−12,0 |
0,4−0,5 |
0,18−0,30 |
1,6−2,0 |
− |
− |
1,5−1,8 Ni |
|
14X17Н2 |
М−Ф |
0,11−0,17 |
16−18 |
− |
− |
− |
− |
− |
1,5−2,5 Ni |
|
|
|
|
|
|
|
|
|
|
|
|
__________
* В сталях: ≤ 0,08 Si; ≤ 0,08 Mn; ≤ 0,025 S; ≤ 0,030 P.
325

Таблица 23.57
Химический состав зарубежных хромистых сталей1, применяемых и предполагаемых для использования в реакторостроении
|
Марка |
|
Струк- |
|
|
турный |
|
|
стали |
|
класс |
|
|
|
стали |
|
|
М |
|
410 |
|
||
416 |
|
М |
|
405 |
|
Ф |
|
430 |
|
Ф |
|
420 |
|
М |
|
31 |
|
М |
|
|
|
Ф−М |
|
|
НТ-9 |
||
|
НТ-7 |
М |
|
|
|
Ф |
|
|
R8 |
||
|
ЕМ-12 |
Ф−М |
|
|
|
М |
|
|
НСМ9М |
||
|
SUS410 |
М |
|
|
SUS420 |
М |
|
|
|
M |
|
|
|
||
1.4914 |
|
||
|
|
|
|
Содержание основных легирующих элементов, %
С |
Сr |
|
Ni |
Мо |
V |
Другие |
|
США |
|
|
|
|
|
|
|
|
|
1,0 |
|
|
≤ 0,15 |
11,5−13,5 |
|
≤ 0,50 |
− |
− |
|
≤ 0,15 |
12,0−14,0 |
|
− |
≤ 0,6 |
− |
− |
≤ 0,08 |
11,5−14,5 |
|
− |
− |
− |
~0,2Аl |
≤ 0,12 |
16−18 |
|
− |
− |
− |
− |
≤ 0,15 |
12−14 |
|
− |
− |
− |
− |
≤ 0,20 |
15−17 |
1,25−2,5 |
− |
− |
− |
|
|
Швеция |
|
|
|
|
|
|
|
|
|
0,55 |
|
|
≤ 0,20 |
11,9 |
|
0,05 |
0,3 |
0,5W |
|
≤ 0,10 |
9 |
|
− |
0,45 |
− |
0,5Nb |
|
Франция |
|
|
|
||
|
|
|
|
1,0 |
|
|
≤ 0,10 |
9,5 |
|
− |
0,35 |
0,5Nb |
|
≤ 0,15 |
9,0 |
|
− |
1,0 |
0,3 |
l,0Nb |
|
Япония |
|
|
|
|
|
|
|
|
0,3−0,7 |
|
|
|
≤ 0,06 |
8−10 |
|
− |
− |
− |
|
≤ 0,15 |
12−14 |
|
− |
− |
− |
− |
0,25− |
12−14 |
|
− |
− |
− |
− |
0,40 |
|
|
|
|
|
|
|
Германия |
|
|
|
||
|
|
0,45− |
|
|||
0,16− |
10,2−10,7 |
0,75− |
0,20− |
0,10−0,25Nb; |
||
0,18 |
|
|
0,95 |
0,65 |
0,30 |
≤0,0015B |
Евросоюз
|
Eurofer-97 |
M |
0,12 |
8,96 |
0,06 |
− |
0,18 |
1,04W; |
|
|
|
|
|
|
|
|
|
0,15Ta |
|
_______ |
|
|
|
|
|
|
|
|
|
|
1В сталях: ≤ 1,0 Si; ≤ 2,0 Mn; ≤ 0,030 S; ≤ 0,04 Р. |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
326

Таблица 23.58
Механические свойства некоторых хромистых мартенситных и ферритно-мартенситных сталей
|
Марка |
Режим термической |
Тисп, |
Е, |
σв, МПа |
σт, МПа |
δ, % |
ψ, % |
ак, |
σдл, МПа, |
за время, ч |
||
|
стали |
обработки * |
°С |
ГПа |
кДж/м2 |
104 |
|
|
105 |
||||
|
|
||||||||||||
|
12X13 |
З (1030 °С) + О (680 °С) |
20 |
− |
740 |
590 |
20 |
66 |
− |
− |
|
|
− |
|
|
З (1030−1050 °С), мас- |
20 |
− |
740 |
600 |
19 |
− |
1400 |
− |
|
|
− |
|
|
ло + О (700−750 °С) |
400 |
193 |
− |
− |
− |
− |
− |
− |
|
|
− |
|
|
|
500 |
183 |
540 |
480 |
15 |
− |
2500 |
220 |
|
|
190 |
|
|
|
530 |
− |
− |
− |
− |
− |
− |
190 |
|
|
160 |
|
|
|
550 |
− |
460 |
420 |
20 |
− |
2700 |
− |
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
327 |
30X13 |
З (1000−1020 °С), |
20 |
− |
960 |
713 |
16 |
52 |
≥ 550 |
− |
|
|
− |
|
воздух или масло + |
300 |
206 |
790 |
640 |
13 |
53 |
1250 |
− |
|
|
− |
|
|
|
О (600−650 °С), воздух |
400 |
197 |
720 |
580 |
12 |
52 |
1600 |
− |
|
|
− |
|
|
|
500 |
− |
620 |
540 |
14 |
54 |
1650 |
− |
|
|
− |
|
|
|
550 |
− |
540 |
490 |
16 |
69 |
1600 |
− |
|
|
− |
|
|
|
600 |
− |
460 |
420 |
21 |
80 |
1600 |
− |
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15X11МФ |
Н или З (1080−1100 °С), |
20 |
− |
740 |
550 |
17 |
66 |
1500 |
− |
|
|
− |
|
|
воздух + О (720−740 |
400 |
193 |
600 |
480 |
15 |
66 |
1900 |
− |
|
|
− |
|
|
°С), |
450 |
− |
550 |
440 |
18 |
61 |
2000 |
− |
|
|
− |
|
|
2 ч, воздух |
500 |
180 |
510 |
420 |
21 |
68 |
2100 |
− |
|
|
− |
|
|
|
550 |
− |
540 |
440 |
16 |
65 |
2000 |
160−200 |
|
|
130−170 |
|
|
|
600 |
− |
450 |
410 |
20 |
78 |
2100 |
97−100 |
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_______
* З − закалка; О − отпуск; Н − нормализация.
327

Окончание табл. 23.58
|
Марка |
Режим термической |
Тисп, |
Е, |
σв, МПа |
σт, МПа |
δ, % |
ψ, % |
ак, |
σдл, МПа, |
за время, ч |
|
|
стали |
обработки * |
°С |
ГПа |
кДж/м2 |
104 |
|
105 |
||||
|
|
|||||||||||
|
12Х12МВБФР |
Н (1000−1050 °С), |
20 |
− |
820−900 |
600−740 |
17−20 |
17−64 |
1300 |
− |
|
− |
|
|
воздух + О (750−780 °С), |
580 |
− |
550 |
500 |
19 |
16 |
− |
200 |
|
160 |
|
|
3 ч, воздух |
600 |
− |
520 |
490 |
19 |
18 |
− |
180 |
|
140 |
|
|
|
650 |
− |
390 |
370 |
20 |
− |
− |
95 |
|
75 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12Х13М2БФР |
З (1050 °С), 30 мин. + |
20 |
− |
750-800 |
780 |
4−19 |
− |
− |
− |
|
− |
|
|
О (720 °С), 1 ч |
350 |
− |
640 |
610 |
6−11 |
− |
− |
− |
|
− |
|
|
|
500 |
− |
610 |
570 |
5−6 |
− |
− |
− |
|
− |
|
|
|
600 |
− |
350−390 |
|
15−20 |
− |
− |
− |
|
− |
328 |
|
|
750 |
− |
180 |
160 |
15−40 |
− |
− |
− |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
13Х12В2Н2МФ |
З (1000− 1020 °С), масло |
20 |
− |
1150−1250 |
1000−1050 |
12−15 |
50−55 |
≥ 800 |
− |
|
− |
|
|
|
|||||||||||
|
|
+ 0(540−590 °С), воздух |
300 |
− |
1100 |
970 |
14 |
55 |
1100 |
− |
|
− |
|
|
|
400 |
− |
1050 |
870 |
14 |
56 |
1100 |
− |
|
− |
|
|
|
450 |
− |
1000 |
840 |
14 |
57 |
1100 |
− |
|
− |
|
|
|
500 |
− |
900 |
730 |
14 |
60 |
1100 |
− |
|
− |
|
|
|
550 |
− |
800 |
500 |
15 |
60 |
1100 |
− |
|
− |
|
|
|
600 |
− |
600 |
490 |
15 |
70 |
1200 |
− |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14Х17Н2 |
З (1030 °С), масло + |
20 |
− |
1200 |
900 |
8 |
62 |
− |
− |
|
− |
|
|
О (580 °С) |
300 |
− |
1120 |
840 |
8 |
32 |
− |
− |
|
− |
|
|
|
500 |
− |
95 |
870 |
16 |
64 |
− |
− |
|
− |
|
|
|
550 |
− |
57 |
440 |
9 |
67 |
− |
− |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
328
Другая особенность 13 %-ных хромистых сталей − даже при небольших колебаниях состава они могут существенно изменять свою структуру и переходить из мартенситного в другой класс (см. рис. 23.157, табл. 23.56 и 23.57). Это отрицательно сказывается на механической прочности при высокой температуре, и поэтому к химическому составу сталей для ответственных деталей предъявляют особые требования в отношении хрома, углерода и некоторых других элементов.
По жаропрочным свойствам и особенно по сопротивлению ползучести стали с 13 % Cr, не содержащие других легирующих элементов, уступают перлитным сталям. Уже при температуре выше 450−480 °С происходит значительное снижение предела ползучести, особенно у сталей с повышенным содержанием углерода
(30X13 и 40X13).
Существенное повышение жаропрочности 12−13 %-ных хромистых сталей возможно путем дополнительного легирования их Mo, W, Nb, V (см. табл. 23.55 и 23.58). Однако оно ограничено довольно узкими пределами. В первую очередь, невелики колебания содержания углерода (0,1−0,2 %), поскольку это необходимо для уменьшения количества карбидных фаз, а также для более высокой концентрации легирующих элементов в твердом растворе.
Содержание других легирующих элементов в мартенситных сталях находится также в довольно узких пределах: около
12−13 % Cr; до 2 % Мо; до 4 % W; 0,2−0,4 % V; 0,1−0,5 % Nb; до
2 % Ni, так как повышенное содержание их переводит сталь в другой класс, например в ферритный (при большом количестве ферритостабилизирующих элементов) или ферритно-аустенитный (при большом количестве Ni). Это сопровождается, как показано выше, ухудшением механических и технологических свойств стали, невозможностью проведения термических обработок (стали ферритного класса). Кроме того, большое содержание ферритостабилизирующих элементов (Мо, V и др.) способствует образованию δ-феррита при 1050 °С (табл. 23.59), что уменьшает прочность. Тем не менее, если необходимо высокое содержание легирующих ферритостабилизирующих элементов, то в стали поддерживают соответствующее содержание аустенитостабилизирующих элементов,
329
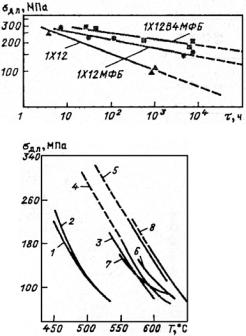
таких, как Ni, Mn, Cu и др. В результате этого достигается полностью аустенитная структура при 1050 °С и полностью мартенситная после закалки перед отпуском.
Таблица 23.59
Изменение количества δ-феррита, образующегося при введении одного
процента легирующего элемента в сталь 10Х12, %
Элемент |
Al |
V |
Ti |
Сr |
Nb |
Si |
Mo |
Mn |
Сu |
Co |
Ni |
С |
N |
δ-феррит |
+54 |
+18 |
+14 |
+14 |
+12 |
+6 |
+5 |
−6 |
−7 |
−7 |
−20 |
−210 |
−220 |
Изучение влияния легирующих элементов на свойства кор- розионно-стойких сталей, содержащих 12−13 % Cr, позволило установить, что наиболее значительно жаропрочность повышает Мо, а затем W и Nb. На рис. 23.162 приведены кривые длительной прочности основных 12 %-ных хромистых сталей при базе испытания 105 ч в зависимости от температуры.
Рис. 23.162. Длительная прочность 12 %-ных хромистых сталей при 600 °С
Рис. 23.163. Сводный график предела длительной прочности сталей за 105 ч в зависимости от температуры:
1 − 12X13; 2 − 20X13 3 − 20Х11МФБН; 4 −
10Х12ВНМФ 5 − 20Х12МВБФР;
6 − 14Х12В2МБ; 7 − 12Х8М1ФБР;
8 − 15Х12М1ВБФР
330
Приведенные на рис. 23.162 и 23.163 данные наглядно свидетельствуют о существенном повышении жаропрочности по мере увеличения числа легирующих элементов и усложнения фазового состава.
Основное упрочнение сложнолегированных сталей типа X13 создается за счет твердого раствора, легированного Cr, Mo, W и V, а также за счет карбидов и дисперсных карбонитридов. В общем виде карбидные и интерметаллидные фазы, образующиеся в сталях с 12−13 % Cr в результате длительного старения, следующие:
сталь с 12% Cr − |
Cr23С6; |
сталь с 12% Cr + Мо − |
М23С6, М6С, Fe2Mo; |
сталь с 12% Cr + Mo + Nb − |
М23С6, M6C, Fe2Mo, Nb(C,N); |
сталь с 12% Cr + Mo + Nb + W − М23С6, M6C, Fe2(Mo,W), |
|
|
Nb(C, N); |
сталь с 12% Cr + Mo + Nb + W + V − М23С6, M6C, Fe2(Mo,W), Nb(C,N); V(C,N).
Фазовый состав хромистых сталей существенно более сложный, чем низколегированных, что также способствует повышению жаропрочности (см. рис. 23.163). Принципиальное различие фазовых составов состоит в том, что в числе упрочняющих имеются фазы Лавеса Fe2Mo, Fe2(Mo, W). Условия формирования этой фазы рассмотрим более подробно на примере сплавов системы Fe−Mo.
Железо и молибден ограниченно растворимы друг в друге: максимальная атомная растворимость Fe в Мо достигает порядка 20 % при 1610 °С, а максимальная атомная растворимость Мо в α-Fe 22 % при 1449 °С (рис. 23.164). С уменьшением температуры растворимость элементов друг в друге значительно снижается и при температуре ниже 600 °С не превышает нескольких долей процента.
Растворимость Мо в γ-Fe незначительна − максимальное ее значение составляет около 1,41 % (атомное содержание) при 1150 °С; двухфазная область γ + α при этой температуре простирается до
2,05 % Мо.
Система Fe−Мо характеризуется наличием четырех химических соединений: λ (Fe2Mo), R (Fe5Мо2) (или Fe62Мо38 − по другим данным), μ (Fе3Мо2) (или Fе7Мо6 − по другим данным) и σ (FеМо) (см. рис. 23.164). Фаза σ образуется по перитектической реакции
331
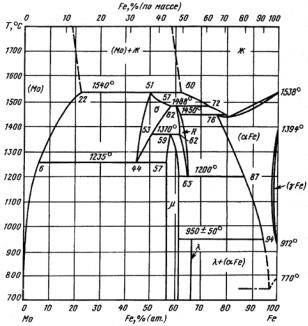
Ж (36,5 ат. % Мо) + (Мо) ' σ при 1610 °С (1540 °С − по другим данным) и распадается по эвтектической реакции на твердый раствор на основе Мо и фазу μ при 1235±20 °С. Фаза R образуется по перитектической реакции Ж (27,5 ат. % Мо) + σ ' R при 1488 °С и распадается по эвтектоидной реакции при 1245 °С (1200±10 °С − по другим данным) на фазы α (твердый раствор Мо в α-Fe) и μ. Фаза μ образуется по перитектоидной реакции (R + σ → μ) при 1370 °С. Фаза λ образуется также по перитектоидной реакции (α + μ → λ) при 950±10 °С (977 °С − по другим данным).
Рис. 23.164. Диаграмма состояния системы Fe−Мо
Фаза σ имеет тетрагональную кристаллическую решетку с
а = (0,9218 ± 0,0002) нм, с = (0,4813 ± 0,0002) нм и 30 атомами в элементарной ячейке.
Периоды гексагональной решетки фазы μ в области сплавов, бо-
гатых железом, составляют а = (0,4754 ± 0,0001) нм, с = (0, 25716 ±
332
± 0,0003) нм (0,4752 и 0,2568 нм соответственно − по другим дан-
ным); ромбоэдрической ячейки − а = 0, 9001 нм, α = 30,62°.
Фаза R содержит 53 атома в элементарной ромбоэдрической ячейке с периодом а = 0,9016 нм, α = 74,46°; эквивалентная ей гексагональная ячейка имеет периоды а = (1,0910 + 0,0003) нм,
с = (1,9354 ± 0,0005) нм.
Фаза λ обладает гексагональной кристаллической решеткой типа
MgZn2 с а = (0,4745 ± 0,0005) нм и с = (0,7734 ± 0,0005) нм (0,4744
и0,7725 нм соответственно − по другим данным).
Вконструкционных сталях содержание Мо (также и других тугоплавких легирующих элементов) обычно не превышает нескольких процентов. Поэтому практический интерес представляет лишь
железный угол диаграммы состояния Fe−Mo, где присутствует единственное выделение λ − так называемая фаза Лавеса, которая является упрочняющей фазой. Она выделяется в процессе нагрева (эксплуатации) изделия длительное время при высокой температуре. Как видно из рис. 23.164, верхний температурный интервал существования λ фазы ограничен 950 °С. Это позволяет легко переводить составляющие фазы Лавеса в твердый раствор посредством нагрева под закалку при температурах выше 1000 °С (на практике закалку проводят с температур 1050−1200 °С).
Схожую левую часть диаграмм состояния имеют и другие тугоплавкие элементы с железом. В этих сплавах (богатых железом) при старении выделяется фаза типа А2В, где А − Fe, В − легирующий элемент (W, Ti, Nb и др.).
Характерной особенностью фаз Лавеса является их медленное выделение из твердого раствора и чрезвычайно медленный рост размеров частиц, что благотворно влияет на стабилизацию механических свойств сталей при длительных высокотемпературных выдержках. Характер выделения фаз Лавеса зависит от температуры эксплуатации (старения) стали. При Т < 600 °С происходит непрерывный распад, частицы распределены равномерно по телу зерна, фаза длительное время сохраняет когерентность с матрицей. В интервале 600−700 °С возрастает роль дефектов структуры и снижается время до момента потери когерентности частиц с матрицей; на дефектах структуры (границах зерен, двойников и т.п.) фаза растет
333
быстрее, чем в зерне. При Т > 700 °С когерентность нарушается очень быстро. Поскольку с потерей когерентности из-за изменения механизма упрочнения снижаются прочностные свойства и ускоряется рост частиц второй фазы (при одновременном уменьшении их объемной плотности), в результате чего нарушается стабильность механических свойств, то в случае упрочнения стали фазой Лавеса
верхний предел температуры эксплуатации изделия ограничен
650 °С − температурой, при которой определенная доля второй фазы может длительное время сохранять когерентную связь с матрицей и эффективно упрочнять сталь.
В хромистых сталях с повышенным содержанием Мо и W интерметаллидная фаза (Fe, Cr)2(Mo, W) образуется в процессе старе-
ния при Т > 550 °С после того, как весь углерод израсходуется на образование карбидов и карбонитридов.
Особая роль в качестве легирующих элементов в сталях с 12−13 % Cr принадлежит V и Nb. В ряде работ было показано, что избыток V сверх необходимого для образования карбида VC разупрочняет твердый раствор за счет уменьшения сил связи между атомами железа. Однако V в концентрации 0,2−0,4 %, входящий во многие мартенситные стали с 12−13 % Cr, не образует самостоятельных карбидов. Часть V (< 0,1 %) связывается в карбонитридах типа M2(C, N), в карбидах типа М23С6 и в первичных карбонитридах V(C, N). Остальная часть V находится в хромистом твердом растворе, и это определенным образом способствует повышению кратковременной и длительной прочности мартенситных сталей с 12−13 % Cr. Наиболее сильное упрочняющее действие Nb проявляется при выделении его в виде высокодисперсных частиц сложного карбонитрида (Cr, Mo, W, Nb)2(C, N) в процессе отпуска (500−650 °С) после закалки от высокой температуры. Однако в дальнейшем при повышенной температуре происходит превращение карбонитрида M2(C, N) в карбид типа М23С6 и прочность стали падает.
Для всех 13 %-ных хромистых сталей характерно следующее изменение механических свойств, определенных при нормальной температуре, в зависимости от температуры отпуска (рис. 23.165). Предел прочности в этих сталях сохраняет свои значения до темпе-
334
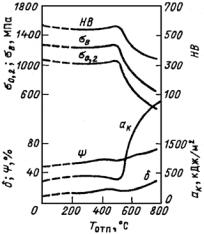
ратуры Тотп ≈ 500 °С с заметной тенденцией к «вторичному» упрочнению, как и в сталях с более низким содержанием Cr (см. рис. 23.140). Выше 500 °С происходит быстрое снижение механических свойств, особенно около 600 °С. Ударная вязкость значительно понижается при 450−500 °С, т.е. примерно при той же температуре, при которой происходит «вторичное» упрочнение. Возможно, это связано с дисперсионным упрочнением или отпускной хрупкостью.
Рис. 23.165. Влияние температуры отпуска на механические свойства стали 12Х13МФ (исходное состояние − закалка с 1000 °С, масло)
В результате высокотемпературного отпуска (при 720−750 °С) можно достаточно надежно стабилизировать структуру 13 %-ных хромистых сталей. Такая стабилизация обеспечивает неизменность механических свойств в процессе последующей длительной работы при температуре 450−500 °С (табл. 23.60). Температуре отпуска 700−725 °С соответствует наибольшая скорость распада аустенита (см. рис. 23.160). При температурах, ниже указанных, вплоть до начала мартенситного превращения Мн аустенит этих сталей обнаруживает высокую стабильность из-за сильного смещения С-образной диаграммы вправо и снижения температуры Мн: в температрурном интервале 500 °С ÷ Мн даже длительные выдержки (τ > 103 ч) не вызывают распада. Это обстоятельство способствует получению мартенситной структуры в изделиях при охлаждении на
335
воздухе. При этом, как видно из рис. 23.160, надо быстро пройти критический интервал температур 700−725 °С, так как при этих температурах распад аустенита начинается примерно через 1 мин и полностью заканчивается уже через 12 мин.
Таблица 23.60
Механические свойства стали 20X13 после длительных испытаний
Условие |
σ |
σ |
δ |
ψ |
а |
, кДж/м2 |
|
в, МПа |
т, МПа |
, % |
, % |
к |
|
Непосредственно после |
|
|
|
|
|
|
высокотемпературного отпуска |
720 |
520 |
21 |
65 |
|
1000 |
После дополнительного |
|
|
|
|
|
|
длительного испытания при |
|
|
|
|
|
|
450 °С (σ = 150−200 МПа, |
730 |
560 |
19 |
61 |
|
900 |
τ = 2100−2300 ч) |
|
При отпуске закаленный мартенсит (М) распадается с выделением различных карбидов в зависимости от температуры отпуска:
винтервале 450−470 °С М → (Fe, Cr)3C + Ф,
винтервале 470−550 °С М → (Cr, Fe)7C3 + Ф,
при Т> 550 °С М → (Cr, Fe)23C6 + Ф,
где Ф − хромистый α-твердый раствор. С образованием стабильного карбида М23С6 твердый раствор существенно обедняется хромом и свойства стали ухудшаются.
Наилучшими характеристиками обладают безникелевые хромистые стали, содержащие комплекс Мо + V + Nb + В, напрмер, 14Х12В2МФ, 12Х12ВМБФР, 12Х13М2БФР и др. (интересно, что все комплекснолегированные хромистые стали содержат комплекс Мо + V − см. табл. 23.56). Сочетание легирующих элементов обеспечивает получение в стали после охлаждения мартенситноферритной структуры, причем содержание свободного феррита в зависимости от соотношения аустенитостабилизирующих (С, N, Ni и др.) и ферритостабилизирующих (Cr, Mo, V, Mb, W и др.) элементов может колебаться от 15 до 40%. В результате отпуска мартенситная составляющая структуры распадается с выделением упрочняющих фаз: М + Ф → С + Ф + упрочняющие фазы. При этом мартенситная часть структуры превращается в сорбит (С).
336
Особенностью старения таких сталей является растянутость во времени процесса распада твердого раствора, связанная с обяза-
тельной последовательностью выделения разных фаз. Так, на на-
чальных стадиях старения сначала из мартенсита выделяется карбид М23С6. При длительном старении (например, при 680 °С в течение 103 ч) имеет место коалесценция карбида М23С6 и выделение карбида типа МС и фазы Лавеса. Такая последовательность фазовых превращений позволяет удерживать прочность стали на высоком уровне вначале за счет твердорастворного упрочнения и карбидной фазы, а затем интерметаллидной.
Следует отметить, что в сталях, содержащих 12−13 % Cr, проблема регулирования состава твердого раствора и вторичных упрочняющих фаз осложняется необходимостью избегать образования свободного феррита в связи с возможностью перехода стали в полуферритный класс и соответственного ухудшения вязкости, обрабатываемости и жаропрочности. Наличие в стали заметного количества Мо, W, Nb и V усиливает ее склонность к образованию свободного феррита и при неблагоприятном их сочетании вызывает необходимость дополнительного легирования элементами, препятствующими выделению феррита. В качестве элементов, расширяющих область γ-фазы, используют главным образом Ni, легирование которым благоприятно влияет на жаропрочность стали. Наиболее сильное влияние на жаропрочность в сталях с 12−13 % Cr никель оказывает при содержании от 0,2 до 2 %. Выше 2 % влияние Ni мало заметно, поэтому все никельсодержащие хромистые стали отечественного производства в зависимости от сочетания С, Мо, V, Nb и В имеют 0,4−1,8 % Ni (см. табл. 23.56). Все никельсодержащие хромистые стали содержат легирующий комплекс Мо + V или Мо + V + Nb +B. Принципиально никельсодержащие стали по фазовому составу не отличаются от таковых без Ni, однако из-за большого вклада тонкой структуры в жаропрочность они относятся к числу наиболее жаропрочных в серии хромистых сталей.
При содержании Cr более 13−15 % сталь приобретает ферритную структуру и теряет способность термически обрабатываться. Восстановление этой способности достигается путем введения в
сталь Ni в количестве 2−4 %, являющегося γ-стабилизатором (см.
337
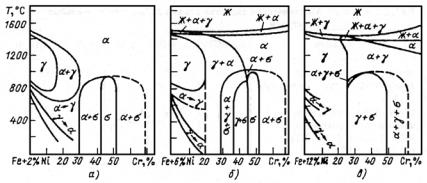
табл. 23.56 − сталь 14X17Н2). Расширяя γ-область, Ni переводит сталь с 16−18 % Cr в мартенситный класс с наличием превращения α ' γ, допускающего термическую обработку (рис. 23.166, а). Изменение свойств закаленной стали после отпуска практически не отличается от изменения свойств 13%-ных хромистых сталей (например, сталь 14X17Н2 − см. табл. 23.58).
Рис. 23.166. Политермические разрезы диаграмм состояний системы Fe−Cr−Ni
при 2 % (а), 6 % (б) и 12 % (в) никеля
Стали, содержащие 16−18 % Cr и 2 % Ni, обладая примерно теми же механическими свойствами, что и 12 %-ные хромистые стали, имеют более высокую коррозионную стойкость вследствие высокой концентрации хрома. Структура и свойства этих сталей существенно зависят от содержания С, Cr и Ni.
Стали IV группы с 14−16 % Cr и повышенным содержанием углерода (0,6−1,0 % С) также относятся к мартенситному классу (см. табл. 23.53) и используются в том случае, когда требуется сочетание высокой твердости и коррозионной стойкости, в частности, для деталей арматуры, нержавеющих подшипников и т.п. Благодаря большому количеству углерода стали этой группы имеют соответственно и значительное количество карбидной фазы. Для более полного растворения карбидов температура закалки должна быть 1000−1050 °С. Отпуск этих сталей проводят при низкой температуре 150−250 °С. Высокая твердость сталей (НВ ≈ 5000 МПа) сохраняется до температуры ~ 500 °С, а затем резко снижается.
338
Двухфазные хромистые стали
Хромистые стали, приобретающие при нагреве только двухфазную структуру (см. рис. 23.121, область ПФ), которая при быстром охлаждении (закалке) преобразуется в структуру, состоящую из смеси мартенсита и феррита (иногда его называют δ-ферритом), относятся к классу двухфазных сталей. Такая структура представлена на рис. 23.137, в.
Изменения количества легирующих элементов, при которых возникает двухфазная область (α + γ), происходят в узком интервале, поэтому четкую границу между составом сталей ферритномартенситного и мартенситного классов установить достаточно трудно (см. табл. 23.56). При наличии в системе углерода в количестве 0,1−0,15 % пределы сосуществования области (α + γ) расширяются (см. рис. 25.19). Если учесть, что легирование ферритообразующими элементами (Mo, W, V, Nb) эквивалентно увеличению содержания Cr [см. табл. 23.42 и уравнение (23.40)], то становится очевидным, что сложнолегированные стали с 12 % Cr легко могут переходить из мартенситного класса в мартенситно-ферритный. Так, если в сталь 10Х12М (содержит около 0,6 % Мо), в структуре которой практически отсутствует феррит (δ-феррит) в виде отдельных зерен, ввести 1 % W и 0,3 % V, то количество феррита в структуре возрастает примерно до 50 %, а после введения 0,3 % V и 0,75 % Nb − примерно до 70 %. Увеличение содержания углерода в стали 10Х12М до 0,2 % (вместо 0,1 %) снижает количество ферритной фазы до 50 % (сталь 20Х13М), а при содержании порядка 0,3 % С феррит в виде отдельных зерен почти полностью исчезает
(сталь 30Х12М).
Для сохранения высокой жаропрочности наличие значительного количества выделений α-фазы (δ-феррита) в структуре сталей с 12−13 % Cr нежелательно, так как α-фаза способствует снижению сопротивления ползучести, релаксации напряжений, уменьшает предел длительной прочности, усиливает способность стали к охрупчиванию при высокой температуре.
Упрочнение двухфазных сталей при легировании, так же как и упрочнение мартенситных сталей, связано c увеличением концен-
339
трации легирующих элементов в ферритной фазе и увеличением стабильности карбидных фаз.
В некоторых двухфазных сталях возможно упрочнение ферритных зерен за счет выделения дисперсных частиц интерметаллидных фаз (фаз Лавеса). Например, ферритно-мартенситная сталь 1Х12В4МФ, которая обладает высокими жаропрочными свойствами, приближающимися к жаропрочным свойствам аустенитной стали, после закалки от 1150 °С приобретает структуру, состоящую из отдельных зерен мартенсита и феррита. Старение при 600 °С в течение от 1,5 до 10 ч приводит к распаду зерен мартенсита с образованием ферритно-карбидной смеси. Электронномикроскопические исследования методом «на просвет» и рентгеновские исследования подтверждают наличие карбидов типа М23С6 в структуре. В зернах феррита новая фаза не установлена. Только после длительного старения (τ ≥ 500 ч) на рентгенограммах наряду с линиями карбида М23С6 появляются линии интерметаллида типа А2В, идентифицированные как Fe2W. Аналогичная микроструктура наблюдается и в ферритно-мартенситной стали 1Х13М2БФР после длительного старения (эксплуатации) при 500 °С (рис. 23.167), где вытянутые частицы представляют собой интерметаллидные выделения фазы Fe2Mo.
Таким образом, упрочнение ферритно-мартенситных сталей происходит во всем объеме: зерна мартенсита при старении образуют дисперсные ферритно-карбидные структуры, а в зернах феррита, который в обычных двухфазных сталях остается неизменным, выделяются чрезвычайно дисперсные частицы фаз Лавеса типа А2В. Суммарный упрочняющий эффект приводит к существенному увеличению жаропрочности двухфазных ферритно-мартенситных сталей.
Однако, несмотря на это, по жаропрочности хромистые стали уступают сталям аустенитного класса. В связи с этим в последнее время все большее внимание привлекают к себе дисперсноупрочняемые мартенситные и ферритно-мартенситные стали: зару-
бежные ODS (oxide dispersion strengthened) и отечественные ДУО
(дисперсно упрочненные оксидами) стали как перспективные материалы для оболочек твэлов реакторов на быстрых нейтронах и возможного использования их для оболочек твэлов реакторов на быстрых нейтронах и первой стенки термоядерных реакторов.
340
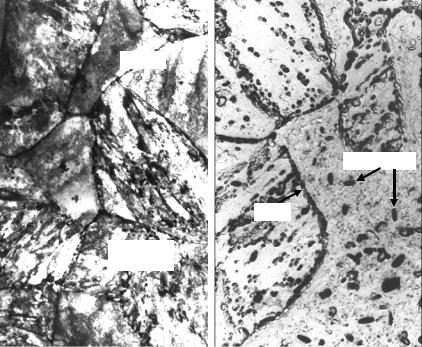
Феррит
Фаза Лавеса
М23С6
Мартенсит
отпуска
|
2 мкм |
|
|
|
|
|
|
|
а |
б |
|||
|
|
|
|
|
|
|
Рис. 23.167. Микроструктура стали 1Х13М2БФР после штатной обработки (закалка от 1050 °С + отпуск 720 °С, 1 ч; фольга) (а) и последующего старения при 550 °С в течение 104 ч (экстракционная реплика) (б)
Из приведенных в табл. 23.61 составов ODS сталей видно, что основу разрабатываемых материалов составляет матрица, содержащая 9, 12−13 или около 20 % Cr. Обращает на себя внимание то, что стали на основе Х12 и Х20 имеют пониженное содержание углерода по сравнению со сталями на основе Х9, а объемная доля упрочняющей дисперсной фазы Y2O3 во всех сталях в среднем колеблется от 0,2 до 0,4%.
Содержание дисперсных частиц в отечественных ДУО сталях приведено в табл. 23.62, а типичная микрострукткра таких сталей − на рис. 23.168.
341
Таблица 23.61
Химический состав дисперсно-упрочняемых жаропрочных хромистых сталей
Осно- |
|
Содержание основных легирующих элементов |
|
||||
ва |
|
|
и упрочняющей фазы, % |
|
|
||
стали |
C |
Cr |
W |
Ti |
Y2O3 |
Другие |
Страна |
9Cr- |
0,13−0,14 |
8,5−9,1 |
1,91−1,97 |
0,18−0,29 |
0,34−0,44 |
(0,27− |
Япония |
ODS |
|
|
|
|
|
0,23)Y |
ЕС* |
|
0,08−0,12 |
8,5−9,5 |
1,8−2,2 |
≤0,1 |
0,20−0,27 |
|
|
|
0,14 |
9,0 |
1,92 |
0,2 |
0,36 |
0,28Y |
ЕС |
12Cr- |
0,02−0,06 |
11,72−12,8 |
1,92−2,75 |
0,3−0,74 |
0,24−0,46 |
|
Япония |
ODS |
0,01−0,02 |
13,9−14,2 |
− |
1,0−1,07 |
0,22−0,27 |
0,3Мо |
Япония |
|
0,02−0,04 |
11,97−13,64 |
1,65−2,02 |
0,28−0,30 |
0,24−0,38 |
(0,19− |
Япония |
|
0,02 |
|
3,0 |
|
|
0,30)Y |
США |
|
13−14 |
0,4−1,0 |
0,25−3,0 |
|
|||
|
0,02 |
13,1 |
− |
2,2 |
0,38 |
1,4Мо |
Россия |
|
0,011 |
13,5 |
− |
1,3 |
0,39 |
0,6Мо; |
Россия |
|
|
|
|
|
|
0,17Al |
|
|
0,007 |
13,4 |
2,1 |
1,1 |
0,39 |
0,2Мо |
Россия |
20Cr- |
0,05−0,10 |
16,0−22,1 |
0,29−1,83 |
0,27−0,28 |
0,36−0,37 |
(0,28− |
Япония |
ODS |
|
|
|
|
|
0,29)Y |
|
|
0,10 |
19,02 |
1,85 |
0,28 |
0,37 |
0,29Y; |
Япония |
|
|
|
|
|
|
1,75Si |
|
|
0,02 |
20 |
− |
0,5 |
− |
5,5Al |
США |
* Евросоюз.
|
|
|
|
|
Таблица 23.62 |
Ферритно-мартенситные ДУО стали, полученные |
|||||
|
во ВНИИНМ им. А.А. Бочвара |
|
|||
|
|
|
|
|
|
Матричная сталь |
|
Содержание |
Содержание |
|
Время механического |
|
Y2О3, % |
Тi, % |
|
легирования, ч |
|
|
|
|
|||
ЭП450 (1Х13М2БФР) |
|
0,5 |
- |
|
48 |
ЭП450 (1Х13М2БФР) |
|
0,25 |
0,4 |
|
30 |
ЭП450 (1Х13М2БФР) |
|
0,25 |
0,4 |
|
48 |
ЭК181 (16Х12В2ФТаР) |
|
1 |
1 |
|
30 |
342

Рис. 23.168. Нанооксиды в ДУО стали ЭП450
В табл. 23.63 приведены механические свойства хромистой стали Eurofer-97 (см. табл. 23.57) и стали на ее же основе с добавлением дисперсных частиц. Видно, что при одинаковом химическом составе матричной основы кратковременные прочностные свойства дисперсно-упрочненной стали существенно превышают прочность стали без дисперсного упрочнения не уступая ей по пластичности.
Таблица 23.63
Пределы прочности σв, текучести σ0,2, равномерное δр и полное δ0 удлинения
стали Eurofer-97 с 0,3 % Y2O3 и без добавки дисперсных частиц
Т, °С |
|
Eurofer-97-ODS |
|
|
Eurofer-97 |
|
||
σв, |
σ0,2, |
δр, % |
δ5, % |
σв, |
σ0,2, |
δр, % |
δ5, % |
|
|
МПа |
МПа |
МПа |
МПа |
||||
20 |
915 |
698 |
9,7 |
14,8 |
655 |
565 |
4,8 |
14,8 |
150 |
− |
− |
− |
− |
600 |
532 |
3,4 |
15 |
200 |
832 |
643 |
13,5 |
17,2 |
− |
− |
− |
− |
250 |
− |
− |
− |
− |
564 |
485 |
3,1 |
12,7 |
300 |
821 |
671 |
12,8 |
13,9 |
− |
− |
− |
− |
350 |
− |
− |
− |
− |
528 |
480 |
2,2 |
11,1 |
400 |
800 |
600 |
10,6 |
14,5 |
− |
− |
− |
− |
450 |
− |
− |
− |
− |
490 |
440 |
2,2 |
11,2 |
500 |
694 |
516 |
4,9 |
10,5 |
440 |
400 |
2 |
23 |
600 |
415 |
326 |
4 |
10,7 |
320 |
300 |
1,5 |
33 |
700 |
272 |
210 |
5,1 |
9,3 |
− |
− |
− |
− |
343
Из результатов испытаний на термическую ползучесть сталей ЭП-450 и ЭП-450-ДУО при температурах 650 и 700 °С (табл. 23.64) и кривых термической ползучести (рис. 23.169) этих сталей видно, что ДУО сталь по характеристике жаропрочности значительно превосходит матричную сталь того же химического состава.
Таблица 23.64
Результаты испытаний на термическую ползучесть плоских образцов из сталей ЭП450 и ЭП450-ДУО при температурах 650 и 700 °С
Материал |
Температура |
Напряжение, |
|
Скорость пол- |
Время до раз- |
|
|
испытания, °С |
МПа |
|
зучести, %/ч |
рушения, ч |
|
ЭП450 |
650 |
140 |
|
|
1,18 10-2 |
392 |
ЭП450-ДУО |
650 |
140 |
|
|
2,38 10-4 |
> 1300 |
ЭП450 |
700 |
120 |
|
9,1 |
2,3 |
|
ЭП450-ДУО |
700 |
120 |
|
|
1,82 10-3 |
187 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 23.169. Кривые термической ползучести сталей ЭП450 и ЭП450-ДУО
Ферритные хромистые стали
Коррозионно-стойкие высокохромистые стали ферритного класса (15−30 % Cr) с низким содержанием углерода характеризуются отсутствием фазового превращения α ' γ при нагреве (см. рис.
344
23.157), поэтому при закалке эти стали не упрочняются. Кроме того, их механические свойства могут существенно снижаться в результате роста зерна, развития тепловой хрупкости, образования σ- фазы. Основное преимущество высокохромистых сталей − значительное сопротивление окислению при высокой температуре, а также высокая коррозионная стойкость в различных агрессивных средах и в атмосфере. Благодаря высокому электросопротивлению многие высокохромистые стали могут применяться в качестве элементов электросопротивления.
При увеличении содержания углерода, расширяющего область γ-фазы, стали могут претерпевать частичное превращение α ' γ, однако механические свойства после термической обработки, как правило, изменяются мало.
Механические свойства и области применения некоторых ферритных сталей, перспективных для использования и в реакторостроении, представлены в табл. 23.65.
Стали, содержащие 17 % Cr, обладают низкой жаропрочностью и поэтому применяются только при небольших механических нагрузках в качестве жаростойких материалов для работы при температуре до 900 °С или в качестве коррозионно-стойких для работы в различных химических средах.
Стали с 25−30 % Cr являются полностью ферритными. Типичной сталью этого класса является сталь марки Х27, применяемая в качестве материала с высоким сопротивлением окислению. В структуре этих сталей, кроме феррита, могут присутствовать при наличии углерода карбиды хрома. Сталям с 27 % Cr присущи те же недостатки, что и сталям с 17 % Cr: большая склонность к росту зерна; появление хрупкости при нагреве выше 800−850 °С; образование при сварке грубозернистой структуры, не устраняемой термической обработкой; переход в хрупкое состояние после отпуска при 475 °С или замедленного охлаждения; низкие жаропрочные свойства.
В стали с 25−30 % Cr часто вводят Ti, Nb, Та и N с целью уменьшения их склонности к росту зерна при нагреве. Из этих элементов наиболее эффективное влияние оказывают Nb и Та. Механические свойства сталей с ниобием и танталом при высокой температуре выше, чем у стали Х27 без дополнительного легирования.
345

Таблица 23.65
Механические свойства и некоторые области применения хромистых коррозионно-стойких сталей ферритного класса
346
Марка |
Термическая |
Тисп, °С |
σв, МПа |
σ0,2, МПа |
δ, % |
ψ, % |
ак, |
Применение |
стали |
Обработка |
кДж/м2 |
В энергетическом машиностроении: |
|||||
08X13 |
Закалка (1000− |
20 |
470 |
280 |
25 |
73 |
2400 |
|
|
1200 ° С), вода + |
300 |
390 |
240 |
22 |
73 |
3400 |
детали котлов, горелок, экраны и т.д. для |
|
+ отпуск (680− |
600 |
170 |
150 |
34 |
87 |
2500 |
работы при Т ≤ 800 °С |
|
700 °С), 12 ч, |
|
|
|
|
|
|
|
|
воздух |
|
|
|
|
|
|
Теплообменники, чехлы термопар, экра- |
12X17 |
Отжиг (740− |
20 |
400−520 |
250−360 |
18−30 |
50–74 |
− |
|
|
780 °С), воздух |
300 |
450 |
26 |
25 |
− |
− |
ны, поддоны и т.д. для длительной рабо- |
|
|
600 |
200 |
150 |
60 |
− |
− |
ты при Т ≤ 850 °С. Рекомендуется как |
|
|
900 |
20 |
− |
58 |
98 |
1700 |
заменитель стали 12Х18Н9 |
|
|
1100 |
10 |
− |
72 |
97 |
1000 |
То же |
08Х17Т |
Нормализация |
20 |
510 |
340 |
36 |
78 |
− |
|
|
(850 °С), воздух |
|
|
|
|
|
|
То же |
15Х18СЮ |
Отжиг (800− |
20 |
500 |
300 |
20 |
50 |
− |
|
|
850 °С), воздух |
|
|
|
|
|
|
|
|
или вода |
|
|
|
|
|
|
Чехлы термопар, трубы пиролизных |
15Х25Т |
Отжиг (730− |
20 |
430−450 |
300 |
12−20 |
45 |
≥ 200 |
|
|
780 °С), воздух |
|
|
|
|
|
|
установок, теплообменники и т.д., рабо- |
|
или вода |
|
|
|
|
|
|
тающие до Т ≤ 1000 °С. Рекомендуется |
|
|
|
|
|
|
|
|
как заменитель стали 12X18Н10Т |
|
|
|
|
|
|
|
|
Детали печей, поддоны, опоры подовых |
15X28 |
Отжиг (740− |
20 |
450−540 |
300−350 |
17−20 |
45 |
− |
|
|
780 °С), воздух |
700 |
77 |
− |
48 |
92 |
1800 |
труб, подовые брусья и т.д., работающие |
|
или вода |
1100 |
8 |
− |
138 |
99 |
1300 |
длительное время до Т ≤ 1100 °С. Реко- |
|
|
|
|
|
|
|
|
мендуется как заменитель стали |
|
|
|
|
|
|
|
|
20Х23Н18 |
346
Для дальнейшего повышения жаростойкости при высокой температуре стали с 25 30 % Cr часто легируют Si и Аl в количестве от 1 до 5 %. Хромистые стали с Si могут применяться для изготовления литых изделий, так как Si улучшает жидкотекучесть стали.
Стали с высоким содержанием Аl, например Х27Ю5, применяют в качестве нагревательных элементов при высокой температуре (до 1200 1300 °С), причем особенно эффективно эти стали работают в средах, содержащих большое количество серы, в которых нихром совершенно неприменим.
Мартенситно-стареющие стали
В настоящее время для внутриреакторного оборудования разработан широкий ряд сталей переходного класса стали с обратным регулируемым ( )-превращением при отпуске (старении), на основе систем Fe Ni Cr, Fe Ni и т.д., дополнительно легированные Mo, Co, Ti, A1 и др. Общей особенностью сталей и сплавов этого класса является пониженное содержание в них углерода (не более 0,03 %). Их матрица после закалки представляет собой-твердый раствор, пересыщенный элементами замещения. При распаде -твердого раствора при старении сплавов происходит выделение упрочняющих интерметаллидных фаз. Принцип создания высокопрочного состояния этих сталей превращения аустенита в мартенсит при закалке и последующее старение мартенситной основы. Основой безуглеродистых мартенситно-стареющих сталей, перспективных для использования в ядерных реакторах, является железо, легированное никелем (5 20 %).
Сплавы системы Fe Ni. Решетка Ni (ГЦК) изоморфна решетке-Fe, атомы Ni и Fe имеют близкие размеры (rFe 0,126 нм, rNi 0,124нм). Никель стабилизирует -фазу железа и образует с ним непрерывный ряд -твердых растворов (рис. 23.170). Никель повышает точку ( )-превращения Ac4 и резко понижает точку
( )-превращения Ac3 , причем температура превращения Ac3 настолько сильно отличается при охлаждении и при нагреве, что для практического использования диаграммы целесообразно
347
указывать |
отдельно температурный |
интервал |
при |
охлаждении |
(γ → α) |
и при нагреве (α → γ). |
Например, |
если |
взять сплав |
Fe−20 % Ni при 200−500 °С, то при охлаждении он будет иметь практически стабильную γ-фазу, а при нагреве при тех же температурах − практически стабильную α-фазу (рис. 23.171), т.е. фазовые превращения в системе Fe−Ni совершаются со значительным гистерезисом.
Ni, мас. %
Fe |
Ni, ат. % |
Ni |
Рис. 23.170. Диаграмма состояния системы Fe−Ni
348
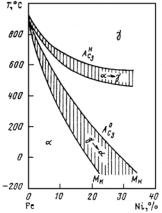
Превращение α ' γ сохраняется |
||
только в сплавах, содержащих пример- |
||
но до 20−25 % Ni. Из-за сильного сни- |
||
жения |
точки Ac3 никелем |
(например, |
уже при 10 % Ni температура превра- |
||
щения |
снижается до 500 °С и ниже), |
|
(α ' γ)-превращение протекает при по- |
||
ниженной температуре, когда диффузи- |
||
онные процессы заторможены. Поэтому |
||
даже |
при замедленном |
охлаждении |
превращение γ → α опускается до срав- |
|
||||
нительно |
низких |
температур, |
вследст- |
Рис. 23.171. Превращение |
|
вие чего сплавы в интервале концен- |
|||||
α ' γ в системе сплавов Fe−Ni |
|||||
траций 5−20 % Ni приобретают мартен- |
при охлаждении ( Aо ) |
||||
ситную |
или |
мартенситоподобную |
С3 |
||
|
|
|
|
||
структуру |
(пересыщенный |
твердый |
и нагреве ( AСн3 ) |
||
раствор Ni в α-Fe) с повышенной твер- |
|
||||
достью. Из-за замедления диффузии никеля при температурах ниже 500 °С и обратное (α → γ)-превращение при нагреве также происходит по мартенситному (бездиффузионному) механизму. Сплавы, содержащие более 35−40 % Ni, имеют чисто γ-структуру, наблюдается только магнитное превращение.
В сплавах, богатых никелем, при 516 °С (503 °С − по другим источникам) может образоваться интерметаллидное соединение Ni3Fe с упорядоченной структурой (γ'-фаза), которое при 345 °С участвует в эвтектоидной реакции (γ ' α) + (Ni3Fe). Соединение Ni3Fe имеет кубическую решетку типа Cu3Au (a = 0,35522 нм). Сплавы, находящиеся в области образования интерметаллидной фазы, приобретают небольшую склонность к дисперсионному твердению после закалки из области γ-твердого раствора (800 °С).
Попытки создать на основе системы Fe−Ni (без Cr) жаропрочные сплавы не увенчались успехом. Это, по-видимому, связано с тем, что при введении Ni в Fe прочность межатомных связей практически не изменяется. Последнее подтверждается слабым влияни-
349

ем Ni на диффузионные константы (энергия активации γ-Fe 285 кДж/г-атом, а сплава с 16 % Ni − 282 кДж/г-атом).
Железоникелевые сплавы, однако, нашли широкое применение в качестве специальных сплавов: пермаллой обладает особыми магнитными свойствами; инвар, элинвар, платинит − особенностями коэффициента линейного расширения; есть сплавы с неизменным в определенном температурном интервале модулем упругости и др.1
Старение мартенсита происходит в диапазоне 350−650 °С при дополнительном легировании Ti, Be, Al, Mn, Mo, W, V, Si, Cu или Nb. При одинаковом атомном содержании элементов наибольшее упрочнение в процессе старения вызывает легирование Ti, Be, Al и наименьшее − Mo, Nb и Si. Наличие Ni позволяет реализовать мартенситный (сдвиговый) механизм (γ → α')-превращения в безуглеродистом Fe при небольших скоростях охлаждения (на воздухе), повышает сопротивление хрупкому разрушению основы.
Обобщенная классификация мартенситно-стареющих сталей по назначению с указанием систем легирования представлена на рис. 23.172, а химический состав и механические свойства некоторых сталей приведены соответственно в табл. 23.66 и 23.67. Из рис. 23.172 видно, что Со является важнейшей легирующей добавкой высокопрочных мартенситно-стареющих сталей. Однако легирование им сталей, применяемых в ядерных реакторах, недопустимо в связи с высокой активируемостью кобальта при нейтронном облучении.
При легировании Fe−Ni мартенсита существенно изменяются температуры прямого (γ → α) и обратного (α → γ) мартенситных превращений (табл. 23.68). В коррозионно-стойких мартенситностареющих сталях, перспективных для реакторостроения, содержание Ni составляет не более 4−10 % (см. рис. 23.172 и табл. 23.66). При добавлении к Fe такого количества Ni происходит снижение Мн (см. рис. 23.171) и после закалки образуется мартенсит замещения.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 22.7.1.
350
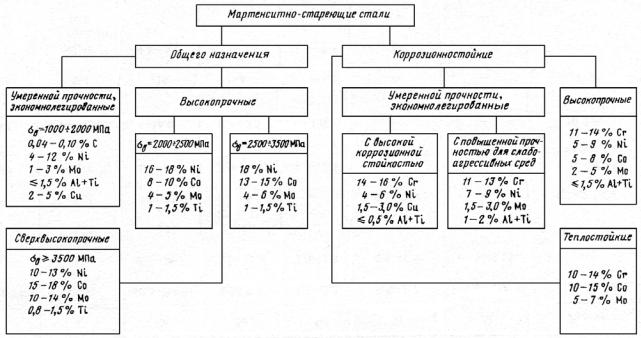
351
Рис. 23.172. Схема классификации мартенситно-стареющих сталей (обобщение литературных данных М.И. Гольдштейна)
351

|
|
|
|
|
|
|
|
|
|
Таблица 23.66 |
|
|
|
|
Химический состав некоторых мартенситно-стареюших сталей |
|
|
||||
|
|
|
|
|
|
Содержание основных элементов, % |
|
|
||
|
|
Марка |
|
|
|
|
|
|||
|
|
стали |
|
|
|
|
|
|
|
|
|
|
|
С |
Сr |
Ni |
Mo |
Ti |
Al |
Другие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
04Х11Н9М2Д2ТЮ |
≤ 0,04 |
10,5−12,9 |
8,5−9,5 |
1,5−2,2 |
0,8−1,2 |
0,8−1,2 |
l,7−2,2 Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
03Х11Н10М2Т |
≤ 0,03 |
9,5−10,7 |
7,2−11,5 |
2,0-3,0 |
0,8-1,5 |
0,15-0,35 |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
05X1ЗН4М |
0,05 |
13 |
4 |
1 |
− |
− |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
08Х15Н5Д2Т |
≤ 0,08 |
14,0−15,0 |
4,5-5,5 |
- |
0,1-0,2 |
− |
1,5−2,5 Cu |
|
352 |
|
|
|
|
|
|
|
|
|
|
|
Бофорс 2RMo* |
≤ 0,10 |
11,5−13,5 |
5,0−6,5 |
1,2-2,0 |
− |
− |
0,2−0,8 Si |
||
|
|
(10Х13Н6М2) |
|
|
|
|
|
|
0,4−0,9 Mn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Авеста 248 SV* |
0,03-0,035 |
16,0 |
5,0−5,5 |
1,0 |
− |
− |
≤ 0,5 Si; ≤0,8 |
|
|
|
(03Х16Н5М) |
|
|
|
|
|
|
Mn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Х16Н4Б |
< 0,1 |
16 |
4 |
− |
− |
− |
1 Nb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
02Н12Х5М |
≤ 0,02 |
4,8-5,2 |
11,8−12,3 |
2,8-3,3 |
<0,20 |
<0,25 |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н12Х5МЗ |
< 0,1 |
5 |
12 |
3 |
− |
− |
− |
|
|
|
|
|
|
|
|
|
|
|
|
________
* Шведские стали.
352
Дополнительное легирование Ti, Al, Mo и другими элементами приводит к развитию старения благодаря уменьшению растворимости легирующих элементов в мартенсите, что сильно повышает характеристики сталей. Заметного увеличения сопротивления хрупкому разрушению можно достичь повышением содержания Ni до 12−20 % благодаря высокой подвижности и облегченному поперечному скольжению дислокаций в матрице.
Таблица 23.67
Механические свойства мартенситно-стареющих сталей
Марка стали |
Режим |
1 |
Тисп, |
σв, |
σ0,2, |
δ, |
ψ, |
ак, |
2 |
|
термообработки |
|
°С |
МПа |
МПа |
% |
% |
кДж/м |
|
04Х11Н9М2Д2ТЮ |
З (900−950 °С), 1 ч, |
20 |
≥ 1550 |
≥ 1550 |
≥ 6 |
≥ 30 |
− |
|
|
|
воздух + С (500− |
|
|
|
|
|
|
|
|
|
550 °С), 3 ч, воздух |
|
|
|
|
|
|
|
|
03Х11Н10М2Т |
З (860 °С) + |
|
20 |
1530 |
1510 |
11 |
56 |
260 |
|
|
+ С (400 °С), 1000 ч |
|
|
|
|
|
|
|
|
|
З (860 °С) + |
|
20 |
1560 |
− |
− |
− |
430 |
|
|
+ С (500 °С), 2 ч |
|
|
|
|
|
|
|
|
|
З (860 °С) + |
|
20 |
1475 |
1430 |
12 |
57 |
450 |
|
|
+ С (530 °С), 2 ч |
|
|
|
|
|
|
|
|
|
З (880−1000 °С) + |
|
20 |
1550 |
1480 |
8 |
50 |
500 |
|
|
+ С (500 °С) |
|
|
|
|
|
|
|
|
05Х13Н4М |
З (1000 °С), 2 ч, |
|
20 |
900 |
610 |
17 |
− |
1200 |
|
|
воздух + + О (630 ± |
|
|
|
|
|
|
|
|
|
± 10 °С), 100 ч |
|
|
|
|
|
|
|
|
08Х15Н5Д2Т |
З (1000 °С), 2 ч, |
|
20 |
1450 |
1350 |
11 |
500 |
800 |
|
|
воздух + С (450 °С) |
|
|
|
|
|
|
|
|
Бофорс 2RMo2 |
З (980−1050 °С) + |
|
20 |
835 |
617 |
15 |
60 |
1080 |
|
|
+ С (580−590 °С) |
|
300 |
685 |
588 |
− |
− |
− |
|
Авеста 48 SV2 |
То же |
|
20 |
835 |
617 |
15 |
50 |
1270 |
|
|
|
|
300 |
685 |
588 |
− |
− |
− |
|
Х16Н4Б3 |
З (1050 °С) + |
|
20 |
≥ 900 |
≥ 750 |
13 |
50 |
≥ 900 |
|
|
+ О (650 °С) |
|
350 |
− |
≥ 650 |
− |
− |
− |
|
02Н12Х5М |
З (950 °С), масло + |
20 |
1050 |
950 |
14 |
55 |
800 |
|
|
|
+ С (550 °С), воздух |
350 |
− |
750 |
− |
− |
− |
|
|
Н12Х5М3 |
Стандартная: З + О |
20 |
− |
1250 |
15 |
− |
500−1100 |
||
____________ |
|
|
|
|
|
|
|
|
|
1З − закалка; С − старение; О − отпуск.
2Температура хрупкого перехода Тх < −170 °С.
3Температура хрупкого перехода Тх < −60 °С.
353

Таблица 23.68
Влияние легирующих элементов на температуру (Мн) начала прямого (γ → α) и обратного (α→γ) мартенситного превращений в сплаве Fe−22 % Ni
|
Изменение температуры |
|
Изменение температуры |
||
Легирующий |
начала превращения |
Легирующий |
начала превращения |
||
элемент |
Мн, °С |
элемент |
Мн, °С |
||
(1%) |
при |
при |
(1%) |
при |
при |
|
охлаждении |
нагреве |
|
охлаждении |
нагреве |
Со |
+17 |
+18 |
Si |
−30 |
+14 |
Al |
0 |
+55 |
V |
−33 |
+28 |
Сu |
−14 |
− |
Ti |
−39 |
+61 |
Мо |
−22 |
+25 |
Nb |
−55 |
+165 |
Ni |
−22 |
−22 |
Cr |
−55 |
−17 |
В отличие от среднелегированных углеродистых сталей, упрочняемых углеродом, который находится в твердом растворе и в составе второй карбидной фазы, мартенситно-стареющие стали упрочняются, как правило, в результате образования сегрегации и дисперсных частиц интерметаллидных фаз (типа Ni3Al, NiAl, Ni2Mo, NiBe и др.).
Как было указано выше, Ti и А1 относятся к наиболее эффективным упрочнителям мартенситно-стареющих сталей в связи с тем, что растворимость их в α-фазе мала и в присутствии Ni при нагреве происходит выделение дисперсных фаз Ni3Ti, NiAl и др. Однако весьма неприятным эффектом Ti и А1 является то, что они резко понижают пластичность и вязкость разрушения, поэтому суммарное количество их обычно не превышает 1%. Понижение пластичности мартенситно-стареющих сталей с увеличением содержания Ti связано с образованием при охлаждении в интервале 1000−800 °С первичного карбонитрида Ti(С, N) по границам аустенитных зерен.
В отличие от Ti и Аl молибден не оказывает столь сильного охрупчивающего влияния, поэтому его содержание в мартенситностареющих сталях может быть значительным (см. рис. 23.172 и табл. 23.66). При концентрации Мо свыше 3 % старение приводит к образованию частиц фаз Ni3Mo (имеет ромбическую кристалличе-
скую решетку с а = 0,5064 нм, b = 0,4223 нм, с = 0,4449 нм),
354
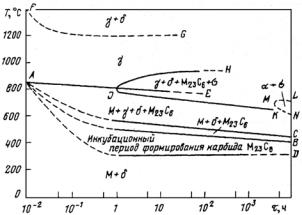
(Fe, Ni)2Mo и т.д., которые весьма благоприятны для обеспечения комплекса механических свойств.
Высокая стоимость мартенситно-стареющих сталей привела к созданию ряда экономнолегированных сталей главным образом за счет повышения содержания углерода и понижения содержания легирующих элементов, в первую очередь Ni (см. табл. 23.66). В таких сталях с повышенным содержанием углерода (до 0,1 %) в качестве упрочняющей фазы могут присутствовать и карбиды. Для примера рассмотрим сталь 05Х13Н4М, диаграмма структурных превращений которой приведена на рис. 23.173. На рис. 23.174 представлены изменения основных механических характеристик, количества фазового остатка, количества остаточного аустенита и удельного электросопротивления этой стали в зависимости от режимов старения.
Рис. 23.173. Диаграмма структурных превращений в мартенситно-стареющей стали 05Х13Н4М (А.М. Паршин)
При температуре 890 °С (точка А на рис. 23.173) происходит полное обратное (α' → γ)-превращение, однако эта температура не является постоянной для мартенситно-стареющих сталей рассматриваемого типа – с увеличением длительности старения она понижается, и ход ее определяется линией АЕ. Выше АЕ сталь имеет устойчивую 100 %-ную аустенитную матрицу.
355
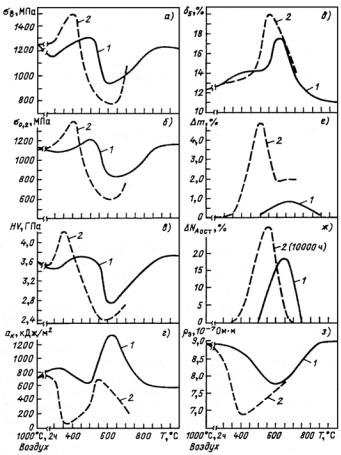
Рис. 23.174. Влияние температуры и длительности старения в течение 1 ч (1) и 5000 ч (2) закаленной (от 1000 °С, 2 ч, воздух) на мартенсит стали 05Х13Н4М на изменение предела временного сопротивления разрушению (а), предела текучести (б), твердости (в), ударной вязкости (г), относительного удлинения (д), количества фазового осадка (е), количества остаточного аустенита (ж)
и удельного электросопротивления (з) при комнатной температуре (А.М. Паршин)
Температура начала появления аустенита из мартенсита также непостоянна – при нагреве она характеризуется кривой АС, лежащей выше кривой АВ, определяющей начало появления хромистых
356
карбидов типа М23С6. На основании этих данных делается вывод о том, что в мартенситно-стареющих сталях с повышенным содержанием углерода (α' → γ)-превращение возможно только после предварительного выпадения карбидов М23С6.
Рассматриваемая сталь в закаленном или нормализованном состоянии, кроме мартенситной матрицы, содержит 2–3 % оставшегося высокотемпературного δ-феррита. При нагреве выше 1200 °С происходит образование нового δ-феррита (кривая FG). Сохранившийся при охлаждении от высоких температур δ-феррит имеет полиэдрическое строение. В зернах δ-феррита, а также на границах раздела δ-феррит–мартенсит отсутствуют выделения вторичных фаз. При высоких температурах происходит распад δ-феррита с образованием σ-фазы типа FeCr (кривая HJK на рис. 23.173), который наиболее интенсивно протекает в интервале температур 700– 900 °С. Формирующийся после длительного старения α-феррит также имеет полиэдрическое строение. Из α-феррита в процессе весьма длительного старения также возможно выделение σ-фазы (кривая LMN).
Отмечается, что выделение карбидов М23С6 возможно не только из распадающегося мартенсита, но и из аустенита при высокотемпературном старении при 800–850 °С. Однако процесс этот замедленный и требует весьма длительной выдержки при этих температурах.
В стали 05X1ЗН4М обнаружены и следы фазы Лавеса типа Fe2Mo, однако из-за незначительного ее количества в упрочнении она не играет роли. Работоспособность конструкций из данной стали в основном определяется процессами карбидообразования как в области рабочих температур (до 400 °С), так и в температурновременной области выбора режимов отпуска (620–640 °С).
Сопоставление изменения механических свойств при комнатной температуре (рис. 23.174, а–д) и структуры (рис. 23.174, е) в результате старения показывает, что снижение ударной вязкости (рис. 23.174, г) и повышение прочности (рис. 23.174, а, б) стали 05X1ЗН4М происходит ранее выделения вторичных карбидов М23С6. Это дало основание заключить, что упрочнение и охрупчивание стали 05X1ЗН4М (и других мартенситно-стареющих сталей
357
данного класса) в температурно-временной области ниже АВ (см. рис. 23.173) определяется процессами предвыделения карбидов М23С6. Начало снижения удельного электросопротивления при температурах 250–340 °С уже после старения в течение 1 ч (см. рис. 23.174, з) может свидетельствовать о появлении сегрегатов (первых концентрационных неоднородностей) в структуре стали (кривая AD на рис. 23.173). В таком случае температурновременная область BAD будет представлять собой область инкубационного периода формирования карбидов в стали 05Х13Н4М.
Основные структурные превращения в стали 05X1ЗН4М, определяющие интенсивность снижения пластических свойств и ак, повышения σв и σ0,2, протекают в температурно-временном интервале, ограниченном кривыми АВ и AD (см. рис. 23.173).
Максимум выделения фаз после старения длительностью 1 ч наблюдается при 600–750 °С; он смещается в область более низких температур с увеличением времени старения – к 500 °С при τ = = 5000 ч (см. рис. 23.174, е). Этому соответствует снижение прочностных характеристик (рис. 23.174, а–в) и повышение ударной вязкости (рис. 23.174, г) и пластичности (рис. 23.174, д), вызванные обеднением твердого раствора легирующими компонентами, коагуляцией и полным обособлением упрочняющей карбидной фазы
М23С6.
Как было отмечено, полное обратное (α′ → γ)-превращение происходит лишь при температурах, соответствующих линии АЕ (см. рис. 23.173). Поэтому в интервале температур от АС до АЕ всегда будет присутствовать некоторое количество остаточного (стабильного) аустенита. Кривые на рис. 23.174, ж характеризуют количество аустенита после охлаждения стали до комнатной температуры в зависимости от длительности старения в интервале температур 340–900 °С. С увеличением длительности старения максимум остаточного аустенита смещается от 650 °С (8 %) после выдержки 0,5 ч до 550 °С (28 %) после выдержки 10000 ч. Температура начала появления аустенита с увеличением длительности старения смещается от 890 °С (точка А) до 400 °С после старения длительностью 10000 ч (точка С, см. рис. 23.173). Наличие аустенита в структуре
358
обеспечивает хорошие сварочно-технологические свойства сталей переходного класса.
Однако стали типа Авеста 248SV и 05X1ЗН4М показали склонность к коррозионному растрескиванию в воде при повышенной температуре. Созданные стали с большим содержанием Cr типа Х16Н4Б (см. табл. 23.66) уже имеют достаточно высокую структурную стабильность, стойкость против коррозионного растрескивания и теплового охрупчивания в сочетании с высоким уровнем механических свойств и необходимой коррозионно-механической прочностью. Кроме того, замена Мо на более сильный карбидообразующий элемент Nb повышает стабильность структуры вследствие торможения формирования хромистых карбидов М23С6 и удержания легирующих элементов, в первую очередь Cr, в твердом растворе.
Коррозионная стойкость хромистых сталей
Скорость коррозии хромистых сталей как в воде, так и в паре значительно ниже, чем перлитных сталей, причем с увеличением содержания Cr она существенно уменьшается (рис. 23.175). Скорость общей коррозии хромистых сталей мартенситного, мартен- ситно-ферритного и ферритного классов при рабочих параметрах теплоносителя первого контура водоохлаждаемых атомных реакторов не превышает 0,002−0,008 мм/год.
Как видно из рис. 23.175, при температуре до 500 °С хромистые стали по коррозионной стойкости в обескислороженной воде и паре удовлетворяют требованиям к материалам оборудования первого контура ядерного реактора, поэтому в отдельных узлах и деталях реакторов для работы в контакте с водой при температуре 200−250 °С и в паре до 400−450 °С возможна в некоторых случаях замена хромо-никелевых сталей более дешевыми хромистыми.
Характер коррозии сталей в воде с повышенным содержанием кислорода становится язвенным, тогда как в деаэрированной воде наблюдается равномерная коррозия. При увеличении содержания кислорода в воде до 40 мг/л скорость коррозии сталей типа X13 при температуре 260−300 °С возрастает в 30−40 раз. С увеличением содержания Cr характер коррозионного поведения хромистых ста-
359
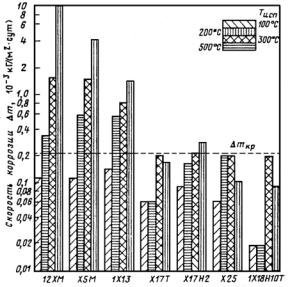
лей в данных условиях изменяется в следующей последовательно-
сти: преимущественно язвенная коррозия (1−6 % Cr) → точечная (питтинговая) коррозия (12−13 % Cr) → равномерная коррозия
(более 13 % Cr, например сталь Х17Н2М).
Рис. 23.175. Скорость коррозии хромистых сталей в дистиллированной обескислороженной воде и паре после испытания в течение 30 ч при различной температуре. Пунктиром показана критическая скорость коррозии mкр, соответствующая скорости 0,01 мм/год, выше которой стали неприемлемы для оборудования первого контура атомных реакторов
Увеличение концентрации кислорода в воде при температуре 20−300 °С не изменяет кинетику анодного процесса, но вызывает интенсификацию катодного процесса, что приводит к смещению потенциала в положительную сторону. Такое смещение в большей степени увеличивает скорость коррозии сталей Х5 и X13 и в меньшей степени − коррозию сталей Х17Н2М и Х25. Поэтому хромистые стали с 12−14 % Cr могут применяться в деаэрированной дистиллированной воде при Траб ≤ 200 °С; стали типа Х17 и Х25 − в воде, содержащей до 2 мг/л кислорода при Траб ≤ 300 °С.
360

Для работы в воде, содержащей хлор-ионы, рекомендуется легирование молибденом сталей с содержанием не менее 13 % Cr (табл. 23.69). Эффект от легирования молибденом хромистых сталей в пределах 1 2 % в наибольшей степени проявляется в соста-
вах с высоким содержанием хрома (не менее 20 % Cr). Влияние Мо не наблюдается в сталях с содержанием Cr менее 12 13 %.
Таблица 23.69
Скорость коррозии хромистых сталей [0,025 % С, 0,025 % N,
до 0,8 % (Nb+ Ti)] в растворе 10 % FeCl3 6H20 + 0,1 М НСl при 25 С
Сталь |
m, 10-3 кг/(м2 ч) |
Сталь |
m, 10-3 кг/(м2 ч) |
Х13 |
5,25 (общая коррозия) |
Х18М2 |
0,49 |
Х13М |
5,45 (общая коррозия) |
Х18М3,5 |
0,32 |
Х13М2 |
0,49 |
Х18М5 |
0,17 |
Х13М3,5 |
0,95 |
Х20М2 |
0,06 |
Х13М5 |
0,82 |
Х23М2 |
0 |
Х18 |
0,89 |
Х25 |
0,17 |
Х18М |
1,47 |
Х25М2 |
0 |
|
|
Х25М3,5 |
0 |
|
|
Х25М5 |
0 |
Скорость коррозии хромистых сталей в теплоносителе с примесями существенно увеличивается при наличии щелей и зазоров между деталями, а в дистиллированной обескислороженной воде при 300 °С влияние щелей и зазоров практически не ощущается. В
контакте с хромоникелевой сталью скорость коррозии хромистых сталей возрастает вследствие образования гальванической пары, анодом которой является хромистая сталь.
Жидкометаллические теплоносители. Хорошо известно1, что коррозионное взаимодействие жидкометаллических теплоносителей (ЖМТ) с конструкционными материалами (КМ) протекает в виде растворения компонент КМ в ЖМТ (и переноса массы), проникновения жидкого металла (ЖМ) в конструкционный материал и образования химических соединений. Нельзя не учитывать и адсорбционное воздействие ЖМТ, которое проявляется при действии
1 Физическое материаловедение. Т. 2. М.: МИФИ, 2007. П. 7.4.
361

растягивающих напряжений в поверхностном слое КМ и проявляется в виде его охрупчивания в контакте с ЖМ: жидкий металл облегчает пластическое течение в поверхностном слое за счет снижения поверхностной энергии твердого тела; по мере развития пластической деформации тонкий слой упрочняется, а у концентраторов (стопоров) зарождаются трещины; трещина развивается скачкообразно через эту зону; при поступлении ЖМ в вершину трещины процесс движения притупленной трещины инициируется? и она движется в глубь материала. Важно подчеркнуть, что все виды коррозионного взаимодействия начинаются с контактной поверхности и зависят от состояния поверхности КМ и уровня примесей (кислорода) в ЖМ.
Стойкость коррозионно-стойких хромистых сталей (более 13 % Cr) в Na и Li при температурах свыше 400 °С значительно выше, чем углеродистых и низколегированных сталей перлитного класса. В отличие от перлитных сталей, которые при испытаниях в жидкометаллической среде (Na, Li и др.) склонны к обезуглероживанию и снижению прочности (табл. 23.70), хромистые стали при наличии в системе углеродистых или малолегированных перлитных сталей способны к науглероживанию, поскольку происходит перенос углерода от сталей с менее сильными карбидообразующими элементами к сталям с более сильными карбидообразующими элементами.
Таблица 23.70
Механические свойства, содержание углерода и глубина коррозии хромистых сталей после выдержки в жидком Na при 600 °С и скорости потока 5 м/с
|
Сталь |
Время |
|
Эталон |
|
После выдержки |
|
|||
|
|
испы- |
|
|
|
|
|
|
|
|
|
|
σ |
δ |
Содержа- |
σ |
δ |
Содержание |
|
Глубина |
|
|
|
тания, |
в, |
, |
ние |
в, |
, |
углерода, % |
коррозии, |
|
|
|
МПа |
% |
МПа |
% |
|||||
|
|
ч |
|
|
углерода, % |
|
|
|
|
мкм |
|
|
2 103 |
|
|
|
|
|
|
||
|
12ХМФ |
510 |
25 |
0,11 |
290 |
39 |
0,03 |
|
0 |
|
|
(перлитная) |
4 103 |
580 |
25 |
− |
320 |
35 |
− |
|
150 |
|
1Х12МФБВ |
2 103 |
520 |
24 |
0,14 |
460 |
25 |
0,13 |
|
0 |
|
(ферритно- |
4 103 |
490 |
26 |
− |
510 |
25 |
− |
|
0 |
|
мартенсит- |
|
|
|
|
|
|
|
|
|
|
ная) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
362

Наиболее интенсивно коррозионные процессы в жидком Li идут в поверхностных слоях и, в первую очередь, по границам зерен. Это приводит к снижению содержания С и Cr в поверхностных слоях хромистых сталей, разрушению карбидов хрома по границам зерен и обеднению приграничных объемов хромом, что является причиной развития межкристаллитной коррозии хромистых сталей при контакте с жидким литием.
Если в контуре, по которому циркулирует жидкометаллический теплоноситель, имеются хромо-никелевые стали, то возможен процесс переноса углерода от хромистых сталей к хромо-никелевым. Например, для предотвращения переноса углерода от хромистой стали к хромо-никелевой при 600 °С необходима концентрация хрома не менее 4,5−5 %.
Стали с 12−13 % Cr при той же температуре обладают высокой коррозионной стойкостью в неизотермическом потоке Na, содержащем не более 5−10-3 % кислорода. В этих условиях их стойкость сравнима с коррозионной стойкостью хромо-никелевых сталей, что дает основание рассматривать возможность применения хромистых сталей в качестве конструкционных материалов в реакторах с жидкометаллическим теплоносителем. Однако при высоких температурах хромистые стали неприемлемы из-за недостаточной жаропрочности.
Увеличение коррозионной стойкости хромистых сталей в жидкометаллических теплоносителях включает два основных пути1.
Во-первых, для снижения коррозионного воздействия жидкометаллической среды на конструкционные материалы принимают специальные меры по очистке теплоносителя от кислорода как при загрузке его в контур реактора (например, путем фильтрации), так и в процессе работы в реакторе (путем применения «холодных» и «горячих» ловушек). Кроме того, увеличение коррозионной стойкости сплавов на основе Fe во многом определяется технологией производства (вакуумная плавка и др.) сталей, их чистотой по неметаллическим примесям2. Во-вторых, повышение коррозионной стойкости хромистых сталей в жидкометаллических теплоносителях
1Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. П. 7.4.4.
2Там же, п. 7.4.3.
363
достигается путем легирования Mo, Nb, W и другими элементами, которые образуют термодинамически более прочные карбиды, чем хромистые карбиды, а также увеличивают прочность межатомных связей в твердом растворе. Стали с 4−10 % Cr могут применяться
для работы в жидком Li при Траб ≤ 400÷500 °С, а стали с 12−16 % Cr
− до Траб = 550÷600 °С.
Кроме растворения и переноса массы, особенностью взаимодействия хромистых сталей с жидкометаллическим теплоносителем, в частности жидким Li, является проникновение и накапливание Li в приповерхностном слое, причем глубина проникновения Li соответствует глубине слоя, в котором наблюдается снижение содержания хрома. Концентрация Li в приповерхностном слое существенно зависит от легирующего состава стали. Например, в стали 1Х13М2БФР содержание Li в поверхностном слое в 6−10 раз ниже, чем в стали 1X13 при одинаковом содержании хрома.
Свинцовый теплоноситель. Свинцовый теплоноситель по сравнению с литием и натрием является инертным по отношению к воде, но достаточно агрессивным со многими конструкционными материалами. Важным фактором «агрессивности» свинца является концентрация примесного кислорода. Превышение концентрации кислорода выше 10−5 % усиливает активность коррозионного взаимодействия свинца. В расплавленном свинце высокой стойкостью обладают тантал и ниобий (до 1000 °С), нерастворимы Si, Al, Mo, V. Железо, углеродистые, хромистые и хромоникелевые стали стойки до 500−600 °С. Стали перлитного класса стоят лучше ферритных и мартенситных. Сильно корродируют обычные аустенитные стали (1 мм/год при 600 °С) из-за избирательного растворения никеля; сталь 0Х18Н11Б хорошо стоит в свинце до 540 °С. В целом температуры совместимости металлов со свинцом следующие: Zr − 600 °С; Be − 700 °С; Cr − 350 °С; Ti − 600 °С; оксид бериллия −
1000 °С; графит − 550 °С. Ингибирующими добавки в свинец являются кислород на уровне (1−3) 10−6 мас.%, Mg и Zr – 0,02 мас.%. Важную роль играет состояние поверхности и степень наклепа.
Концепция безопасного реактора на быстрых нейтронах (извеcтный проет «Брест-300») основана на использовании в качестве теплоносителя свинца. К конструкционным материалам активной
364
зоны такого реактора предъявляются следующие требования: однородность химического состава и структуры; минимальная растворимость в свинце и отсутствие химического взаимодействия со свинцом (образования соединений); отсутствие примесей и элементов, активно взаимодействующих со свинцом.
Наиболее перспективным конструкционным материалом для активной зоны реактора являются хромистые стали, например фер- ритно-мартенситная сталь ЭП823 (см. табл. 23.56). Работоспособность стали должна быть обеспечена в свинце, содержащем концентрацию кислорода в интервале 5 10−6–2,5 10−5 мас. %. Замедлить растворение стали можно оксидной пленкой, например Cr2O3. Процесс коррозии включает переноса кислорода и компонентов стали в потоке жидкого свинца, диффузионный перенос хрома, железа и кислорода в оксидной пленке, межзеренное окисление и межзеренное растрескивание. Важно знать оптимальное содержание кислорода в теплоносителе, при котором может достигаться максимальное время стойкости стали в жидком свинце или изменить СФС поверхностного слоя стали таким образом, чтобы замедлить (прекратить) взаимодействие стали со свинцом.
Возможны различные методы и приемы улучшения коррозионной стойкости хромистой стали в свинце. Например, известно, что избыток хрома в поверхностном слое снижает проникновение ЖМ. Нужно иметь чистые границы, связать примеси в соединения внутри зерна. Все, что тормозит диффузию примеси к поверхности, затрудняет проникновение ЖМ в КМ. Чем мельче зерно, тем меньше проникновение.
Применительно к увеличению стойкости хромистых сталей, включая сталь ЭП823, в потоке свинца, перспективным является модифицирование СФС приповерхностного (контактного) слоя, а именно: измельчить зерно; создать избыток хрома в поверхностном слое или избыток нерастворимых в свинце элементов (например, Mo, Аl, Si, V); создать устойчивую при эксплуатации зону напряжений сжатия в поверхностном слое.
Возможность такого модифицирования поверхностного слоя твэльных трубок с одновременным изменением размера зерна и состояния легирующих элементов дает применение потоков высокотемпературной импульсной плазмы (ВТИП). Воздействие пото-
365
ков ВТИП за время до 20 мкс приводит к быстрому (106 К/с) нагреву и охлаждению (закалке) слоя металла на глубину до 20 мкм, в результате которого создается (в приповерхностных слоях) микрокристаллическая (нанокристаллическая) структура пересыщенного твердого раствора. Если на поверхность стали предварительно нанести пленку из заранее выбранных химических элементов, то ВТИП позволяют проводить поверхностное легирования стали через жидкую фазу, в которой растворимость легирующих элементов выше, чем в равновесном твердом растворе.
С целью исследования возможности повышения коррозионной стойкости стали ЭП823 в жидком свинце проведены испытания коррозионной стойкости модифицированных перед испытаниями фрагментов штатных оболочек твэлов из стали ЭП823. Модифицирование фрагментов твэльных труб проведено облучением потоками гелиевой и азотной импульсной плазмы.
Модифицирование стали ЭП823 потоками гелиевой импульсной плазмы приводит к ослаблению интенсивности коррозионного взаимодействия с жидким свинцом, содержащим более высокую концентрацию кислорода: после выдержки при температуре 650 С глубина коррозии не превышала 5 мкм, а после выдержки при температуре 750 С была не более 7 мкм, и она лимитируется оксидной пленкой на стали ЭП823 в свинце. Это шпинель (Fe, Cr)3O4, в которой обнаружены следы Si, Mn, V, Mo, W.
Жидкофазное легирование стали ЭП823 алюминием, силумином и хромом, осуществленное в процессе плазменной ВТИПобработки, позволило обогатить приповерхностный слой алюминием до 13,5 %, кремнием до 12,4 %, хромом до 15,7 %. Коррозионные испытание «легированных» образцов, проведенные при температуре 650 С в течение 1000 ч в потоке свинца (скорость – 1,0 м/с) показали, что сопротивление коррозии в свинце возрастает при легировании и толщина оксидной пленки имеет следующие (максимальные значения): сталь, легированная алюминием – 1–3 мкм; сталь, легированная силумином – 2–4 мкм; сталь, легированная хромом – 3–5 мкм. Для сравнения отметим, что толщина оксида на стали в необработанном состоянии равна 9–18 мкм. Таким образом, жидкофазное легирование поверхностного слоя ферритной стали
366
алюминием является весьма эффективным способом повышения коррозионной стойкости стали ЭП823 в жидком свинце.
Применение хромистых сталей
Хромистые стали по комплексу механических, тепловых и коррозионных свойств находят широкое применение в различных отраслях машиностроения (см. табл. 23.65). Однако из-за недостаточной жаропрочности при высоких температурах, относительно невысокой технологичности, особенно при сварке, а также склонности к хрупким разрушениям (например, в интервале температур от +20 до 80 °С ударная вязкость снижается почти в 5 раз от 600 1500 до 100 500 кДж/м2) хромистые стали в ядерных реакторах применяют ограниченно. Например, их них изготавливяют чехлы ТВС реатора БН-600, детали внутриреакторных механизмов.
Хромистые мартенситные стали нашли применение для изготовления деталей приводов регулирующих органов реактора. Для изготовления деталей повышенной прочности (штоки, захваты, корпусные детали) применяют стали 20X13, 30X13, 14Х17Н2 в высокоотпущенном состоянии. Для деталей повышенной твердости и износостойкости (втулки, червяки, шестерни, полумуфты и другие трущиеся детали) используют хромистые стали с повышенным содержанием углерода 30X13, 40X13, 20Х17Н2, 95X18 и т.д. в низкоотпущенном состоянии. Стали типа Х13 с различным содержанием углерода и других легирующих элементов используют для изготовления трубопроводов, крепежных и пружинных элементов. Имеющие высокие механические свойства до 500 °С стали 20X13 и 30X13 (см. табл. 23.60) нашли применение для изготовления лопаток паровых турбин, работающих длительное время при температуре пара 450 475 °С.
Из стали типа Х13НДЛ были изготовлены литые корпуса насосов и арматуры для АЭС с ВВЭР-440 и ВВЭР-1000. Можно ожидать, что в дальнейшем объем применения литых деталей и корпусов будет расширяться при использовании перспективного метода электрошлакового литья.
Основное назначение мартенситной стали 15Х11МФ сопловые и рабочие лопатки паровых турбин с максимальной температурой
367
длительной службы 550 °С. В циркуляционных насосах из феррит- но-мартенситной стали 14Х17Н2 изготовлены валы электродвигателей. Для магнитопроводов и электромагнитных приводов СУЗ применяют ферритные стали типа 08X17Н.
Стали типа Х16Н4Б рассматриваются как перспективные для изготовления корпусных конструкций (корпуса насосов, арматуры), высоконагруженных деталей (валы, штоки, крепеж), а в ряде случаев и для пар трения.
Интерес для атомного машиностроения представляют мартен- ситно-стареющие высокопрочные стали типа Н12Х5МЗ, имеющие после стандартной термообработки (закалка + отпуск) предел текучести до 1300 МПа, достаточно высокую пластичность и ударную вязкость (см. табл. 23.67).
При выборе материала для парогенераторов реакторов на быстрых нейтронах с натриевым теплоносителем для работы при температуре 520−550 °С и выше, обеспечивающим большой ресурс как по критерию обезуглероживания в Na, так и по коррозионной стойкости в пароводяной среде, в качестве перспективных рассматриваются хромистые ферритно-мартенситные стали, такие, как отечественная Х12НМ, зарубежные 9Cr−1Mo (Z10CD9). 9Cr−2Мо−Nb−V и др. Отмечается, что они надежны в зоне испарения в условиях многоциклового термического нагружения.
Имеется опыт эксплуатации хромистых сталей в установках с гелиевым теплоносителем (например, для труб испарителя реактора «Пич-Боттом» была использована сталь 5Cr−0,5Мо). Для лопаток компрессора гелиевой турбины АЭС, работающей при Т = 200 °C и р = 2,7÷7,3 МПа в течение τ ≥ 105 ч предполагают использовать хромистые стали 20X12, 20Х12МНВФ и Х20.
Для энергетических установок с диссоциирующим газом (N2O4) рассматривают в качестве перспективной ферритно-мартенситную хорошо свариваемую сталь 05Х12Н2М с оптимальным содержанием в структуре δ-феррита от 5 до 20 %.
Коррозионно-стойкая сталь ферритно-мартенситного класса 1Х13М2БФР успешно эксплуатируется в качестве чехлов ТВС реакторов на быстрых нейтронах для возможной замены этой сталью сильнораспухающих коррозионно-стойких сталей аустенитного
368
класса, являющихся на сегодняшний день основным конструкционным материалом активной зоны реакторов на быстрых нейтронах.
Рассматриваются возможности применения хромистых сталей в качестве конструкционного материала бланкета и рабочей камеры ТЯР. Наиболее вероятным вариантом замены хромо-никелевых сталей на хромистые исследователи считают использование специиально созданных жаропрочных хромистых сталей с дисперсным упрочнением (см. табл. 23.61−23.64).
Облучение быстрыми нейтронами вызывает значительное по-
вышение σв и σ0,2 и понижение пластичности хромистых сталей, причем тем больше, чем ниже температура облучения и чем больше флюенс (табл. 23.71).
|
|
|
|
|
|
|
|
|
|
|
Таблица 23.71 |
|||
Влияние нейтронного облучения (Фн ≈ 1024 м−2, Тобл = 200÷240 °С ) |
|
|||||||||||||
|
|
на механические свойства хромистых сталей |
|
|
|
|
||||||||
|
(σв0, σт0, δ0 − до облучения; σвn, σтn, δn − после облучения) |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Материал |
σв0, |
σвn, |
σп −σ0 |
|
σт0, |
σтn, |
σп −σ0 |
, |
δ0, |
|
δn, |
|
δп −δ0 |
|
|
МПа |
МПа |
в в |
, |
МПа |
МПа |
т т |
% |
|
% |
|
|
, |
|
|
δ0 |
|||||||||||||
|
|
|
σв0 |
|
|
|
σ0т |
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
% |
|
|
|
|
|
% |
|
Fe |
400 |
520 |
+30 |
|
120 |
375 |
+213 |
|
55 |
|
35 |
|
-36 |
|
Х4 |
350 |
475 |
+36 |
|
150 |
440 |
+193 |
|
42 |
|
24 |
|
-43 |
|
2Х6МСТ |
800 |
820 |
+3 |
|
520 |
580 |
+12 |
|
27 |
|
23 |
|
-15 |
|
Х13 |
415 |
535 |
+29 |
|
220 |
265 |
+20 |
|
36 |
|
20 |
|
-44 |
|
1Х12МС |
645 |
705 |
+9 |
|
445 |
590 |
+33 |
|
30 |
|
27 |
|
-10 |
|
Х12НМ* |
1245 |
1415 |
+14 |
|
1040 |
1285 |
+24 |
|
20 |
|
15 |
|
-25 |
|
Х15Н* |
540 |
765 |
+42 |
|
405 |
765 |
+89 |
|
36 |
|
14 |
|
-61 |
|
96Х16М |
1440 |
1680 |
+17 |
|
1300 |
1430 |
+10 |
|
− |
|
− |
|
− |
|
1Х16МСБ |
680 |
735 |
+8 |
|
440 |
595 |
+35 |
|
26 |
|
19 |
|
-27 |
|
___________
*Тобл = 82÷88 °С.
В связи с тем что ряд сталей ферритно-мартенситного класса применялись в качестве конструкционных материалов оболочек твэлов и ТВС экспериментальных сборок быстрых реакторов (например, отечественная сталь 1Х13М2БФР − в реакторе БОР-60;
369
зарубежные стали НТ-9, Р8 и др.), стояла проблема их радиационного распухания в активной зоне. Имеющиеся в настоящее время данные свидетельствуют о весьма высокой стойкости этих сталей против распухания. Например, распухание сталей Х9, Х12, Х15, Х18, Х12М, Х12М2, Х12МЗ при облучении быстрыми нейтронами
(E > 0,1 МэВ) при Фн = (3÷4) 1026 м−2 и Тобл = 400÷450 °С не превы-
шает 0,05−0,6 %. При флюенсе, эквивалентном около 80 сна (в случае нейтронного облучения) и около 150 сна (в случае облучения ионами Сr3+), распухание стали 1Х13М2БФР составило соответственно всего 0,2 и 0,5 %, что на два порядка ниже распухания аустенитной стали 0Х16Н15МЗБ, достигающего 20 % и выше в аналогичных условиях облучения.
Большим достоинством хромистых сталей, в частности стали
1Х13М2БФР, является то, что они не подвержены высокотемпературному радиационному охрупчиванию (ВТРО) (при 600−750 °С) и охрупчиванию при умеренных температурах (450−550 °С), что выгодно отличает их от аустенитных сталей, склонных к ВТРО (см.
п. 23.3.7), но проявляют склонность к низкотемпературному радиационному охрупчиванию (ниже 350 °С). Отжиг радиационных дефектов в хромистых сталях, как и в перлитных (см. п. 23.3.5), происходит примерно в том же интервале температур (350−375 °С).
23.3.7. Жаропрочные коррозионно-стойкие стали аустенитного класса
Введение в сталь достаточного количества элементов, расширяющих γ-область, переводит ее в класс аустенитных (см. п. 23.3.4). В зависимости от состава основы аустенитные коррозионностойкие стали бывают хромоникелевые, хромомарганцевые и хромомарганцевоникелевые.
Сплавы систем Fe–Cr–Ni и Fe–Cr–Мn
Система Fe–Cr–Ni была предметом многих исследований. В сплавах этой системы существуют обширные области γ-фазы, устойчивой в широком интервале температуры от отрицательной до температуры плавления.
370
Сплавы со структурой γ-фазы обладают ценными физикохимическими и механическими свойствами: высоким сопротивлением электрохимической и химической коррозии, комплексом механических свойств при повышенной температуре (жаропрочностью), хорошими технологическими свойствами (деформируемостью, свариваемостью) и др.
Особенности влияния Cr и Ni (или Мn) на структуру и превращения в Fe позволяют создавать стали и сплавы различного класса. Стали, содержащие более 12–13 % Cr, становятся коррозионностойкими, а введение достаточного количества Ni (или Мn) делает их аустенитными.
Представления об условиях образования фаз и взаимном влиянии Cr и Ni на структуру стали дает тройная диаграмма состояния системы Fe–Cr–Ni. На рис. 23.176 приведен изотермический ее разрез при 650 °С (сплошные линии). Однофазные области и α-, и γ-фаз разделены двухфазными (α + γ; α + σ; γ + σ) и трехфазными (α + γ + σ) областями. При низком содержании Ni (< 8÷9 %) в структуре сплава, кроме γ-фазы, появляется α-фаза; увеличение концентрации Cr более 20 % может вызвать появление твердой и хрупкой σ-фазы (НV = 5500÷7500 МПа). И в том, и в другом случае снижаются жаропрочные характеристики – длительная прочность, предел ползучести, релаксационная стойкость. Одновременно в той или иной степени ухудшаются пластические свойства и ударная вязкость, происходит охрупчивание, возрастает анизотропия свойств в прокатанном состоянии. Присутствие α-фазы (а также σ-фазы) понижает стойкость аустенитных сталей при электрохимической коррозии и окислении.
Положение двухфазной (α + γ)-области (и других фазовых областей) зависит от температуры. При температурах ниже 650 °С область (α + γ) уходит вправо и при 20 °С соответствует области, ограниченной пунктирными линиями е–с и f–g, а в области температур выше 650 °С она смещается влево, и ее крайнее положение при 1100 °С ограничено пунктирными линиями е–d и f–а. Соответствующие изменения происходят и с другими областями.
Высокотемпературный разрез системы Fe–Cr–Ni показан на рис. 23.177. При понижении температуры сужается γ-область и расширяется α-область, а с повышением температуры – наоборот. От-
371
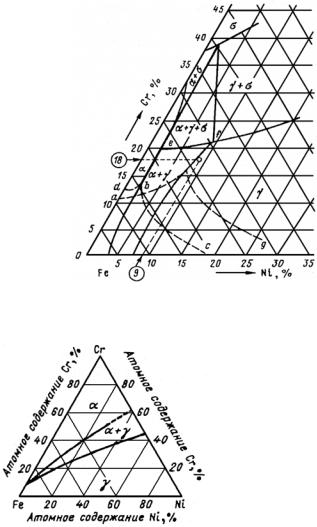
Отсюда следует вывод о том, что сплавы, лежащие ниже линии а b с, имеют полную (γ ' α)-перекристаллизацию со структурой феррита при 20 °С; между линиями аbс и dеfg заключены полуферритные (или полуаустенитные) сплавы с частичным (γ ' α)- превращением; правее линии fg расположена область аустенитных сплавов.
Рис. 23.176. Изотермический разрез при 650 °С (сплошные линии) диаграммы состояния системы Fe−Сг−Ni (железный угол)
Рис. 23.177. Изотермический разрез системы Fe−Cr−Ni
при 1300 °С
372
Таким образом, для обеспечения однофазной аустенитной структуры в широком интервале температуры (до комнатной и ниже) необходим определенный состав тройного сплава. Никель и хром существенно понижают температуры мартенситного превращения (см. рис. 23.107, б). Практически однофазная γ-область фиксируется при содержании не менее 8–9 % Ni для содержания от 16 до 22 % Cr (наиболее широко известна аустенитная сталь 1Х18Н9Т, содержащая около 18 % Cr и 9 % Ni – белый кружок на рис. 23.176). Это подтверждается политермическими разрезами, представленными на рис. 23.166. Как видно, в хромоникелевых сталях с низким содержанием Ni (< 6 %) в широком интервале концентраций Cr (примерно 30 %) структура может быть только двухфазной (α + γ) (см. рис. 23.166, а, б). При более высоких концентрациях Ni (12 %) однофазная γ-структура сохраняется при температурах от комнатной вплоть до температуры плавления в значительном интервале концентраций Cr (10–24 %) (см. рис. 23.166, в).
Для стабилизации аустенитной структуры и снижения возможности образования α-фазы в настоящее время содержание Ni в чисто хромоникелевых сталях повышено в среднем с 8 до 9–10 % (стали типа Х18Н9, 0Х18Н10), а в современных реакторных сталях – до
16 % [07Х16Н15М3БР (ЭП-172), 06Х16Н15М2Г2ТФР (ЧС-68)].
Никель, а также азот и марганец, будучи аустенитостабилизирующими элементами (см. п. 23.3.3), способствуют расширению однофазной аустенитной области и снижают склонность стали к выделению α-фазы (см. рис. 23.166).
В системе Fe–Cr–Mn аустенитную структуру можно получить лишь при содержании более 15 % Mn и менее 15 % Cr (рис. 23.178). При других соотношениях Mn и Cr структура стали получается двухфазной (А + Ф, А + М, А + Ф + σ), поэтому при замене Ni марганцем приходится или понижать содержание Cr, или заменять Ni частично, или проводить дополнительное легирование сильным аустенитостабилизирующим элементом (например, азотом). Кроме того, более низкая эффективность Mn как стабилизатора аустенита по сравнению с Ni и его высокий коэффициент диффузии предопределяют повышенную тенденцию к нестабильности аустенита сталей системы Fe–Cr–Mn за счет превращений с образованием ферритных и мартенситных фаз при термических отжигах и старении.
373
Таблица 23.72
Химический состав некоторых отечественных и зарубежных коррозионно-стойких жаропрочных сталей аустенитного класса, %
|
|
Стра- |
|
|
|
|
|
|
|
|
Некоторые зарубежные |
||
|
Марка стали |
С |
Сr |
Ni |
Мn |
Мо |
Nb |
Ti |
Другие |
|
аналоги |
||
|
|
на |
|
|
|
|
|
|
|
|
США |
Гер- |
Велико- |
|
|
|
|
|
|
|
|
|
|
|
мания |
британия |
|
|
|
|
|
|
|
|
Гомогенные |
стали |
|
|
|
|
|
|
04Х18Н10 |
СССР |
≤0,04 |
17−19 |
9−11 |
1−2 |
− |
− |
− |
≤0,8Si |
304L |
4306 |
1501-801С |
|
(ЭИ-842) |
|
|
|
|
|
|
|
|
|
|
|
|
|
06Х18Н11 |
СССР |
≤0,06 |
17−19 |
10−12 |
1−2 |
− |
− |
− |
≤0,8Si |
304 |
4301 |
Еп-58Е |
|
(ЭИ-684) |
|
|
|
|
|
|
|
|
|
|
|
|
|
08Х18Н10 |
СССР |
≤0,08 |
17−19 |
9−11 |
1−2 |
− |
− |
≥5 С*÷0,6 |
≤0,8Si |
321 |
4541 |
Еп-58С |
374 |
(ЭИ-914) |
|
|
|
|
|
|
|
|
|
|
|
|
12Х18Н10Т |
СССР |
≤0,12 |
17−19 |
9−11 |
1−2 |
− |
− |
≥5 (С− |
≤0,8Si |
− |
− |
− |
|
|
(ЭЯ-1Т) |
|
|
|
|
|
|
|
−0,02)÷0,7 |
|
|
|
|
|
08Х18Н12Б |
СССР |
≤0,08 |
17−19 |
11−13 |
1−2 |
− |
≥8 С*÷1,2 |
− |
≤0,8Si |
347 |
4550 |
Еп-58G |
|
(ЭИ-402) |
|
|
|
|
|
|
|
|
|
|
|
|
|
12Х18Н12Т |
СССР |
≤0,12 |
17−19 |
11−13 |
1−2 |
− |
− |
≥5 (С− |
≤0,8Si |
347 |
4550 |
Еп-58G |
|
|
|
|
|
|
|
|
|
−0,02)÷0,7 |
|
|
|
|
|
10Х17Н13М2Т |
СССР |
≤0,10 |
16−19 |
12−14 |
1−2 |
1,8−2,5 |
− |
0,3-0,6 |
≤0,8Si |
316 |
4401 |
845В |
|
(ЭИ-448) |
|
|
|
|
|
|
|
|
|
|
|
|
|
10Х17Н13МЗТ |
СССР |
≤0,10 |
16−18 |
12−14 |
1−2 |
3,0−4,0 |
− |
0,3-0,6 |
≤0,8Si |
317 |
4438 |
846 |
|
(ЭИ-432) |
|
|
|
|
|
|
|
|
|
|
|
|
|
08Х17Н16МЗТ |
СССР |
≤0,08 |
16−18 |
15−17 |
1−2 |
3,0−3,5 |
− |
0,3-0,6 |
≤0,8Si |
− |
4401 |
845В |
|
(ЭИ-580) |
|
|
|
|
|
|
|
|
|
|
|
|
|
09Х16Н15МЗБ |
СССР |
≤0,09 |
15−17 |
14−16 |
0,8 |
2,5-3,0 |
0,6−0,9 |
− |
0,2Si |
− |
4401 |
845В |
|
(ЭИ-847) |
|
|
|
|
|
|
|
|
|
|
|
|
374
|
|
|
|
|
|
|
|
|
|
|
Продолжение табл. 23.72 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Некоторые зарубежные |
||
|
Марка стали |
Стра- |
С |
Сr |
Ni |
Мn |
Мо |
Nb |
Ti |
Другие |
|
аналоги |
|
|
на |
|
|
|
|||||||||
|
США |
Гер- |
Велико- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
мания |
британия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
07Х16Н15МЗБР |
СССР |
0,05− |
15−17 |
14−16 |
0,8 |
2,5-3,0 |
0,6−0,9 |
− |
≤0,6Si; |
− |
− |
− |
|
(ЭП-172) |
|
0,09 |
|
|
|
|
|
|
0,005−0,01 |
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
06Х16Н15М2Г2 |
Рос- |
0,06 |
16 |
15 |
1,8 |
2,2 |
− |
0,4 |
0,4Si; |
− |
− |
− |
|
ТФР (ЧС-68) |
сия |
|
|
|
|
|
|
|
0,14V; |
|
|
|
|
|
|
|
|
|
|
|
|
|
0,003B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
09Х14Н16Б |
СССР |
0,07− |
13−15 |
14−17 |
0,8 |
− |
0,9−1,3 |
− |
≤0,6Si |
− |
− |
− |
375 |
(ЭИ-694) |
|
0,12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
09Х14Н19В2БР |
СССР |
0,07− |
13−15 |
18−20 |
0,8 |
− |
0,9−1,3 |
− |
2,0−2,8W; |
− |
− |
− |
|
|
|
|
0,12 |
|
|
|
|
|
|
≤0,008В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
07Х16Н19М2Г2 |
Рос- |
0,07 |
16 |
19 |
1,8 |
2,0 |
0,25 |
0,35 |
0,4Si; |
− |
− |
− |
|
БТФПР |
сия |
|
|
|
|
|
|
|
≤0,15V; |
|
|
|
|
(ЭК-164) |
|
|
|
|
|
|
|
|
0,003B; |
|
|
|
|
|
|
|
|
|
|
|
|
|
0,022P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
08Х15Н24В4ТР |
СССР |
≤0,08 |
14−16 |
22−25 |
0,8 |
− |
− |
1,4−1,8 |
4−5W; |
− |
− |
− |
|
|
|
|
|
|
|
|
|
|
≤0,005В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AISI304L |
США |
≤0,03 |
18−20 |
8−11 |
≤2,0 |
− |
− |
− |
≤1,0Si |
− |
4306 |
1501-801С |
|
AISI304 |
США |
≤0,08 |
18−20 |
8−11 |
≤2,0 |
− |
− |
− |
≤1,0Si |
− |
4301 |
Еп-58Е |
|
A1SI347 |
США |
≤0,08 |
17−19 |
9−13 |
≤2,0 |
− |
− |
− |
≤1,0Si |
− |
4550 |
Еп-58С |
|
AISI321 |
США |
≤0,08 |
17−19 |
9−12 |
≤2,0 |
− |
− |
≥5 С |
≤1,0Si |
− |
4551 |
Еп-58С |
|
AISI316L |
США |
≤0,03 |
16−18 |
10−14 |
≤2,0 |
2,0−3,0 |
− |
− |
≤1,0Si |
− |
− |
− |
375
|
|
|
|
|
|
|
|
|
|
|
Продолжение табл. 23.72 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Некоторые зарубежные |
||
|
Марка стали |
Стра- |
С |
Сr |
Ni |
Мn |
Мо |
Nb |
Ti |
Другие |
|
аналоги |
|
|
на |
|
|
|
|||||||||
|
США |
Гер- |
Велико- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
мания |
британия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AISI316M |
США |
≤0,06 |
16,5− |
13−14 |
1,5− |
2,0− |
− |
− |
≤0,8Si |
− |
− |
− |
|
|
|
|
17,5 |
|
2,0 |
2,75 |
|
|
|
|
|
|
|
AISI316 |
США |
≤0,08 |
16−18 |
10−14 |
≤2,0 |
2,0−3,0 |
− |
− |
≤1,0Si |
− |
4401 |
845В |
|
AISI317 |
США |
≤0,08 |
18−20 |
11−15 |
≤2,0 |
3,0−3,4 |
− |
− |
≤1,0Si |
− |
− |
− |
|
D9 |
США |
0,05 |
13,5 |
15,5 |
2,0 |
1,8 |
− |
0,25 |
0,006B; |
− |
− |
− |
|
|
|
|
|
|
|
|
|
|
0,03P |
|
|
|
376 |
FV548 |
Вели- |
≤0,10 |
16−17 |
~12 |
~1 |
1,4−2,0 |
~1 |
− |
≤0,4Si; |
− |
− |
− |
|
кобри- |
|
|
|
|
|
|
|
≤0,004B |
|
|
|
|
|
|
тания |
|
|
|
|
|
|
|
|
|
|
|
|
1.4970 |
Гер- |
≤0,10 |
15,2 |
14,7 |
1,8 |
1,2 |
− |
0,3 |
0,3Si; |
− |
− |
− |
|
|
мания |
|
|
|
|
|
|
|
0,006В |
|
|
|
|
1.4988 |
Гер- |
0,06 |
16,0 |
13,0 |
1,3 |
1,3 |
0,8 |
− |
0,7Y; 0,1N |
− |
− |
− |
|
|
мания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Х12Г14Н4ЮМР |
СССР |
≤0,1 |
~12 |
~4 |
~14 |
~1 |
− |
− |
~1Al; |
− |
− |
− |
|
(ЭП-838) |
|
|
|
|
|
|
|
|
≤0,01B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10Х14Г14Н4Т |
СССР |
0,10 |
13−15 |
2,8− |
13−15 |
− |
− |
5 (С− |
− |
− |
− |
− |
|
(ЭИ-711) |
|
|
|
4,5 |
|
|
|
−0,02)÷0,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12Х17Г9АН4 |
СССР |
0,12 |
16−18 |
3,5− |
8− |
− |
− |
− |
0,15−0,25N |
− |
− |
− |
|
(ЭИ-878) |
|
|
|
4,5 |
10,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15Х17АГ14 |
СССР |
0,15 |
16−18 |
0,6 |
13,5− |
− |
− |
− |
0,25−0,37N |
− |
− |
− |
|
(ЭПС213) |
|
|
|
|
15,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
376
|
|
|
|
|
|
|
|
|
|
|
Продолжение табл. 23.72 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стра- |
|
|
|
|
|
|
|
|
Некоторые зарубежные |
||
|
Марка стали |
С |
Сr |
Ni |
Мn |
Мо |
Nb |
Ti |
Другие |
|
аналоги |
||
|
на |
|
|
|
|||||||||
|
США |
Гер- |
Велико- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
мания |
британия |
|
|
|
|
|
|
|
Стали с карбидным упрочнением |
|
|
|
|
|||
|
45Х14Н14В2М |
СССР |
0,4− |
13−15 |
13−15 |
≤0,7 |
0,25− |
− |
− |
2,0−2,75W; |
− |
− |
− |
|
(ЭИ-69) |
|
0,5 |
|
|
|
0,4 |
|
|
≤0,8Si; |
|
|
|
|
|
|
|
|
|
|
|
|
|
≤0,3Cu |
|
|
|
|
31Х19Н9МВБТ |
СССР |
0,28− |
18−20 |
8−10 |
0,8− |
1,0−1,5 |
0,2−0,5 |
0,2−0,5 |
1,0−1,5W; |
− |
− |
− |
|
(ЭИ-572) |
|
0,35 |
|
|
1,5 |
|
|
|
≤0,7Si |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
377 |
42Х15Н7ГФ2МС |
СССР |
0,38− |
14−16 |
6−8 |
6−8 |
0,65− |
− |
− |
1,5−1,9V; |
− |
− |
− |
(ЭИ-388) |
|
0,47 |
|
|
|
0,95 |
|
|
0,9−1,4Si |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
37Х12Н8Г8МФБ |
СССР |
0,34− |
11,5− |
7,9− |
7,5− |
1,1−1,4 |
0,25−0,45 |
− |
1,25−1,55V |
− |
− |
− |
|
(ЭИ-481) |
|
0,4 |
13,5 |
9,0 |
9,5 |
|
|
|
; 0,3−0,8Si |
|
|
|
|
|
|
|
|
Стали |
с |
интерметаллидным упрочнением |
|
|
|
|
||
|
10Х11Н20ТЗР |
СССР |
≤0,10 |
10− |
18−21 |
≤1,0 |
− |
− |
2,6−3,2 |
≤0,8А1; |
− |
− |
− |
|
(ЭИ-686) |
|
|
12,5 |
|
|
|
|
|
≤1,0Si; |
|
|
|
|
|
|
|
|
|
|
|
|
|
0,008÷0,02 |
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
10Х11Н35МТЮР |
СССР |
≤0,10 |
10− |
34−36 |
≤1,0 |
− |
− |
2,6−3,2 |
≤0,8А1; |
− |
− |
− |
|
|
|
|
12,5 |
|
|
|
|
|
≤1,0Si; |
|
|
|
|
|
|
|
|
|
|
|
|
|
≤0,02В |
|
|
|
|
12Х15Н35ВТ |
СССР |
≤0,12 |
14−16 |
34−38 |
1,0− |
− |
− |
1,1−1,5 |
2,8−3,5W; |
− |
− |
− |
|
(ЭИ-612) |
|
|
|
|
2,0 |
|
|
|
≤0,6 Si |
|
|
|
377
|
|
|
|
|
|
|
|
|
|
|
|
Окончание таблицы 23.72 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Некоторые зарубежные |
||
|
|
Марка стали |
Стра- |
С |
Сr |
Ni |
Мn |
Мо |
Nb |
Ti |
Другие |
|
|
аналоги |
|
|
|
|
на |
|
|
|
|
|
|
|
|
|
США |
Гер- |
Велико- |
|
|
|
|
|
|
|
|
|
|
|
|
|
мания |
британия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
05ХН32Т |
СССР |
≤0,05 |
19−22 |
30−34 |
≤0,7 |
− |
− |
0,25−0,60 |
≤0,25А1; |
|
− |
− |
In800 |
|
|
|
|
|
|
|
|
|
|
|
≤0,7Si |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
08Х15Н35ВТЮ |
СССР |
≤0,08 |
14−16 |
33−37 |
≤0,6 |
− |
− |
2,4−3,2 |
2,8−3,5W; |
|
− |
− |
− |
|
|
(ЭИ-787) |
|
|
|
|
|
|
|
|
0,7−1,7А1; |
|
|
|
|
378 |
|
|
|
|
|
|
|
|
|
|
≤0,02В; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≤0,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
04Х15Н35М2БТЮР |
СССР |
0,04 |
15,9 |
36,0 |
1,3 |
2,44 |
0,91 |
1,08 |
1,ЗА1, |
|
− |
− |
− |
|
|
(ЭП-150) |
|
|
|
|
|
|
|
|
0,5Si; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,02Се; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,002В |
|
|
|
|
|
|
Инколой-800 |
Вели- |
0,03− |
19−23 |
30−35 |
1,5 |
− |
− |
0,15−0,60 |
0,15−0,60А |
|
− |
− |
− |
|
|
|
кобри- |
0,06 |
|
|
|
|
|
|
1; ≤l,0Si |
|
|
|
|
|
|
|
тания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_______ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Здесь С − концентрация углерода, %. |
|
|
|
|
|
|
|
|
|
|
||||
378
Рис. 23.178. Структурная диаграмма системы Fe Cr Mn после закалки от 1100 °С (Ф.Ф. Химушин)
Помимо указанных факторов система Fe–Cr–Mn по сравнению с Fe–Cr–Ni имеет более низкую энергию дефектов упаковки и повышенную склонность к механическому двойникованию, что увеличивает в этих материалах тенденцию к вводимым при деформацияхи мартенситным превращениям.
Влияние легирования на структуру и свойства аустенитных сталей
В настоящее время разработано большое количество различных марок сталей, многие из которых содержат, кроме Cr и Ni, до трех и более легирующих элементов (табл. 23.72).
Таблица 23.73
Влияние легирования на длительную прочность аустенитных сталей
Марка стали |
|
104 , МПа, при различной температуре, °С |
|
||||
|
600 |
|
650 |
700 |
750 |
|
800 |
1Х18Н9 |
120 |
|
75 |
40 |
|
|
|
1Х18Н9Т |
190 |
|
90 |
65 |
|
|
|
1Х18Н12М2 |
195 |
|
106 |
44 |
40 |
|
24 |
1Х16Н25М6 |
220 |
|
155 |
95 |
85 |
|
42 |
1Х15Н36Б3Т |
210 |
|
180 |
|
|
|
|
Молибден и вольфрам являются основными легирующими элементами, вводимыми в аустенитную сталь для повышения жаропрочности путем легирования твердого раствора (табл. 23.73). Эффективность влияния их обусловлена главным образом увеличени-
379
ем прочности межатомных связей в решетке γ-твердого раствора. Молибден повышает устойчивость против коррозии в морской воде и кислотах.
Ниобий, титан и ванадий также вводят для увеличения жаропрочности сталей (см. табл. 23.73), однако действие их основано не только в упрочнении твердого раствора, но и создании ими высокодисперсных упрочняющих фаз разного типа (карбиды, карбонитриды, интерметаллиды и др.). Кроме того, легирование этими элементами широко используют для снижения склонности аустенитных сталей к межкристаллитной коррозии путем связывания углерода в специальные (безхромистые) карбиды.
Бор и иттрий вводят в жаропрочные стали в малых количествах для изменения состояния границ зерен. Являясь поверхностноактивными элементами, В и Y (и их соединения с другими элементами) сильно замедляют диффузию на границах зерен, увеличивают жаропрочность.
Редкоземельные элементы (РЗМ) значительно улучшают деформируемость аустенитных сталей при высокой температуре, повышают жаропрочность. Чаще всего в качестве присадок РЗМ применяют комплексный концентрат под названием мишметалл, основной составляющей которого является церий. Кроме Се, мишметалл содержит La, Nd, Sm, Pr, Pm. Благодаря высокой химической активности эти элементы нейтрализуют действие вредных примесей: О, Н, S и др. Считается, что оптимальное количество РЗМ составляет от 0,9 до 2,5 кг/т выплавляемой стали.
Алюминий вводят в аустенитные стали в сочетании с Ti (см. табл. 23.72) для увеличения жаропрочности путем создания высокоэффективной упрочняющей γ'-фазы Ni3(Ti,Al).
Кремний не улучшает жаропрочность аустенитных сталей, тем не менее существует ряд сталей с высоким содержанием Si (до 3%), используемых в качестве жаростойких материалов (например,
Х20Н14С2, Х15Н35С2 и др.).
Азот до 0,15–0,4 % используют для стабилизации аустенита и частичной замены никеля в Cr–Mn–Ni-сталях (см. табл. 23.72). Наиболее сильно упрочняют γ-твердый раствор элементы внедрения – углерод и азот, затем следуют ферритообразуюшие элемен-
380
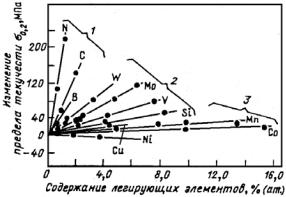
ты, растворяющиеся по типу замещения. Аустенитообразующие элементы, образующие твердые растворы замещения, оказывают незначительное влияние на упрочнение твердого раствора
(рис. 23.179).
Рис. 23.179. Влияние атомного содержания легирующих элементов на упрочнение аустенита:
1 − элементы, образующие твердые растворы внедрения; 2 − ферритообразующие элементы, растворяющиеся по типу замещения; 3 − аустенитообразующие элементы, растворяющиеся по типу замещения
Усложнение состава хромоникелевых сталей путем дополнительного легирования ферритостабилизирущими элементами (Мо, Nb, W, Ti, Al, Si и др.) эквивалентно увеличению концентрации хрома [см. формулу (23.40)], в результате чего склонность к появлению α-фазы возрастает. Конечная структура хромоникелевых сталей определяется суммарным воздействием всех легирующих элементов. Так, при дополнительном легировании ферритостабилизирующими элементами необходимо увеличить в стали содержание Ni (стали Х18Н10Т, Х18Н12Т, 0Х17Н13М2Т). Аналогичным образом поступают и в том случае, если в аустенитной стали увеличивается содержание Cr сверх оптимальной концентрации (сталь Х23Н18).
Вследствие того, что растворимость углерода в хромоникелевом аустените не превышает 0,01 % (см. рис. 23.120), при наличии
381
0,08–0,15 % С, обычным для наиболее распространенных хромоникелевых сталей, равновесная структура должна состоять из аустенита и карбидов типа М23С6. Однако в процессе производства полуфабрикатов (листов, труб и др.), а также при закалке, часто применяемой при изготовлении полуфабрикатов и изделий, возникает неравновесная структура, состоящая из пересыщенного γ-твердого раствора, не содержащего карбидов или содержащего минимальое их количество.
При нагреве такой стали до 800 °С в результате распада пересыщенного γ-твердого раствора происходит выделение хромистых карбидов, и локальные объемы γ-твердого раствора вокруг них могут обедняться хромом. При достаточно низком содержании Cr в этих объемах появляется ферромагнитная α-фаза. Так, в закаленной от 1150 °С в воду стали с 0,15 % С, 15 % Cr и 10,8 % Ni (Х15Н11)
следы ферромагнитной α-фазы появляются в результате старения при 600 °С через 20 ч, а через 1000 ч по границам зерен выделяется уже сетка α-фазы. При более высокой температуре старения (700 °С) выделение ферромагнитной α-фазы более значительно. При температуре 800 °С максимальное количество α-фазы наблюдается через 100 ч, но через 1000 ч она практически полностью исчезает (рис. 23.180), так как в связи с развитием диффузионных процессов концентрация Cr в локальных объемах вокруг выделившихся карбидных частичек становится близкой к концентрации Cr в основном γ-твердом растворе.
Рис. 23.180. Изменение количества α-фазы в стали 15X15H10 в зависимости от температуры и времени старения
382
Увеличение содержания Ni в указанной стали до 15 % (Х15Н15) ограничивает появление ферромагнитной α-фазы, а повышение содержания Ni до 25 % (Х15Н25) настолько повышает устойчивость аустенита, что ферромагнитная α-фаза вовсе не появляется. Аналогичное влияние оказывает также уменьшение концентрации углерода в стали, поскольку при этом образуется меньше карбидов хрома. Например, уменьшение содержания С от 0,15 до 0,08 % при содержании 15 % Ni не приводит к появлению ферромагнитной α-фазы, так как больше Cr остается в твердом растворе.
Появление -фазы наиболее характерно для двойных систем, в которых существуют широкие области α-фазы с ОЦК структурой (системы Fe–Cr, Fe–V, Fe–Mo и др.). Анализ условий, благоприятствующих появлению -фазы в хромоникелевых сталях, показывает, что наиболее чувствительными к выделению -фазы являются стали, состав которых приближается к областям с гетерогенной струк-
турой ( + ) и ( + α + ) (см. рис. 23.166, 23.176).
После длительной работы при высокой температуре присутствие -фазы обнаружено также в сталях, содержащих 18 % Cr и 8 % Ni и дополнительно легированных такими ферритообразующими элементами, как Мо или Nb (например, Х18Н8Б), а также в сталях с 23–25 % Cr и 12–20 % Ni (например, Х24Н16), особенно если в них введены ферритстабилизирующие элементы. Причиной такого изменения структуры при длительном воздействии высокой температуры может быть процесс расслоения твердого раствора в локальных объемах, обнаруженный методом ядерного-резонанса.
При старении закаленных сплавов системы Fe–Cr (450–500 °С) происходит изменение формы резонансного спектра поглощения-квантов. В частности, интенсивность пиков, связанных с атомами Fe, не имеющими по соседству атомов Cr, увеличивается. Перераспределение интенсивностей свидетельствует об образовании в твердом растворе областей, обедненных атомами Cr, т.е. о расслоении твердого раствора на области с различной концентрацией хрома. Такой процесс может благоприятствовать образованию -фазы даже в сплавах с относительно низким содержанием хрома.
383
Аналогичные явления наблюдались и в хромоникелевых сплавах. Анализ изменения величин, характеризующих долю атомов в различном окружении атомов Cr, показывает, что в закаленном на мартенсит сплаве 0Х16Н6 в результате старения при 400 °С в течение 100 ч образуются области, обедненные хромом, в которых содержится около 14 % Cr; при старении сплава 0Х12Н12 при 500 °С в течение 50 ч в аналогичных областях концентрируется примерно 10 % Cr. Таким образом, расслоение твердого раствора и образование локальных объемов с различной концентрацией легирующих элементов возможно и в хромоникелевых сталях.
Для предупреждения появления σ-фазы необходимо, так же как и для ограничения выделений α-фазы, увеличивать концентрацию легирующих элементов, стабилизирующих и расширяющих область γ-структуры; в первую очередь следует повышать содержа-
ние Ni (стали Х18Н12М3Т, Х17Н16М3Т, Х16Н25М6, Х14Н14В2М
и др.). Часто идут по пути сокращения концентрации Cr как ферритообразующего элемента (сталь Х12Н20Т2 и др.).
Ускоренное охлаждение от высокой температуры, осуществляемое в большинстве случаев на практике, тоже может предотвратить выделение σ-фазы в сталях, для которых характерно ее присутствие при низкой температуре. Поэтому последующий длительный нагрев до температуры ниже 800–900 °С будет способствовать выделению ее из пересыщенного твердого раствора, особенно по границам зерен.
Роль α-фазы в процессах образования σ-фазы можно проиллюстрировать на примере стали Х18Н12М4. В этой стали после закалки наблюдаются включения α-фазы. Однако уже после старения при 600 °С в течение 5 ч происходит распад включений α-твердого раствора с образованием мелкодисперсных выделений σ-фазы, которые после травления 10 %-ной хромовой кислотой имеют вид темных точек внутри зерен α-фазы. При этом микротвердость основной аустенитной фазы остается на прежнем уровне (Нμ ≈ 2500 МПа), в то время как твердость объемов распавшегося α- твердого раствора увеличивается примерно до 4800 МПа.
384
При длительном старении стали Х18Н12М4 (при 750 °С в течение 1000 ч) наблюдаются только выделения σ-фазы, что подтверждается как рентгенофазовым и электронно-микроскопическим анализами, так и высокой твердостью выделений (Нμ ≈ 7400 МПа); Фаза σ располагается по границам зерен в виде крупных слегка вытянутых образований, а также по кристаллографическим плоскостям внутри зерен в виде тонких цепочек, и имеет высокую концентрацию Cr (45–50 %). Поэтому ее выделение способствует образованию концентрационной неоднородности твердых растворов по хрому со всеми вытекающими отсюда последствиями.
С увеличением продолжительности старения частицы σ-фазы склонны к коагуляции. Одновременно, как показывают исследования, в результате развития диффузионных процессов состав σ-фазы не остается неизменным. Обладая значительной областью гомогенности, она обогащается такими легирующими элементами, как Cr, Mo, Si, Al и др.
Вравновесных структурах хромоникелевых сталей, обычно содержащих не менее 0,06–0,1 % С, практически весь углерод идет на образование карбидных фаз.
Внелегированных хромоникелевых сталях по данным рентгено-
структурного анализа образуются карбиды хрома (Cr, Fe)23C6 со сложной ГЦК кристаллической решеткой. Эти карбиды являются наиболее распространенными в аустенитных корозионно-стойких
жаропрочных сталях. Гексагональный карбид (Cr, Fe)7C3 в аустенитных сталях практически не встречается.
При легировании хромоникелевых сталей Ti, Nb и V образуются карбиды типа МС. Эти карбиды являются фазами внедрения и по сравнению с карбидами хрома обладают повышенной термической
стойкостью – растворяются в γ-твердом растворе при более высокой температуре, при старении выделяются в крайне дисперсном состоянии (см. п. 23.3.3); кроме того, они менее склонны к коагуляции.
Карбид TiC образует твердые растворы с Mo, W, Nb и Cr; железо в карбиде титана не растворяется. В карбиде NbC растворяются W, Мо, но с Cr и Fe карбид ниобия твердых растворов не образует.
385
Карбиды Мо2С, W2C или МоС, WC в виде отдельных частиц в хромоникелевых сталях не наблюдаются, поскольку свободные энергии их образования выше, чем основного легирующего элемента – Cr, а также Ti и Nb (см. рис. 23.126). При легировании молибденом и вольфрамом образуются карбиды (Cr, Fe, Mo, W)3C6. В состав карбидов типа М23С6 могут входить также до 6 % Ni, до 1,5 % Mn, до 1 % V. Титан и ниобий в этих карбидах не растворяются.
В хромоникелевых сталях с высоким содержанием Cr (более 18–20 %) карбид ванадия VC как самостоятельная фаза почти не выделяется, а V в основном входит в состав карбидов типа М23С6.
Из указанных выше карбидов наиболее легко растворяются начиная примерно с 600 °С карбиды хрома (Cr, Fe)23C6, а его составляющие переходят в γ-твердый раствор. При высокой температуре (1300–1350 °С) концентрация углерода в железохромоникелевом γ-твердом растворе может доходить до 0,5–0,6 %.
Термически стойкие карбиды TiC и NbC обладают сравнительно малой растворимостью в железохромоникелевом аустените. Например, в стали 1Х18Н10Т, содержащей карбиды титана, после нагрева до 1100–1150 °С и последующего охлаждения в воде наблюдается только частичный переход углерода в аустенит, большая же часть углерода остается по границам зерен в виде карбидов. Растворение карбидов TiC и NbC в γ-твердом растворе становится заметным только при температуре нагрева выше 1150–1250 °С.
Если закаленный с высоких температур γ-твердый раствор подвергнуть новому нагреву в интервале температур 550–800 °С, то возникают условия для перехода неравновесной (метастабильной) структуры в равновесную. При этом из пересыщенного γ-твердого раствора выделяются частички карбидных фаз типа М23С6 или МС, и структура хромоникелевых сталей становится, таким образом, гетерогенной. В результате возникновения гетерогенных структур может быть существенно повышена жаропрочность хромоникелевых сталей (рис. 23.181) за счет так называемого карбидного упрочнения.
386

Рис. 23.181. Время до разрушения τ хромоникелевой стали (16 % Сr, 32 % Ni, Mo и W − переменное содержание) при 700 °С и σ = 120 МПа в зависимости от количества mк выделившихся карбидных фаз (по массе электролитически выделенного осадка)
Величину упрочнения определяют дисперсность, количество и термическая стойкость карбидных частичек, однако эффект карбидного упрочнения становится заметным только при значительном содержании углерода (0,3–0,6 % и выше).
При длительном воздействии высокой температуры развиваются диффузионные процессы и, в первую очередь, диффузия углерода, что приводит к укрупнению (коагуляции) карбидных включений, вызывающему разупрочнение сталей. Большой склонностью к коагуляции обладают карбиды хрома (Cr,Fe)23C6, особенно при температуре старения около 700 °С, в результате чего резко снижается жаропрочность (рис. 23.182), что и ограничивает уровень рабочей температуры.
Рис. 23.182. Влияние температуры старения и концентрации Сr на предел ползучести ( σ1% /104 ч )
хромоникелевой стали с 20 % Ni
387
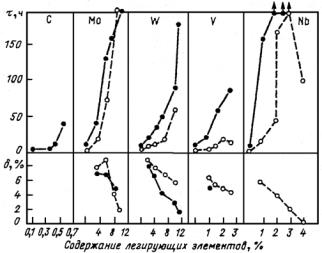
Использование хромоникелевых сталей при рабочей температуре 650 °С и выше возможно при дополнительном легировании их Mo, Nb, W и другими элементами (рис. 23.183). В результате усложнения состава γ-твердого раствора и карбидов, как правило, замедляются диффузионные процессы и возрастает стабильность карбидных фаз. Тем не менее при повышенной температуре и длительной выдержке все же наблюдаются изменения состава карбидов типа М23С6, выражающиеся в накапливании в карбидах элементов, обладающих значительным химическим сродством к углероду
– Cr, Mo, W и др. Элементы, имеющие меньшее сродство к углероду, например Fe, постепенно переходят из карбидов типа М23С6 в γ- твердый раствор.
Рис. 23.183. Влияние легирования на время до разрушения τ
(Тисп = 700 °С, σ = 180 МПа) и пластичность δ стали Х20Н20 (закалка от 1150 °С в воду) при содержании 0,1 ({) и 0,4 % С (z)
Карбиды TiC и NbC из-за их малой растворимости в γ-твердом растворе при обычной температуре закалки (1100–1150 °С) почти не участвуют в процессах старения. Однако их присутствие в хромоникелевых сталях несколько повышает жаропрочность.
388
В некоторых хромоникелевых сталях, легированных Mo, W, Ti, Аl, возможно появление в структуре интерметаллидных фаз Ni3Ti, Ni3(Ti, Al), Fe2Mo и др. Их образование (по аналогии с карбидными фазами) способствует упрочнению хромоникелевых сталей (так называемое интерметаллидное упрочнение) и поэтому используется на практике при создании дисперсионно-упрочняемых сталей. Наибольшее применение получило интерметаллидное упрочнение, осуществляемое путем легирования хромоникелевых сталей алюминием и титаном. В дисперсионно-твердеющих сталях, легированных только алюминием, при старении выделяется фаза NiAl с ОЦК кристаллической решеткой в виде видманштеттовой сетки или пластин. Добавление Ti ведет к образованию подобной фазы типа Ni(Al, Ti), которая при увеличении содержания Ti превращается в упорядоченную фазу Ni2(Al, Ti). Дальнейшее увеличение содержания Ti в стали при старении ведет к образованию ГЦК фазы γ′-Ni3(Al, Ti), которая имеет сферическую форму и когерентно связана с матрицей (рис. 23.184, а). При еще более высоком содержании Ti образуется фаза η-Ni3Ti с ГПУ кристаллической решеткой в виде видманштеттовой сетки или зернограничных ячеи-
стых выделений (рис. 23.184, б).
Эффект старения проявляется в результате возникновения когерентных напряжений и общего дисперсионного упрочнения, и его можно повысить путем увеличения суммарного объема выделений или когерентных напряжений, увеличивая параметр несоответствия решеток выделений и матрицы. Объем выделений возрастает с увеличением содержания Al + Ti, а несоответствие решеток – в результате увеличения отношения Ti:A1. Фаза γ′-Ni3(Al, Ti), имеющая ту же кристаллическую решетку, что и матрица, медленнее коагулирует по сравнению с другими рассмотренными выше фазами (сферическая форма выделений при перестраивании энергетически более выгодна). Выделение этой фазы дает максимальный эффект дисперсионного твердения.
Таким образом, для получения высокодисперсных и термически стабильных выделений γ′-фазы необходимо использовать совместное легирование стали титаном и алюминием. Однако количество Al + Ti, которое можно использовать, лимитируется, так как при
389
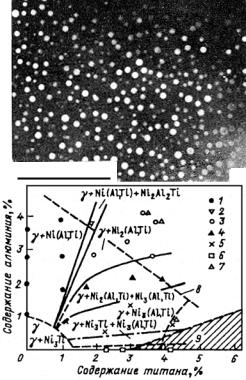
большем содержании Al + Ti образуется δ-феррит. В то же время высокое отношение Ti:Аl нежелательно с точки зрения образования ячеистых выделений фазы η-Ni3Ti. Поэтому в сталях оптимального состава содержится не более 3–3,5 % Ti и 1,5–3 % Аl; эти же стали содержат и повышенное (до 20–35 %) количество Ni (см. табл. 23.72). При старении этих сталей формируется γ′-фаза типа Ni3Al или Ni3(Al, Ti), которая кристаллизуется в структуру с ГЦК решеткой, аналогичной решетке основного γ-твердого раствора.
0,5 мкм |
а) |
|
б)
Рис. 23.1848. Характерный вид γ′-Ni3(Al, Ti) фазы (темнопольное изображение в ПЭМ) (а) и влияние содержания Аl и Ti на фазовый состав аустенитной корро- зионно-стойкой стали с 15 % Сr и 25 % Ni при температуре старения 800 °С (б):
1 − Ni(Al, Ti); |
2 − Ni(Al, Ti) + Ni2(Al,T i); 3 − Ni2(Al, Ti); 4 − Ni2(Al, Ti) + Ni3(Al, Ti); |
5 − Ni3(Al, Ti); |
6 − Ni3Ti; 7 − σ-фаза; 8 − граница аустенито-ферритной области |
в состоянии закалки; 9 − ячеистые выделения (Ф.Б. Пикеринг)
390
Максимальные жаропрочные свойства аустенитных сталей с интерметаллидным упрочнением возникают в основном в тех случаях, когда упрочняющая фаза находится еще в стадии формирования (в метастабильном состоянии) и не превратилась в фазу с границами раздела. На этой стадии кристаллическая решетка интерметаллидной фазы обычно имеет в той или иной степени когерентную связь с решеткой основной металлической матрицы.
Близкие параметры кристаллических решеток γ- и γ′-фазы (аγ = 0,358 нм, аγ′ = 0,360 нм) благоприятствуют сохранению когерентной связи между ними даже при высокой температуре старения, и поэтому γ′-фаза имеет меньшую склонность к коагуляции по сравнению с карбидами. Одновременно наличие когерентной связи между частицами γ′-фазы и основного γ-твердого раствора является причиной часто наблюдаемого дробления зерен и субзерен γ-твердого раствора. Размеры образующихся при этом блоков могут доходить до 200 нм. Это обстоятельство благоприятствует тому, что упрочняющее влияние γ′-фазы сохраняется до температуры
750–800 °С.
В жаропрочных сталях аустенитного класса, легированных Mo, W, Nb (стали 0Х16Н15МЗБ, 1Х14Н20В2БР и др.), возможно образование также интерметаллидных соединений типа фаз Лавеса – Fe2Mo, Fe2W, Fe2(Mo, W), Fe2Nb и т.д. Эти фазы могут растворять Сr и Ni и приобретать более сложный состав, например (Fe, Cr, Ni)2W, (Fe, Cr, Ni)2(W, Mo) и др.
При легировании титаном наряду с γ′-фазой встречается ингерметаллидная фаза Fe2Ti с гексагональной кристаллической решеткой, которая может растворять никель. Однако при совместном легировании титаном и молибденом фаза Fe2Ti не образуется в связи с более низкой диффузионной подвижностью атомов компонентов в твердом растворе, в котором присутствует молибден.
Использование интерметаллидных фаз в качестве упрочняющих связано с переводом их в дисперсное состояние. Это достигается с помощью термической обработки, которая, также как и при термической обработке сталей с карбидным упрочнением, осуществляется в два этапа.
На первом этапе путем нагрева до высокой температуры (1100–1200 °С) интерметаллидные фазы переводят в твердый рас-
391
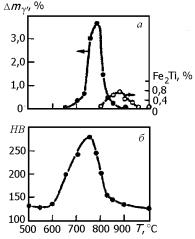
твор и фиксируют их в нем с помощью последующего ускоренного охлаждения (закалки) – в результате получают пересыщенный γ-твердый раствор с ГЦК кристаллической решеткой. Например, в стали Х12Н20Т3ЮР полное растворение γ′-фазы наблюдается при 875 °С (рис. 23.185), а интерметаллида Fe2Ti – при 1000 °С. Таким образом, растворимость интерметаллидных фаз, по сравнению с карбидами типа МС, происходит при более низкой температуре.
Рис 23.185. Количество интерметаллидных фаз (a) и изменение твердости (б) в стали X12Н20Т3ЮР в зависимости от температуры старения в течение 16 ч
Для других сталей и интерметаллидов температурные условия и кинетика растворения могут быть другими. Частицы фазы Fe2Mo начинают растворяться при температуре 900–950 °С; частицы Fe2W
– при 1000–1050 °С; полное растворение их наступает при темпе-
ратуре 1200–1300 °С.
Второй этап термической обработки аустенитных сталей с интерметаллидным упрочнением заключается в выдержке пересыщенных твердых растворов при температуре 700–850 °С (старение), в результате которого происходит образование гетерогенных структур. Оптимальные условия старения, обеспечивающие максимальное упрочнение, обычно определяются составом стали. Так, для аустенитной хромоникельтитановой стали Х12Н20Т3ЮР мак-
392
симум количества γ′-фазы (3–4 %) и соответственно твердости, кратковременной и длительной прочности наблюдается при температуре старения около 750 °С (рис. 23.185, б). Более высокая температура старения (Т > 750÷800 °С) вследствие коагуляции γ′-фазы, а также уменьшения ее количества (вновь происходит растворение в γ-твердом растворе) приводит к разупрочнению (см. рис. 23.185).
Для сложных хромоникелевых сталей, содержащих Ti и Аl и дополнительно легированных Мо и W (стали Х15Н35В3Т3Ю, Х14Н35М3Т2Ю3Р и др.), оптимальная температура старения равна 750–770 °С. При этом выделяется интерметаллид Ni3(Ti, Al), количество которого доходит до 8–12 %. Такие стали обладают более высокими жаропрочными свойствами, чем например, сталь Х12Н20Т3ЮР. Легирование молибденом и вольфрамом хромоникелевых сталей с Ti и Аl повышает температуру рекристаллизации твердых растворов, а наличие Мо и W в интерметаллидных фазах повышает их термическую стойкость.
Интерметаллидные фазы типа Fe2M выделяются в процессе старения при более высокой температуре, поскольку их растворение по сравнению с γ′-фазами происходит при более высокой температуре. Например, в стали Х12Н20Т3ЮР максимальное количество фазы (Fe, Ni)2Ti наблюдается при 875 °С (при времени старения 16 ч) (см. рис. 23.185). Упрочняющий эффект фаз типа Fe2M менее значителен, чем упрочнение за счет интерметаллидов типа γ′-фаз. По-видимому, это связано с тем, что выделяющиеся при более высокой температуре частицы интерметаллидной фазы типа Fe2M имеют большие размеры.
Таким образом, следует отметить, что в аустенитных сталях оп-
тимальная температура старения для образования γ′-фаз равна
750–800 °С, а для фаз Лавеса 800–900 °С.
В аустенитных сталях, содержащих в качестве легирующих элементов Ti и В (0,008÷0,015 %), обнаружена боридная фаза TiB2. В аналогичных сталях, дополнительно легированных Мо, возможно присутствие фазы типа М3В2, например (Мо, Сr)3В2. Количество Мо и Сr в этой фазе возрастает при повышении температуры старения от 650 до 900 °С. Длительное старение (100–500 ч) при высо-
393
кой температуре (775–800 °С) приводит к тому, что в боридные фазы переходит практически весь бор.
В сплавах, легированных титаном и ниобием и содержащих примеси азота, образуются нитриды TiN и NbN. Образование нитридов ниобия происходит даже раньше, чем карбидов NbC. Нитридные фазы обладают малой растворимостью в γ-твердом растворе, поэтому они часто наблюдаются в микроструктуре аустенитных сталей даже в закаленном состоянии.
В сталях, содержащих повышенное количество азота, после закалки и последующего нагрева выше 550 °С выделяются карбонитридные фазы. Например, в хромоникельмолибденовой стали Х16Н25М6 с 0,15 % N после закалки и выдержки при 700–800 °С в течение 5 ч карбонитрид имеет состав (Cr, Fe, Mo, Ni)23(C, N)6, а после продолжительной выдержки при 700–800 °С превращается в более сложную фазу (Fe, Ni)2(Mo, Cr)4(C, N).
Увеличение содержания Nb сверх необходимого для перевода углерода в карбиды (Nb/C > 10) вызывает значительное понижение ударной вязкости в закаленном состоянии, что связано с образованием интерметаллида Fe3Nb2. Выделение фазы Fe3Nb2 способствует также снижению жаропрочности, что, по-видимому, объясняется большей склонностью этой фазы к коагуляции.
По способу упрочнения аустенитные стали могут быть разделены на две группы (см. рис. 23.106): 1) гомогенные, не упрочняемые термообработкой; 2) гетерогенные, упрочняемые термообработкой (закалка + отпуск), или, по-другому, дисперсионно-упрочняемые. Последние, в свою очередь, подразделяются на стали с карбидным и интерметаллидным упрочнением.
Гомогенные стали
К сталям этой группы относятся главным образом низкоуглеродистые (не более 0,1 % С) хромоникелевые стали, дополнительно легированные элементами, упрочняющими γ-твердый раствор. Составы и механические свойства ряда аустенитных сталей, в том числе применяемых в качестве конструкционных материалов ядерных реакторов, приведены в табл. 23.72 и 23.74 соответственно.
394
Таблица 23.74
Термообработка и механические свойства аустенитных жаропрочных сталей
|
|
Режим термической |
|
|
|
|
|
|
ак, |
σдл, МПа, за |
|||
|
Марка стали |
Тисп, °С |
Е, ГПа |
σв, МПа |
σ0,2, МПа |
δ, % |
ψ, % |
время, ч |
|
||||
|
обработки * |
кДж/м2 |
|
|
|
|
|||||||
|
|
10 |
4 |
10 |
5 |
||||||||
|
12Х18Н10Т |
|
20 |
|
|
|
|
|
2200 |
|
|
||
|
З (1050−1100 °С), воздух, |
− |
520−560 |
200−230 |
40−46 |
≥55 |
− |
|
− |
|
|||
|
|
масло или вода |
400 |
177 |
− |
− |
− |
− |
− |
− |
|
− |
|
|
|
|
500 |
169 |
− |
− |
− |
− |
− |
− |
|
− |
|
|
|
|
550 |
− |
390 |
140 |
31 |
− |
2200 |
− |
|
− |
|
|
|
|
600 |
160 |
350 |
120 |
28 |
− |
2000 |
− |
|
− |
|
|
|
|
650 |
− |
280 |
120 |
27 |
− |
− |
− |
|
− |
|
|
|
|
700 |
− |
270 |
120 |
20 |
− |
− |
− |
|
− |
|
|
|
З (1050−1100 °С) + |
600 |
− |
− |
− |
− |
− |
− |
≥170 |
≥135 |
||
|
|
О (800 °С), 10 ч, воздух |
650 |
− |
− |
− |
− |
− |
− |
≥105 |
≥75 |
||
395 |
10Х17Н13М2Т |
З (1050−1100 °С), воздух, |
20 |
− |
520−540 |
220−236 |
35−40 |
55 |
− |
− |
|
− |
|
09Х16Н15МЗБ |
масло или вода |
20 |
− |
570 |
400 |
32 |
− |
− |
− |
|
− |
|
|
|
|
|
|||||||||||
|
З (1050−1200 °С), воздух, |
|
|
||||||||||
|
|
масло или вода |
350 |
− |
500 |
380 |
15 |
− |
− |
− |
|
− |
|
|
|
|
400 |
174 |
− |
− |
− |
− |
− |
− |
|
− |
|
|
|
|
500 |
167 |
− |
− |
− |
− |
− |
− |
|
− |
|
|
|
|
600 |
158 |
− |
− |
− |
− |
− |
− |
|
− |
|
|
|
|
750 |
− |
280 |
200 |
34 |
− |
− |
− |
|
− |
|
|
07Х16Н15МЗБР |
З (1050−1120 °С), воздух, |
20 |
− |
710 |
520 |
37 |
− |
− |
− |
|
− |
|
|
|
масло или вода |
350 |
− |
530 |
400 |
19 |
− |
− |
− |
|
− |
|
|
|
|
500 |
− |
520 |
390 |
16 |
− |
− |
− |
|
− |
|
|
|
|
750 |
− |
350 |
280 |
35 |
− |
− |
− |
|
− |
|
|
08Х15Н24В4ТР |
З (1130−1150 °С), 2 ч, воздух |
20 |
− |
750 |
450 |
18 |
35 |
≥800 |
− |
|
− |
|
|
|
+ С (730−750 °С), 16 ч, воз- |
600 |
− |
− |
− |
− |
− |
− |
400 |
300 |
||
|
|
дух |
650 |
− |
650 |
430 |
16 |
30 |
1000 |
290 |
230 |
||
|
|
|
700 |
− |
600 |
400 |
10 |
16 |
1000 |
180 |
140 |
||
|
|
|
750 |
− |
500 |
350 |
20 |
40 |
1000 |
120 |
80 |
||
395
Продолжение таблицы 23.74
396
|
Режим термической |
|
|
|
|
|
|
ак, |
σдл, МПа, за |
||||
Марка стали |
Тисп, °С |
Е, ГПа |
σв, МПа |
σ0,2, МПа |
δ, % |
ψ, % |
время, ч |
|
|||||
обработки * |
кДж/м2 |
10 |
4 |
10 |
5 |
||||||||
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10Х14Г14Н4Т |
З (1000−1080 °С), воздух, |
20 |
− |
600−700 |
250−300 |
35−40 |
50 |
− |
− |
|
− |
|
|
42Х15Н7Г7Ф2МС |
масло или вода |
20 |
190 |
|
|
15 |
15 |
300 |
− |
|
− |
|
|
З (1170−1190 °С), вода или |
900−1000 |
600−620 |
|
|
|||||||||
|
воздух + С (820±20 °С), 8−10 |
500 |
− |
700 |
490 |
12 |
23 |
− |
− |
|
− |
|
|
|
ч, воздух |
600 |
− |
640 |
500 |
9 |
23 |
− |
250 |
− |
|
||
|
|
700 |
− |
520 |
430 |
8 |
32 |
− |
110 |
− |
|
||
|
|
800 |
− |
380 |
280 |
8 |
17 |
− |
50 |
− |
|
||
|
|
900 |
− |
250 |
− |
7 |
18 |
− |
− |
|
− |
|
|
|
|
1000 |
− |
160 |
− |
6 |
21 |
− |
− |
|
− |
|
|
10Х11Н20Т3Р |
З (1100−1150 °С), 2 ч, вода |
20 |
− |
800−1000 |
450−600 10−25 15−30 |
800 |
− |
|
− |
|
|||
|
или воздух + С (750− |
500 |
− |
800 |
550 |
25 |
30 |
− |
− |
|
− |
|
|
|
775 °С), 15−25 ч, воздух |
600 |
− |
800 |
530 |
22 |
30 |
− |
− |
|
− |
|
|
|
|
700 |
− |
680 |
470 |
15 |
18 |
− |
− |
|
− |
|
|
|
|
800 |
− |
360 |
250 |
25 |
45 |
− |
− |
|
− |
|
|
08Х15Н35ВТЮ |
Двойная закалка: |
20 |
− |
950−1050 |
600−700 |
6−7 |
8−10 |
250 |
− |
|
− |
|
|
|
З (1150−1180 °С), 4−8 ч, |
550 |
− |
1000 |
690 |
5 |
7 |
500 |
− |
|
− |
|
|
|
воздух + З (1050 °С), 4 ч, |
600 |
− |
1000 |
670 |
− |
12 |
− |
− |
|
− |
|
|
|
воздух + С (750−800 °С), |
700 |
− |
920 |
680 |
5 |
9 |
− |
− |
|
− |
|
|
|
16 ч, воздух |
750 |
− |
850 |
650 |
6 |
6 |
300 |
− |
|
− |
|
|
|
|
800 |
− |
680 |
600 |
13 |
22 |
500 |
− |
|
− |
|
|
|
|
850 |
− |
360 |
330 |
19 |
46 |
550 |
− |
|
− |
|
|
|
|
900 |
− |
200 |
200 |
20 |
50 |
− |
− |
|
− |
|
|
|
Двойная закалка: |
20 |
− |
950−1230 |
600−740 |
6−21 8−30 |
250−1300 |
− |
|
− |
|
||
|
З (1150−1180 °С), 6−10 ч, |
550 |
− |
1140 |
− |
18 |
32 |
950 |
640 |
− |
|
||
|
воздух + З (1050 °С), 4 ч, |
600 |
− |
1000−1160 |
600−690 |
12−17 17−22 |
500 |
460 |
− |
|
|||
|
воздух + С (750−840 °С), |
650 |
− |
− |
− |
− |
− |
− |
380 |
− |
|
||
|
16 ч, воздух |
700 |
− |
740−850 |
600 |
6−10 10−15 |
500 |
260 |
− |
|
|||
|
|
750 |
− |
− |
− |
− |
− |
− |
160 |
− |
|
||
* Термообработка: З − закалка; О − отпуск; С − старение.
396
Жаропрочность гомогенных сталей обеспечивается в основном твердорастворным упрочнением. Термин «гомогенные стали» следует понимать условно, так как в структуре сталей почти всегда присутствует некоторое количество вторых фаз, например, первичные карбиды или карбонитриды типа NbC, TiC, Nb(C, N), Ti(C, N) и др., но в количествах, не вызывающих сильного эффекта упрочнения.
Гомогенные аустенитные стали используют в закаленном (аустенизированном) с 1050–1200 °С (вода или воздух) состоянии. Реже применяют аустенизацию со стабилизирующим отпуском при 700–750 °С с целью получения более однородного γ-твердого раствора, заданный размер зерна (3–6 баллов) и стабильную структуру, а также снятия внутренних напряжений. Стабилизация аустенитной структуры при низком содержании углерода достигается повышением содержания Ni (см. п. 23.3.3).
Повышенное содержание Nb и [отношение (Nb + Ti)/(C + N) более 10] обеспечивает в исходном состоянии присутствие карбидов TiC, NbC и карбонитридов Ti(C, N), Nb(C, N), которые препятствуют образованию при эксплуатации карбидных фаз типа М23С6. Во многих аустенитных сталях, как правило, содержание Ti состав-
ляет от 5 (С – 0,02) до 0,7 %, Nb – от 8С до 1,2 %, где С — концен-
трация углерода. Такое количество Ti и Nb – необходимое условие обеспечения стойкости аустенитных сталей против межкри-
сталлитной коррозии. Повышение жаропрочности гомогенных аустенитных сталей объясняется высокой легированностью γ-твер- дого раствора такими элементами, как Мо (до 3 %), W (до 4 %) и др.
В связи с широкой распространенностью в ядерном реакторостроении аустенитных гомогенных сталей рассмотрим более подробно диаграммы распада и структуру наиболее типичных отечественных реакторных сталей 1Х18Н9Т, 0Х16Н15МЗБ (ЭИ-847) и американской стали AISI316 (сталь типа Х17Н12М3).
Сталь 1Х18Н9Т. После аустенизации (закалка в воду от 1050– 1200 °С) в структуре стали присутствуют: аустенитная матрица (твердый раствор легирующих элементов в γ-Fe); возможно незначительное количество δ-феррита; первичные карбид титана TiC, нитрид титана TiN или карбонитрид Ti(C, N). Кроме того, могут
397

присутствовать незначительные количества интерметаллидов − феррит титана Fe3Ti и сульфид титана Ti2S. Основные фазовые выделения − TiC, TiN или Ti(C, N) располагаются как по границам, так и внутри зерен аустенита.
Температурно-временная диаграмма структурных превращений в сталях типа 1Х18Н9Т приведена на рис. 23.186.
Рис. 23.186. Диаграмма структурных превращений в сталях типа 1Х18Н9Т
При охлаждении из жидкой фазы кристаллизуется аустенит и δ-феррит. Составы их существенно различаются: в δ-феррите
398
больше растворены ферритообразующие элементы (Cr, Ti), чем в аустените, и, наоборот, в аустените больше растворены аустенитостабилизирующие элементы (С, N, Ni). Кроме того, формируются первичные TiC, TiN, (Fe3Ti), (Fe2S) (область выше АВ). При охлаждении при температурах АВ δ-феррит начинает превращаться в аустенит (δ → γ). Область между ОР и АВ характеризуется твердым раствором легирующих элементов в стабильном аустените (γ) и метастабильном δ-феррите, а также первичными TiC, TiN, (Fe3Ti), (Ti2S).
В температурной области между РТ и ОР при длительной выдержке (старении) происходят различные структурные превращения − выделяются вторичные фазы. При температурах и временах, соответствующих линии CD, начинают распадаться δ-феррит и аустенит. Продуктами распада δ-феррита являются карбиды Сr23С6, σ-фаза (FeCr) и новый аустенит (γ). Время полного распада δ-феррита определяется линией MN.
При температуре и времени, соответствующих линии EF, начинается выделение частиц вторичной фазы Fe3Ti из аустенита. Выделение σ-фазы из аустенита начинается значительно позже, чем из δ-феррита, причем σ-фаза сначала выделяется по границам зерен, затем по плоскостям двойникования и позже − внутри зерен аустенита.
Выделение карбидов начинается при достаточно низкой температуре (около 400−500 °С), но вследствие малой скорости диффузии при этих температурах процесс образования карбидов идет очень медленно и преимущественно по границам зерен. При 600−700 °С скорость диффузии выше, отчего карбиды выделяются быстрее, в большом количестве и более крупные. При 800−900 °С образование карбидов происходит еще быстрее, сопровождается усиленной коагуляцией, поэтому число карбидов уменьшается, а размеры их увеличиваются. При Т > 900 °С наряду с коагуляцией начинается обратный процесс перехода составляющих карбидов в твердый раствор.
Наибольшее количество карбидов в стали типа 1Х18Н9Т выделяется при 800 °С. Максимальная потеря коррозионной стойкости относится к 600 °С. Максимальное упрочнение при использовании отпуска относится к 650−700 °С, причем оно зависит от степени
399
дисперсности карбидов − наибольшее упрочнение соответствует дисперсности примерно 0,1 мкм.
Наиболее быстро обособление σ-фазы в аустенитных сталях типа 1Х18Н9Т происходит при температуре 700−800 °С, с понижением температуры время до появления ее резко увеличивается (кривая GL). При Т = 900 °С в исследуемой стали происходит растворение σ-фазы, а при 850 °С еще наблюдается ее выделение из аустенита, т.е. температура равновесия σ-фазы и аустенита находится в интервале 850−900 °С.
При температуре, близкой к температуре плавления, практически все карбиды (и карбонитриды) титана растворяются. При последующем охлаждении в соответствии с кривой предельной растворимости происходит выпадение карбидов титана из аустенита. При высокой температуре (1050−1350 °С) для завершения процесса требуется всего 1−2 ч.
О возможности выпадения карбидов титана при умеренной температуре (500−850 °С) существуют противоречивые мнения. Большинство исследователей считают, что в этом температурном интервале энергетически более выгодно выпадение хромистых карбидов типа Сr23С6, однако указывается и на возможность наряду с этим выпадения небольшого количества TiC.
В общем случае положения кривых на диаграмме (см. рис. 23.186) существенно сдвигаются по оси времени в зависимости от предыстории стали (например, степени деформации), химического состава, особенно содержания углерода. Например, повышенное содержание углерода, а также предварительное деформирование ускоряют процессы выделения вторичных фаз. Диаграммы, подтверждающие это, рассматриваются на примере стали
AISI316.
Сталь 07Х17Н12М3 (AISI316). Сталь типа 316 выпускается в двух модификациях: с нормальным содержанием углерода − около 0,07 % (316) и с пониженным содержанием углерода − примерно
0,02 % (316L) (см. табл. 23.72).
Температурно-временные диаграммы распада сталей типа 316 приведены на рис. 23.187 и 23.188, а данные о кристаллической структуре и составе выделяющихся при старении фаз представлены в табл. 23.75.
400

401
Рис. 23.187. Диаграмма распада аустенита |
Рис. 23.188. Диаграмма распада аустенита |
|
стали 316L (0,022 % С) для двух температур аустенизации |
||
стали 316 (0,066% С), обработанной по режиму: |
||
(1090 °С и 1260 °С в течение 1,5 ч + закалка в воду) (а) |
||
аустенизация при 1260 °С 1,5 ч + закалка в воду (а) |
||
и изменение количества выделяющихся фаз |
||
и изменение количества выделяющихся фаз |
||
в зависимости от времени старения при 815 °С (б) |
||
в зависимости от времени старения при 815 °С (б) |
||
|
Таблица 23.75
Кристаллическая структура и состав фаз в состаренных аустенитных коррозионно-стойких сталях типа 316L и 316
402
|
Кристал- |
Параметр решетки, нм |
|
|
|
|
|
|
|
|
|
|
Состав фаз,% |
|
|
|
|
|
|
|
|
|||||||||||
Фаза |
лическая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Данные Б. Вейсса и |
Обобщение литера- |
Данные Б. Вейсса и |
Обобщение литера- |
|||||||||||||||||||||||||||||
|
структура |
Р. Стиклера* |
турных данных |
|
|
Р. Стиклера* |
|
|
турных данных |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
М23С6 |
ГЦК |
а= 1,0569 (650 °С, 1500 ч) |
|
1,060 ÷ 1,068 |
|
|
Mo |
|
Cr |
|
Fe |
|
Ni |
|
|
|
(Cr17Fe4,5Mo1,5)C6; |
|||||||||||||||
|
|
а = 1,0676 (900 °С, 150 ч) |
|
|
14 |
63 18 |
|
5 |
|
|
|
|
(Fe, Cr)23C6 |
|
|
|||||||||||||||||
|
|
|
|
|
|
(Cr16Fe5Mo2)C6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
М6С |
ГЦК |
а = 1,095 ± 0,001 |
|
1,085 ÷ 1,111 |
|
|
|
|
|
− |
|
|
|
|
|
|
|
(Cr, Co, Mo, Ni)6C; |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fе3Мо3С |
|
|
|||||
Сигма (σ) |
Тетраго- |
а = 0,8828 |
0,8799 |
÷ 0,8828 |
|
|
Mo |
|
Cr |
|
Fe |
|
Ni |
|
|
|
|
FeCr, FeMo; |
||||||||||||||
|
|
11 |
29 |
55 |
|
|
||||||||||||||||||||||||||
|
нальная |
(815 °С, 3000 ч) |
0,4544 |
для FeCr |
|
|
|
|
|
|
5 |
|
|
|
|
Fe(Cr, Mo) |
|
|
||||||||||||||
|
с = 0,4597 |
÷ 0,4547 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
а = 0,8832 |
0,8832 ÷ 0,9188 |
|
(Fe, Ni)x(Cr, Mo)y |
|
|
Mo |
|
|
|
Cr |
|
|
Fe |
|
Ni |
|
||||||||||||||
|
|
(900 °С, 150 ч) |
|
для FeMo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,35 |
30,84 |
− |
|
4,1 |
|
|||||
|
|
с = 0,4599 |
0,4599 ÷ 0,4812 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Хи (χ) |
ОЦК типа |
а = 0,8878 ± 0,0005 |
0,8862 |
÷ 0,8920 |
|
|
Mo |
|
Cr |
|
Fe |
|
Ni |
|
|
|
Fe36C2Mo; Мо18С; |
|||||||||||||||
|
α-Мn |
|
|
|
22 |
21 52 |
|
5 |
|
|
|
(Fe, Ni)36Cr18Mo4 |
||||||||||||||||||||
Лавеса (λ) |
Гексаго- |
а = 0,473 ± 0,001 |
0,4729 |
÷ 0,4744 |
|
|
Mo |
|
Cr |
|
Fe |
|
Ni |
|
|
|
|
|
|
|
Fe2Mo |
|
|
|||||||||
|
|
45 |
11 |
38 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
нальная |
с = 0,772 ± 0,001 |
0,7719 |
÷0,7725 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Аустенитная |
ГЦК |
а = 0,3598 |
0,3595 |
÷ 0,3598 |
|
Mo |
|
Cr |
|
|
Fe |
|
Ni |
|
|
Mo |
|
Cr |
|
Fe |
|
Ni |
||||||||||
|
2,66 |
17,3 |
осн. |
|
13,1 |
1,99 |
16,3 |
осн. |
15,85 |
|||||||||||||||||||||||
матрица (γ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Weiss B. and Stickler R. Phase Stabilities during high temperature exposure of 316 austenitic stainless steel // Metallurgical Transactions. 1972. V. 3. P. 851−866.
402
При температуре старения ниже 900 °С в сталях 316 и 316L первой выделяющейся фазой является карбид типа М23С6, на более поздних стадиях появляются различные интерметаллидные фазы, классифицированные как χ, σ и λ (фаза Лавеса). В стали 316L при температуре 815 °С χ- и λ-выделения появляются примерно после 10 ч выдержки, а σ-фаза − после 100 ч. В области более низких температур (например, при 650 °С) основными фазовыми составляющими являются М23С6 и λ, однако при длительном старении при этой температуре формируются карбиды М6С.
Основные закономерности распада аустенита при старении сталей 316 (эти закономерности сохраняются и для других Fe−Cr−Ni сталей и сплавов аустенитного класса) описаны ниже.
1.Чем выше была температура аустенизации, тем раньше и при
более низкой температуре выпадают карбиды М23С6 при старении (см. рис. 23.187). Это связано с тем, что при более высокой температуре (1260 °С) твердый раствор больше насыщен в отношении углерода, следовательно, в закаленном состоянии сталь более метастабильная. Поэтому достаточны относительно невысокий нагрев или небольшое время нагрева, чтобы вызвать распад такого раствора. При меньшей температуре аустенизации (1090 °С), повидимому, часть карбидов не растворяется, и после охлаждения эта сталь более структурно равновесна.
Данная закономерность на интерметаллиды не распространяет-
ся.
2.Предварительная холодная деформация аустенизированной стали ускоряет выделения карбидов и интерметаллидов.
3.Более высокое содержание углерода существенно влияет на области стабильности различных фаз на температурно-временной
диаграмме распада (см. рис. 23.188): карбиды М23С6 при старении появляются очень быстро, но формирование интерметаллидных фаз значительно замедляется (ср. рис. 23.188 и 23.187). В стали 316
λ- и χ-фазы появляются лишь после 100 ч старения, а σ-фаза − только после 1000 ч.
Карбиды М23С6. В карбиде часть атомов Сr замещается на атомы Fe и Мо, и примерный состав его в стали 316 − (Cr16Fe5Mo2)C6. Со-
403
став карбида и, следовательно, параметр его решетки существенно зависят от химического состава стали, температуры и времени старения. Например, в стали 316L с пониженным содержанием углерода параметр решетки возрастает с увеличением температуры старения, а в стали 316 с высоким содержанием углерода − при больших временах старения (табл. 23.76).
Таблица 23.76
Параметр решетки карбида М23С6 в Мо-содержаших коррозионно-стойких сталях в зависимости от температуры и времени старения
Сталь |
Термообработка |
Параметр решетки, нм |
02Х17Н13М3 (316L) |
650 °С, 1500 ч |
1,0569 ± 0,0002 |
|
815 °С, 15 ч |
1,0676 ± 0,0002 |
07Х17Н12М2 (316) |
815 °С, 15 ч |
1,0569 ± 0,0002 |
|
815 °С, 3000 ч |
1,0676 ± 0,0002 |
|
900 °С, 150 ч |
1,0676 ± 0,0002 |
06Х16Н16М2 (316) |
800 °С, 1000−10000 ч |
1,0680 |
Увеличение параметра решетки карбида связывают с возрастанием количества растворенных атомов Мо в решетке карбида М23С6, так как молибден имеет большой фактор размерного несоответствия с элементом, формирующим матрицу (в карбиде М23С6 − с хромом) (табл. 23.77).
При старении аустенизированной стали карбиды М23С6 выделяются в последовательности: вначале на границах зерен, некогерентных двойниковых границах, когерентных двойниковых границах и, наконец, в теле зерна (рис. 23.189), причем если в стали с малым содержанием углерода (316L) карбиды М23С6 располагаются в основном по границам зерен (рис. 23.190, а), то длительное старение стали с большим содержанием углерода (316) приводит к относительно равномерному выделению мелких частиц М23С6 в матрице на дислокациях (рис. 23.190, б), хотя цепочки дендридоподобных карбидных частиц присутствуют и на границах. Холодная деформация увеличивает скоростью зарождения карбидных частиц и ускоряет их рост. Это объясняется возрастанием мест их зарождения, а именно дислокаций и различных дефектов решетки кри-
404
сталла, а также повышенной диффузией в матрице, насыщенной дислокациями.
Ориентация внутризеренных частиц М23С6 по отношению к решетке аустенита следующая:
{100}γ || {100} M 23C6 , <100>γ || <100> M 23C6 . (23.54)
Таблица 23.77
Относительное несоответствие атомных радиусов основных и легирующих элементов при распаде твердых растворов аустенитных хромоникелевых сталей и сплавов с образованием
карбидных и интерметаллидиых фаз
|
|
Атомный ради- |
Атомный |
|
Фактор раз- |
||||
|
Формула |
ус элемента, |
радиус |
r−r0, |
мерного не- |
||||
Фаза |
формирующего |
входящего |
соответствия |
||||||
соединения |
матрицу выде- |
в фазу эле- |
нм |
|
|
r − r0 |
|
|
|
|
ε = |
|
|
,% |
|||||
|
|
ления, r0, нм |
мента r, нм |
|
|
|
|||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
r0 |
||
Fe |
− |
0,127 |
− |
− |
|
|
− |
||
Сr |
− |
0,128 |
− |
− |
|
|
− |
||
Ni |
− |
0,124 |
− |
− |
|
|
− |
||
Карбид |
(Cr,Fe,Nb,Mo)23C6 |
0,128 |
0,127; |
−0,001; |
|
0,8; |
|
|
|
|
|
|
0,140; |
0,012; |
|
9,4; |
|
|
|
|
|
|
0,147 |
0,019 |
|
14,8 |
|
|
|
σ |
FeCr |
0,127 |
0,128 |
0,001 |
|
0,8 |
|
|
|
|
Fe(Cr, Mo) |
0,127 |
0,128; |
0,001; |
|
0,8; |
|
|
|
|
|
|
0,140 |
0,013 |
|
10,2 |
|
|
|
|
Fe (Cr, W) |
0,127 |
0,128; |
0,001; |
|
0,8; |
|
|
|
|
|
|
0,141 |
0,014 |
|
11,0 |
|
|
|
λ |
Fe2(Mo, Nb) |
0,127 |
0,140; |
0,013; |
|
10,2; |
|
|
|
|
|
|
0,147 |
0,020 |
|
15,7 |
|
|
|
γ′ |
Fe2Ti |
0,127 |
0,145 |
0,018 |
|
14,2 |
|
|
|
|
Fe2W |
0,127 |
0,141 |
0,014 |
|
11,0 |
|
|
|
|
Ni3Al |
0,124 |
0,143 |
0,019 |
|
15,3 |
|
|
|
|
Ni3(Al, Ti) |
0,124 |
0,143; |
0,019; |
|
15,3; |
|
|
|
|
|
|
0,145 |
0,021 |
|
16,9 |
|
|
|
Фаза с |
NiNb2 |
0,124 |
0,147 |
0,023 |
|
18,5 |
|
|
|
решеткой |
|
|
|
|
|
|
|
|
|
Ni(Nb, Mo)2 |
0,124 |
0,147 |
0,023 |
|
18,5 |
|
|
||
типа М6С |
|
|
0,140 |
0,016 |
|
12,9 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
405
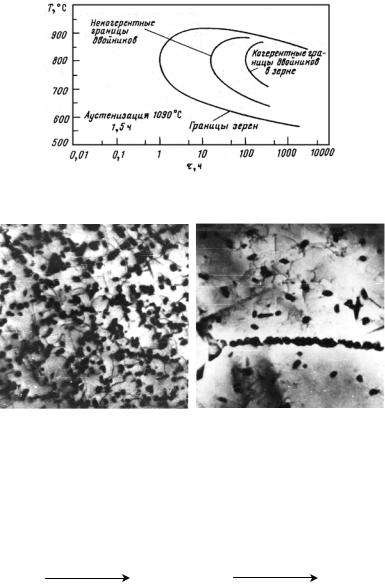
Рис. 23.189. Последовательность выделений карбида М23С6
в коррозионно-стойкой стали 316L, аустенизированиой при 1090 °С, 1,5 ч
|
1 мкм |
|
|
|
|
|
1 мкм |
|
|
а) |
|
|
|
б) |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 23.190. Морфология и распределение частиц карбида М23С6 в сталях 316L (а) и 316 (б) после старения при 650 °С в течение 1500 ч (a) и 3000 ч (б)
Карбид М6С. В карбиде часть атомов Сr замещается на атомы Мо, и примерный состав его в стали 316 (Сr3Мо3)С.
Частицы М6С формируются на поздних стадиях распада аустенита. Примерная реакция образования карбида М6С в стали 316 следующая:
+ Mo |
(Fe, Cr)21Mo2C6 |
+ Мо |
M6C. (23.55) |
М23С6 650 °C / 1500 ч |
|
σ-Фаза. В Fe−Cr−Ni сталях, содержащих легирующие элементы, например Мо, состав этой фазы выглядит как Fe(Сr, Мо) или (Fe,
406

Ni)(Cr, Mo), т.е. часть атомов Сr замещена атомами Мо, а атомов Fe − атомами Ni. Параметр решетки σ-фазы а существенно увеличивается с ростом температуры старения, а с практически не зависит от термообработки.
Области стабильности σ-фазы в стали 316 видны на рис. 23.187 и 23.188. Сначала σ-фаза появляется в тройных точках, затем по границам зерен, а при длительном старении при высоких температурах − на некогерентных границах двойников и, наконец, зарождается в зерне на оксидных включениях (рис. 23.191). Во многих исследованиях показано, что σ-фаза не зарождается гомогенно в аустенитной матрице.
200 нм
Рис. 23.191. Выделение σ-фазы в стали 316 после старения при 815 °С, 3000 ч
Холодная деформация стали перед старением ускоряет процесс образования σ-фазы. Ориентация частиц σ-фазы и аустенитной матрицы в основном произвольная, однако часто встречаются такие:
(111)γ || (001)σ и <011>γ || <140>σ. |
(23.56) |
χ-Фаза. Полагают, что χ-фаза имеет в составе растворенный углерод и может рассматриваться либо как интерметаллид, либо как карбид (см. табл. 23.75). Фаза χ встречается во многих сплавах пе-
407
реходных металлов, обычно она связана с σ-фазой и имеет ОЦК кристаллическую решетку типа α-Mn. В системе Fe−Cr−Ni−Мо параметр решетки этой фазы был определен примерно равным 0,892 нм, что соответствовало составу Fe36C12Mo10. Однако в зависимости от количества легирующих элементов, исходной термообработки и т.д. состав и параметр решетки выделения весьма сильно изменяются.
Области стабильности χ-фазы представлены на рис. 23.187 и 23.188. В низкоуглеродистой стали 316L, (см. рис. 23.187) выделение χ-фазы опережает образование σ-фазы, С-образная кривая ее существования распространяется в области более высоких температур, а процесс формирования χ-фазы продолжается дольше, чем образование карбидов. В высокоуглеродистой стали 316 (см. рис. 23.188) χ- и σ-фазы выделяются в одном и том же температурном интервале, однако при очень длительном старении.
С увеличением времени старения процесс выделения χ-фазы происходит в последовательности: образование ее на границах зерен и некогерентных двойниковых границах, а при длительной выдержке (более 100 ч) − в зерне. Морфология χ-фазы распространяется от прутикообразных до глобулообразных массивных частиц, похожих по внешнему виду на σ-фазу.
По некоторым данным предварительная холодная деформация ускоряет зарождение χ-фазы, причем выделение их происходит преимущественно в зерне в виде прутикообразных частиц, когерентных с матрицей. Часто χ-фаза образуется на плоских дефектах и вблизи карбидных частиц (рис. 23.192). Кристаллографическая ориентация частиц χ-фазы по отношению к аустенитной матрице определена как
(111)γ || (110)χ и <011>γ || <110>χ. |
(23.57) |
Фаза Лавеса (λ). Полагают, что главной причиной появления фазы Лавеса Fe2Mo является чисто геометрический фактор. Температурная область стабильности λ-фазы лежит ниже 850 °С (см. рис. 23.187). Фаза Лавеса выделяется в виде равноосных частиц или кластеров частиц в матрице, а также в виде отдельных частиц
408
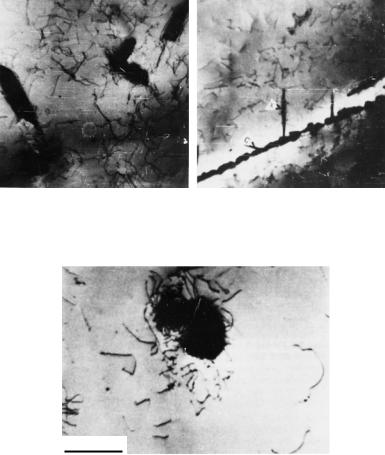
на границах зерен (рис. 23.193). Холодная деформация лишь незначительно ускоряет формирование фазы Лавеса. Повышение содержания углерода существенно задерживает ее появление (см.
рис. 23.188).
|
300 нм |
|
|
а) |
|
б) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 23.192. Морфология частиц χ-фазы в состаренной стали 316L:
а− прутикообразные выделения после старения 815 °С, 1500 ч;
б− зарождение χ-фазы на частицах M23C6 после старения 730 °С, 1500 ч
0,5 мкм
Рис. 23.193. Частицы фазы Лавеса в стали 316 L, состаренной при 730 °С, 1500 ч
Предполагаемые механизмы фазовой нестабильности коррози-
онно-стойких сталей типа 316. Схематическая диаграмма фазовых реакций при старении коррозионно-стойких сталей 316L и 316 при-
409
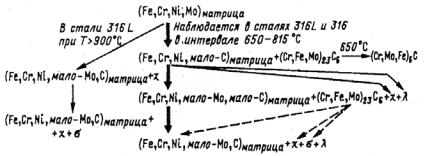
ведена на рис. 23.194. Процесс распада твердого раствора (аустенита) и формирования новых фаз можно представить следующим образом: сначала при температурах ниже 900 °С в результате пересыщения аустенитной матрицы углеродом выделяется карбид М23С6, а затем М6С, χ-, λ- и σ-фазы.
Рис. 23.194. Схематическая диаграмма фазовых реакций при старении коррозионно-стойких сталей 316 и 316L:
λ − (Fe2Mo); σ − (Cr, Mo)(Fe, Mo); χ − (Cr, Fe, Mo)18C
Формирование карбидов происходит быстро вследствие сегрегации карбидообразующих элементов вдоль мест первичного образования карбидов, а именно границ зерен, а также высокой диффузионной подвижности межузельного углерода. С уменьшением содержания углерода в твердом растворе начинается формирование χ- и λ-фаз, приводящее к обеднению матрицы хромом и молибденом. Замедление образования интерметаллидных фаз по сравнению с выделением карбидов может быть вызвано меньшей диффузионной подвижностью элементов, входящих в интерметаллидные фазы, чем элементов, составляющих карбид М23С6.
После выделения некоторого количества χ-, σ- и λ-фаз растворимость углерода в аустените, обедненном молибденом и хромом, возрастает, что приводит к обратному растворению части выделившихся карбидов М23С6 (см. рис. 23.194) и переводу его составляющих (Сr, Fe, Ni, Mo, С) в твердый раствор. Из-за низкой диффузионной подвижности металлических составляющих карбидов образуются локальные области, обогащенные Сr и Мо, которые,
410
в свою очередь, служат местами дальнейшего зарождения χ- и σ-фаз.
В малоуглеродистой стали (316L) интерметаллидные χ- и σ-фазы образуются непосредственно из матрицы на высокоэнергетических межфазовых границах при температуре старения Т ≥ 900 °С, когда концентрация углерода ниже предела растворимости. В высокоуглеродистой стали (316) предел растворимости углерода перемещается в область более высоких температур, расширяя интервал стабильности карбида. При температурах 800−850 °С образование интерметаллидов значительно заторможено вследствие того, что требуется достаточно времени для снижения концентрации углерода в матрице до уровня, позволяющего формирование этих фаз. Старение при температурах выше температуры стабильности карбида не приводит к формированию интерметаллидных фаз вплоть до очень длительных времен выдержки (τ ≥ 1500 ч), так как содержащийся в твердом растворе углерод предотвращает или сильно тормозит зарождение интерметаллидных фаз.
Сталь 0Х16Н15М3Б (ЭИ-847). В отличие от стали 1Х18Н9Т (и других близких композиций 0Х18Н10Т, 12Х18Н10Т и т.д.) в стали 09Х16Н15М3Б наблюдается только аустенит, отсутствует превращение δ ' γ при высокой температуре. Это обусловлено в основном повышенным содержанием Ni (примерно до 15 % по сравнению с 9 % в стали 1Х18Н9Т). От американской стали 316 отечественная сталь типа Х16Н15М3Б отличается добавкой Nb и большим содержанием Ni. Другая близкая модификация − это сталь Х16Н15М3БР, отличающаяся небольшой добавкой бора (см.
табл. 23.72).
В целом вид диаграммы распада и основные избыточные фазы стали 09X16Н15М3Б такие же, как и для рассмотренной выше ста-
ли 316 (см. рис. 23.187−23.189).
После аустенизации (при 1050−1200 °С в течение 0,5−1 ч, охлаждение в воде или на воздухе) твердый раствор пересыщен в отношении Cr, Mo, Nb, С и т.д. Однако наличие сильного карбидообразующего элемента (Nb) существенно влияет на структуру: в
411
сталях Х16Н15М3Б и Х16Н15М3БР сохраняются нерастворившиеся при температуре аустенизации первичные карбонитриды или карбонитробориды типа Nb(С, N) или Nb(С, N, В), что не наблюдалось в сталях 316 и 316L. Эти частицы чаще всего имеют вид кубов с округленными вершинами (размером 0,1−0,5 мкм), распределены преимущественно в зерне относительно равномерно по всей матрице.
Первичные карбонитриды сохраняются в структуре сталей длительное время практически неизменными и после дальнейших выдержек при температурах старения (выделения типа I на рис. 23.195). Изменение общего количества избыточных фаз в этой стали в зависимости от длительности старения приведено на рис. 23.196, а характеристики этих фаз − в табл. 23.78.
2 мкм
Рис. 23.195. Структура стали 09Х16Н15МЗБ после старения при 700 °С, 2000 ч (Ю.Н. Сокурский и др.)
Карбид М23С6 (выделения типа II на рис. 23.195). В отличие от стали 316 (без Nb) в стали 09Х16Н15М3Б, стабилизированной ниобием, сложный карбид М23С6 выделяется только по границам зерен (как и в малоуглеродистой стали 316L), образуя вдоль них вытянутые характерные цепочки. Выделения данной морфологии этого карбида могут привести к охрупчиванию стали, которое увеличивается по мере возрастания коэффициента заполнения границ.
412
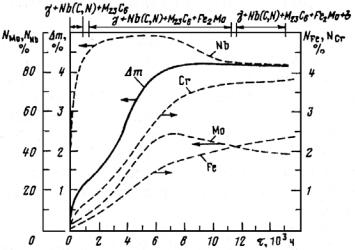
Кроме того, при невысоком отношении Nb/C формирование на границах карбидов М23С6 может привести к обеднению приграничных областей хромом, следовательно, к межкристаллитной коррозии этой стали в пароводяных и других агрессивных средах.
Рис. 23.196. Изменение общего количества избыточных фаз ( т)
в стали 09XI6H15МЗБ (массы осадка после электролитического растворения металлической матрицы) и количества Fe, Сr, Мо, Nb (соответственно NFe, NCr, NMo, NNb), перешедших в избыточные фазы, в зависимости от длительности старения при 650 °С (Ю.Н. Сокурский и др.)
Скорость коагуляции карбида М23С6 более чем в 30 раз превышает скорость коагуляции карбонитрида ниобия и фазы Лавеса. Процесс завершается образованием на границах зерен и в тройных точках крупных частиц М23С6, которые превращаются последова-
тельно в М6С, σ- и χ-фазы.
С течением времени количество Fe, Cr, Мо и Nb, перешедших в избыточные фазы, сильно меняется (см. рис. 23.196). Карбид хрома Cr23С6 растворяет некоторое количество Fe и Мо (см. табл. 23.78), в результате чего в стали типа Х16Н15МЗБ он обычно представляет собой карбид типа (Cr, Fe, Mo)23C6, а в стали Х16Н15МЗБР с бором
− (Cr, Fe, Mo)23(C, B)6.
413

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 23.78 |
|
|
Характеристика фаз в стали 09Х16Н15М3Б |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тип |
Параметры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Типичная |
Размер |
Фаза |
|
|
Состав фазы, % |
форма |
частицы, |
||||||||||||||||||
решетки |
решетки, нм |
|
|
||||||||||||||||||||
|
ГЦК |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
частицы |
мкм |
γ-фаза |
a=0,3560÷0,3595 |
|
|
|
|
С |
|
|
|
Cr Ni Mo |
− |
− |
|||||||||||
(матрица) |
|
|
0,06 |
16 15 |
|
|
3 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Nb |
|
|
|
|
|
|
||||
|
ГЦК |
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|||||
Nb(C, N) |
а=0,4360÷0,4437 |
|
|
|
|
Мо С N |
|
|
|
|
Куб с округ- |
0,1−0,8 |
|||||||||||
|
|
|
5 |
10 1 |
|
|
|
|
|
|
|
лыми верши- |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Nb |
|
|
|
|
нами |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
ГЦК |
|
|
|
|
|
|
остальное |
|
|
|
|
|
|
|||||||||
M23C6 |
а = 1,064 ÷ 1,069 |
|
|
|
|
Cr Fe Mo С |
Цепочки |
0,2−2 |
|||||||||||||||
|
|
|
60 23 12 |
|
|
|
5 |
|
|
вдоль границ |
|
||||||||||||
|
ГЦК |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зерен |
|
М6С |
a ≈ 1,09 |
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
Бесформен- |
>2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ные выделе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ния в тройных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
точках и на |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
границах зе- |
|
|
Гексаго- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рен |
|
λ-фаза |
а = 0,470÷0,476 |
|
Fe Cr |
|
|
|
|
|
Mo |
|
|
Nb |
|
Прутикооб- |
d=0,1÷0,5 |
||||||||
(Лавеса) |
нальная |
с = 0,766÷0,790 |
40 15 40÷35 5÷10 |
|
разная |
l=0,4÷2,0 |
|||||||||||||||||
|
(ГПУ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тетраго- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ-фаза |
а=0,8811÷0,8840 |
|
|
|
|
Сr |
|
|
|
|
|
Mo |
|
|
Ni |
|
Различные: от |
10 |
|||||
|
нальная |
с=0,4538÷0,4635 |
|
|
|
25÷28 |
5÷7 5÷7 |
|
|
прутикооб- |
|
||||||||||||
|
|
|
|
|
|
|
Nb |
|
|
|
|
|
Fe |
|
|
|
|
разных до |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глобуло- |
|
||||||
|
|
|
|
0,8÷1,2 остальное |
|
||||||||||||||||||
|
Сложная |
|
|
образных |
|
||||||||||||||||||
χ-фаза |
a = 0,889 ÷ 0,890 |
|
|
|
|
Сr |
|
|
|
|
|
Mo |
|
|
Ni |
|
То же |
10 |
|||||
|
кубиче- |
|
|
20÷21 |
|
|
12÷13 |
3÷5 |
|
|
|
||||||||||||
|
ская типа |
|
|
|
|
|
Nb |
|
|
|
|
|
Fe |
|
|
|
|
|
|
||||
|
α-Мn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
2 |
|
|
|
|
остальное |
|
|
||||||||||||||
|
ГПУ |
|
|
|
|
|
|
|
|||||||||||||||
CrS |
a ≈ 1,27; с ≈ 1,14 |
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
Пластинчатая |
− |
||||
Карбонитрид Nb(C, N) (выделения типа I на рис. 23.195). Как было отмечено выше, этот карбонитрид присутствует в структуре аустенизированной стали как первичное выделение. Особенностью стали Х16Н15М3Б по сравнению со сталью 316 при старении явля-
414
ется выделение в теле зерна вместо фазы М23С6 другой упрочняющей фазы − мелких частиц ( 0,05 мкм) вторичных карбонитридов ниобия Nb(C, N), которые зарождаются на дефектах структуры (дислокациях) в теле зерна. Эти выделения являются эффективной упрочняющей фазой. С течением времени небольшая часть атомов Nb замещается атомами Мо (см. табл. 23.78), в связи с чем карбонитрид в стали Х16Н15М3Б представляет собой (Nb, Mo)(C, N), а в стали Х16Н15М3БР − карбонитроборид (Nb, Mo)(C, N, B).
Карбид М6С (выделения типа V на рис. 23.195). Выделения этой фазы образуются после длительных выдержек по границам зерен, и особенно на тройных точках. В стали Х16Н15М3Б этот карбид может растворять Fe, Mo, Nb, немного Ni, в связи с чем его можно представить в виде (Cr, Fe, Mo, Nb, Ni)6C. Однако точный состав карбида М6С можно определить лишь для конкретной стали, конкретных температур и времени старения, так как в зависимости от этих параметров содержание элементов в карбиде М6С значительно изменяется.
Фаза Лавеса Fe2(Mo, Nb) (выделения типа III и IV на рис. 23.195). На более поздних стадиях старения в стали Х16Н15М3Б наблюдаются выделения прутикообразной формы, которые зарождаются на остаточных карбонитридах ниобия в виде вытянутых игл. С течением времени карбонитриды Nb(C, N) полностью обволакиваются фазой Лавеса и постепенно в ней растворяются. Выделения фазы Лавеса, так же как и мелких карбонитридов, в процессе старения практически не укрупняются, что делает их эффективной упрочняющей фазой, благотворно влияющей на длительную прочность стали.
Фаза Лавеса растворяет значительное количество Cr (см. табл. 23.78), в связи с чем в стали Х16Н15М3Б она имеет состав
(Fe, Cr)2(Mo, Nb).
σ-Фаза и χ-фаза (см. табл. 23.78). Количество σ- и χ-фаз в стали ЭИ-847 регламентированного состава даже после весьма длительного старения (более 1600 ч при 750 °С) не превышает 3−4 %, что не представляет опасности с точки зрения охрупчивания. Следует, однако, учесть, что скорость выделения этих фаз увеличивается при измельчении зерна и при переходе от аустенизированного со-
415
стояния к холодно-деформированному в тем большей степени, чем больше измельчение зерна и выше степень обжатия.
Морфология выделения σ- и χ-фаз была рассмотрена выше на примере стали 316. Их вид может распространяться от прутикообразных до глобулообразных массивных частиц (рис. 23.197). Обычно σ-фазу в сталях обозначают как FeCr. Однако она растворяет большое количество других элементов, поэтому состав σ- и χ-фаз в стали Х16Н15М3Б можно представить в виде (Fe, Ni)(Cr, Mo, Nb) с различным соотношением входящих в них атомов (см.
табл. 23.78).
1 мкм
Рис. 23.197. Выделения σ-фазы в стали 09Х16Н15М3Б, состаренной при 700 °С, 2000 ч
Кроме установленных точно и практически важных фаз в структуре состаренной стали типа Х16Н15М3Б может присутствовать и небольшое количество других выделений, которые, однако, не имеют практического значения в связи с их незначительным содержанием. Например, некоторые исследователи указывают на формирование выделений пластинчатой формы, идентифицированных как сульфид хрома CrS (см. табл. 23.78).
При высоких значениях отношений Nb/C > 6 в аустените остаются растворенными 20−25 % введенного Nb и, следовательно, имеется возможность выпадения ниобийсодержащих интерметаллидных фаз. Действительно, многие исследователи после старения этой стали в интервале 600−900 °С обнаружили образование феррониобида Fe3Nb. Количество Fe3Nb увеличивалось с повышением отношения Nb/C в стали.
416
Улучшение служебных характеристик и снижение стоимости гомогенных сталей обычно связывают с направлениями исследований, такими, как:
1)оптимизация состава, в частности частичная замена Ni на Мn
иN, использование различных видов термомеханических обработок (например, наклеп или другие виды горячей и холодной деформации);
2)регулировка размера зерна (например, при Т > 600 °С длительная прочность и сопротивление ползучести у крупнозернистых сталей выше, чем у мелкозернистых);
3)более широкое использование микролегирования бором и
РЗМ;
4)усовершенствование технологии выплавки, обработки давлением и режимов термообработки;
5)тщательная отработка и контроль технологии изготовления сталей;
6)контроль по вредным примесям и т.д.
Стали с карбидным упрочнением
Основу сталей с карбидным упрочнением составляет Cr−Ni или Cr−Ni−Mn-аустенит. Жаропрочные и технологические свойства сталей этого типа достигаются введением большого количества углерода (0,3−0,5 %) и комплексным легированием карбидообразующими элементами V, Nb, W, Mo и др. Относительно высокие жаропрочные свойства сталей этого типа (см. табл. 23.74) обусловлены двумя основными факторами: многокомпонентным легированием матрицы и субмикроскопической тонкой структурой, образующейся при выделении карбидных фаз.
Для обеспечения достаточного уровня сопротивления сталей к окислению все они содержат не менее 12 % Сr (см. табл. 23.72). Наиболее высокой жаропрочностью обладают чисто аустенитные стали (без наличия α-фазы), в связи с этим количество аустенитостабилизирующих элементов (С, N, Ni, Mn и др.) должно быть таким, чтобы при всех вариантах термической обработки обеспечивалось устойчивое аустенитное состояние.
417
Упрочняющими карбидными фазами в аустенитных сталях этого типа являются карбиды (карбонитриды) ванадия, ниобия и титана, а также карбиды хрома (М23С6 и М7С3). Так как карбиды TiC и NbC растворяются в аустените лишь при температурах выше 1200 °С, а температура нагрева сталей под закалку не превышает указанной температуры, то карбиды и карбонитриды TiC, Ti(C, N), NbC, Nb(C, N) слабо участвуют в дисперсионном твердении, присутствуя в сталях в основном в виде первичных выделений. Положительная роль этих фаз заключается в том, что они препятствуют росту аустенитного зерна при нагреве под закалку, и в частности образованию разнозернистости. Карбид VC наименее устойчив среди других монокарбидов типа МС и начинает растворяться в матрице при сравнительно низких температурах и уже выше 950−980 °С компоненты карбида полностью переходят в твердый раствор. При старении VC выделяется в высокодисперсном виде, образуя структуру, характерную для непрерывного распада, и благодаря устойчивой когерентной связи с матрицей в течение длительного времени сохраняет дисперсность, обеспечивая значительную долю упрочнения сталей при длительной эксплуатации.
Значительное упрочнение аустенитные стали приобретают в результате выделения из твердого раствора (при старении или эксплуатации при повышенных температурах) карбидов хрома. Основным карбидом на основе Сr является карбид М23С6 − сложный карбид переменного состава, который в широком интервале концентраций растворяет в себе Fe, Ni, V, W, Mo и др. (см. табл. 23.75
и 23.78).
Механические свойства, особенно длительная прочность и термическая стабильность, сталей данного класса зависят от температуры старения. При низкотемпературном старении (500−600 °С) упрочнение сталей за счет выделения карбидных фаз протекает медленно, но с образованием большого количества частиц высокой степени дисперсности. При этих режимах старения стали, несмотря на высокую прочность, имеют низкую пластичность, возрастает чувствительность к хрупкому разрушению, причем прочностные свойства при изотермических выдержках непрерывно увеличиваются. С повышением температуры старения скорость процессов
418
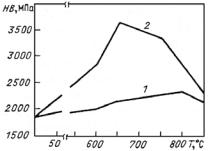
выделения и коагуляции возрастает, достигается определенный максимум упрочнения, положение которого зависит от состава стали (рис. 23.198). С целью получения наиболее выгодных с точки зрения служебных свойств сталей для них применяют старение при температурах на 100−150 °С выше, чем рабочая температура (стабилицация структуры), или двойное старение (низкотемпературное + высокотемпературное). При двойной термообработке применение низкотемпературного старения обеспечивает равно-
мерное выделение упрочняющих фаз; высокотемпературная стадия служит для снятия напряжений, возникающих на предыдущем этапе термообработки.
Рис. 23.198. Зависимость твердости сталей с карбидным упрочнением от температуры старения
при выдержке в течение 16 ч: 1 − сталь 37Х12Н8Г8;
2 − 37Х12Н8Г8МФБ
По сравнению с гомогенными сталями в сталях с карбидным упрочнением тонкое распределение второй фазы существенно повышает жаропрочность. Однако в ряде случаев это преимущество сохраняется только для кратковременного срока службы: при длительности эксплуатации более 100 ч избыточная упрочняющая фаза коагулирует, и тогда гомогенные стали по жаропрочности могут превзойти дисперсионно-твердеющие стали. Поэтому задача создания высокопрочных и жаропрочных сталей с карбидным упрочнением включает создание стали с максимальным инкубационным периодом выделения фаз и временем до начала их коагуляции. Один из основных путей − усложнение состава: чем сложнее карбидные фазы по составу, чем легированнее аустенит стали, тем больше эффект упрочнения при старении и медленнее разворачиваются процессы разупрочнения.
419
Стали с интерметаллидным упрочнением
Хромоникелевые стали с интерметаллидным упрочнением в отличие от сталей с карбидным упрочнением имеют ограниченное содержание углерода, обычно не более 0,1 % (см. табл. 23.72), чтобы не связывать легирующие элементы (Mo, W, Nb, Ti и др.) в карбиды, что привело бы к снижению жаропрочности. По этой причине для получения устойчивой γ-структуры стали должны содержать значительное количество Ni, сбалансированное с содержанием ферритостабилизирующих элементов.
Легирование сталей с интерметаллидным упрочнением преследует цель создания высоколегированного железоникелевого аустенита, обладающего склонностью к распаду при старении, для чего Fe−Сr−Ni-основу комплексно легируют элементами, упрочняющими твердый раствор и вызывающими дисперсионное твердение.
Оказалось, что чем выше содержание Ni, тем выше жаропрочность и технологичнее сталь в металлургическом производстве. Концентрация Ni в сталях этого типа доходит до 35−38 % (см. табл. 23.72). Более богатую никелем основу сплава можно легировать дополнительно сложным комплексом и давать легирующие элементы в большом количестве. Обычно для упрочнения вводят
10−30 % Сr, до 7 % Мо, до 6 % W, до 1,3 % Nb, до 0,5 % V, до
3,2 % Ti, до 3,2 % Аl, а также иногда Та и другие элементы. Кроме основных легирующих элементов, весьма сильно упрочняют Fe−Сr−Ni-аустенит элементы внедрения С, N и В, которые вводят, однако, в ограниченных количествах, так как при превышении оптимального их количества падает пластичность. Для повышения технологической пластичности в стали добавляют РЗМ и металлы группы IIа, которые связывают вредные примеси в стойкие соединения, выводя их тем самым из твердого раствора.
Из интерметаллидных фаз, используемых для дисперсионного упрочнения сталей, необходимо отметить важнейшие: γ′-фазу типа Ni3Al, β- и η-фазы типа Ni3Ti, фазы Лавеса типа Fe2Mo. На самом деле составы упрочняющих выделений в этих сталях изменяются в зависимости от легирования, в частности, фазы могут растворять
420
значительное количество других элементов и имеют вид:
γ′-(Ni, Fe)3(Al, Ti, Nb); фазы Лавеса Fe2(Mo, W) и др. Помимо этого значительную роль в формировании свойств сталей и сплавов могут играть бориды.
В связи с важностью жаропрочных сталей с интерметаллидным упрочнением в энергомашиностроении рассмотрим основные закономерности структурных превращений в процессе длительного старения на примере дисперсионно-твердеющей стали
04Х15Н35М2БТЮР (ЭП-150).
После аустенизации (нагрев при 1100 °С, 2 ч + охлаждение в воде) структура стали состоит из аустенитной матрицы (твердый раствор легирующих элементов в γ-Fe) и первичных карбидов или карбонитридов титана и ниобия (Ti, Nb)(C, N). Твердый раствор пересыщен в отношении легирующих элементов, т.е. при низких температурах (область I на рис. 23.199) имеет место метастабильный аустенит. Старение стали характеризуется многостадийностью структурных превращений, предшествующих выпадению равновесной интерметаллидной γ′-фазы типа Ni3(Ti, Al, Nb). Другой вторичной интерметаллидной фазой является фаза Лавеса (Fe, Cr)2(Mo, Nb). Выпадение γ′-фазы происходит в интервале температур 550−875 °С, причем максимальное количество ее отмечается при 650−750 °С. Фаза Лавеса выделяется в области более высоких температур − в интервале 650−950 °С, максимум ее наблюдается при 850 °С. Соответственно температура растворения γ′-фазы составляет примерно 875 °С, а фазы Лавеса − 950 °С (см. рис. 23.199).
Изучение микроструктурных изменений стали ЭП-150, подвергнутой старению при температуре интенсивного выделения интерметаллидных фаз (750 °С) длительностью от 0,25 до 5000 ч, свидетельствует о том, что при τ < 1 ч не наблюдается каких-либо видимых в ПЭМ структурных изменений. При выдержке длительностью 10 ч появляются высокодисперсные частицы сферической формы со средним диаметром d = 5,5 нм при объемной концентрации ρv ≈ 1,5 1022м-3, идентифицированные как γ′-фаза. Кроме того, на отдельных участках границ зерен наблюдаются относительно крупные выделения неправильной формы − фаза Лавеса типа Fe2Mo.
421
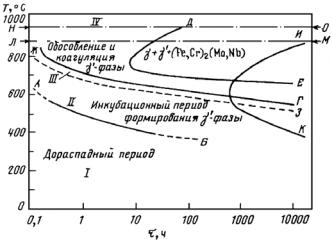
В
Рис. 23.199. Диаграмма структурных превращений дисперсионно-твердеющей стали 04Х15Н35М2БТЮР:
АБ − начало появления сегрегатов; ВГ − начало обособления γ′-фазы
Ni3(Ti, Al, Nb); ДЕ − начало выделения фазы (Fe, Cr)2(Mo, Nb); ЖЗ − начало образования когерентной γ′-фазы Ni3(Ti, Al, Nb); ИК − температурно-временная область (правее кривой) развитого распада твердого раствора; ЛМ − температура растворения γ′-фазы; НО − температура растворения фазы Лавеса;
I − метастабильный аустенит (γ) + первичные карбонитриды титана и ниобия (Ti, Nb)(C, N); II − область предвыделений γ′-фазы (от образования сегрегатов до начала образования γ′-фазы; III − заключительная стадия инкубационного периода и образование когерентной γ′-фазы; IV − стабильный аустенит
(γ) + (Ti, Nb)(C, N) (A.M. Паршин и др.)
С увеличением времени старения количество интерметаллидных фаз (масса осадка) возрастает. Так, в интервале времени от 25 до 5 103 ч количество γ′-фазы увеличивается от 5 до 8 %. При этом происходит коагуляция частиц: d возрастает от 10 до 100 нм, а ρv понижается от ~1022 до ~2,2 1020 м-3.
Типичная микроструктура состаренной стали ЭП-150 приведена на рис. 23.200. В структуре стали после старения при 750 °С длительностью 5 103 ч видны выделения γ′-фазы сферической формы, распределенные равномерно по всей матрице, и выделения фазы Лавеса в виде пластин, располагающихся по границам и внутри зерен.
422

2 мкм
Рис. 23.200. Микроструктура стали 04Х15Н35М2БТЮР после старения при 750 °С, 5000ч [сферические выделения γ′-фазы в зерне и пограничные выделения фазы Лавеса (Fe, Cr)2(Mo, Nb)]
Изменение параметров выделяющейся γ′-фазы в зависимости от времени выдержки при 750 °С показано на рис. 23.201. Зависимость размера частиц γ′-фазы от длительности старения при 750 °С может быть выражена эмпирическим соотношением
d = Aτ0,4, (23.58)
где d − средний диаметр выделений, нм; А − коэффициент, равный 14 нм/τ0,4; τ − длительность старения.
Рис. 23.201. Влияние длительности старения при 750 °С на размер d и плотность ργ′ выделений
γ′-фазы в стали
04Х15Н35М2БТЮР
423
Кривая АБ, соответствующая наиболее раннему температурновременному интервалу старения (см. рис. 23.199), характеризует начало распада пересыщенного твердого раствора. За начало распада принято образование сегрегатов, т.е. таких областей матрицы, которые имеют концентрацию основных легирующих элементов, формирующих избыточную фазу, более высокую, чем характерные для твердого раствора флуктуации концентрации. Размер сегрегатов составляет всего лишь около 1−2 нм. Обнаружить такие структурные неоднородности в ПЭМ сложно, так как, во-первых, эти величины d соответствуют почти пределу разрешения современных микроскопов и, во-вторых, такие сегрегаты не сильно отличаются от матрицы по структуре и слабо выделяются по контрасту. О наличии их обычно судят по эффекту аномального возрастания удельного электросопротивления в процессе изотермической выдержки.
Втаком случае на рис. 23.199 температурно-временную область II между кривыми АБ и ВГ следует рассматривать как область
предвыделения γ′-фазы, в которой протекает инкубационный период распада − от образования сегрегатов до выделения γ′-фазы. Область I левее кривой АБ следует принять за дораспадную, так как для нее характерны ничтожно малые скорости диффузии основных легирующих элементов, не позволяющие выявить образование концентрационных неоднородностей принятыми методами. Темпе- ратурно-временная область III между кривыми ВГ и ЖЗ характеризует заключительную стадию инкубационного периода распада аустенита − образование когерентной γ′-фазы.
Следующим этапом старения стали является коагуляция и обособление γ′-фазы, которая происходит в температурно-временной области между кривыми ВГ и ДЕ, причем когерентные часицы постепенно становятся не полностью (или частично) когерентными, затем некогерентными, т.е. решетка выделения полностью теряет связь с решеткой аустенита. Такие частицы легко могут быть вырваны из матрицы, например, репликой. Примером может служить микрофотография, представленная на рис. 23.200, где черные точки (показаны стрелкой) − сферические частицы γ′-фазы, вырванные из матрицы угольной репликой.
424
Одновременно в температурно-временной области ВГ−ДЕ происходят подготовительные процессы к выделению другого интерметаллида − фазы Лавеса (Fe, Cr),(Mo, Nb), а выпадение ее начинается на линии ДЕ. В температурно-временной области правее ИК завершаются структурные превращения − область развитого распада твердого раствора.
Полагают, что формирование хромистых карбидов типа М23С6 при старении стали 04Х15Н35М2БТЮР незначительно, так как весь углерод в этой стали связан в первичных карбидах (карбонитридах) титана и ниобия из-за высокого отношения (Ti + Nb)/C > 50.
Если в хромоникелевые стали вместо Nb ввести Ti, то картина фазовых превращений существенно меняется. Весьма сильное химическое взаимодействие между Ti и Ni приводит к образованию при старении фазы Ni3Ti, которая в зависимости от времени старения имеет кристаллическую ГЦК решетку, подобную решетке твердого раствора, или ГПУ решетку.
В сталях, содержащих большое количество сильных карбидообразующих элементов, хромистые карбиды типа М23С6 не образуются. Так, они не обнаружены в стали Х12Н20Т3Р и других аналогичных сталях, что обусловлено высоким содержанием титана, связывающего весь углерод в первичные карбиды (или карбонитриды).
Уровень длительной прочности при различных температурных испытаниях определяется составом упрочняющих фаз в стали. Например, выделения фаз различной природы в стали Х15Н25В5, содержащей порядка 0,08 % С и дополнительно легированной Al, Nb,
Mo, Ti, вызывают разную длительную прочность σ750дл o С при раз-
личных базах испытания (рис. 23.202). Видно, что в стали с интерметаллидным упрочнением наиболее выкокая жаропрочность обеспечивается при совместном выделении в структуре γ′-фазы и фаз Лавеса (А2В), а наименьшая − при упрочнении карбидами
М23С6.
Аустенитные стали с интерметаллидным упрочнением содержат повышенное количество Ni, однако замену его на Мn в сталях этого типа не проводят, так как Мn не образует благоприятных для
425
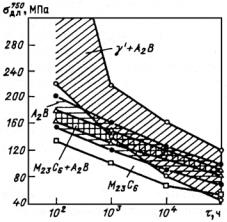
упрочнения интерметаллических фаз и понижает жаростойкость сталей.
Рис. 23.202. Длительная прочность при 750 °С стали типа 08X15Н25В5,
дополнительно легированной (0−2,2)% Аl, (0−2,0)% Ti, (0−2,5)% Nb, (0−2,24)% Mo в зависимости от типа основной упрочняющей фазы:
{ − γ′ + А2В; z − А2В; − М23С6; U − М23С6 + A2B, где A2B − фаза Лаевеса
Особенностью ТО сложнолегированных дисперсионно-упроч- няемых сталей является использование двойной закалки перед старением. Например, сталь 08Х15Н35ВТЮ, обладающую высокой жаропрочностью, при первой закалке нагревают до 1150−1180 °С для выращивания зерна определенного размера и перевода γ′-фазы в твердый раствор (см. табл. 23.74). Закалку проводят путем охлаждения на воздухе, при этом часть γ′-фазы выделяется. При нагреве под вторую закалку (1050 °С) небольшая часть γ′-фазы остается нерастворенной, кроме того, переходят в твердый раствор не все карбиды хрома. При 1050 °С вторая фаза укрупняется. При охлаждении на воздухе при повторной закалке и последующем старении γ′-фаза выделяется в виде дисперсных включений размером 20−50 нм. После полной ТО сталь 08Х15Н35ВТЮ состоит из четырех основных фаз: γ-твердого раствора, интерметаллида
γ′-(Ni, Fe, Cr)3(Al, Ti, W), карбида титана TiC и борида М3В2. В ре-
426

зультате двойной закалки со старением сталь наряду с мелкими включениями имеет определенный объем укрупненных выделений. Такая структура позволяет получить высокую прочность и необходимый запас пластичности. Если же двойную закалку не делать, то прочность и жаропрочность будут несколько выше, чем при одной закалке, но тогда сталь не будет иметь запаса пластичности и будет проявлять высокую чувствительность к надрезу.
Коррозионная стойкость аустенитных сталей
Аустенитные коррозионно-стойкие стали успешно применяют в качестве оболочек твэлов, ТВС и других элементов активной зоны в реакторах на быстрых и тепловых нейтронах. Одна из причин широкого использования аустенитных сталей в реакторостроении − их достаточно высокая коррозионная стойкость в теплоносителях.
Коррозионная стойкость в воде и паре. Коррозионно-стойкие аустенитные стали обладают высоким сопротивлением коррозии в воде и паре при высокой температуре. С повышением температуры воды от 100 до 200 °С скорость коррозии стали 1Х18Н9Т практически не изменяется (табл. 23.79), а повышение температуры от 200 до 300 °С увеличивает скорость коррозии почти в 10 раз. Повышение температуры до значений, соответствующих сверхкритическому состоянию (от 300 до 400 °С), приводит к уменьшению скорости коррозии стали почти в 5 раз. Дальнейший нагрев увеличивает скорость коррозии.
Таблица 23.79
Влияние температуры на скорость коррозии стали 1Х18Н9Т в обескислороженной воде и паре (время испытания 50 ч)
Условия испытаний |
Скорость |
Условия испытаний |
Скорость |
||
|
|
коррозии, |
|
|
коррозии, |
Температура, |
Давление, |
Температура, |
Давление, |
||
°С |
МПа |
г/(м2 сут) |
°С |
МПа |
г/(м2 сут) |
100 |
− |
0,019 |
400 |
10 |
0,042 |
200 |
1,5 |
0,019 |
500 |
10 |
0,09 |
300 |
8,7 |
0,20 |
|
|
|
427

Общая коррозия аустенитных сталей в дистиллированной воде при комнатной температуре протекает с кислородной деполяризацией1. С ростом температуры возрастает скорость разряда ионов водорода, и при Т = 300÷400 °С в деаэрированной воде коррозия протекает с водородной деполяризацией. При наличии в воде кислорода аустенитная сталь может корродировать с кислородной деполяризацией и при высокой температуре.
Содержание кислорода − одна из важнейших характеристик воды, применяющейся в качестве теплоносителя в ядерных реакторах. Кислород оказывает слабое влияние на развитие коррозии коррозионно-стойких сталей, однако он интенсифицирует такие виды разрушения, как межкристаллитная коррозия и коррозионное растрескивание под напряжением (КРН). Кроме того, кислород способствует увеличению продуктов коррозии. Для повышения надежности работы реакторных материалов в воде первого и второго контуров необходимо поддерживать концентрацию кислорода на низком уровне (0,01−0,02 мг/л).
Скорость коррозии аустенитных сталей в насыщенном паре практически равна скорости коррозии ее в воде при той же температуре.
В результате радиолиза окислительные свойства воды возрастают. Для нейтрализации вредного влияния кислорода и уменьшения продуктов коррозии целесообразно вводить водород, который, соединяясь с азотом, образует аммиак и тем самым повышает рН. С увеличением значения рН от до 11 скорость коррозии аустенитных сталей замедляется, а поступление в контур продуктов коррозии уменьшается до вполне допустимых пределов.
Скорость общей коррозии в воде в статических условиях при 280−350 °С составляет 0,8−4 мкм/год, а в пароводяной смеси при наличии кислорода при Т = 600 °С и р = 3,5 МПа она равна 5−10 мкм/год. Стали этого класса при высокой температуре достаточно устойчивы и к эрозионному воздействию воды при скорости движения до 10 м/с и пара при скорости до 150 м/с. Хотя в промышленных установках под действием радиации и при циркуляции
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. П. 7.3.9.
428
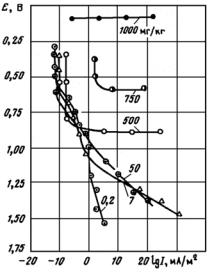
воды и пара скорость коррозии несколько повышается, но до Т = 600 °С аустенитные стали достаточно коррозионно-устойчивы.
Наличие в стали шлаковых включений, трещин, раковин, различных загрязнений и других неоднородностей может привести к развитию местной коррозии (язвенной, точечной или отдельными пятнами). Этот вид коррозионных повреждений особенно опасен для тонкостенных оболочек твэлов, так как образование отверстия в оболочке открывает доступ теплоносителя к ядерному топливу, что приводит к аварийному состоянию реактора. Различные неоднородности металла приводят к образованию микрогальванических коррозионных пар, следствием которого являются местная депассивация участков металла и их растравливание.
С увеличением концентрации ионов хлора в воде скорость коррозии (особенно местной коррозии) аустенитной стали возрастает, поскольку ионы хлора вызывают усиление процессов депассивации поверхности металла (рис. 23.203) и уже при стационарном потенциале начинается растворение в области перепассивации.
Рис. 23.203. Анодные кривые стали 1Х18Н9Т в воде с различным содержанием ионов хлора
429
С увеличением концентрации ионов хлора в растворе область пассивности сокращается, и при концентрации 1000 мг/кг хлоридов металл переходит полностью в активное состояние. Поэтому допустимое количество хлоридов в реакторной воде не должно превышать 0,1 мг/кг.
Если в растворе присутствует значительное количество кислорода, то за счет увеличения скорости катодного процесса стационарный потенциал смещается в положительную сторону, и область пассивации еще больше сокращается. При этом увеличивается в значительной степени скорость растворения металла и коррозия становится язвенной.
Легирующие элементы (Ti, Nb, Mo) оказывают незначительное влияние на скорость коррозии аустенитных сталей в воде критических параметров. Повышение содержания Ni до 20 % практически не отражается на коррозионной стойкости аустенитной стали.
Одним из опасных местных повреждений является щелевая коррозия, развивающаяся в зазорах и щелях между деталями (в шари- ко-подшипниках циркуляционных насосов, воздуходувках, электромагнитных устройствах, в местах заклепок и др.). Щелевая коррозия появляется в результате действия коррозионного тока, возникающего при различной концентрации металлических ионов в электролите внутри щели и вне ее, а также при различной концентрации кислорода внутри щели и за ее пределами.
Изучение влияния присутствия кислорода в воде при 260 °С в системе втулка−вал показало, что щелевая коррозия становится значительной уже при концентрации кислорода 10-6 м3/кг в зазоре 0,05 мм. В воде, содержащей 10-7 м3/кг кислорода, щелевая коррозия весьма незначительна. С увеличением зазора скорость коррозии уменьшается и при 0,12−0,15 мм становится сравнимой со скоростью коррозии в объеме электролита.
Введение водорода в воду значительно уменьшает коррозию вследствие снижения отрицательного влияния кислорода. Предполагается, что концентрация водорода в воде от 2,5 10-5 до 5 10-5 м3/кг вполне достаточна для предупреждения щелевой коррозии. Установлено, что высокое значение рН (10−11) оказывает замедляющее влияние аналогично добавкам водорода.
430
Межкристаллитная коррозия. Межкристаллитная коррозия
(МКК) − один из наиболее опасных видов местной коррозии аусте-
нитных коррозионно-стойких сталей и сплавов. Проявляется она в том, что границы зерен металла подвергаются в воде, паре и различных электролитах избирательному разрушению и металл, часто без каких-либо видимых изменений, в течение короткого времени теряет прочность и пластичность.
Сущность МКК состоит в том, что выдержка этих сталей при Т = 450÷850 °С приводит к выпадению по границам зерен хромосодержащих вторичных фаз − карбидов (карбонитридов), σ-фазы, интерметаллидов. Это приводит к обеднению приграничных областей хромом. С помощью радиоактивного изотопа 51Сr было показано, что ширина обедненной хромом зоны вдоль границ зерен хромоникелевой стали после закалки и старения в температурной области, в которой проявляется склонность к МКК, может достигать
1−2 мкм.
На первых этапах испытания в электролитах (растворах кислот и др.) разрушаются наиболее обедненные хромом участки. Например, было установлено, что после испытаний в течение 24 ч растворились участки, содержащие 6−8 % Сr (всего в стали содержалось 18 % Сr). С увеличением продолжительности испытания разрушаются и более богатые хромом зоны вдоль границ зерен (после 48 ч испытания растворялись участки, содержащие до 12−15 % Сr). Таким образом, локальные объемы γ-твердого раствора по границам зерен, обедненные хромом, перестают быть стойкими к электрохимической коррозии. Наиболее интенсивно МКК в аустенитной стали протекает в интервале Т = 550−650 °С.
Особые требования к устойчивости против МКК предъявляют к хромоникелевым коррозионно-стойким сталям и сплавам, применяемым в ядерных энергетических установках для работы в контакте с водой и паром при высокой температуре. Выход из строя различных узлов и деталей реакторных установок, нарушение герметичности системы, разрушение тонкостенных оболочек твэлов, стенок сильфонов и другие неисправности могут привести к тяжелым авариям.
431
В течение длительного времени считалось, что вода и пар даже при высокой температуре не являются настолько агрессивными средами, чтобы вызвать МКК хромоникелевых коррозионностойких сталей и сплавов. Однако это не так. Хотя часто этот процесс развивается медленно, но при определенных условиях разрушение границ зерен может стать значительным.
Отмечается, что сталь с повышенным содержанием углерода более чувствительна к МКК, так как при 550−650 °С углерод интенсивно диффундирует к границам зерен и связывает Сr из приграничных областей твердого раствора в карбиды. Это согласуется с «карбидной» теорией МКК. Для уменьшения этой склонности стремятся снизить содержание углерода в стали до предела его растворимости при 20 °С (примерно до 0,01 %) (например, стали 00Х18Н18Т, 00Х16Н15М3Б). Тем не менее такие стали с низким содержанием углерода не всегда обеспечивают стойкость против МКК.
Увеличение содержания хрома должно приводить к обратному эффекту. По мере увеличения времени выдержки при отпуске (старении) пониженное содержание хрома в локальных объемах вокруг карбидов не остается постоянным. Происходит его перераспределение из объемов зерен к границам, и склонность к МКК снижается. Однако при температуре отпуска до 650 °С скорость диффузии хрома в ГЦК решетке еще мала, и поэтому преимущественное значение приобретает скорость выделения карбидов. При температуре выше 650 °С диффузия хрома из внутренних зон зерна все быстрее компенсирует его убыль в периферийных зонах при образовании карбидов.
Вотличие от аустенитных сталей ферритные и ферритномартенситные стали при 650 °С значительно меньше подвержены МКК, поскольку в ОЦК решетке при этой температуре скорость диффузии хрома высока, и одновременно с выпадением хромосодержащих выделений по границам будет происходить диффузионное выравнивание концентрации хрома в приграничной зоне.
Внастоящее время накоплен большой экспериментальный материал, подтверждающий справедливость карбидной теории обеднения границ зерен хромом: МКК хромоникелевой стали является
432
следствием разрушения границ зерен, обедненных хромом, являющихся анодами при электрохимической коррозии.
Карбидная теория становится более совершенной, если, кроме состава, учитывать также распределение и структуру карбидов. Широкое применение современных физических методов исследования (электронная микроскопия, электронное микрозондирование, микрорадиография) позволило установить, что склонность аустенитных коррозионно-стойких сталей к МКК связана с появлением по границам зерен тонких дендритных выделений карбидов хрома. Количество таких карбидов зависит от степени разориентации двух соседних кристаллитов. Одно из наиболее характерных свойств дендритных карбидов − исключительно высокая скорость их роста в плоскости соприкосновения между зернами. Поскольку разрушение металла вокруг карбидных частиц является процессом электрохимическим, в котором карбид играет роль катода, то межкристаллитное разрушение и должно существенно зависеть от морфологии карбидов.
Расположение карбидов по границам зерен в виде непрерывных взаимосвязанных или слаборазобщенных частиц обеспечивает проникновение коррозионной жидкости по границам зерен. Если частицы изолированы друг от друга, то коррозия не может пойти в глубь металла (рис. 23.204). Карбидные частицы в виде дендритных пластин появляются преимущественно при низкотемпературном отпуске (450−650 °С) (это наблюдалось, например, в стали Х18Н9 с 0,038 % С), и коррозионная среда может легко проникать в металл.
Рис. 23.204. Схема межкристаллитного расположения карбидов в стали, склонной (а) и не склонной (б) к межкристаллитной коррозии
433
При 700−850 °С карбиды выпадают в основном в виде изолированных дендритов, причем с повышением температуры количество пластинчатых выделений уменьшается. В этом случае МКК появляется только на небольшом числе границ зерен. С увеличением времени нагрева пластинки постепенно превращаются в цепочку разобщенных частиц; непрерывность между ними, необходимая для проникновения коррозионной среды, нарушается и исчезает склонность к МКК.
Обедненные хромом зоны в хромоникелевых коррозионностойких сплавах могут возникнуть и в результате выделения таких фаз, как σ-фаза (FeCr), которая образуется в хромоникельмолибденовых сталях после отпуска при 650−850 °С. Появление обедненных хромом зон при выделении на границах зерен σ-фазы доказано экспериментально.
Причиной появления у аустенитных коррозионно-стойких сталей склонности к МКК может быть, по-видимому, и выделение хромистого феррита, приводящее к обеднению границ зерен хромом. По мнению некоторых исследователей, МКК аустенитных хромоникелевых коррозионно-стойких сталей возникает не в результате обеднения хромом прилегающих к карбидам участков металла, а является следствием работы локальных микроэлементов, состоящих из карбидов и аустенита. Работа таких локальных элементов ограничивается зоной, непосредственно прилегающей к карбидам. Однако теория локальных элементов недостаточно обоснована и встречает серьезные возражения.
Аустенитостабилизирующие элементы (Ni, Mn, N, С) в аустенитных сталях либо не влияют на склонность их к МКК (Ni, Mn), либо увеличивают ее (С, N).
Повышение содержания ферритостабилизирующих элементов (Cr, Si, Mo и др.) в некоторых случаях способствует пассивации обедненных границ и тем самым увеличивает стойкость аустенитных сталей к МКК. Однако такой способ борьбы с этим видом разрушения не является радикальным.
Наиболее распространенным способом предотвращения МКК является легирование (стабилизация) сталей сильными карбидообразующими элементами − титаном или ниобием. При их введении
434
в сталь углерод связывается в карбиды типа МС, которые в отличие от карбидов хрома почти не растворяются в аустените при температуре закалки (1050−1100 °С). В стабилизированных сталях содержание свободного углерода, т.е. не связанного в карбиды Ti и Nb, мало и не превышает растворимости углерода в аустените при комнатной температуре. Этим самым предотвращается выделение карбидов хрома по границам зерен при отпуске или старении. Количество вводимого Ti или Nb должно соответствовать стехиометрическому составу карбидов: для Ti не ниже 5 (С − 0,03 %), для Nb − не ниже 10 (С − 0,01 %); в данном случае С − концентрация углерода, выраженная в процентах. Наибольшее промышленное применение нашли стали, легированные титаном (1Х18Н10Т и др.). Однако титан при сварке в отсутствие защитной среды сильно окисляется. Поэтому сварные швы обычно легируют ниобием (электроды из хромоникелевониобиевой стали) и тогда, когда сталь содержит титан.
Если сталь легирована азотом (обычно азот добавляют в хромомарганцевые стали для расширения аустенитной области), то стабилизировать ее следует ниобием, так как Ti расходуется на образование нитридов. Для изготовления особо тонкостенных труб толщиной не более 0,5 мм также следует применять стали, легированные Nb (например, типа Х16Н15М3Б), так как Ti может давать карбиды, размеры которых могут быть почти соизмеримы с толщиной стенки трубы.
Стойкость аустенитных коррозионно-стойких сталей к МКК существенным образом зависит от термической обработки. Влияние температуры и продолжительности термической обработки на восприимчивость их к МКК можно охарактеризовать температур- но-кинетическими кривыми (рис. 23.205). Вид кривых зависит от состава сталей. При постоянной температуре с увеличением продолжительности нагрева склонность стали к МКК сначала растет, достигает максимума, затем уменьшается и наконец исчезает.
Склонность аустенитных сталей к МКК возрастает с повышением температуры закалки до 1300 °С. В этом случае почти полностью переходят в твердый раствор все карбиды. Последующий нагрев в интервале температуры 450−850 °С способствует выделе-
435
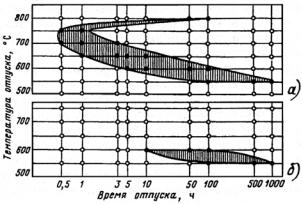
нию, в первую очередь, карбидов хрома. Длительный нагрев при 850−950 °С приводит к полному выделению и коагуляции карбидов. Поэтому он используется как метод борьбы с МКК аустенитных сталей (стабилизирующий отжиг). Суть стабилизирующего отжига заключается в том, что максимальное количество углерода связывается в карбиды; приграничные области зерен при этом обедняются хромом, однако при 800−900 °С скорость диффузии Сr достаточно велика, и вследствие диффузии его из объема зерна к границам концентрация Сr у границ увеличивается и сталь становится стойкой к МКК.
Рис. 23.205. Температурно-кинетические кривые, характеризующие склонность коррозионно-стойких сталей 0Х23Н28М3ДЗТ (а) и Х18Н10Т (б)
кмежкристаллитной коррозии. Заштрихованные площади − области максимальной чувствительности к межкристаллитной коррозии
Наблюдаются случаи, когда сталь с Ti и Nb после длительной эксплуатации при Т = 500−600 °С оказывается все-таки подверженной МКК. В связи с этим вместо закалки в некоторых случаях рекомендуется проводить стабилизирующий отжиг при 850−900 °С с последующим охлаждением в воде или на воздухе. Смысл этой обработки заключается в том, что из твердого раствора выделяется только карбид титана, в то время как при отпуске до температуры 800 °С (после высокотемпературной закалки) выделяется преиму-
436
щественно карбид хрома. Для обеспечения стойкости аустенитной стали к МКК следует увеличивать отношение Ti/C в стали и при длительной эксплуатации в интервале 500−700 °С отношение содержаний Ti и С должно быть Ti/C = 10−17.
Выпадение карбидов и обеднение границ зерен хромом происходят при нагреве стали в процессе сварки. Нагрев стали до 550−650 °С происходит в околошовной зоне, которая чаще всего и становится склонной к МКК.
В стали, склонной к МКК, последняя интенсивно развивается в кислых средах при повышенной температуре. При температуре выше 100 °С и высоком давлении МКК развивается при наличии в воде и паре кислорода более 0,1−0,3 мг/кг. В деаэрированной воде и паре МКК не развивается на сталях, склонных к ней, при испытаниях по стандартному методу, так же как и в аэрированной воде при температуре ниже 100 °С.
Большое влияние на развитие МКК оказывают растягивающие напряжения, по значению близкие к пределу текучести стали или превышающие его. Разрушение может наступить даже в таких средах, в которых без растягивающих напряжений аустенитные стали не корродируют.
Влияние холодной деформации перед отпуском на склонность аустенитных сталей к МКК в значительной мере зависит от состава стали, который определяет скорости диффузии хрома и углерода и возможность образования ферритной фазы. Деформация после отпуска всегда уменьшает склонность аустенитных сталей к МКК, так как дробление зерен и нарушение непрерывности границ зерен препятствует проникновению разрушения в глубь металла.
Коррозионное растрескивание под напряжением (КРН). Ау-
стенитные коррозионно-стойкие стали при совместном воздействии на них механических напряжений и коррозионно-агрессивной среды подвергаются особому виду разрушений − КРН. Опасность коррозионного растрескивания заключается в том, что за сравнительно короткое время металл, практически не затронутый общей коррозией, поражается сквозными трещинами и разрушение происходит внезапно, без предварительных видимых изменений детали. Опыт эксплуатации водоохлаждаемых реакторов показывает,
437
что наиболее часто выходят из строя парогенераторы, теплообменники, оболочки твэлов кипящих реакторов с перегревом пара и др. В большинстве случаев причиной таких разрушений было несоблюдение водного режима и, в частности, повышенное содержание хлоридов и кислорода в воде, а также наличие остаточных или действующих напряжений.
КРН возникает при одновременном действии растягивающих напряжений и корродирующей среды. Возможность КРН установлена для многих технических материалов (алюминиевых и магниевых сплавов, углеродистых и малолегированных сталей, коррози- онно-стойких сталей, никелевых сплавов). Различие заключается лишь в составе агрессивных сред и в величине действующих растягивающих напряжений.
Коррозионно-стойкие аустенитные стали наиболее сильно подвержены так называемому хлоридному КРН в растворах хлоридов железа, магния, цинка, кальция, лития и др. Исследования большого числа твэлов, вышедших из строя по причине КРН, показывают, что наиболее опасными в этом отношении являются хлориды железа. КРН проявляется в виде трещин, скорость распространения которых зависит от состава и параметров коррозионной среды. Трещины могут развиваться от поверхности в глубь металла, проходя по телу зерен (транскристаллитное разрушение) и по границам зерен (межкристаллитное разрушение). КРН зависит от многих факторов − напряжения, состава среды, температуры, длительности воздействия среды, структуры и состава металла, степени пластической деформации (наклепа), характера защитных пленок на металле и др.
Для снижения склонности аустенитной стали к КРН необходимо обеспечить полное снятие наклепа. Растягивающие напряжения от наклепа, складываясь с растягивающими действующими (рабочими) напряжениями, могут резко усилить растрескивание.
Характер КРН аустенитных сталей макроскопически во многом аналогичен механическому разрушению хрупких металлов. Напряженная сталь в хлоридсодержащей среде растрескивается еще до появления заметной пластической деформации без образования типичной для пластического разрушения шейки. Трещины распро-
438
страняются в направлении, перпендикулярном к направлению растягивающей нагрузки (рис. 23.206), что характерно для хрупкого разрушения отрывом. Сам вид трещин во многих случаях таков, как будто они образовались в результате мгновенного разделения прилегающих слоев атомов (скорость распространения трещины достигает нескольких мм/ч). К тому же на поверхности стали, в том числе и у самой трещины, часто нет видимых продуктов коррозии и других признаков общего коррозионного разрушения.
Рис. 23.206. Схематическое изображение трещины при коррозионном растрескивании аустенитной стали:
К − катод; А − анод (стенки недеформируемого металла); А* − анод (вершина деформируемого металла, j ≈ 5 103 А/м2); р − направление приложения нагрузки
Естественно, возникает вопрос: каким образом химическое воздействие может приводить к хрупкому разрушению такого пластичного материала, как аустенитная коррозионно-стойкая сталь? В настоящее время механизм КРН полностью не выяснен. Есть несколько гипотез, которые объясняют многие наблюдаемые экспериментальные факты. Наибольшее распространение получила так называемая механико-химическая гипотеза. Сущность ее в том, что при пластическом деформировании металла в вершине развивающейся трещины, вызываемой концентрацией напряжений в этой области, настолько усиливается анодное растворение металла по сравнению с ее ненапряженными боковыми стенками, что трещина распространяется вглубь со скоростью 0,5−2,5 мм/ч. Катодом коррозионной ячейки является поверхность металла, катодным деполяризатором − растворенный кислород (см. рис. 23.206).
При деформации анодное растворение металла усиливается. Так, при исследовании стали типа 18−10 в кипящем растворе MgCl2
439
с помощью потенциостатического метода на деформированных образцах обнаружено повышение скорости анодного растворения более чем в 104 раз (по сравнению с недеформируемым металлом) при одном и том же значении потенциала. Вместе с тем у сплавов на основе Fe−45 % Ni, не склонных к коррозионному растрескиванию, анодное растворение возрастало лишь в 10 раз.
Такое различие обусловлено неодинаковым числом активных центров растворения, возникающих в процессе пластической деформации. Кроме того, достоверно установлено расклинивающее действие продуктов коррозии в трещинах или надрезах на аустенитных коррозионно-стойких сталях в растворах хлоридов.
Более тщательные исследования, проведенные в последнее время, показали, что зарождение и распространение трещин при КРН происходит на участках поверхности напряженного металла, со-
держащих определенные группировки дислокаций. Сначала на спла-
вах меди, а затем и на аустенитных сталях было выяснено, что склонность к внутрикристаллическому коррозионному растрескиванию − характерная черта однофазных сплавов с четко выраженной компланарной (плоскостной) дислокационной структурой. Такая структура типична для материалов с низкой энергией дефектов упаковки (рис. 23.207, а). Дислокации в них легко расщепляются, удерживаясь в первоначальной плоскости скольжения, а поперечное скольжение дислокации затруднено.
Стали с ячеистой дислокационной структурой (рис. 23.207, б). обладают повышенной стойкостью к внутрикристаллическому коррозионному растрескиванию. Образование ячеистого распределения дислокации типично для неупорядоченных материалов с высокой энергией дефектов упаковки, в которых облегчено поперечное скольжение.
Стойкость аустенитных хромоникелевых сталей к хлоридному КРН возрастает с увеличением содержания Ni более 10−14 % (рис. 23.208), так как он заметно влияет на распределение дислокаций в аустените, повышая энергию дефекта упаковки и облегчая поперечное скольжение.
440
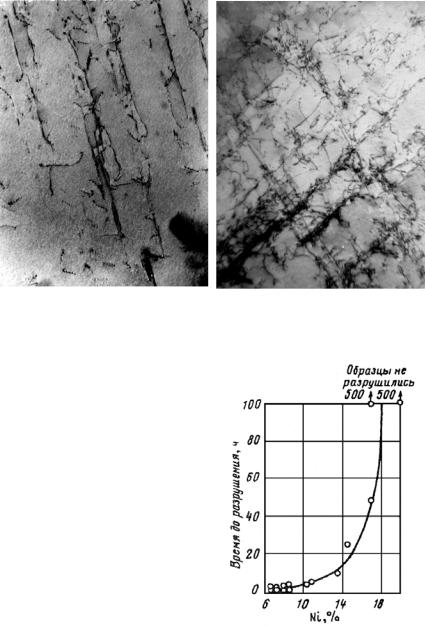
|
0,5 мкм |
|
|
|
|
|
0,3 мкм |
|
|
||
а) |
|||||||||||
|
|
|
б) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 23.207. Компланарное расположение дислокаций в аустенитной стали (а) и ячеистое расположение в никелевом сплаве (б) после растяжения на 5 %
Рис. 23.208. Влияние содержания Ni в аустенитной коррозионно-стойкой стали (17−18% Сr) на склонность
еек коррозионному растрескиванию
вкипящем растворе MgCl2
при σ = 2,8 МПа
441
Стойкость к КРН возрастает также при снижении концентрации Cr при постоянном содержании Ni, a также при уменьшении со-
держания элементов, способствующих образованию аустенита
(С, N) до 0,002 %. Легирование ниобием, титаном или молибденом, повышая энергию дефектов упаковки аустенита, также уменьшает склонность к КРН.
Многочисленные исследования, подтверждая влияние дислокационной структуры на развитие КРН, приводят к выводу о том, что это необходимый, но недостаточный признак восприимчивости к хлоридному внутрикристаллическому коррозионному растрескиванию. По-видимому, механизм этого явления более сложен. Для КРН аустенитных сталей обычно недостаточно присутствия в коррозионной среде одних хлоридов − должны присутствовать одновременно хлориды и кислород, т.е. большую роль в коррозионном растрескивании аустенитных коррозионно-стойких сталей играет состав коррозионной среды. Опасные концентрации хлор-иона и кислорода, при которых возникает КРН, в водных средах взаимосвязаны. В частности, чем чище вода по хлор-иону, тем более высокое содержание кислорода необходимо для КРН, а чем меньше кислорода присутствует в воде, тем большая концентрация хлоридов безопасна. Для КРН важна не столько концентрация кислорода, сколько сам факт его присутствия. Так, при концентрации кислорода 1 мг/кг в присутствии в воде хлоридов наблюдается КРН, которое не испытывает резкого усиления с увеличением концентрации кислорода до 1200 мг/кг.
С увеличением содержания в растворе хлоридов уменьшается область пассивации таких сталей (см. рис. 23.203): при содержании в растворе 1000 мг/кг хлоридов стали переходят в активное состояние и образцы полностью разрушаются.
В настоящее время известно, что КРН аустенитных сталей может происходить и в водяном паре − насыщенном, перегретом, закритическом − опять-таки в присутствии хлоридов и кислорода. Но наиболее опасными в отношении КРН являются участки металла, подверженные попеременному увлажнению и высушиванию, т.е. местному упариванию. В ядерных энергетических реакторах используют в качестве теплоносителя воду высокой чистоты. Реак-
442
торная и подпиточная вода строго нормируется по содержанию хлор-иона. Но, несмотря на малые нормируемые значение содержания хлоридов в реакторной воде (от 0,1 до 0,5 мг/кг) и в воде парогенератора (0,5−1 мг/кг), в некоторых местах (места заделки труб парогенератора в трубные доски, участки с вялой циркуляцией и т.п.) может возникнуть упаривание и повышение содержания хлоридов до опасных с точки зрения КРН концентраций.
В прямоточных парогенераторах с давлением 3−5 МПа растворимость солей в паре мала. В связи с этим происходит накопление хлоридов в воде в зоне испарения. Это исключает создание прямоточного парогенератора со средними параметрами пара из аустенитных коррозионно-стойких сталей.
Для р > 18 МПа вследствие быстрого увеличения растворимости хлоридов в паре их концентрация в воде не превышает допустимых значений. Следовательно, прямоточные парогенераторы, в которых теплообменник выполнен из аустенитной стали, целесообразно создавать только на высокие давления.
КРН начинается лишь при наличии растягивающих внешних или внутренних напряжений. По своему происхождению эти напряжения могут быть самыми различными: механическими, гидростатическими, термическими, фазовыми, технологическими. С ростом растягивающих напряжений хлоридное КРН аустенитных сталей, как правило, ускоряется. На развитие КРН сильно влияет и пластическая деформация, которая, хотя бы в микрообъемах, повидимому, является необходимым условием коррозионного растрескивания.
Присутствие в воде щелочей может в определенных условиях вызывать КРН аустенитных сталей и сплавов (щелочная хрупкость). Она может развиваться и в отсутствие кислорода. Природа этого разрушения еще не выявлена. Щелочная хрупкость может наблюдаться, например, в местах упаривания, где происходит увеличение содержания щелочи в 10 раз и более. Введение щелочей в воду первого и второго контуров атомных и тепловых электростанций обычно уменьшает общую коррозию узлов из нелегированных и малолегированных сталей и снижает переход в воду продуктов коррозии. Однако в этом случае конструкции из коррозион-
443
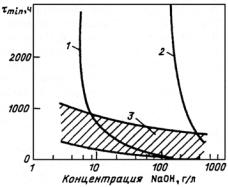
но-стойких сталей и сплавов, работающие в горячей щелочной воде, подвергаются опасности КРН.
Известно несколько крупных аварий изготовленного из аустенитных коррозионно-стойких сталей оборудования ядерных и обычных энергетических установок, вызванные КРН в присутствии щелочей, специально введенных или случайно попавших в водный теплоноситель.
Поскольку зарождение и развитие процесса КРН обусловлено совместным действием двух факторов − механического и коррозионного, различные способы защиты от этого вида разрушения должны основываться на ослаблении или полном исключении хотя бы одного их этих факторов: уменьшении концентрации напряжений; повышении степени чистоты обработки поверхности; снятии остаточных напряжений путем термической обработки; применении защитных покрытий (никелем и другими металлами и сплавами), устраняющих действие коррозионного фактора; специальной обработке коррозионной среды (уменьшении концентрации хлоридов, кислорода) и других мероприятий. Существенное значение приобретает правильный выбор тепловой схемы ЯЭУ и правильных конструктивных решений ее элементов. Немаловажное значение имеет также выбор состава конструкционного материала.
Рис. 23.209. Влияние состава щелочной среды (концентрация NaOH)
при 350 °С на минимальное значение времени до образования
трещины глубиной 100 мкм (τmin) в С-образных образцах:
1 − аустенитная сталь типа 316;
2 − инконель-800;
3 − инконель-600 (заштрихованная область)
Так, из представленных на рис. 23.209 данных, характеризующих чувствительность трех материалов трубопроводов к КРН в зависимости от концентрации щелочи в воде, видно, что наибольшей
444

стойкостью к коррозионному растрескиванию обладает сплав ин- конель-800 (типа 02Х21Н34). Аустенитная сталь 316 (типа 08Х17Н12М2) и никелевый сплав инконель-600 (типа 08Х23Н61Т) больше подвержены КРН.
Коррозионная стойкость в жидкометаллических теплоноси-
телях. Коррозионно-стойкие аустенитные стали могут применяться для изготовления оболочек твэлов, трубопроводов, насосов, корпусов реакторов и других узлов ядерных установок, охлаждаемых жидкометаллическими теплоносителями: Na, К, эвтектикой Na К, Pb Bi, Li и др. Во всех жидкометаллических теплоносителях лимитируется содержание кислорода. Содержание кислорода в натрии и в натриево-калиевом сплаве должно поддерживаться не выше 5 10-3 %. В этих условиях аустенитные стали при температуре до 500 °С практически не корродируют в потоке жидких металлов. Не наблюдается также заметного термического переноса массы. С повышением температуры выше 500 °С пленки пассивности восстанавливаются натрием, и наблюдается коррозионное взаимодействие межкристаллитного характера, а в некоторых сталях и увеличение общей скорости коррозии (табл. 23.80). Коррозионное воздействие жидкого металла на сталь отличается своеобразием; эти воздействия имеют иную природу, чем химическая или электрохимическая коррозия1.
Таблица 23.80
Коррозия коррозионно-стойких сталей в Na при Tисп = 600 °С, содержание кислорода (6 8) 10-3 %
Марка стали |
Время ис- |
Глубина |
Марка стали |
Время испы- |
Глубина |
пытания, ч |
коррозии, |
тания, ч |
коррозии, |
||
|
|
мкм |
|
|
мкм |
1Х18Н10Т |
1500 |
50 |
1Х17Н12М2Т |
1500 |
80 |
|
3000 |
70 |
|
3000 |
120 |
|
5100 |
100 |
|
5100 |
150 |
|
|
|
1Х18Н16МБ |
2000 |
0 |
1 Физическое материаловедение. Т. 2. М.: МИФИ, 2007. П. 7.4.
445

Для аустенитной коррозионно-стойкой стали при сложном составе жидкометаллического теплоносителя (например, эвтектика Na−K) и при наличии различных примесей (С, О, N, Н и др.) процессы взаимодействия значительно усложняются. В этом случае возможно избирательное взаимодействие отдельных компонентов жидкого металла с твердым металлом (сплавом) и его компонентами.
При Т > 500÷600 °С в системах аустенитных коррозионностойких сталей с щелочными жидкометаллическими теплоносителями наблюдается термический перенос массы − коррозионные поражения при этом локализуются в местах с максимальной температурой, а растворенная масса компонентов стали осаждается из теплоносителя в более холодной части контура из-за значительных различий растворимости составляющих аустенитной стали в теплоносителе при разной температуре (табл. 23.81).
Таблица 23.81
Примерная растворимость твердых металлов в жидкометаллических теплоносителях
|
Жидкий |
|
Т, °С |
|
Содержание элемента, % |
|
||
|
металл |
|
|
Ni |
Сr |
Fe |
Nb |
Mo |
|
Li |
600 |
0,1 |
0,01 |
0,002 |
− |
− |
|
|
|
|
800 |
1,8 |
0,02 |
0,005 |
− |
− |
|
|
|
1000 |
4,0 |
− |
0,025 |
Менее |
Менее |
|
|
|
1200 |
− |
4,0 |
0,065 |
0,0001 |
0,0001 |
|
Na |
600 |
|
0,00001 |
0,001 |
− |
0,03-0,1 |
|
|
− |
− |
− |
|||||
|
|
|
800 |
− |
− |
0,002 |
− |
− |
|
|
|
1000 |
0,004 |
− |
0,008 |
0,0007 |
− |
|
|
|
1200 |
− |
− |
0,06 |
0,003 |
− |
Скорость растворения vр стали возрастает с увеличением скорости движения теплоносителя vт примерно как v ~ vт0,8 . При очень
высоких скоростях возможно также эрозионное и механическое повреждение конструкционного материала.
446
В аустенитных сталях, содержащих 12 % Ni, при 600 °С в натрии обнаружена только МКК, увеличивающаяся с продолжительностью испытаний. Стали с более высоким содержанием никеля не были подвержены МКК, но имели некоторую потерю массы в результате избирательного растворения никеля в натрии (см.
табл. 23.80).
В настоящее время установлено, что коррозионная стойкость аустенитных сталей в Na при высокой температуре зависит главным образом от содержания кислорода в натрии. Увеличение скорости коррозии аустенитных сталей в Na с высоким содержанием кислорода, по-видимому, обусловлено тем, что кислород в Na образует с компонентами сталей хорошо растворимые соединения типа ферритов (Na2О)2 FeO.
С увеличением концентрации кислорода в Na происходит не только увеличение скорости коррозии, но и существенно ухудшаются механические свойства сталей. Так, после испытания в динамических условиях (v = 5 м/с) в Na, содержащем 2 10-2 % кислорода, наблюдается значительное уменьшение прочности и пластично-
сти (от σв = 750 МПа и δ = 25 % до σв = 700 МПа и δ = 4%).
В неизотермических условиях коррозионные процессы в натрии протекают интенсивнее даже при более низком содержании кислорода.
Если в системах с натриевым теплоносителем имеются разнородные материалы, то наблюдается перенос углерода от углеродистых или малолегированных перлитных сталей к аустенитным, содержащим более сильные карбидообразующие элементы. При переносе углерода его содержание в углеродистых и перлитных сталях уменьшается, а в аустенитных сталях увеличивается, происходит науглероживание. При этом наблюдаются значительные изменения механических свойств (табл. 23.82). С увеличением концентрации кислорода в натрии скорость переноса углерода возрастает.
Науглероживание усиливается при наличии углеродсодержащих материалов в системе и может сопровождаться переносом углерода в ней. Перенос массы усиливается также в случае значительного перепада температуры в системе (150−200 °С).
447

Таблица 23.82
Механические свойства и науглероживание стали 1Х18Н10Т псле испытаний в Na в течение 600 ч при содержании кислорода 8 10-3 %
в присутствии высокоуглеродистой стали У-8
Тисп, °С |
σв, МПа |
δ, % |
Скорость науглерожи- |
|
вания, %/ч |
||||
|
|
|
||
500 |
700 |
23 |
0,0014 |
|
600 |
720 |
Около 0 |
0,0040 |
|
700 |
620 |
Около 0 |
0,0055 |
Аустенитные коррозионно-стойкие стали наиболее пригодны для длительной работы в жидкометаллических теплоносителях до температуры 600 °С. При более высокой температуре наблюдается заметное науглероживание поверхности коррозионно-стойких сталей.
Коррозионная стойкость аустенитных сталей в эвтектике Na−К ниже, чем в натрии, и понижается с увеличением содержания калия в смеси. В Li скорость коррозии значительна, кроме того, не рекомендуется сочетать с ним стали с высоким содержанием никеля, так как Ni заметно выщелачивается. На увеличение скорости коррозии в Li существенным образом влияют примеси, в первую очередь азот и кислород. Хромоникелевые стали с литиевым теплоносителем можно применять до 600 °С, при более высокой температуре (700−800 °С) предпочтение следует отдать ферритным корро- зионно-стойким сталям (например, 0X13, 1X13, 1Х13М2БФР и др.), не содержащим никеля.
В целом можно считать, что возможности применения аустенитных хромоникелевых сталей в качестве конструкционного материала для работы в контакте с Li сильно ограничены в связи с неудовлетворительной коррозионной стойкостью. В то же время следует отметить, что этот вывод требует дальнейших подтверждений, поскольку существенное влияние не результаты оказывают условия испытаний. Например, если испытания хромоникелевой стали производить в контейнерах из железа, то в связи с концентрационным переносом массы хрома и никеля на поверхность железных контейнеров может интенсивно разрушаться поверхност-
448
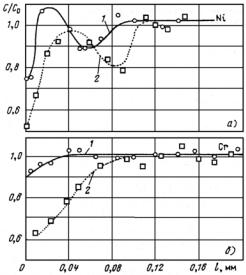
ный слой образцов коррозионно-стойких сталей. Это подтверждают данные работ, в которых с помощью радиоактивного изотопа 14С и послойным спектральным анализом поверхностного слоя на Сr и Ni было показано, что в случае испытания хромоникелевой стали в контейнерах из той же стали наблюдаются минимальные изменения состава поверхностного слоя (рис. 23.210) и механических свойств (табл. 23.83). После испытаний стали 1Х18Н9Т в контейнерах из железа армко поверхностная зона существенно обедняется хромом и никелем, а прилегающие к поверхности слои образца сильно травятся (травление в 5 %-ном растворе HNO3 в спирте) (рис. 23.211), что свидетельствует о наличии значительной концентрации дефектов структуры после испытания в литии, особенно по границам зерен. Возникновение таких дефектов указывает на возможность развития в среде жидкометаллического теплоносителя МКК.
Рис. 23.210. Относительное изменение концентрации С/С0 Ni (а) и Сr (б) в стали 1Х18Н9Т по глубине после испытания в Li при 700 °С в течение 200 ч:
1 − испытания в контейнере из стали 1Х18Н9Т; 2 − испытания в контейнере из технического железа; в Li введено 0,1 % С
449

Таблица 23.83
Изменение механических свойств стали 1Х18Н9Т после испытания в Li при 700 °С в течение 200 ч
Условия испытания |
σв, МПа |
δ, % |
В атмосфере аргона |
678 |
48 |
В контейнерах из стали 1Х18Н9Т |
666 |
47 |
В контейнерах из железа армко |
694 |
26 |
100 мкм
Рис. 23.211. Микроструктура стали 1Х18Н9Т на глубине 0,06 мм после испытания в Li при 700 °С в течение 200 ч в контейнерах из железа армко
Воздействие жидких металлов на конструкционные материалы особенно опасно при длительных контактах. Так, длительная прочность стали Х15Н35В3Т существенно снижается в среде жидкого лития (рис. 23.212), в стали 1Х14Н14М3Б скорость установившейся ползучести в потоке жидкого натрия выше, чем при испытании на воздухе (рис. 23.213).
Рис. 23.212. Длительная прочность стали Х15Н35В3Т при 1000 °С: 1 − испытание на воздухе; 2 − испытание в литии
450
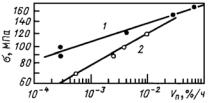
Рис. 23.213. Зависимость скорости установившейся ползучести стали 1Х14Н14МБ от напряжения при 700 °С:
1 − испытание на воздухе; 2 − испытание в конвекционном потоке жидкого натрия
Коррозионная стойкость при взаимодействии с продуктами деления ядерного топлива. Отдельного обсуждения заслуживает коррозионная стойкость аустенитных сталей в средах, содержащих продукты деления (ПД) ядерного топлива. Это касается поврежений на внутренней поверхности оболочек твэлов реакторов на быстрых нейтронах, контактирующей с ядерном топливом, т.е. внутритвэльной коррозии. Глубина коррозии внутренней поверхности оболочек зависит от степени выгорания топлива и может составлять десятки микрометров.
Наиболее серьезным видом поражения оболочек твэлов является образование межкристаллитных трещин на их внутренней поверхности в зоне максимального увеличения диаметра твэла, которые имеют тенденцию распространения вдоль оси твэла. Их глубина в ряде случаев превышает 100 мкм, т.е. более 0,25 толщины оболочки штатного твэла реактора БН-600.
В целом, на деградацию оболочки твэла реактора на быстрых нейтронах в условиях высоких выгораний в процессе эксплуатации влияют: физико-химическое взаимодействие топлива и ПД с оболочкой; КРН в присутствии агрессивных ПД с зарождением и развитием микротрещин; изменение прочностных характеристик и радиационное охрупчивание оболочек; распухание оболочек; воздействие нейтронного облучения на характеристики ползучести оболочек.
Наибольшие повреждения оболочке наносят ПД топлива, такие химически активные элементы, как Cs, Te и I, активно взаимодействующие с внутренней поверхностью оболочки вплоть до утоне-
451
ния ее до 100−150 мкм. Эти значения относятся к оболочкам из коррозионностойкой аустенитной реакторной стали ЭИ847.
На процесс взаимодействия влияют параметры, которые можно разделить на три группы:
параметры топлива: состав, начальная величина отношения числа атомов кислорода к числу атомов урана (О/М), величина химического потенциала кислорода в зазоре между топливом и оболочкой, плотность топлива;
параметры облучения: глубина выгорания, линейная тепловая мощность твэла, температуры внутренней поверхности оболочки и внешней поверхности топлива;
параметры оболочки: химический состав материала оболочки, способ его предварительной обработки, наличие механических напряжений в оболочке.
Анализ работ, посвященных исследованию твэлов с оксидным топливом, облученных в реакторах на быстрых нейтронах, показывает, что в зоне коррозии внутренней поверхности оболочки всегда присутствуют продукты деления (в основном, цезий, йод и теллур) и кислород. Коррозия внутренней поверхности оболочки сопровождается переносом компонентов материала оболочки в топливо. Особенно это проявляется в твэлах с высоким выгоранием и повышенной линейной тепловой мощностью (до 500 Вт/см).
Межкристаллитная и, частично, фронтальная коррозия вызывается, в первую очередь, совместным воздействием цезия и теллура, ускоряющих окисление границ зерен при кислородном потенциале, превышающем порог окисления хрома в коррозионностойкой стали.
Химический перенос компонентов оболочки в топливо связан с их растворением в жидкой среде. При этом главную роль играет смесь Те с Сs, считающаяся подходящей средой для переноса Fe, Cr и Ni в зазоре между топливом и оболочкой. Под действием градиента температуры компоненты оболочки в виде теллуридов поступают в глубь топлива, где начинают преобладать процессы разложения.
Обобщение литературных данных и оценки показывают, что оболочка твэла находится под давлением гелия, исходная величина
452
которого изменяется в зависимости от типа топлива от 0,1−0,5 до 2−2,5 MПа. Давление может несколько возрасти за счет выхода из топлива Xe и Kr (от 0,56 до 2,39 % газов, накопившихся в топливе). Если предположить, что в зазор выходит весь накопившийся в топливе газ (консервативная оценка), то давление может увеличиться в несколько раз. Вследствие давления газов в оболочке постоянно существуют окружные (наиболее опасные) напряжения. При выходе 2,5 % накопившегося газа оценки дают величины окружных напряжений в оболочке твэла, равные 40 МПа при температуре 400 °C, а при 100 % выходе газа − 170 МПа. С учетом равномерного окисления оболочки (уменьшения толщины металла) до 10−80 мкм или нодулярной коррозии до 400 мкм величины напряжений бyдут заметно выше. Расчетами получены прогнозные оценки окружных напряжений в оболочке при температуре 400 °C при условии 100 % выхода газа в зазор и окислении оболочки до половины исходных толщин, равные примерно 325±10 МПа. Опасен не столько уровень напряжений, сколько их концентрация в локальных местах.
В качестве ориентира по накоплению газообразных продуктов деления (ГПД) ядерного топлива консервативно взяты оценки для реактора ВВЭР-1000 при выгорании 45 МВт сут/кг U, в результате которого в зазор «сердечник−оболочка твэла» выходит около 1 % ГПД, нарабатываемых в топливе. В зазоре накапливается 0,7 % I, 1,0 % Cs, 0,1 % Te, 1,4 % Bа и другие продукты деления.
Из продуктов деления наиболее агрессивными являются легко летучие и химически активные I, Cs, Te и их соединения, и поэтому представляется целесообразным рассмотреть их коррозионное взаимодействие с аустенитными сталями. Рассмотрим изотопы этих химически активных ГПД.
Как видно из данных табл. 23.84, теллур (z = 52) имеет два стабильных изотопа (осколка деления), йод (z = 53) имеет один стабильный изотоп и один долгоживущий изотоп и цезий (z = 55) имеет один стабильный изотоп и три долгоживущих изотопа, причем установлено, что массовая доля осколков (продуктов деления) слабо зависит от типа реактора.
453
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 23.84 |
|
|
|
|
|
|
Изотопы теллура, иода и цезия |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Атомная масса |
|
|
Выход при |
Выход при |
σa, |
|||||||||
|
|
|
|
делении, 235U |
делении, 239Pu |
10−28 м−2 |
||||||||||
128 |
− Te |
|
|
|
|
|
3,9 10-3 |
8,3 10-3 |
4 |
|||||||
130 |
− Te |
|
|
|
|
|
1,8 10-2 |
2,4 10-2 |
5 |
|||||||
127 |
− I |
|
|
|
|
|
1,2 10-3 |
4,6 10-3 |
10 |
|||||||
129 |
( |
τ |
= 16 млн. лет) |
− |
I |
7,8 |
|
10 |
-3 |
1,4 |
|
10 |
-2 |
40 |
||
1/2 |
|
|
|
|
|
|
||||||||||
133 |
− Cs |
|
|
|
|
|
6,6 10-2 |
6,9 10-2 |
33 |
|||||||
134 |
(τ1/2 = 2 года) − Cs |
|
|
|
0 |
|
|
0 |
|
162 |
||||||
135 |
( |
τ |
= 2,3 млн. лет) |
− |
Cs |
6,2 |
|
10 |
-2 |
6,5 |
|
10 |
-2 |
14 |
||
1/2 |
|
|
|
|
|
|
||||||||||
137 |
( |
τ |
= 30 лет) |
− |
Cs |
|
|
6,6 |
|
10 |
-2 |
7,2 |
|
10 |
-2 |
2,7 |
1/2 |
|
|
|
|
|
|
|
|
||||||||
Степень физико-химического взаимодействия ГПД с материалами, например оболочки твэла, в большой степени зависит от термодинамической активности кислорода в оксидном топливе. При взаимодействии ГПД с конструкционными материалами также необходимо учитывать химический потенциал кислорода (кислородный потенциал), который определяется как:
|
|
= RT ln(P / P0 ) , |
(23.59) |
||
G |
|||||
|
O2 |
O2 |
O2 |
|
|
где PO2 − парциальное |
давление |
кислорода |
в объеме; |
||
P0 = 1,013 105 Па − давление кислорода в стандартном состоянии;
O2
R − универсальная газовая постоянная; T − абсолютная температура.
Кислородный потенциал зависит от состава топлива, его стехиометрии (т.е. отношения О/М), выгорания топлива и температуры. Применительно к взаимодействию ГПД с аустенитной сталью порог окисления при 700 °С составляет −565 кДж/моль. Например, некоторые продукты деления активно взаимодействуют с конструкционными материалами только при величине кислородного потенциала выше определенного значения.
Рассмотрим взаимодействие цезия, теллура, йода и их соединений с аустенитными сталями.
454
Цезий образует с кислородом ряд соединений: Cs2O – оксид, Cs2O2 – перекись, Cs4(O2)3 – триоксид, CsO2 – надперекись, CsO3 – озонид. При сгорании на воздухе или в кислородсодержащей среде образуется CsO2 с примесями Cs4(O2)3 и Cs2O2. Между Cs и Cs2O имеются еще 4 оксида: Cs7O, Cs4O, Cs2O7 и Cs3O. Эти оксиды плавятся при низкой температуре, и их свойства мало изучены. Переход от Cs7O к CsO2 определяется парциальным давлением кислорода. Монооксид цезия можно получить при действии ограниченного количества сухого воздуха на металл (Cs) или при взаимодействии с нитратами.
Вопросу изучения химического взаимодействия цезия и корро- зионно-стойкой стали посвящено значительное количество работ. Это связано с образованием большого количества цезия как продукта деления при облучении топлива и с высокой химической активностью цезия как одного из самых активных щелочных металлов. Цезий в заметных количествах обнаруживался в продуктах коррозии облученных твэлов. Все это дает основания считать цезий одним из наиболее опасных продуктов деления с точки зрения воздействия на оболочку. Оксиды цезия имеют достаточно высокие значения энергии образования от 286 кДж/моль для CsO2 до 450 кДж/моль для Cs2O2.
Элементарный цезий в присутствии достехиометрического (О/М < 2,00) и стехиометрического (О/М = 2,00) диоксида урана не взаимодействует с коррозионно-стойкой сталью до 1000 °С. В случае застехиометрического (О/М > 2,00) состава топлива наблюдается процесс взаимодействия, который сильно зависит от кислородного потенциала и количества присутствующего цезия. Продукты реакции − в основном хроматы цезия и твердые растворы на основе ферритной и аустенитной фаз с составами, отличными от состава материалов оболочки.
При высоких значениях кислородного потенциала цезий образует уранаты цезия, особенно при низких температурах. С учетом этих условий цезий существует в топливе в конденсированном виде, что существенно задерживает его взаимодействие с оболочкой. Чем выше отношение О/М, тем выше должна быть температура, при которой начинается значительное взаимодействие стали и це-
455
зия (600 °С / 144 ч при О/М = 2,01; 700 °С / 500 ч при О/М = 2,08; 800 °С / 500 ч при О/М = 2,30).
Химическое взаимодействие цезия и сталей наблюдалось только в присутствии кислорода. Это, очевидно, связано с образованием хроматов цезия, которые не могут защитить сталь от дальнейшего окисления. Проникновение цезия в сталь по границам зерен происходит при выдержках стали в цезии при 700 °С в течение 100 ч при значении кислородного потенциала, равного −400 кДж/моль. При более низких значениях кислородного потенциала проникновения не наблюдалось. При тех же значениях времени выдержки и температуры испытаний смесь цезия и теллура в соотношении 2:1 взаимодействует с коррозионно-стойкой сталью даже при таких значениях кислородного потенциала, как −590 кДж/моль.
Коррозия стали при температуре 680 °С в присутствии небольших количеств иода и теллура была слабой; но при более высоких отношениях Te/Cs наблюдалась более интенсивная коррозия оболочки. В жидкой фазе реакция была более интенсивной, чем в газовой.
Даже малые добавки кислорода (5·10 −2 ат.%) в цезий резко увеличивают его агрессивность по отношению к стали. Например, выдержка при температуре 650 °С в течение 4200 ч приводит к глубине проникновения 125 мкм, причем наблюдается как фронтальная, так и межзеренная коррозия. Элементарный цезий, как известно, не взаимодействует с оболочкой при значении кислородного потенциала, равного −400 кДж/моль. По другим данным для протекания коррозии кислородный потенциал в цезии и оксида цезия должен быть больше, чем −350 кДж/моль.
Наиболее полно процесс взаимодействия цезия и коррозионностойкой стали исследовали в запаянных ампулах из коррозионностойкой стали, в которых создавали давление цезия от 10−3 до 0,1 МПа. при температурах до 800 °С и различных значениях кислородного потенциала. При этом создавался градиент температур, обеспечивающий перенос цезия в более горячую зону. Взаимодействие цезия с коррозионно-стойкой сталью проявлялось в окислении образцов, окислении границ зерен и глубоком проникновении
456
цезия на глубину до 500 мкм. Интенсивная коррозия наблюдалась при значениях кислородного потенциала выше −420 кДж/моль.
При температурах ниже 550−600 °С существенной коррозии стали в цезии не наблюдалось, а наиболее интенсивная коррозия отмечена при температуре 800 °С. В ряде случаев заметное проникновение цезия в сталь наблюдалось только за первые 200 ч, что может быть объяснено загрязнением кислородного источника цезием. Варьирование давления паров цезия не оказывает существенного влияния на коррозию по границам зерен. Слабое науглероживание испытываемой коррозионно-стойкой стали не привело к существенному изменению глубины проникновения цезия, однако, в этом случае окисление было локализовано по границам зерен и наблюдалось растрескивание поверхности материала оболочки.
Межзеренная коррозия коррозионно-стойкой стали ускоряется в присутствии соединения CsOH, которое образуется по реакции
Cs+ |
1 |
H 2 |
+ |
1 |
О2 → CsOH. |
(23.60) |
2 |
|
2 |
|
|
||
Источниками водорода являются обычно ядерное топливо, содержащее водород и влагу. Гидрооксид цезия существует на внутренней стенке оболочки твэла во время облучения. Монооксид цезия очень активно проникает внутрь коррозионно-стойкой стали на глубину до 50 мкм при температуре 650 °С в течение 45 ч.
Взаимодействие оксидов цезия с коррозионно-стойкой сталью при температурах от 450 до 690 °С вызывает межзеренную коррозию, которая имеет линейную зависимость от времени. Межзеренная коррозия коррозионно-стойкой стали в контакте с оксидами цезия контролируется образованием комплексных соединений, которые содержат цезий и компоненты стали. Наиболее вероятно, что это хромат цезия.
Цезий−теллур. Теллур в комбинации с цезием вызывает очень интенсивную межзеренную коррозию коррозионно-стойкой стали при значениях кислородного потенциала от −564 кДж/моль при 725 °С (окислительный порог для коррозионно-стойкой стали) до −334 кДж/моль (слегка застехеометрическое топливо). Особенно активна смесь цезия и теллура в соотношении Cs:Te ≤ 2. Ответст-
457
венным за процесс химического взаимодействия является теллур. Несмотря на то, что обычное отношение цезия и теллура как продуктов деления находится в пределах от 5:1 до 7:1, всегда за счет температурного градиента будут образовываться локальные области с очень опасным соотношением Cs:Te ≤ 2. Глубина проникновения в коррозионно-стойкую сталь была значительной и изменялась в зависимости от условий испытаний от 110 до 150 мкм. В случае соединения Cs2Te при температуре испытаний 700 °С в течение 168 ч, наблюдалось проникновение коррозионного фронта в корро- зионно-стойкую сталь до 40 мкм.
Состав и абсолютное количество смеси цезия и теллура влияют на форму и глубину химического взаимодействия со сталью. При значении кислородного потенциала несколько выше порога окисления коррозионно-стойкой стали происходит глубокое проникновение продуктов коррозии по границам зерен при соотношении 1:5 ≤ Cs:Te ≤ 3:1. Наряду с глубокой межзеренной коррозией в этом случае наблюдается и слабая фронтальная коррозия. Наименьшее значение кислородного потенциала, при котором происходит химическое взаимодействие со сталью в смеси цезия и теллура, совпадает с термодинамическим порогом окисления хрома в стали. Если кислородный потенциал растет выше порога окисления хрома в стали, то уменьшается глубина межзеренной коррозии в смеси цезия и теллура.
Вслучае существования примесного углерода выделения карбидов вдоль границ зерен коррозионно-стойкой стали окисляются в
первую очередь. Переход карбидов типа М23С6 в высшие карбиды М7С3 и М3С2 за счет примесного углерода приводит к более быстрому окислению, стимулированному присутствием цезия и теллура.
Теллур в присутствии цезия вызывает глубокую коррозию по границам зерен коррозионно-стойкой стали как при наличии, так и при отсутствии кислорода. Кислород, в свою очередь, ускоряет коррозию коррозионно-стойкой стали под воздействием теллура и цезия, но этот процесс ослабляет введение йода.
Взаключение следует сделать несколько общих замечаний. Взаимодействие коррозионно-стойких сталей с цезием происходит
458
только в присутствии кислорода при значении кислородного по-
тенциала выше приблизительно −420 кДж/моль. Продукты коррозии состоят в основном из хроматов цезия. Введение теллура в цезий существенно интенсифицирует коррозию. Следует отметить, что практически все кислород содержащие соединения цезия очень сильно взаимодействуют с коррозионно-стойкой сталью.
Теллур. Учитывая химическую активность, а также существенный выход теллура при делении оксидного топлива, можно считать его вторым после цезия продуктом деления с точки зрения активности в коррозионном процессе. Несмотря на то, что основное внимание во внереакторных исследованиях направлено на изучение влияния добавок теллура на коррозию сталей в цезии, вопрос о взаимодействии сталей с теллуром является важным, так как основные черты этого взаимодействия прослеживаются в Cs-Te- коррозии.
При 700 °С взаимодействие теллура с коррозионно-стойкой сталью приводит к дехромизации стали преимущественно вдоль границ зерен. При температуре выше 700 °С глубина проникновения теллура зависит от размера зерен стали и возрастает с увеличением размера зерна. Исследование совместимости теллура со сталями 316 и FV548 показало, что жидкий теллур вызывает межзеренную коррозию сталей с образованием соединений типа FeTe0,9. Глубина проникновения теллура в сталь 316 составляла около 150 мкм при температуре 650 °С после выдержки в течение 4000 ч, а в сталь FV548 − после выдержки в течение 2000 ч. Кинетика межзеренной коррозии сталей, вызываемой жидким теллуром, описана уравне-
нием y = a τn , где у − глубина проникновения в микрометрах, τ − время выдержки в часах, а и n − константы, равные: для стали 316
а = 18,87, n = 0,25; для стали FV548 а = 32, n = 0,25. Межзеренная коррозия сопровождалась образованием интерметаллических соединений.
При высокой температуре (900−1000 °С), обеспечивающей значительное давление паров теллура и способствующей усиленной коррозии стали, в продуктах коррозии обнаружена фаза, богатая хромом и марганцем. Ее состав, определенный с помощью рентге-
459
новского микроанализатора, был следующим (мас.%): Cr−19,0; Mn − 6,1; Te − остальное. Выпадение фазы, богатой хромом, приводило к локальной дехромизации стали, а это, в свою очередь, понижало ее сопротивляемость межзеренной коррозии.
Изменение температуры привело к существенному изменению вида коррозии. При низких температурах коррозия была равномерной, наблюдался плоский фронт коррозионного взаимодействия. При высоких температурах преобладала межзеренная коррозия.
Существенным фактором является влияние кислородного потенциала на взаимодействие теллура и коррозионно-стойких сталей. При выдержке коррозионно-стойкой стали в контакте с оксидным топливом и теллуром установлено, что теллур может взаимодействовать с коррозионно-стойкой сталью в случае достехиометрического топлива. Продуктами коррозии коррозионно-стойкой стали и теллура в присутствии достехиометрического оксида были теллуриды хрома и никеля. Коррозия наблюдалась при температурах 400 °С и выше.
Порядок образования теллуридов, в зависимости от активности теллура, соответствовал данным об относительной термодинамической стабильности этих соединений. Сродство теллура к компонентам оболочки уменьшается в следующем порядке: теллурид хрома → теллурид никеля → теллурид железа. При низкой активности теллура образовывался теллурид хрома, при более высоком потенциале, кроме этого соединения, образовывался теллурид никеля, однако, в присутствии хрома и никеля теллурид железа никогда не образовывался. Наряду с теллуридами хрома и никеля иногда наблюдалась фаза, состоящая из теллура, хрома и марганца, которая, была обнаружена как основной продукт взаимодействия теллура с коррозионно-стойкой сталью. Эти результаты ставят под сомнение выводы о том, что коррозия коррозионно-стойкой стали в теллуре идет с образованием соединения FeTe0,9.
Жидкий теллур интенсивно взаимодействует с оболочкой из коррозионно-стойкой стали, причем ниже 700 °С наблюдается в основном фронтальная коррозия оболочки, а выше этой температуры преобладает межзеренная коррозия. Взаимодействие компонентов стали с теллуром сопровождается образованием интерметалли-
460
ческих соединений с низкой температурой плавления, что в результате приводит к высокой подвижности компонентов коррозионностойкой стали, особенно никеля, и ускоряет их диффузию в топливо. Дополнительное окисление материала оболочки усиливает его коррозию под влиянием теллура.
Для глубокого межзеренного проникновения продуктов деления в сталь типа 316 (при воздействии смесей из теллура, цезия и йода при различных значениях кислородного потенциала при температуре 678 °С) необходимым элементом является теллур. В целом, теллур вызывает глубокую межзеренную коррозию.
Таким образом, коррозия коррозионно-стойких аустенитных сталей в теллуре сопровождается образованием теллуридов хрома, железа, никеля и марганца при температурах выше 400 °С. Коррозия может быть как межзеренная, так и фронтальная. Состояние теллура (газообразное или жидкое) существенно влияет на глубину проникновения. В силу наибольшей термодинамической стабильности происходит преимущественное образование теллурида хрома, что приводит к дехромизации стали, преимущественно вдоль границ зерен. Это, в свою очередь, приводит к снижению сопротивляемости коррозии аустенитных сталей.
Йод и бром начинают слабо реагировать со сталью при 400 °С независимо от кислородного потенциала топлива. Однако глубина проникновения при более высоких температурах увеличивается с ростом кислородного потенциала. Продуктами реакции являются йодид и бромид хрома. Однако в топливе при соотношении О/М < 2,00 йод и бром не существуют в элементарном виде и связаны с цезием как йодиды и бромиды. Взаимодействие йодида и бромида цезия со сталью не наблюдалось вплоть до 800 °С при О/М ниже 2,00, т.е. когда йод и бром не могут существовать в элементарном виде. Взаимодействие йодида и бромида цезия со сталью возможно только в том случае, когда эти соединения переходят в термодинамически более стабильное состояние и выделяются элементарный йод и бром. Это может происходить при достаточно высоких О/М ≥ 2,01, при этом начало взаимодействия отмечено при температуре 800 °С и времени выдержки 1000 ч.
461
Некоторые данные о взаимодействии йодида цезия и коррози- онно-стойкой стали очень противоречивы. С одной стороны, отмечается относительная инертность йодида цезия по отношению к коррозионно-стойкой стали при температуре 680 °С, а с другой − сообщается, что йодид цезия реагирует с коррозионно-стойкой сталью при 700 °С, хотя он обладает высокой термодинамической стабильностью.
Имеются данные, что йодид цезия может реагировать с корро- зионно-стойкой сталью только в присутствии кислорода, что радиация способствует разложению йодида цезия на цезий и йод, который способствует переносу компонентов коррозионно-стойких сталей.
Йод очень интенсивно взаимодействует с коррозионно-стойкой сталью и глубина проникновения составляет 150 мкм после выдержки при температуре 650 °С в течение 150 ч. Добавка цезия в таких количествах, чтобы образовывался йодид цезия, подавляет такую интенсивную коррозию. Однако небольшие добавки кислорода к йодиду цезия вновь резко интенсифицирует процесс взаимодействия. Показано, что йодид цезия является переносчиком железа и хрома, что приводит к существенной дехромизации стали.
Термодинамическая стабильность йодидов компонентов стали ниже йодида цезия, и поэтому непосредственно йодид цезия не должен взаимодействовать со сталью. Вместе с тем при достаточно высоком кислородном потенциале среды становятся возможными образование Cs2O и частичное высвобождение йода, реагирующего с компонентами стали.
Существует гипотеза о механизме воздействия йода на коррози- онно-стойкую сталь, которая основана на переносе железа и хрома в паровую фазу. Смысл этого процесса состоит в том, что йодид цезия, образованный путем реакции цезия и йода, будет реагировать с оболочкой, оставляя в ней цезий и образуя смеси летучих йодидов железа и хрома. Эти соединения будут двигаться по трещинам и порам в топливо под действием градиента температур. Ближе к центральной части топлива они будут разлагаться и обра-
462
зовывать металлические включения, богатые хромом и йиодом, а выделившийся йод вновь вступит в реакцию.
В заключение рассмотрим особенности взаимодействия цезия, йода и теллура со коррозионно-стойкими сталями. Таких результатов недостаточно, но известно, что коррозионная стойкость стали 1.4541, которая по химическому составу близка к стали 08Х18Н10Т, в среде цезия при температуре 800 °С и времени выдержки 1000 ч составляет 20−30 мкм. Микрозондовый анализ реакционной зоны показывает отчетливое падение содержания железа и никеля и сильное возрастание содержания хрома по сравнению с исходным распределением элементов. В части этой зоны можно обнаружить обогащение цезием (вероятно образование хромата цезия). С повышением содержания кислорода в газовой среде увеличивается глубина реакционной зоны до 100 мкм при температуре
800°С.
Вслучае отсутствия кислорода цезий не реагирует со сталью
1.4541 до температуры 1000 °С при длительности отжига 3000 ч. Чистый йод реагирует со сталью 1.4541 при температурах 600 и 800 °С и времени выдержки 1000 ч, образуя реакционные зоны глубиной соответственно 20 и 250 мкм. Йодид цезия слабо взаимодействует со сталью 1.4541 при этих условиях.
Химическое взаимодействие между сталью 1.4541 и парами теллура не наблюдается при температуре 300 °С за время выдержки 3000 ч. При 800 °С и времени выдержки 1000 ч зона взаимодействия составляет около 400 мкм, однако не сообщается фазовое состояние теллура (жидкое или газообразное), что по нашим данным является решающим фактором.
Таким образом, приведенные данные показывают, что результат взаимодействия смеси химически активных цезия, йода и теллура со сталями существенно зависит от кислородного потенциала (особенно для цезия), агрегатного состояния этих элементов (особенно для теллура), от состава и концентрации смеси, температуры и времени испытания.
463

Применение аустенитных коррозионно-стойких сталей в ЯЭУ
Коррозионно-стойкие хромоникелевые аустенитные стали благодаря их высокой жаропрочности, коррозионной стойкости и технологичности находят широкое применение (примеры использования сталей этого класса приведены в табл. 23.85; см. также табл. 23.50).
Таблица 23.85
Конструкционные материалы внутриреакторных деталей и узлов
Установка |
Страна- |
Наименование детали |
Температура |
Применяемый или |
|
разработ- |
или узла |
работы, °С |
рекомендуемый |
|
чик |
|
|
материал |
БОР-60 |
СССР |
Оболочки твэлов |
До 700−740 |
Сталь марки |
|
|
|
|
0Х16Н15МЗБР |
|
|
Основное оборудование |
− |
Коррозионно- |
|
|
первого и второго кон- |
|
стойкая сталь |
|
СССР |
туров |
|
|
БН-600 |
Оболочки твэлов |
680−700 |
Хромоникелевые |
|
|
|
|
|
коррозионно- |
|
|
|
|
стойкие стали |
|
|
Детали активной зоны и |
580 |
То же с поверхно- |
|
|
механизм перегрузки |
|
стным упрочнени- |
|
США |
|
|
ем |
EBR-II |
Оболочки твэлов |
< 550 |
Сталь марки 316, |
|
|
|
|
|
холоднодеформи - |
|
|
|
|
рованная сталь |
|
|
|
|
316, сталь 321, |
|
|
|
|
сталь 304 |
|
|
Сборки активной зоны |
< 500 |
Сталь марки 304 |
|
|
и зоны воспроизводст- |
|
|
|
|
ва, оболочки регули- |
|
|
|
Велико- |
рующих стержней и др. |
|
|
PFR |
Оболочки твэлов |
< 692 |
Сталь марки 304 |
|
|
британия |
|
|
|
|
Оболочки топливных |
− |
Сталь марки 304 |
|
|
Франция |
сборок |
|
|
«Супер- |
Детали первого контура |
< 550 |
Сталь марки 316L |
|
Феникс» |
Германия |
|
|
|
SNR |
Оболочки твэлов |
< 620 |
Хромоникелевая |
|
|
|
|
|
аустенитная сталь |
464
В реакторостроении коррозионно-стойкие аустенитные стали по существу являются основным конструкционным материалом для изготовления важнейших узлов ЯЭУ различного назначения: оболочек твэлов, парогенераторов, теплообменников, трубопроводов, циркуляционных насосов, различной арматуры активной зоны и других ответственных деталей первого и второго контуров. Аустенитные стали могут работать при температуре до 750 °С, тогда как предельная температура применения хромистых сталей составляет 620 °С (см. п. 23.3.6). Однако продолжительная эксплуатация сталей этого типа при 500−700 °С может привести к охрупчиванию некоторых из них из-за выделения избыточной вторичной фазы по границам и образования σ-фазы (сигматизации) типа FeСr. Выделение фаз Лавеса (типа Fe2Mo или Fe2W), коагуляция карбидных фаз и в некоторых сталях выделение в небольших количествах (1−2 %) интерметаллидов типа Ni3Ti, протекающие в зерне очень медленно, незначительно влияют на пластичность и жаропрочность.
По своим жаропрочным свойствам аустенитные коррозионностойкие стали приближаются к сплавам на основе Ni и в некоторых случаях служат их заменителями. Из жаропрочных сталей с интерметаллидным упрочнением изготовляют компрессоры, турбины пароперегревателей и трубопроводы установок сверхвысокого давления, роторы, диски, лопатки турбин, крепежные детали с длительным сроком службы при температурах до 850 °С.
Аустенитные коррозионно-стойкие стали на сегодняшний день являются наиболее вероятными конструкционными материалами демонстрационных и опытных установок и реакторов синтеза. Так, сталь типа Х16Н11М3Т предложена в качестве конструкционного материала разрядной камеры международного опытного термоядерного реактора ITER.
Аустенитные коррозионно-стойкие стали, применяемые в активной тоне ядерных реакторов, а также предполагаемые в качестве материала первой стенки и банкета ТЯР, могут накопить за период эксплуатации большие дозы нейтронов (Фн > 1026÷1027 м-2 с Е > 0,1 МэВ). В связи с этим остро стоит проблема устойчивости их микроструктуры под облучением.
465
Облучение нейтронами аустенитных сталей при температуре Т < 100 °С приводит к радиационному упрочнению − повышению предела прочности, предела текучести и понижению пластичности при нормальной температуре испытания (табл. 23.86). При температуре испытания до 400 °С облученная сталь также обладает более высокими прочностными характеристиками и меньшей пластичностью. Начиная с 400 °С влияние облучения на упрочнение уменьшается, а при температуре 625−650°С оно практически не проявляется, что обусловлено отжигом радиационных дефектов.
Таблица 23.86
Механические свойства сталей 1Х18Н9Т и 1Х18Н11Б, облученных нейтронами при 100 °С, при нормальной температуре
Марка стали |
Фн, м−2 (Е > 1 МэВ) |
σв, МПа |
σт, МПа |
δ, % |
1Х18Н9Т |
− |
650 |
240 |
66 |
|
1,4 1022 |
740 |
440 |
55 |
|
2,0 1024 |
740 |
660 |
44 |
1Х18Н11Б |
− |
630 |
400 |
69 |
|
2,4 1025 |
760 |
690 |
51 |
|
3,7 1026 |
810 |
750 |
32 |
В аустенитных сталях, кроме радиационного упрочнения, наблюдается явление так называемого высокотемпературного радиационного охрупчивания (ВТРО), заключающееся в существенном снижении пластических свойств при температурах облучения выше 350−500 °С и значительных флюенсах (Фн > 1025 м−2).
Высокотемпературное охрупчивание проявляется при длительных испытаниях в снижении длительной прочности (рис. 23.214), а при кратковременных испытаниях − в росте предела текучести (приближающееся к значениям предела прочности), а также в интенсивном уменьшении пластичности до 2 % (табл. 23.87).
Как следует из табл. 23.87, при большом флюенсе (1,1 1027 м-2) развивается тенденция к разупрочнению. Повышение температуры облучения от 370 до 460−470 °С приводит к менее интенсивному снижению пластических свойств.
466
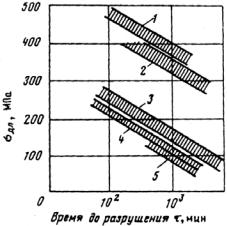
Рис. 23.214. Длительная прочность стали XI8H10T, необлученной и облученной до Фн = (1÷3) 1024 м-2, при Тисп = 600 и 700 °С:
1 − 600 °С (без облучения); 2 − 600 °С (облучение при Тобл = 450 °С) ; 3 − 700 °С (без облучения); 4 − 700°С (облучение при Тобл = 450 °С); 5 − 700 °С (облучение при Тобл = 550 °С)
Таблица 23.87
Механические свойства аустенитной стали 0Х18Н10 при кратковременных испытаниях после облучения
Фн, 1026 м−2 (Е > 0,1 МэВ) |
Тобл, °С |
Тисп, °С |
σ0,2, МПа |
σв, МПа |
δ, % |
2,8 |
370 |
370 |
734 |
763 |
2,0 |
4,5 |
370 |
370 |
757 |
787 |
1,9 |
10,7 |
400 |
370 |
714 |
740 |
2,0 |
10,7 |
470 |
480 |
346 |
477 |
14,2 |
Сравнивая высокотемпературное поведение аустенитных сталей различного состава, можно заключить, что все материалы в какойто мере подвержены высокотемпературному снижению пластичности, причем ВТРО увеличивается с ростом содержания Ni в стали. Величина эффекта и температурная область, где ВТРО наблюдается, существенно различны для сталей с одинаковой основой, но различающихся составом легирующих добавок. Например, на рис. 23.215 приведена температурная зависимость изменения отно-
467
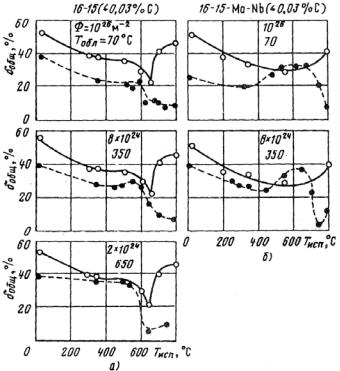
сительного общего удлинения двух гомогенных сталей Х16Н15 и Х16Н15 + Mo + Nb, облученных нейтронами при разных температурах. Из рис. 23.215 видно, что у стали Х16Н15 без дополнительного легирования начиная с Т = 600 °С обнаруживается после облучения существенное снижение пластичности, в то время как пластичность стали Х16Н15 + Mo + Nb при Т ≈ 600 °С становится даже выше или примерно такой же, что и у необлученной стали. Только при Т > 700 °С пластичность облученной стали Х16Н15 + + Mo + Nb резко снижается.
Рис. 23.215. Температурные зависимости общего относительного удлинения сталей X16H15 (а) и Х16Н15 + Мо + Nb (б):
| − необлученные образцы; z − образцы, облученные нейтронами
468
Аналогичное поведение пластичности под облучением наблюдается и у дисперсионно-твердеющих сталей. Так, сталь Х15Н35ВТ склонна к ВТРО, начиная с 500 °С, показывая при больших темературах почти нулевое удлинение (δ ≈ 0 %), в то время как сталь Х15Н35МТЮБР даже при 750 °С еще имеет δ ≈ 10 %.
В целом по склонности к ВТРО различные Fe−Cr−Ni-стали и сплавы могут быть размещены по схеме (рис. 23.216), в которой склонность к ВТРО возрастает слева направо и сверху вниз. Можно видеть, что горизонтальные ряды соответствуют факту корреляции ВТРО с составом Fe−Cr−Ni-основы (изменение содержания Ni), а вертикальные свидетельствуют о положительной или отрицательной роли разных легирующих добавок.
Образцы с ВТРО не восстанавливают своих свойств даже после высокотемпературного отжига при Т ≥ 1100 °С из-за происшедших необратимых изменений на границах зерен.
При больших флюенсах нейтронов наблюдается еще одно явление − радиационное распухание хромоникелевых сталей. Аустенитные коррозионно-стойкие стали, как и другие металлические сплавы, подвержены распуханию. Однако распухание существенно зависит от состава основы, легирования и исходной структуры сталей.
На рис. 23.217 представлены результаты исследования ряда Fe−Cr−Ni-сталей и сплавов с содержанием (18±3) % Cr и различным содержанием никеля. Видно, что по основному химическому составу группа аустенитных сталей с 10−18 % Ni − традиционных материалов оболочек твэлов и чехлов ТВС реакторов на быстрых нейтронах (стали типа 304, 316, Х18Н10Т, Х16Н15М3Б
и др.) − относится к классу наиболее интенсивно распухающих материалов.
Рис. 23.217. Зависимость распухания сплавов Fe−Cr−Ni с 18±3% Cr, облученных ионами
Ni6+ (46,5 МэВ) при 600−650 °С до Фн = 40 сна, от содержания никеля
469
470
Рис. 23.216. Схема послерадиационной высокотемпературной охрупчиваемости сплавов системы Fe−Cr−Ni (С.Н. Вотинов)
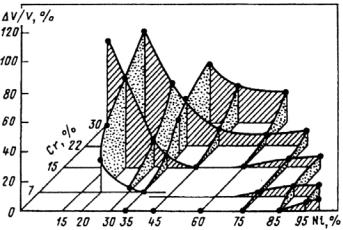
Зависимость распухания сплавов от содержания никеля проходит через минимум при 35−60 % Ni, с увеличением содержания Cr распухание возрастает (рис. 23.218).
Рис. 23.218. Тройная диаграмма зависимости распухания сплавов Fe−Cr−Ni
от содержания Ni и Cr (облучение ионами Ni2+, Е = 5 МэВ, Тобл = 675 °С,
Фн = 140 сна)
По контурам изораспухания также видно (рис. 23.219), что для большинства сплавов, устойчивых к распуханию вплоть до 140 сна ( V/V ≤ 1 %), содержание Cr не превышает 20 %. В многочисленных исследованиях установлено, что от содержания Cr и Ni, а также от температуры облучения скорость распухания стали зависит лишь на переходной стадии, как и длительность переходной стадии, а на установившейся стадии распухание тройных Fe−Cr−Niсплавов не зависит от перечисленных факторов и скорость распухания их составляет 1 %/сна.
Среди аустенитных коррозионно-стойких сталей наибольший переходный (инкубационный) период имеют стали с содержанием
35−40 % Ni (рис. 23.220).
471
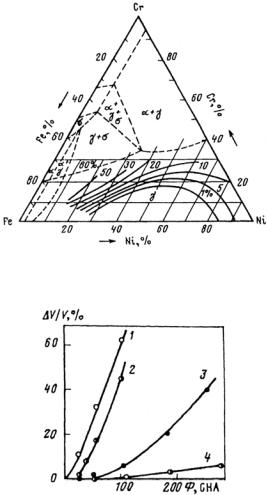
Рис. 23.219. Контуры изораспухания для лабораторных и промышленных сплавов Fe−Cr−Ni (облучение ионами Ni2+, Е = 5 МэВ, Тобл = 675 °С, Фн = 140 сна)
Рис. 23.220. Влияние Ni на длительность переходного периода распухания Fe−Cr−Ni-сталей при облучении ионами Ni1+ при 675 °С:
1 − 20; 2 − 25; 3 − 35; 4 − 45 % Ni
Полагают, что, кроме упомянутых механизмов влияния состава сплавов, на склонность сталей к радиационному распуханию влия-
ет их фазовое состояние в процессе облучения: наиболее устойчи-
вы к распуханию однофазные стали (например, чисто ферритные,
472
чисто аустенитные), с увеличением числа фаз [(γ + σ), (α + γ + σ) и др.] склонность к радиационному распуханию увеличивается (см. рис. 23.217 и 23.219). Это проиллюстрировано на рис. 23.221, на котором показана зависимость величины распухания от разности свободных энергий ферритного и аустенитного состояния сплава при температуре облучения δ( F), являющейся характеристикой состояния сплава в течение облучения. Видно, что с увеличением δ( F) распухание сплава уменьшается, следовательно, повышение термодинамической устойчивости однофазного (в рассматриваемом случае аустенитного) состояния сопровождается повышением устойчивости сплавов к радиационному распуханию.
Рис. 23.221. Зависимость относительного удлинения образцов Fe−Cr−Ni-сталей и сплавов, вызванного распуханием при облучении в реакторе DFR (D = 30 СНА, Тобл = 600 °С), от различия свободной энергии в аустенитном и ферритном состояниях:
1 − FV548 (основа − X17H12); 2 − 347 (X18H9); 3 − 316L (X16H14);
4 − 316 (X18H12); 5 − М316 (X17H14); 6 − 321 (X18H10); 7 − G68 (X14H25); 8 − РЕ16 (Х17Н43); 9 − GAB (X16H43) 10 − РЕ16 (Х17Н43); 11 − РЕ16 (Х16Н40)
Другой путь влияния на склонность аустенитных сталей к радиационному распуханию − легирование и разумное варьирование концентрацией примесей внедрения. Многие исследователи отмечают, что легирующие элементы (и примеси) сдерживают развитие пористости только тогда, когда находятся в твердом растворе.
473
Распад твердого раствора с формированием вторичных фаз, следовательно, обеднением матрицы легирующими элементами как до, так и в процессе облучения сопровождается ускорением распуха-
ния (табл. 23.88).
Таблица 23.88
Влияние термомеханической обработки на распухание стабилизированной титаном и ниобием аустенитной коррозионно-стойкой стали AISI316, облученной электронами в высоковольтном электронном микроскопе при 400−600 °С до Фн = 30 сна (измерения проведены при температуре максимума распухания Ттах = 550 °С)
|
Сталь |
Термомеханическая обработка |
Распухание, % |
316 |
+ 0,25 % Ti |
Аустенизация (при 1100 °С) |
< 1 |
|
|
Аустенизация + ХД 20 % |
< 1 |
|
|
Аустенизация + ХД 20 % + |
11 |
|
|
+ старение при 900−950 °С, 1 ч |
|
316 |
+ 0,5 % Nb |
Аустенизация (при 1100 °С) |
< 1 |
|
|
Аустенизация + ХД 20 % |
< 1 |
|
|
Аустенизация + ХД 20 % + |
16 |
+старение при 900−950° С
Всостаренных сталях с Ti и Nb обнаружены многочисленные карбиды титана и ниобия, которые являлись местами интенсивного зарождения пор. Полагают, что второй высокотемпературный максимум распухания многих аустенитных сталей (рис. 23.222) связан с образованием в процессе облучения карбидов, так как температура облучения в пике распухания совпадает с интервалом интен-
Рис. 23.222. Температурная |
сивного образования карбидов (при- |
зависимость распухания |
мерно 550−600 °С). О связи процесса |
отожженной стали 316, |
распада твердого раствора и порооб- |
облученной в реакторе |
|
до флюенсов Фн = 8 1026 (1) |
разования свидетельствует и тот факт, |
и 1,3 1027 (2) м−2 (Е > 0,1 МэВ) |
что для стали, легированной кремни- |
|
474 |
ем, температурно-дозные интервалы образования интерметаллидной γ′-фазы Ni3Si и развития пористости совпадают, хотя в γ- твердом растворе Si существенно подавляет распухание.
Вместе с тем встречаются и диаметрально противоположные результаты − в ряде систем в температурно-дозном интервале формирования вторичных фаз распухание подавлено.
Неоднозначность результатов исключает выработку универсальных для всех систем рекомендаций принципов легирования и создания структур, которые могут быть положены в основу разработки радиационно-стойких материалов. Такие рекомендации могут быть выработаны только для конкретных систем. Для аустенитных коррозионно-стойких сталей и сплавов многие исследователи с целью подавления распухания рекомендуют обеспечение определенным легированием непрерывно однородного распада твердого раствора с сильно выраженным инкубационным периодом и определенной величиной объемной дилатации, создание структур с высокой концентрацией мелкодисперсных выделений и т.д.
Весьма эффективным с точки зрения подавления распухания аустенитных сталей является легиро-
вание их Mo, Zr, Al, Ti, Si, Nb и дру-
гими элементами замещения, имеющими атомный радиус, сильно отличающийся от радиуса атома основы твердого раствора (рис. 23.223). Часто действие легирующих элементов взаимно усиливают влияние друг
друга. Так, Si эффективно сдерживает распухание аустенитной стали при наличии в ней Ti, V, Zr и Сu, причем существует оптимальная концентрация для наиболее интенсивного подавления распухания − 0,5 % Si; совместное легирование Si и Ti сдерживает распу-
475
хание более эффективно, чем каждым элементом в отдельности в том же количестве.
Многие легирующие элементы подавляют распухание аустенитной стали столь же эффективно, как и оптимизация Fe−Cr−Niосновы. Легирование влияет на скорость распухания на переходной стадии, длительность инкубационного периода, но, как правило, не влияет на скорость распухания на установившейся стадии. Более того, те же элементы, эффективно сдерживающие распухание на переходной стадии, могут ускорить развитие пористости на установившейся стадии. В частности, это относится к элементам, интенсифицирующим распад твердого раствора и способствующим выходу из твердого раствора элементов, сдерживающих порообразование.
Таким образом, несмотря на то, что наиболее широко используемые в настоящее время реакторные коррозионно-стойкие стали аустенитного класса подвержены интенсивному распуханию при облучении, это не исключает перспективу их использования в качестве материалов основы для разработки радиационно-стойких материалов путем оптимизации состава сплава и количества легирующих элементов и примесей.
Контрольные вопросы
1.Дайте характеристику кристаллической структуры и свойств железа.
2.Дайте классификацию двойных диаграмм состояния железа. Оха-
рактеризуйте растворимость химических элементов в α- и γ-модифика- циях железа.
3.Какие элементы относятся к ферритостабилизирующим, а какие к аустенитостабилизирующим? Какова их роль в создании сталей различного класса и жаропрочных структур?
4.Назовите условия выбора основных и вспомогательных легирующих элементов в железе. По каким критериям элемент причисляется к вредным примесям? Приведите примеры.
5.Что такое исходный легирующий комплекс в стали? Какая сталь называется углеродистой?
6.Как выбираются легирующие комплексы при создании жаропрочных сталей? Назовите основные легирующие комплексы, применяемые в сталях.
476
7.Назовите способы классификации конструкционных сталей. Дайте классификацию сталей по равновесной структуре и по структуре, получаемой при охлаждении на воздухе.
8.Дайте классификацию сталей по химическому составу и по качеству.
9.Расшифруйте принципы маркировки отечественных легированных конструкционных сталей. Какие элементы и в каком количестве содержатся в сталях: 15Х2НМФАА, 10Х13М2БФР, 12Х18Н12Т, 04Х15Н35М2БТЮР?
10.Назовите основные структуры систем Fe−С в области «стальной» концентрации углерода. Дайте характеристику каждой фазы.
11.Предскажите структуру, фазовый состав и свойства стали с 0,05 % С в состоянии термодинамического равновесия и объясните изменение структуры и свойств при: закалке от 930 °С; последующем отпуске при 500 °С.
12. Предскажите структуру, фазовый состав и свойства стали с 0,5 % С в состоянии термодинамического равновесия и объясните изменение структуры и свойств при: закалке от 950 °С; последующем отпуске при 700 °С.
13. Предскажите структуру, фазовый состав и свойства стали с 0,8 % С в состоянии термодинамического равновесия и объясните изменение структуры и свойств при: закалке от 800 °С; последующем отпуске при 600 °С.
14.Какова роль углерода в стали? При каких концентрациях углерода в структуре стали появляется цементит? Что такое легированный цементит?
15.Дайте характеристику диаграммы состояния Fe−Сr. Как влияет введение углерода в сплав Fe−Сr на диаграмму состояния?
16.Предскажите структуру сплавов Fe−8 % Сr, Fe−12,5 % Сr и Fe−18 % Сr, образующихся после закалки от 1100 °С. Какие процессы происходят при длительном нагреве их при 600 °С? Назовите формирующиеся фазы.
17.Какая структура образуется при быстром охлаждении сплава
Fe−40 % Сr от 1000 °С? При последующем длительном нагреве его при
800°С?
18.Какие элементы образуют в сталях устойчивые карбиды? Как зависит это от электронного строения легирующего элемента? Какие карбиды более вероятны в равновесных условиях в структуре стали, содержащей Сr и V, и почему?
19.Какие карбиды имеют структуру фаз внедрения? Каков критерий возможности образования фаз внедрения? Дайте классификацию карбидов в легированных сталях.
20.В чем смысл введения эквивалентов хрома и никеля? Пользуясь диаграммой Шеффлера (рис. 23.128), определите класс сталей: 03X30, 12Х2НМФА, 08Х16Н11М3, 10Х13М2БФР, Х18Н8, Х16Н15М3БР.
477
21.Перечислите типы основных упрочняющих фаз в стали. Назовите их достоинства, недостатки и эффективность.
22.Назовите основные виды термических обработок сталей и их применение.
23.От чего зависит температура закалки и какие процессы при этом происходят?
24.Для чего применяется старение и как выбирается режим старения? Назовите примерные оптимальные температурные интервалы старения
легированной стали, упрочняемой карбидами типа М23С6, γ′-фазой и фазой Лавеса.
25.Какие виды распада твердого раствора при старении вы знаете? Дайте их характеристики.
26.Назовите температурно-силовые условия работы теплоустойчивых жаропрочных и жаростойких сталей. Какие стали к ним относятся?
27.Что такое прокаливаемость? Какое значение она имеет при создании, например, корпуса ядерного реактора?
28.Какие пути улучшения прокаливаемости сталей вы знаете? Назовите наиболее эффективные элементы для увеличения прокаливаемости стали.
29.Какие стали относятся к сталям перлитного класса? Какова их структура?
30.Чем вызвана отпускная хрупкость низколегированных сталей? В
чем причины охрупчивания сталей в интервале 250−400 °С, 600−625 °С, 400−600 °С?
31.Назовите основные легирующие элементы, применяемые в реакторных перлитных сталях. Какова их роль в стали?
32.Назовите структуру, фазовый состав и свойства стали 15Х3НМФАА в состоянии термодинамического равновесия и объясните изменение структуры и свойств при: закалке от 850 °С; последующем отпуске при 300 °С.
33.Какие виды, упрочнения применяют к перлитным сталям?
34.Какова роль Ni в перлитных сталях? В чем заключается опасность использования его в качестве легирующего элемента? Назовите вредные примеси в перлитной стали, механизмы их влияния на охрупчивание.
35.Какие пути повышения коррозионной стойкости перлитных сталей
вкислородосрдержащей среде вы знаете?
36.Назовите основные легирующие элементы и их значение в хромистых сталях. Какие стали относятся к коррозионно-стойким?
37.Какова роль углерода в хромистых сталях? Предскажите структуру сталей 05X13, 12X13, 25X13 и 40X13 в равновесном состоянии.
38.Предскажите структуру сталей 20X9, 20X13, 10Х17Н2 и 80X16 после закалки.
478
39.Какие стали относятся к мартенситному классу? Назовите преимущества и недостатки этих сталей.
40.Перечислите основные карбидные и интерметаллические упроч-
няющие фазы, встречающиеся в сталях с 12−13 % Сr после длительного старения. В чем состоит принципиальное отличие фазового состава хромистых сталей от низколегированных сталей?
41.Какие изменения претерпевают механические свойства сталей типа Х13 при отпуске в интервале температур: до 500 °С, 500−600 °С, 720−750 °С?
42.От чего зависит структура хромистой стали, охлаждаемой из аустенитной области? Как получить при комнатной температуре мартенситную структуру?
43.Какие процессы происходят при распаде закаленного мартенсита
при отпуске в интервале температур 450−470 °С, 450−550 °С, выше
550°С?
44.Какие процессы происходят в двухфазной стали 12Х12В4МФ при: закалке от 1150 °С; старении при 600 °С в течение 10 ч и 1000 ч? Назовите фазовые составляющие, присутствующие в стали при каждой операции.
45.Предскажите структуру, фазовый состав стали 12Х13М2БФР в состоянии термодинамического равновесия и объясните изменение структу-
ры и свойств при: закалке от 1000 °С; последующем отпуске при
650°С.
46.Предскажите структуру стали Х28 после охлаждения от 1000 °С. Какие легирующие элементы используют для снижения склонности ста-
лей с 25−30 % Сr к росту зерна, повышения жаростойкости?
47.В чем заключается принцип создания высокопрочного состояния мартенситно-стареющих сталей? Какие элементы составляют основу сталей этого класса, какие легирующие элементы используют? Какая оптимальная температура старения легированного мартенсита?
48.Пользуясь диаграммой состояния Fe−Ni на рис. 23.170, объясните, какие процессы происходят в сплавах Fe − 2 % Ni и Fe − 10 % Ni при: закалке от 1000 °С; медленном охлаждении от 1000 °С; изотермическом нагреве закаленных сплавов при 320 и 450 °С. При каких концентрациях
Ni превращение γ→α протекает как мартенситное, а не диффузионное?
49.Какова коррозионная стойкость хромистых сталей в воде и паре по сравнению с перлитными сталями? Какие пути повышения коррозионной стойкости хромистых сталей в теплоноситеях вы знаете?
50.При каких условиях возможно обезуглероживание хромистых сталей в жидкометаллических теплоносителях?
51.Назовите концентрации Ni для создания коррозионно-стойких ста-
лей с аустенитной структурой. При каких концентрациях Сr и Ni обеспе479
чивается однофазная γ-структура? Появление каких фаз можно ожидать в коррозионно-стойкой аустенитной стали при: снижении содержания Ni менее 8−9 %; повышении содержания Сr выше 20 %?
52.Назовите концентрационную область существования однофазной аустенитной структуры в системе Fe−Сr−Мn. В чем заключаются преимущества и недостатки замены никеля марганцем в аустенитных корро- зионно-стойких сталях?
53.Назовите основные легирующие элементы и их роль в аустенитных сталях. С чем связано эффективное влияние Мо и W, Ti и Nb, Al и Ti на жаропрочность аустенитных сталей? Для чего вводят в стали небольшие количества В, Y, РЗМ?
54.Какие меры применяют для предотвращения появления α- и σ-фаз
ваустенитных сталях?
55.Какие карбиды встречаются в нелегированных (например, Х18Н9) и легированных (например, Х18Н12М2Т) аустенитных сталях? В чем за-
ключается причина отсутствия карбидов типа МоС, WC, Mo2C, W2C в хромоникелевых сталях?
56.Какие виды упрочнения применяют в аустенитных сталях? Назовите основные виды упрочняющих фаз в сталях этого класса. Какая термообработка используется для создания жаропрочной структуры коррозион- но-стойкой хромоникелевой стали при использовании интерметаллидного
упрочнения: γ′-фазой, фазой Лавеса?
57.Назовите процессы, происходящие при нагреве дисперси-онно-
упрочненной γ′-фазой и фазой Лавеса Fe2Mo аустенитной стали 05Х15Н35М2БТЮР до температур: 875, 1000 и 1200 °С. Какие фазы сохраняются в структуре стали после закалки с этих температур?
58.Предскажите наличие и тип возможных фазовых превращений и объясните изменение структуры и свойств стали 0Х14Н28В3Т3ЮР в процессе: закалки от 1150 °С; закалки и старения при 750 °С.
59.Предскажите структуру стали Х12Н20Т3ЮР после: закалки от 1150 °С; длительном старении при 650, 750 и 850 °С.
60.Какие аустенитные стали относятся к гомогенным? Какие фазы присутствуют в этих сталях после: закалки, старения?
61.Дайте характеристику фаз в сталях Х18Н9Т, Х16Н15МЗБ и Х16Н15МЗБР. Когда образуются первичные карбиды и карбо-нитриды типа МС и M(C, N)?
62.Предскажите структуру, фазовый состав и свойства стали Х16Н15М3БР в состоянии термодинамического равновесия и объясните изменение структуры и свойств при: закалке от 1100 °С; последующем старении при 800 °С.
480
63.Какие аустенитные стали относятся к сталям с карбидным упрочнением? Каково количество углерода в этих сталях? Какие особенности термообработки сталей этого типа?
64.Какие аустенитные стали относятся к сталям с интерметаллидным упрочнением? Каково количество углерода в этих сталях? Какие особенности легирования и термообработки сталей этого типа?
65.Назовите основные интерметаллидные упрочняющие фазы в аустенитных сталях с дисперсионным упрочнением. Дайте характеристику этих фаз.
66.Пользуясь диаграммой распада дисперсионно-упрочняе-мой аустенитной стали 04Х15Н35М2БТЮР (рис. 23.199) предскажите микроструктурные изменения с увеличением времени нагрева при: 500, 700, 800
и1000 °С. При каких температурах происходит в этой стали наиболее
интенсивное выделение фаз: γ′-Ni3(Al, Ti), Fe2Mo?
67.Какова коррозионная стойкость аустенитных сталей в пароводяных и жидкометаллических средах? Какие примеси в теплоносителях оказывают отрицательное влияние на коррозионную стойкость аустенитных сталей? Каковы механизмы такого влияния?
68.Что такое межкристаллитная коррозия? В чем причина подверженности аустенитных коррозионно-стойких сталей межкри-сталлитной коррозии? При каких температурах она проявляется?
69.Назовите основные пути повышения стойкости аустенитных кор- розионно-стойких сталей против межкристаллитной коррозии. Какие легирующие элементы наиболее эффективны в подавлении этого вида коррозии аустенитных сталей?
70.В чем смысл стабилизирующего отжига в подавлении межкристаллитной коррозии аустенитных сталей? Какие режимы отжига при этом используют?
71.Что такое коррозионное растрескивание аустенитных сталей, при каких условиях проявляется? В каких средах и по какой причине оно наиболее интенсивно протекает?
72.Назовите пути повышения сопротивляемости аустенитных сталей коррозионному растрескиванию.
73.К каким последствиям может привести протекание межкристаллитной коррозии и коррозионного растрескивания оболочки твэлов, сделанной из аустенитнои коррозионно-стойкой стали?
74.Каковы причины науглероживания аустенитных коррозионностойких сталей в жидкометаллических теплоносителях?
481

23.4.Жаропрочные никелевые сплавы
23.4.1.Основные свойства никеля
Элемент Ni был открыт в 1751 г., а его промышленное использование началось в середине XIX века.
Никель (порядковый номер z = 28 в Периодической системе элементов Д.И. Менделеева) является переходным металлом с недостроенной d-оболочкой и заканчивает ряд переходных металлов
в IV периоде. Электронное строение свободных атомов никеля
3s23p63d84s2.
Никель имеет ГЦК решетку с а = 0,35238 нм (20 °С) и вплоть до температуры плавления (1453 °С) у него отсутствуют аллотропические превращения. Для Ni характерно сочетание высокой прочности (σв = 280 ÷ 560 МПа) и модуля упругости (Е = 196 ÷ 220 ГПа) с хорошей пластичностью (δ = 30 ÷ 40%). Теплопроводность у никеля несколько выше [93 Вт/(м К)], чем у железа [75 Вт/(м К)]. Сечение поглощения тепловых нейтронов высокое − 4,6 1028 м2 (см.
табл. 23.1).
23.4.2.Легирующие элементы и примеси
вникелевых сплавах
Никель образует непрерывные твердые растворы с 8 элементами: Mn, Fe, Co, Cu, Rh, Pd, Pt и Au; растворимость в нем более 10 % имеет 21 элемент, от 1 до 10 % − 10 элементов, т.е. при создании сплавов на никелевой основе имеется широкий выбор легирующих элементов.
Основные легирующие элементы. Условиями выбора основ-
ных легирующих элементов являются1:
α > 10; ω > 0,5.
Этому требованию удовлетворяют, как видно из рис. 23.224, 26 элементов. Из них можно исключить явно дорогие Ru, Rh, Tc, Pd, Pt, Au, Ir, Ge, Be. Для создания жаропрочных конструкционных сплавов из оставшихся 15 элементов представляют практический
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П.16.2.3.
482

интерес только те, которые несущественно снижают Тпл никеля (не ниже 1270 °С). В стандартных жаропрочных сплавах никеля используют: Сr, Fe, Со, А1, Ti, Nb, Mo, Та, W, Re; кроме них, в некоторые промышленные сплавы вводят V, Si и Мn, однако целесообразность их применения для высокожаропрочных сплавов вызывает сомнения вследствие существенного снижения Тпл сплава (1202, 1152 и 1018 °С соответственно).
Рис. 23.224. Выбор легирующих добавок и определение вредных примесей сплавов никеля (Б.Б. Гуляев)
Вспомогательные легирующие элементы. Условия выбора1: 0,5 < α < 10; ω > 0,1 .
В качестве вспомогательных элементов можно привлечь восемь элементов: Sb, С, Те, Zr, Ca, Os, Ag и Li. Из них последние три (Os, Ag, Li) дорогие, Sb, Те и Са обладают низкой температурой плавления и вряд ли могут заметно улучшить свойства сплавов при их совместном введении с другими элементами. Поэтому практическое применение нашли только С и Zr, причем С образует карбиды со многими из основных легирующих элементов и может служить дополнительным упрочнителем при введении в небольших количествах.
Модификаторы. Элементы, отвечающие условиям
0,007 < ωNi < 0,008; βNi < 2,5; Tпр >1000 °С,
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П.16.2.4.
483

где Тпр − температура превращения в сплаве с Ni, потенциально могут являться модификаторами никелевых сплавов. Этим условиям удовлетворяют: В, Mg, Y, La, Ba, Hf и Sc, из которых практическое применение находят В, Mg, La, Ba. Кроме того, для модифицирования никелевых сплавов могут быть привлечены тугоплавкие соединения − карбиды, нитриды, оксиды, бориды.
Вредные примеси. В никелевых сплавах вредными примесями являются элементы, имеющие низкий критерий распределения и низкую температуру превращения, удовлетворяющие условию
α > 0,001; ω < 0,08; Тлр < 900 °С.
На практике в сплавах никеля ограничивают содержание S, Bi, P, Pb, As, Cd, а также щелочных металлов Rb, Cs, K; в сплавах практически отсутствуют Se и Sr. Кроме перечисленных, несомненно вредными примесями являются О2, Н2 и N2, которые могут быть источниками газовой пористости в отливках, а кислород, помимо этого, активно взаимодействует с образованием плен со многими компонентами жаропрочных сплавов: Сr, Мо, Al, Ti и др. В технических условиях, кроме того, оговариваются ограниченные содержания ряда элементов, не являющихся вредными, но могущих искажать картину легирования (Fe, Si, С, Сu, Sb, Zn, Sn и др.).
Легирующие комплексы1. Современные жаропрочные сплавы на никелевой основе имеют очень сложный состав: в них входят до 7−9 основных легирующих элементов и большое количество примесей, содержание которых в сплаве следует контролировать. Как было отмечено выше, никель образует твердые растворы со многими элементами, что обусловливает значительные возможности достижения высокой жаропрочности сплавов на его основе. Но важно отметить, что растворимость легирующих элементов в многокомпонентных сплавах на основе никеля может существенно различаться в сторону уменьшения от значений, полученных, при изучении бинарных сплавов никель − легирующий элемент.
Многие из легирующих элементов, растворимые в никеле или нихроме, являются эффективными упрочнителями и повышают сопротивление ползучести сплавов на основе никеля.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 16.2.4.
484
Несмотря на сложность составов жаропрочных никелевых сплавов, можно сформулировать следующие основные принципы, используемые при их создании.
1.Жаропрочные сплавы представляют собой основной (матричный) γ-твердый раствор на хромоникелевой основе, легированный тугоплавкими элементами-упрочнителями (Mo, W, Nb), причем наиболее эффективное влияние оказывает на жаропрочность именно комплексное введение легирующих элементов. В сплавы, предназначенные для обычной техники (не реакторные конструкционные материалы) часто вводят кобальт. Содержание легирующих элементов в сплаве зависит от его назначения и экономической целесообразности.
2.В сплавах обязательно присутствуют титан, ниобий и алюми-
ний (суммарно до 8−10 %), которые в основном обеспечивают образование главной упрочняющей фазы этих сплавов γ′-фазы.
3.Присутствующие в сплавах хром и алюминий обеспечивают сопротивление окислению и газовой коррозии вследствие образования защитных пленок, богатых оксидами Сr2O3 и А12O3.
4.Углерод содержится в сплавах в небольших количествах
(обычно 0,08−0,12 %), образуя карбиды и карбонитриды. Существенное влияние оказывает также бор, который вводится в сплавы в количестве 0,005−0,015 % и образует бориды типа МеВ2. Кинетика выделения и морфология карбидных и боридных фаз при кристаллизации, термообработке и в процессе эксплуатации также в значительной степени определяет жаропрочность сплавов на никелевой основе.
5. Важное значение имеют в никелевых сплавах легкоплавкие примеси (Pb, Cd, Ag, Bi, Sb, S), содержание которых следует ограничивать, так как они снижают жаропрочные и технологические свойства сплавов. Уменьшение количества примесей возможно благодаря применению чистых шихтовых материалов, введению РЗМ и специальной обработке расплавов, применением различных методов специальной металлургии.
Таким образом, жаропрочность, жаростойкость и другие характеристики сплавов на никелевой основе связаны с оптимизацией их состава по соотношению легирующих элементов, входящих в мат-
485
ричный γ-твердый раствор и упрочняющие интерметаллидные, карбидные и боридные фазы, а также с уровнем содержания вредных легкоплавких примесей.
Выбор состава сплава следует проводить с учетом его рабочей температуры, напряжений, агрессивности среды, ресурса и режима работы.
В сплавы, предназначенные для работы при сравнительно невысоких температурах (750−850 °С) длительное время, вводят повышенное количество хрома (до 16−18 %), молибдена и вольфрама (до 10−12 % суммарно), титана, ниобия и алюминия (8−10 % суммарно). Это дает возможность получить большое количество упрочняющей γ′-фазы и высокую жаропрочность матрицы.
Для высокотемпературной (975−1050 °С) работы важно положение температуры солидуса сплава. Поэтому в сплавах ограничивают содержание хрома (6−10 %), молибдена (3−4 %) и титана. Введение дополнительно кобальта и вольфрама несколько повышает температуру солидуса, что полезно.
При работе в средах повышенной агрессивности (например, содержащих соли, соединения ванадия и др.) важнейшим элементом, обеспечивающим коррозионную стойкость, считается хром.
Отсутствие полиморфных превращений Ni накладывает отпечаток на механизмы упрочнения при легировании и используемые для сплавов термообработки. Как и аустенитные стали, сплавы на основе Ni могут быть гомогенными (нихромы, инконели) и гетерогенными, или стареющими (нимоники). Гомогенные сплавы содержат минимальное количество С и других легирующих элементов, которые могли бы образовать вторые фазы. Они не обладают высокой жаропрочностью и используются для ненагруженных деталей в качестве жаростойких материалов (нагреватели печей сопротивления, различные жаростойкие обшивки и др.). Основными тяжело нагруженными жаропрочными конструкционными сплавами являются нимоники, к которым применяют высокоэффективное комплексное легирование. Нимоник «классического» состава является комплексом Ni + Сr + Ti + Аl. В зависимости от условий эксплуатации и назначения изделия никелевые сплавы могут содержать наиболее перспективные элементы, образующие благоприят-
486
ные комплексы: Сr, Ti, W, Та, Mo, Nb, а также менее эффективные Al, Fe, Co, Re. Сплавы с твердорастворным упрочнением, содержащие такие элементы, как Сr, Mo, Nb и др., как правило, применяют в закаленном или нормализованном состоянии; дисперсион- но-твердеющие сплавы с Ti, Al и др. используют в состоянии старения.
Диаграммы состояния Ni−Cr, Ni−Ti, Ni−Al
Основным легирующим элементом в никелевых сплавах являет-
ся Сr, обеспечивающий высокое сопротивление окислению.
Хром и никель образуют диаграмму состояния эвтектического типа с температурой эвтектического равновесия 1345 °С (рис. 23.225). Хотя атомные радиусы Сr и Ni близки (rСr ≈ 0,127 нм, rNi ≈ 124 нм), но вследствие неизоморфности их решеток (Сr − ОЦК, Ni − ГЦК) они образуют ограниченные твердые растворы − γ-твердый раствор на основе Ni и α-твердый раствор на основе хрома. В области твердого раствора γ при понижении температуры до 580 °С может образоваться упорядоченная фаза CrNi2, имеющая ромбическую структуру типа MoPt2. Есть также сведения о возможности образования фазы CrNi3 при снижении температуры до 540 °С, однако конкретных сведений об этом недостаточно.
В области концентраций Сr (до 20 %), обычно используемых в конструкционных сплавах, при всех температурах фиксируется γ- твердый раствор Сr в Ni (растворимость Сr в Ni при комнатной температуре составляет более 20 %). Особое место в создании дис-
персионно-твердеющих сплавов на основе никеля занимают Ti и Аl.
Начальные участки диаграмм состояния Ni−Ti и Ni−Al приведены на рис. 23.226.
Система Ni−Ti характеризуется наличием двух соединений Ni3Ti и NiTi, плавящихся конгруэнтно соответственно при 1379±1 и 1240 °С, а также NiTi2, образующегося при 1015 °С по перитектической реакции. Практически важной как упрочняющее выделение в никелевых сплавах является фаза η-Ni3Ti, которая в равновесном состоянии имеет ГПУ решетку с а = 0,51010 нм и с = = 0,83067 нм.
487
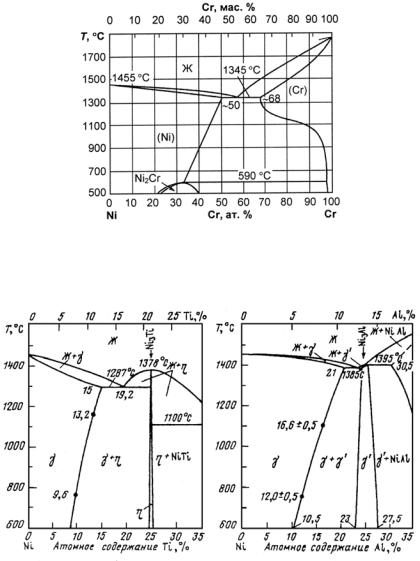
Рис. 23.225. Диаграмма состояния системы Сr−Ni
а |
б |
Рис. 23.226. Температурная зависимость растворимости η-фазы в сплавах системы Ni−Ti (а) и γ′-фазы в сплавах системы Ni−Al (б)
488
Система Ni−Al характеризуется наличием четырех соединений: Ni3Al, NiAl, Ni2Al3 и NiAl3. Соединение NiAl плавится конгруэнтно при 1638 °С; Ni3Al, Ni2Al3 и NiAl3 образуются по перитектическим реакциям соответственно при 1395, 1133 и 854 °С. Практическое значение в жаропрочных сплавах имеет фаза γ′-Ni3Al с ГЦК решеткой (типа Cu3Al) с a = 0,356 нм.
Характерным для обеих диаграмм состояния является ограниченная растворимость Ti и Аl в Ni при всех температурах от комнатной до Тпл, что позволяет подвергать термообработке никелевые сплавы, содержащие эти элементы, и создавать дисперсионноупрочняемые сплавы на основе никеля со структурой, состоящей из γ-фазы и выделений η-Ni3Ti, γ′-Ni3Al или γ′-Ni3(Ti, Al).
23.4.3.Влияние легирующих элементов на структуру
исвойства никелевых сплавов
Основное преимущество высоконикелевых сплавов заключается в том, что они обладают лучшими жаропрочными свойствами по сравнению с хромоникелевыми сталями. Рабочая температура сталей при наличии внешней нагрузки обычно не превышает 650−750 °С, а у сплавов на основе никеля она может достигать
800−850 °С и более.
Отмечается своеобразное поведение Ni при образовании сплавов и интерметаллидов. Его валентность, так же как и большей части переходных металлов, является, по-видимому, переменной и принимается равной обычно в интервале от 0 до 2. Установлено также, что искажения кристаллической решетки твердых растворов на основе Ni непрерывно и плавно возрастают по мере увеличения числа легирующих компонентов и их концентрации. Это может свидетельствовать о том, что в твердых растворах на основе Ni возникают дополнительные полярные связи и определяющим фактором стабильности фазы является электронная концентрация, а не различие размеров атомов.
В табл. 23.8 и 23.90 приведены составы и механические свойства типичных никелевых сплавов.
489
|
|
|
|
|
|
|
|
|
|
|
Таблица 23.89 |
|
|
|
Составы и некоторые области применения типичных никелевых сплавов |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Материал |
|
|
|
Химический состав, % |
|
|
Применение |
||||
|
|
С |
Ni |
Сr |
Ti |
А1 |
Mo |
W |
Fe |
Другие |
|
|
|
00ХН40М4Б |
0,013 |
40,9 |
19,39 |
− |
− |
4,71 |
− |
Ост. |
0,63Nb |
Кандидатный материал для |
|
|
(ЭП-753) |
|
|
|
|
|
|
|
|
|
быстрых реакторов и ТЯР |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нимоник РЕ-16 |
0,08 |
43,7 |
16−17 |
0,9−1,3 |
0,9−1,2 |
3−4 |
− |
Ост. |
0,001−0,02В; |
Материал активной зоны |
|
|
(Х17Н42М4ТЮР) |
|
|
|
|
|
|
|
|
0,1V; 0,04Zr |
быстрых реакторов; пер- |
|
|
|
|
|
|
|
|
|
|
|
|
спективен для первой стен- |
|
|
|
|
|
|
|
|
|
|
|
|
ки ТЯР |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хастелой-Х |
<0,15 |
45−46 |
~22 |
0,44 |
− |
~9 |
− |
19−20 |
− |
Рассматривается для ЯЭУ |
|
490 |
(ХН45М) |
|
|
|
|
|
|
|
|
|
|
|
02Х20Н45М4БЧ |
0,016 |
45,45 |
19,64 |
0,08 |
0,1 |
4,0 |
− |
Ост. |
0,84Nb; 0,07Cu; |
Оболочки твэлов быстрых |
||
|
||||||||||||
|
(ЧС-42) |
|
|
|
|
|
|
|
|
0,05Y |
реакторов; кандидатный |
|
|
|
|
|
|
|
|
|
|
|
|
материал для первой стен- |
|
|
|
|
|
|
|
|
|
|
|
|
ки и бланкета ТЯР |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Х20Н45М4БРЦ |
0,022 |
44,9 |
19,35 |
0,02 |
0,16 |
3,55 |
− |
Ост. |
0,89Nb; 0,04Cu; |
То же |
|
|
(ЧС-43) |
|
|
|
|
|
|
|
|
0,035Zr; |
|
|
|
|
|
|
|
|
|
|
|
|
0,005B; |
|
|
|
|
|
|
|
|
|
|
|
|
0,008N2 |
|
|
|
Хастелой-А |
0,12 |
54,88 |
1 |
− |
− |
21 |
− |
19 |
3Mn; 1Si |
Для корпусов ядерных |
|
|
(Н55МГС) |
|
|
|
|
|
|
|
|
|
реакторов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХНМ |
− |
Ост. |
35−48 |
− |
− |
1−5 |
− |
− |
− |
Рассматривается для ЯЭУ |
|
|
Инконель-625 |
0,03 |
62,3 |
22,0 |
0,25 |
0,17 |
8,75 |
− |
1,86 |
4,24(Cd+Ta) |
Рассматривается для ЯЭУ |
|
|
(ХН62МТЮ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
490
|
|
|
|
|
|
|
|
|
|
|
Окончание табл. 23.89 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Материал |
|
|
|
Химический состав, % |
|
|
Применение |
|||
|
|
С |
Ni |
Сr |
Ti |
А1 |
Mo |
W |
Fe |
Другие |
|
|
ХН62МБВЮ |
<0,06 |
Ост. |
13 15 |
|
0,9 1,4 |
4,5 5,5 |
4 5 |
5,5 8, |
5,l 5,9Nb; |
Высоконагруженные сварные |
|
(ЭП-709) |
|
|
|
|
|
|
|
0 |
<0,01Ce |
изделия с рабочей температу- |
|
|
|
|
|
|
|
|
|
|
|
рой до 750 °С |
|
ХН70ВМТЮ |
0,12 |
Ост. |
13 16 |
1,8 2,3 |
1,7 2,3 |
2 4 |
5 7 |
5 |
0,1 0,5V; |
Лопатки газовых турбин с |
|
(ЭИ-617) |
|
|
|
|
|
|
|
|
0,02B; |
весьма длительным сроком |
|
|
|
|
|
|
|
|
|
|
0,02Ce |
службы при Т 850 °С |
|
Хастелой-С |
0,12 |
Ост. |
16 |
|
|
1,6 |
4,5 |
6 |
|
Рассматривается для ЯЭУ |
|
(ХН72МВ) |
|
|
|
|
|
|
|
|
|
|
|
Инконель-Х750 |
0,04 |
72,5 |
15,13 |
2,62 |
0,74 |
|
|
6,87 |
0,98(Nb+Ta) |
То же |
491 |
(ХН73БТЮ) |
|
|
|
|
|
|
|
|
|
|
ХН75МТЮ |
0,01 |
Ост. |
20,55 |
0,58 |
0,62 |
2,23 |
|
0,14 |
0,01Cu; |
Рассматривается для ТЯР |
|
|
(ЭП-125) |
|
|
|
|
|
|
|
|
0,01Ce |
|
|
ХН77ТЮР |
0,07 |
Ост. |
19 22 |
2,4 2,8 |
0,6 1,0 |
|
|
4,0 |
0,01B; |
Жаропрочный сплав для ис- |
|
(ЭИ-437Б) |
|
|
|
|
|
|
|
|
0,02Ce |
пользования при высоких |
|
|
|
|
|
|
|
|
|
|
|
температурах. Втурбострое- |
|
|
|
|
|
|
|
|
|
|
|
нии (рабочие лопатки, тур- |
|
|
|
|
|
|
|
|
|
|
|
бинные диски, кольца и дру- |
|
|
|
|
|
|
|
|
|
|
|
гие детали газовых турбин) |
|
|
|
|
|
|
|
|
|
|
|
для службы приТ 750 °С |
|
ХН78Т |
0,12 |
Ост. |
19 22 |
0,15 0,35 |
0,03 |
|
|
6 |
|
Трубы и листы для камер |
|
(ЭИ-435) |
|
|
|
|
|
|
|
|
|
сгорания для использования |
|
|
|
|
|
|
|
|
|
|
|
кратковременно при |
|
|
|
|
|
|
|
|
|
|
|
1200 °С, ограниченный срок |
|
|
|
|
|
|
|
|
|
|
|
при 1000 °С |
|
Х20Н80 (нихром) |
0,15 |
77 |
20 |
|
0,2 |
|
|
Ост. |
|
Жаростойкий материал |
491

|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 23.90 |
||
|
|
Механические свойства некоторых никелевых сплавов |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Материал |
Термическая |
Тисп, |
Е, ГПа |
σ , МПа |
σ0,2, |
δ, % |
ψ, % |
ак, |
|
σдл, МПа, |
||||
|
за время, ч |
||||||||||||||
|
|
обработка* |
°С |
|
в |
МПа |
|
|
кДж/м2 |
102 |
|
|
103 |
|
104 |
|
|
|
|
|
|
|
|
||||||||
|
ХН45Ю |
Нагрев 1050−1150 |
20 |
207 |
600−650 |
220−300 |
15−50 |
20−55 |
− |
− |
|
|
− |
|
− |
|
(ЭП-747) |
°С, воздух |
800 |
124 |
150 |
100 |
33 |
30 |
− |
− |
|
|
− |
|
− |
|
|
|
1000 |
− |
50 |
30 |
40 |
40 |
− |
20 |
|
|
− |
|
− |
|
|
|
1200 |
− |
20 |
− |
90 |
75 |
− |
5 |
|
|
2,5 |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Х20Н45М4БЧ |
Аустенизация |
20 |
198 |
620−650 |
250−300 |
52−76 |
80 |
− |
− |
|
|
− |
|
− |
492 |
(ЧС-42) |
1050 °С, 1 ч, вода |
300 |
184 |
510−580 |
200−280 |
51−71 |
78 |
− |
− |
|
|
− |
|
− |
|
|
650 |
− |
450 |
180 |
52−72 |
55 |
− |
− |
|
|
− |
|
120−180 |
|
|
|
|
|
|
|
||||||||||
|
|
|
800 |
− |
− |
100 |
80 |
− |
− |
− |
|
|
− |
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХН56ВМТЮ |
Нагрев 1200 °С, |
20 |
219 |
1000 |
650 |
25 |
− |
800 |
− |
|
|
− |
|
− |
|
(ЭП-199) |
воздух |
800 |
175 |
700 |
600 |
5 |
− |
530 |
280 |
|
|
− |
|
− |
|
|
|
1000 |
− |
120 |
− |
30 |
− |
900 |
30 |
|
|
− |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХН70М |
Закалка |
20 |
− |
850 |
400 |
45 |
45 |
500 |
− |
|
|
− |
|
− |
|
ХН70МФ |
Закалка |
20 |
210 |
950 |
400 |
45 |
45 |
500 |
− |
|
|
− |
|
− |
|
ХН70Ю |
Закалка (1200 °С, |
20 |
− |
730−750 |
− |
30−75 |
− |
− |
− |
|
|
− |
|
− |
|
(ЭИ-652) |
10 мин), воздух |
800 |
− |
360 |
− |
14 |
− |
− |
85−90 |
|
|
50 |
|
29 |
|
|
|
1000 |
− |
86 |
− |
55 |
− |
− |
19 |
|
|
8 |
|
3,4 |
|
|
|
1200 |
− |
24 |
− |
136 |
− |
− |
5 |
|
|
2,2 |
|
0,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
___________
* Воздух − среда охлаждения.
492

|
|
|
|
|
|
|
|
|
|
Окончание табл. 23.90 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Материал |
Термическая |
Тисп, |
Е, ГПа |
в, МПа |
0,2, |
, % |
, % |
ак, |
дл, МПа, за время, ч |
|||||||
|
обработка |
|
|
|
МПа |
|
|
кДж/м2 |
10 |
2 |
|
10 |
3 |
|
10 |
4 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
С |
|
|
|
|
|
|
|
|
|
|
||||
|
ХН70ВМТЮ |
Закалка (1190±10 °С, |
20 |
200 |
1050 1070 |
700 |
14 16 |
13 16 |
|
|
|
|
|
|
|
|
|
|
(ЭИ-617) |
2 ч) + закалка |
800 |
145 150 |
700 720 |
580 |
4,5 6 |
9 10 |
|
240 250 |
|
175 |
|
125 |
|||
|
|
(1050 °С , 4 ч), воздух + |
900 |
130 |
490 |
380 |
14 |
19 |
|
130 |
|
|
|
|
|
|
|
|
|
старение (800 °С, 16 ч), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
воздух |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Инконель-600 |
Состояние поставки |
20 |
|
887 |
831 |
14,5 |
|
|
|
|
|
|
|
|
|
|
|
(ХН76ТЮД) |
(холодное волочение) |
500 |
|
770 |
700 |
16 |
|
|
|
|
|
|
|
|
|
|
493 |
|
|
700 |
|
473 |
421 |
43 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ХН77ТЮР |
Закалка (1080±10 °С, |
20 |
215 |
1000 |
650 680 |
13 20 |
16 21 |
300 500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
(ЭИ-437Б) |
8 ч), воздух + старение |
700 |
172 |
700 750 |
– |
15 |
20 |
|
410 |
|
300 |
|
180 |
|||
|
|
(700±10 °С, 16 ч), |
750 |
167 |
– |
– |
|
|
– |
300-350 |
|
200 |
|
110 |
|||
|
|
воздух |
800 |
161 |
500 |
420 |
12 |
20 |
900 |
200 |
|
100 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Закалка (1080 °С, 8 ч), |
20 |
|
1000 1050 |
660 740 |
14 34 |
15 18 |
300 |
|
|
|
|
|
|
|
|
|
|
воздух + старение |
700 |
|
800 820 |
540 550 |
16 20 |
21 |
|
440 |
|
300 |
|
140 |
|||
|
|
(750 775 °С, 16 ч), |
750 |
|
|
(640) |
(2 4) |
|
|
|
|
|
|
|
|
|
|
|
|
воздух |
|
|
520 |
2 3 |
|
– |
320 |
|
|
|
|
|
|
||
|
|
|
800 |
|
520 550 |
440 |
14 16 |
36 |
|
220 |
|
100 |
|
30 40 |
|||
|
|
|
|
|
|
(260) |
|
|
|
|
|
|
|
|
|
|
|
493
Наиболее используемыми легирующими элементами жаропрочных никелевых сплавов являются Сr, Аl и Ti. Легирование хромом обеспечивает высокое сопротивление окислению. Содержание Сr в зависимости от назначения и условий работы сплава обычно колеблется в пределах от 10 до 25 %. Сплавы Ni с Сr, получившие название нихромов, а также сплавы (известные как ферронихромы), в которых для удешевления часть Ni заменена на Fe (до 15 20 %), имеют жаропрочные свойства, аналогичные свойствам обычных аустенитных сталей (рис. 23.227). Это связано с тем, что их структура состоит из ограниченных по концентрации двух твердых растворов -твердого раствора на основе Ni и -твердого раствора на основе Сr или их смеси (см. рис. 23.225).
Легирование никеля хромом оказывает упрочняющее влияние главным образом при кратковременных испытаниях (табл. 23.91). При длительных испытаниях (рис. 23.228) увеличение концентрации Сr в -твердом растворе примерно до 20 % дает небольшое упрочнение. Значительное упрочнение наблюдается только при содержании 30 40 % Сr. Двойные сплавы, у которых структура состоит из смеси - и - твердых растворов, также обладают низкой жаропрочностью.
Таблица 23.91
Кратковременная прочность никеля и сплава 80 % Ni + 20 % Сr
Металл или сплав |
|
в, МПа, при температуре, С |
|
|||
|
20 |
400 |
600 |
700 |
800 |
900 |
Ni |
380 |
220 |
120 |
70 |
30 |
15 |
80% Ni + 20% Сr |
820 |
760 |
630 |
470 |
280 |
150 |
494
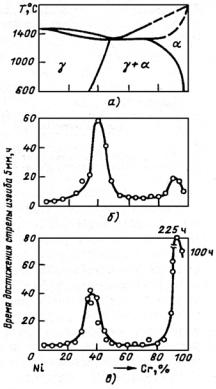
Рис. 23.228. Жаропрочность сплавов системы Ni−Cr:
а − диаграмма состояния; б − время достижения стрелы изгиба 5 мм при 1000 °С и σ = 27 МПа; в − время достижения стрелы изгиба 5 мм при 800 °С и σ = 123 МПа
Сплавы типа нихромов и ферронихромов с гомогенной структурой, состоящей из твердых растворов, обладают большим электрическим сопротивлением и высокой жаростойкостью и поэтому используются в основном для изготовления нагревателей, работающих при высокой температуре.
Повышение жаропрочности нихромов и ферронихромов достигается путем легирования титаном и алюминием (рис. 23.229). Упрочнение сплавов двойных систем Ni−Ti и Ni−Al может быть осу-
ществлено за счет создания дисперсной гетерогенной структуры,
495
состоящей из γ-твердого раствора (металлическая матрица) и упрочняющих фаз Ni3Ti и Ni3Al. Последние имеют переменную растворимость (см. рис. 23.226), и поэтому возможна термическая обработка (дисперсионное упрочнение). Интерметаллид Ni3Al имеет небольшую область гомогенности. Он растворяет Ti и небольшое количество Сr. Интерметаллидное соединение Ni3Ti (η-фаза) имеет гексагональную кристаллическую решетку (с/а =1,63) и не имеет области гомогенности; η-фаза не растворяет также ни хром, ни алюминий.
Рис. 23.229. Влияние легирующих элементов на длительную прочность сплавов типа Х20Н80 при 800 °С
В тройных сплавах систем Ni−Cr−Ti и Ni−Cr−Al растворимость Ti и Аl в никель-хромовом твердом растворе меньше, чем в двойных сплавах, вследствие чего выделение упрочняющих интерметаллидных η- или γ′-фаз происходит при меньших концентрациях Ti и Аl, чем в двойных системах Ni−Ti и Ni−Аl (см. рис. 23.226).
Необходимо отметить, что легирование нихромов только Аl или Ti не получило достаточного распространения. Так, интерметаллидное соединение титана с никелем Ni3Ti с ГПУ кристаллической решеткой не может быть полностью когерентно связанным с никелевой матрицей (ГЦК) и не растворяет другие легирующие элементы. Кроме того, существенное упрочнение можно получить только при значительных количествах Аl или Ti (см. рис. 23.229), а это резко снижает способность сплавов к деформации. Важным легирующим элементом в сплавах на основе никеля является алюминий.
Легирование алюминием, когда упрочняющей фазой является интерметаллид Ni3Al, обычно сочетается с легированием вольфра-
496
мом, молибденом и ванадием, находящимися в γ-твердом растворе (например, сплавы ХН42М4ТЮР, ХН75ВМФЮ и др., см. табл. 23.89), в результате чего достигается упрочнение γ-твердого раствора.
Более эффективно совместное введение титана и алюминия. В сплавах Ni−Cr−Ti−Al может отдельно присутствовать как фаза η-Ni3Ti, так и фаза γ′-Ni3(Ti, Al). При соответствующем составе сплава фазы η и γ′ могут присутствовать одновременно.
Важную роль в упрочнении жаропрочных сплавов на никелевой основе играет γ′-фаза Ni3(Ti, Al), способная частично растворять титан, поэтому в большинстве сплавов применяется совместное легирование титаном и алюминием (см. табл. 23.89); γ′-фаза имеет ГЦК кристаллическую решетку, близкую к решетке γ-твердого раствора, но с несколько большим параметром (около 0,358 нм). Титан, так же как и другие легирующие элементы, например Nb, вводят в никелевые сплавы совместно с Аl в таких количествах, чтобы они не образовывали самостоятельных интерметаллидных фаз, а входили бы в состав интерметаллидной фазы, образуемой алюми-
нием и никелем.
Подобие решеток приводит к существованию когерентной связи между частицами γ′-фазы и матрицей из γ-твердого раствора, а геометрическое несоответствие этих решеток − к искажению кристаллических решеток и внутренним напряжениям, достигающим наибольших значений на поверхности раздела частица−матрица и резко убывающих по мере удаления от частицы. Возникновение в матрице модулированного поля напряжений тормозит скольжение дислокаций, упрочняя тем самым сплав.
Изменение растворимости γ′-фазы в γ-твердом растворе в зависимости от температуры дает возможность упрочнять никелевые сплавы путем термической обработки − закалки (аустенизации) и последующего старения (дисперсионного упрочнения). Естественно, что чем больше количество интерметаллидной фазы растворяется при нагреве под закалку, а затем выделяется при старении из твердого раствора, тем больше ее упрочняющее действие и эффек-
497

тивность термообработки1. Обычно степень легирования, а следовательно, и упрочнения жаропрочных никелевых сплавов оценивают по суммарному содержанию титана и алюминия.
С увеличением содержания Ti и Аl в никель-хромовом растворе увеличивается количество γ′-фазы. Например, в сплаве ХН77ТЮ при содержании 0,7 % Аl количество γ′-фазы составляет около 5 %, а при содержании 1,8 % Аl − порядка 25 % (рис. 23.230, а). Общее увеличение количества интерметаллидной фазы приводит к росту температуры, при которой она сохраняется в достаточно большом для упрочнения сплава количестве, и, следовательно, к росту рабочей температуры сплава. Чем выше концентрация Ti и Аl, тем прочнее сплав в закаленном и состаренном состояниях. При этом, однако, необходимо учитывать технически допустимое снижение пластичности сплава, которое наблюдается при увеличении количества интерметаллидов, а также возможность изменения морфологии упрочняющей фазы, а следовательно, эффективности упрочнения этими частицами (см. рис. 23.181).
Количество упрочняющей фазы существенно изменяется также и в зависимости от температурно-временных режимов эксплуатации изделия (параметров старения) (рис. 23.230, б, в). Так, в зависимости от температуры и продолжительности выдержки закаленного сплава (например, типа ХН77ТЮ) при старении характерны следующие изменения структуры.
1. При нагреве до 550 °С даже за длительное время в закаленном γ-твердом растворе, обладающем прочностью σв ≈ 780 МПа и пластичностью δ ≈ 45 %, каких-либо структурных преобразований не обнаруживается, а период решетки не претерпевает заметных изменений. С увеличением температуры испытания длительность инкубационного периода сокращается (рис. 23.230, б).
2. При Т ≈ 700 °С подвижность атомов возрастает и происходит выделение частиц γ′-фазы, о чем свидетельствует уменьшение периода кристаллической решетки γ-твердого раствора (вследствие перехода растворенных атомов из матрицы в выделения), увеличение прочности до σв ≈ 1000 МПа и снижение пластичности до δ ≈ 25 % (продолжительность старения τ = 16 ч).
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 16.2.3.
498
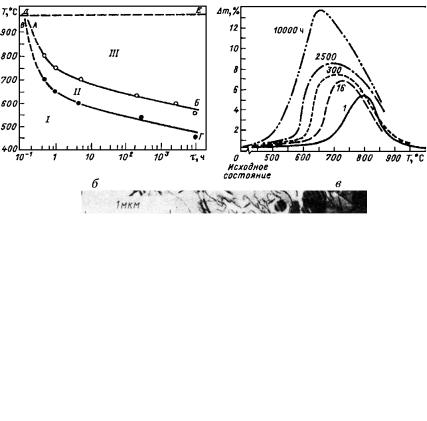
|
|
1 мкм |
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 23.230. Микроструктура состаренного высоконикелевого дисперсионно-твердеющего сплава ХН77ТЮ (а), диаграмма распада (б) и изменение количества фазовых выделений в зависимости от температуры
идлительности старения (в) (исходное состояние: нагрев при 1050 °С
втечение 1 ч, закалка в воду):
I − ранние стадии инкубационного периода; кривая ВГ характеризует начало появления разрешимых в ПЭМ зон предвыделений;
II − заключительная стадия инкубационного периода − образование зон предвыделений γ′-фазы; АБ − начало распада зон предвыделений у границ зерен
собразованием γ′-фазы;
III− обособление и коагуляция стабильной γ′-фазы типа N3(Al, Ti); линия ДЕ приблизительно определяет температуру, выше которой кубическая γ′-фаза
не образуется (А.М. Паршин)
499
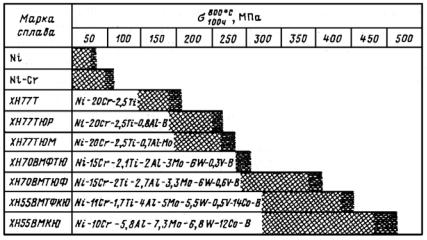
3. С увеличением температуры старения (800 °С и выше) возможно как ускорение процесса выделения γ′-фазы и рост ее частиц, так и частично растворение уже выделившихся частиц γ′-фазы и уменьшение их количества. И в том, и в другом случае дисперси- онно-упрочненный сплав может разупрочняться. Рост частиц второй фазы приводит к увеличению расстояния между ними, потере когерентности и более легкому скольжению дислокаций. При 850−950 °С длительность сохранения не только разрешаемых в электронном микроскопе зон предвыделения γ′-фазы, но и всего инкубационного периода (от возникновения областей, обогащенных титаном и другими легирующими элементами, до обособления стабильной γ′-фазы) исчисляется минутами.
Раздельное введение Mo, W и Nb не оказывает большого влияния на жаропрочные свойства нихромовых сплавов без Ti и Аl (см. рис. 23.229). Однако при комплексном легировании, когда эти элементы вводят вместе с Ti и Аl, эффект упрочнения более значительный, особенно в области высокой температуры (рис. 23.231).
Рис. 23.231. Роль легирующих элементов в изменении жаропрочности никеля (диаграмма изменения длительной прочности)
500
Молибден и вольфрам входят в γ-твердый раствор, снижают диффузионную подвижность атомов в нем и тем самым повышают температуру рекристаллизации и термическую стойкость, в результате чего затрудняется разупрочнение γ-твердого раствора при высокой температуре. Одновременно затрудняется рост частиц упрочняющей фазы.
Ниобий способствует повышению термической стойкости твердого раствора, а при введении в достаточном количестве участвует в образовании интерметаллидной фазы типа Ni3Nb с ГЦК решеткой или входит в состав γ′-фазы, а также в состав карбидов. В сложнолегированных сплавах Ni−Cr−Mo−Nb−Ti−Al оптимальное количество Nb составляет 1,8−2,5 %. Ниобий в сочетании с другими легирующими элементами повышает пластичность некоторых сплавов при длительных испытаниях, измельчает зерно сплава благодаря образованию карбидов NbC, а выделение карбидов по границам зерен упрочняет приграничные объемы.
При чрезмерно высоком комплексном легировании ферритостабилизирующими элементами − Cr, Mo, W, Ti, Al и другими − возможно снижение жаропрочных характеристик в результате образования грубых выделений первичных (выделяющихся из жидкой фазы) интерметаллидов, а также в результате появления α- и σ-фаз.
Кроме упрочняющей γ′-фазы в сплавах никеля, несмотря на малое количество углерода, образуются труднорастворимые карбиды TiC или карбонитриды Ti(C, N), а также хромистые карбиды Cr23C6, Cr7C3. В низкоуглеродистых сплавах углерод в основном входит в состав карбидов Сr23С6, принимающих участие в процессе дисперсионного твердения. В присутствии значительных количеств Мо и W наблюдаются карбиды типа М6С.
Повышение содержания углерода более 0,2−0,3 %, обеспечивающее образование в металле большого количества высокоэффективной упрочняющей карбидной фазы, сопровождается таким интенсивным развитием местной ликвации, что слитки растрескиваются в процессе кристаллизации. В результате во всех жаропрочных никелевых сплавах, выпускаемых в настоящее время, содер-
501
жание С и N ограничено (см. табл. 23.89). Кроме того, при повышенном содержании С возможно уменьшение количества упрочняющей γ′-фазы Ni3(Ti, Al) в связи с переводом части Ti в карбиды, что может также отрицательно влиять на жаропрочность.
Необходимо отметить, что в настоящее время интенсивно исследуется возможность получения крупных заготовок никелевых жаропрочных сплавов методами порошковой металлургии, которая позволит избежать макронеоднородности металла и получить деформируемые сплавы с содержанием более 1 % С. Исходный порошок в данном случае получают путем распыления жидкого металла нужного состава. Образующиеся при этом частицы − гранулы − однородны по химическому составу и обладают высокой пластичностью даже при значительном содержании углерода.
Жаропрочные свойства сплавов на никелевой основе улучшаются, если в них вводят малые количества бора, кальция, церия, бе-
риллия, циркония.
Бор сравнительно мало растворяется в γ-твердом растворе и при старении выделяется в виде боридных фаз различного состава
[Cr5B3B , (Cr, Ni)5B3B , M3B2B , (Mo, Cr, W, Ni)4B3B ] преимущественно по границам зерен. При малых концентрациях (до 0,05 %) он может находиться как в виде твердого раствора, так и в виде высокодисперсных боридных фаз. При повышении содержания бора наблюдаются более крупные образования боридных фаз с преимущественным выделением их по границам зерен. В присутствии В и С вольфрам и молибден могут входить в состав упрочняющих фаз − боридов и карбонитридов.
Малые добавки Са, Zr и Се способствуют измельчению частиц упрочняющей γ′-фазы и препятствуют ее росту при длительном старении. Однако такое влияние проявляется не всегда одинаково.
Вредное влияние на жаропрочные свойства никелевых сплавов оказывают такие примеси, как свинец, олово, сурьма, сера (рис. 23.232). Эти легкоплавкие примеси обычно располагаются по границам зерен (например, сера в виде Ni3S2 образует с никелем легкоплавкую эвтектику с температурой плавления 645 °С) и оказывают отрицательное влияние на жаропрочные свойства не только
502
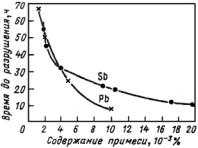
в интервале рабочей температуры (600−900 °С), но и при температуре горячей обработки давлением. Для снижения вредного влияния указанных примесей необходимо пользоваться чистыми исходными материалами и современными металлургическими мето-
дами, например вакуумной плав- |
|
||
кой и др. Улучшение технологи- |
|
||
ческих свойств никелевых спла- |
|
||
вов при вакуумной плавке обу- |
|
||
словлено |
существенным умень- |
|
|
шением в металле примесей О, N, |
|
||
Н, а также неметаллических |
|
||
включений и таких примесей, как |
|
||
Pb, Sn, S и др. |
|
||
Как показывают исследования, |
Рис. 23.232. Влияние Рb и Sb |
||
основное |
свойство жаропрочных |
||
на длительную прочность сплава |
|||
сплавов − длительная прочность − |
ХН77ТЮ при 700 °С и σ = 360 МПа |
||
определяется природой и распре- |
|
||
делением упрочняющих фаз. Для упрочнения никелевых сплавов необходимо учитывать следующие общие закономерности:
1)наиболее эффективно многокомпонентное легирование (на-
пример, сплавы Ni−Cr−W−Ti−Al или еще более сложные);
2)средний уровень прочности достигается при содержании упрочняющих фаз до 30 %; более высокому уровню прочности отвечают сплавы, содержащие до 60 % упрочняющих фаз;
3)оптимальное расстояние между частицами упрочняющих фаз
составляет 20−50 нм; 4) для предотвращения больших напряжений на границе раздела
фаза−матрица желательно, чтобы частицы второй фазы допускали частичное прохождение дислокаций; для предупреждения проскальзывания зерен относительно друг друга и снижения уровня межзеренной пластичности целесообразно на границах зерен иметь выделения упрочняющей фазы.
Эффективность многокомпонентного легирования связана с возникновением сложных по составу γ-твердых растворов, у которых по мере увеличения количества легирующих компонентов воз-
503
растает степень искажения кристаллической решетки. Например, в восьмикомпонентных сплавах на основе Ni параметры решетки γ-твердого раствора увеличиваются более чем на 1,9 % по сравнению с чистым никелем. В этих условиях существенно затормаживаются диффузионные процессы и упрочняющие фазы выделяются в виде субмикроскопических частиц и дисперсных включений, когерентно связанных с матрицей, которые при совместном действии оказывают максимальное сопротивление движению дислокаций в процессе ползучести. Сплавы в этом состоянии обладают наибольшей жаропрочностью.
Недостатком никелевых сплавов, основным и наиболее общим, является изменение СФС и свойств в процессе эксплуатации при высокой температуре. Во-первых, сплавы на основе Ni склонны к охрупчиванию во время работы при высокой температуре. Под влиянием одновременно действующих длительной нагрузки и повышенной температуры потеря пластичности у большинства сплавов происходит быстрее, чем при кратковременных испытаниях. Во-вторых, в процессе испытания никелевых сплавов под нагрузкой при высокой температуре они обнаруживают большой разброс значений предела длительной прочности. Исследованиями уста-
новлено, что этот разброс обусловлен неравномерностью распределения упрочняющей γ′-фазы и неоднородной величиной зерен структуры сплавов. Такие дефекты являются, как правило, наследственными, связанными с дефектами исходного слитка. Уменьшение разброса механических характеристик сплавов Ni в изделиях может быть достигнуто в результате создания равномерного распределения упрочняющей фазы и получения однородной по размеру зерен структуры путем многократной горячей деформации и термической обработки. В-третьих, в процессе эксплуатации дис- персионно-упрочняемых сплавов при повышенной температуре в условиях облучения нейтронами процессы фазовыделения ускоряются, что может привести к резкой потере пластичности и хрупкому разрушению таких сплавов.
В связи с указанными недостатками дисперсионно-твердеющих жаропрочных никелевых сплавов для использования в ядерных реакторах были разработаны растворно-упрочняемые никелевые
504
сплавы типа Х20Н45М4Б, которые дополнительно содержали небольшое количество Y (сплав ЧС-42) или В + Zr (сплав ЧС-43) (см. табл. 23.89). Основной фазовый состав и характеристики структуры сплавов такого типа при разных режимах термообработки приведены в табл. 23.92.
Таблица 23.92
Фазовый состав и характеристики структуры никелевых сплавов типа Х20Н45М4Б (ЧС-42 и ЧС-43)
|
|
Массовое содержание |
|
Режим термической |
|
М, размер d |
|
Фазовый состав |
и концентрация С |
||
обработки |
|||
|
основных вторичных |
||
|
|
||
|
|
фаз |
|
Аустенизация (1050 °С, 1 ч), |
γ + первичные Nb(C, N) |
Отсутствуют |
|
вода |
|
|
|
Аустенизация (1200 °С, 5 ч), |
γ + первичные Nb(C, N) |
Отсутствуют |
|
вода |
|
|
|
Аустенизация (1050 °С, 1 ч), |
γ + первичные Nb(C, N) |
Отсутствуют |
|
вода + старение (500 °С, 10 ч), |
|
|
|
воздух |
|
|
|
Аустенизация (1050 °С, 1 ч), |
γ + первичные Nb(C, N) |
М = 2,7 %, d ≈ 500 нм |
|
вода + старение (700 °С, |
+ карбиды M23C6 и |
(карбиды); |
|
500 ч), воздух |
М6С+ фаза Лавеса |
d ≈ 500÷2500 нм (фаза |
|
|
Fe2Mo |
Лавеса); |
|
|
|
Собщ ≈ 5 1016 м-3 |
Микроструктура никелевых сплавов ЧС-42 и ЧС-43 в аустенизированном состоянии (нагрев при 1050−1200 °С, 1−5 ч с последующим охлаждением в воде) состоит из аустенита и первичных карбонитридов ниобия Nb(C, N) (рис. 23.233, а). Выделений вторичных фаз не обнаружено, а первичные карбонитриды ниобия располагаются как по границам, так и внутри зерен, в большинстве случаев залегают в виде скоплений.
На рис. 23.233, б представлена типичная микрофотография состаренного сплава 03Х20Н45М4БЧ. Диаграмма структурных превращений сплавов типа Х20Н45М4Б приведена на рис. 23.234.
505

|
1 мкм |
|
|
|
а |
||||
|
|
|
|
|
|
|
|
|
|
|
2 мкм |
|
|
|
б |
||||
|
|
|
|
|
|
|
|
|
|
Рис. 23.233. Микроструктура сплава 03Х20Н45М4БЧ после:
а− аустенизации при 1050 °С, 1 ч + охлаждение на воздухе;
б− старения при 720 °С, 16 ч
Характерным для сплавов этого типа, так же как и для диспер- сионно-твердеющей стали 04Х15Н35М2БТЮР (см. п. 23.3.7), является длительный инкубационный период формирования вторичных фаз при температуре Т ≤ 500÷550 °С. Старение при 500 или 550 °С длительностью до 5000 ч не приводит к видимым изменениям микроструктуры в сплавах типа Х20Н45М4Б. При больших временах старения обнаруживаются очень мелкие частицы вторичных фаз,
506
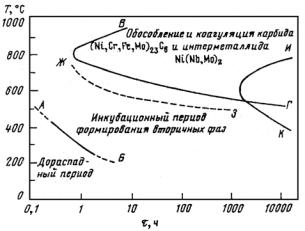
но вплоть до 10000 ч старения при этих температурах обособленных интерметаллидных фаз обнаружено не было.
Рис. 23.234. Диаграмма структурных превращений сплавов типа Х20Н45М4Б (сплавы ЧС-42П и ЧС-43П):
АБ − начало появления сегрегатов; область АБ−ВГ − инкубационный период формирования вторичных фаз; ВГ − начало обособления и коагуляции карбида (Cr, Fe, Mo, Ni)23C6 и интерметаллида Ni(Nb, Мо)2; ЖЗ − начало образования когерентной фазы Ni(Nb, Mo)2; ИК − температурно-временная область (правее кривой) развитого распада твердого раствора
Старение при более высокой температуре (Т > 550 °С) вызывает образование небольшого количества разрешимых в ПЭМ хромистых карбидов типа М23С6. В связи с тем, что концентрация углерода в рассматриваемых сплавах невысока (менее 0,03 %), а часть его связывается в первичных карбидах NbC и Nb(C, N), количество вторичных карбидов М23С6 относительно мало, и они распределены преимущественно по границам зерен. Максимальное количество карбидов М23С6 выпадает в интервале температур 600−800 °С, а с увеличением длительности старения температурный интервал их максимального обособления расширяется (550−800 °С). При длительном старении при повышенных температурах выделяется ин-
терметаллидная упрочняющая фаза Лавеса типа Fe2Mo (см.
507
табл. 23.92), распределенная относительно равномерно в матрице сплава.
Еще одной вторичной фазой, выделяющейся при старении сплавов типа Х20Н45М4Б, по исследованиям А.М. Паршина, предположительно является интерметаллид ниобид никеля Ni(Nb, Mo)2, который имеет ГЦК решетку типа карбида М6С с параметром решетки а ≈ 1,123 нм. Эта интерметаллидная фаза появляется позже, чем карбид М23С6, причем она выделяется преимущественно внутри зерен аустенита. По аналогии с распадом стали типа 316 (см. п. 23.3.7) можно предположить, что фаза Ni(Nb, Mo)2 растет на карбидах М6С, сохраняя на начальном этапе зарождения структуру, изоморфную кристаллической структуре карбида М6С.
При старении до τ ≤ 10 ч обособления фаз Ni(Nb, Mo)2 при всех температурах обнаружено не было (происходит обособление лишь карбидов М23С6 при 600−800 °С). После старения длительностью 500 ч наибольшее количество обособившихся частиц Ni(Nb, Mo)2 наблюдается при 700−800 °С, а при температурах 600 и 650 °С обособление фазы Ni(Nb, Mo)2 происходило только после старения длительностью соответственно 10000 и 5000 ч.
Характерными особенностями упрочняющей фазы Ni(Nb, Mo)2 в отличии от других фаз, присутствующих в аустенитных сталях, являются:
1)выделение и обособление ее происходит относительно равномерно по всему телу зерна;
2)форма частиц Ni(Nb, Mo)2 относительно округлая по сравнению, например, с пластинчатой фазой Лавеса в сталях;
3)инкубационный период формирования и обособления ее при
Т< 500÷550 °С значительно длиннее, чем для интерметаллидов в аустенитных сталях.
Такие особенности формирования СФС растворно-упрочняемых никелевых сплавов 03Х20Н45М4БЧ и 03Х20Н45М4БРЦ обеспечивают высокие механические характеристики, особенно пластичность, хорошую технологичность при достаточной жаропрочности этих сплавов (см. табл. 23.90).
508
23.4.4. Коррозионная стойкость никелевых сплавов
Никель обладает меньшим сродством к кислороду (для NiO значение G0298 = 211,8 кДж/г-атом О) по сравнению с Fe (для FeO значение G0298 = 245,8 кДж/г-атом О). Он является коррозионностойким в сухой и влажной атмосфере, в растворах электролитов и поэтому широко используется в качестве защитных покрытий (никелирование изделий).
При повышенной температуре Ni образует единственный оксидNiO с ГЦК структурой. Этот оксид изоморфен с FeO и является полупроводником р-типа с недостатком металла (избытком анионов).
Сплавы на основе Ni, работающие при высокой температуре, должны содержать в качестве легирующего элемента Сr для повышения сопротивления окислению никеля (для Сr2О3 значение
G0298 = 352,9 кДж/г-атом О). Оксиды NiO и Ci2О3 могут взаимодействовать друг с другом, образуя хромит никеля NiCr2О4
(NiO Cr2О3) со структурой шпинели. Возникновение этих трех оксидных соединений и распределение их в окалине зависят от конкретных условий и состава сплава.
Окисление сплавов системы Ni Сr на воздухе может происходить следующим образом. При содержании в сплаве до 10 % Сr во внешней части окалины преобладает оксид NiO, в то время как во внутренних объемах окалины Сr остается связанным в виде гранул хромита никеля NiCrО4, распределенных в матрице из NiO. В областях, примыкающих к границе раздела сплав окалина, наблюдаются выделения Сr2О3, окруженные чистым никелем. При увеличении содержания Сr в сплавах примерно до 20 % внутренний слой, состоящий из Сr2О3 и никеля, исчезает и на границе раздела окалина сплав формируется сплошной слой оксида Сr2О3, над которым располагается слой с включением шпинели NiCr2О4. В сплавах с содержанием Сr более 20 % образуется окалина, состоящая из шпинели NiCr2О4 и преобладающего слоя оксида Сr2О3, который в конце концов может стать единственной составляющей окалины. Однако приведенные выше представления об окислении никель-
509
хромовых сплавов не могут считаться окончательно установленными, поскольку недостаточно полными и надежными являются данные о взаимной растворимости оксидов NiO и Сr2О3, о растворимости оксидов в шпинели, о механизме переноса и диффузии атомов компонентов в этих соединениях.
Присутствие легирующих элементов в никель-хромовых сплавах оказывает соответствующее влияние на окисление. Так, введение Аl (до 4 %) эффективно улучшает защитные свойства оксида, вероятно, вследствие образования оксидов Аl2О3, затрудняющих диффузию кислорода. Легирование примерно до 0,7 % Ti уменьшает окисление, что, возможно, связано с упрочнением межатомных связей в твердом растворе. При более высоком содержании Ti наблюдается образование оксида TiО2, не обладающего достаточными защитными свойствами. Данные по влиянию легирования сплавов типа нихромов молибденом и вольфрамом на процессы окисления практически отсутствуют.
Вдвойных сплавах системы Ni−Мо скорость окисления сплавов
сатомным содержанием Мо до 3 % быстро возрастает; при атомном содержании до 12 % Мо она остается практически постоянной; при дальнейшем увеличении атомной концентрации Мо окисление уменьшается, достигая у сплавов с атомным содержанием Мо 20 % значений, близких к скорости окисления чистого никеля.
Легирование Ni вольфрамом по влиянию на процессы окисления примерно аналогично легированию молибденом.
Вслое окалины двойных сплавов системы Ni−Мо наблюдаются
оксиды NiO, NiMoО4 и МоО2, а сплавов системы Ni−W − оксиды NiO и NiWО4. Необходимо, однако, отметить, что процессы окисления этих сплавов изучены недостаточно.
Вцелом сплавы с высоким содержанием Ni весьма перспективны как коррозионно-стойкие материалы. Стойкость к КРН хромоникелевых коррозионно-стойких сталей в пароводяных средах возрастает с повышением содержания никеля (см. п. 23.3.7). Для обеспечения невосприимчивости к коррозионному растрескиванию содержание никеля в стали должно быть выше 40 %, т.е. это высоконикелевый сплав.
510
Коррозионные испытания сплава 1Х15Н75 в условиях, характерных для реакторов [наличие значительных напряжений, рН 11, содержании кислорода 0,2 0,5 мг/кг, хлоридов (в виде NaCl) 50 550 мг/кг, PO43- (в виде Na2HPО4) 250 350 мг/кг, скорость движения воды 3 9 м/с и температура 260 316 °С] показали, что никелевый сплав в отличие от коррозионно-стойкой аустенитной стали является устойчивым к КРН.
Никелевые сплавы обладают достаточной коррозионной стойкостью и в жидком натрии. Испытания при 650 °С в течение 4000 ч в статических изотермических условиях не обнаружили развития коррозионных процессов при содержании кислорода в жидком Na до 0,1 %. Изменения механических характеристик при контакте с жидкометаллическим теплоносителем незначительны: так, в сплаве 1Х15Н75 наблюдалось уменьшение в на 20 30 МПа и увеличение пластичности на 1 2 %; временное сопротивление разрушению в в более легированном сплаве 1Х18Н60Ю3 осталось без изменений, а пластичность возросла на 2 3%.
Использование тех или иных сплавов в контурах с жидкометаллическими теплоносителями ставит проблему совместимости их друг с другом. При разнородных по составу конструкционных материалах наблюдается перенос массы компонентов от одного сплава к другому. В этом отношении особенно нежелателен перенос углерода, так как разрушение карбидных фаз в одном сплаве может вызвать их разупрочнение, а науглероживание других сплавов их охрупчивание. Исследования совместимости никелевых сплавов (1Х20Н75) с хромистыми сталями (3X13) в жидком Na, содержащем кислорода до 0,1 % при 650 °С и выдержке до 4000 ч в статических условиях, показали, что переноса углерода не происходит. Следовательно, содержание 13 % хрома и 0,35 % углерода обеспечивало при этой температуре достаточную стабильность сложных карбидов типа (Fe, Cr)23C6 в среде жидкого натрия.
При контакте с фтористыми солями (LiF, BeF2, ThF4, UF4) типичные по составу никелевые сплавы показали себя не с лучшей стороны. Например, в сплаве инконель (78 % Ni; 15 % Сr; 7 % Fe) было обнаружено значительное избирательное выщелачивание
511
хрома. В сплаве хастеллой-В (65 % Ni; 1 % Сr; 28 % Мо; 4 % Fe), несмотря на высокую коррозионную стойкость, в результате выделения вторичных фаз наблюдалась значительная потеря пластичности в интервале температуры 350−815 °С; кроме того, в этом температурном интервале высокое содержание Мо в сплаве способствовало образованию на внешней поверхности, контактирующей с воздухом, соединения NiMoО4, которое при циклических изменениях температуры отслаивалось.
23.4.5. Области применения никелевых сплавов
Никель используется во многих важных в техническом отношении сплавах. На основе Ni или при значительном содержании его в качестве легирующего элемента изготавливаются разнообразные по свойствам сплавы: конструкционные и термоэлектродные сплавы, сплавы сопротивления, сплавы с особыми физическими свойствами, а также большое число жаропрочных сплавов (сплавы типа
нимоников).
Сложнолегированные сплавы на основе Ni в отличие от сплавов на основе Fe характеризуются значительно более высокой жаропрочностью при температуре 800−900 °С и поэтому находят весьма широкое применение в различных отраслях науки и техники.
В настоящее время сплавы на никелевой основе имеют наибольшее значение в качестве жаропрочных материалов, предназначенных для работы при температурах от 700 до 1100 °С. Их используют в газовых турбинах двигателей самолетов, кораблей, энергетических установок, при изготовлении деталей ракетнокосмической техники, в нефтехимическом оборудовании. Так, в авиационном газотурбинном двигателе более 70 % массы составляют жаропрочные сплавы на никелевой и железоникелевой основах − это диски, сопловые и рабочие лопатки турбин, камеры сгорания и т. п.
Резко возросло применение никелевых сплавов и при изготовлении стационарных газовых турбин, так как повышение рабочих температур позволяет значительно улучшить их техникоэкономические показатели.
512
Таблица 23.93
Химический состав, %, и максимальная рабочая темпкратура жаропрочных литейных сплавов на никелевой основе
|
|
|
|
|
|
|
|
|
|
|
|
|
Другие |
max |
|
|
Сплав |
С |
Si |
Мn |
Сr |
Со |
Мо |
Ti |
А1 |
W |
V |
Fe |
элементы |
Траб , °С |
|
|
ЖС3 |
0,11−0,16 |
≤ 0,6 |
≤ 0,6 |
14−18 |
− |
3−4,5 |
1,6−2,3 |
1,6−2,2 |
4,5−6,5 |
− |
≤ 8,0 |
≤ 0,3V; |
800−850 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≤ 0,02В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЖС3Д |
0,08−0,13 |
≤ 0,4 |
≤ 0,4 |
11−13 |
− |
3,5−4,5 |
2,5−3,2 |
4,3−4,8 |
− |
− |
≤ 2,0 |
≤ 0,015Се; |
≤ 900 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≤ 0,02В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
513 |
ЖС6 |
0,11−0,18 |
≤ 0,4 |
≤ 0,4 |
11,5−13,5 |
− |
4−5,5 |
2,2−2,8 |
4,7−5,2 |
6−8 |
− |
≤ 2,0 |
0,02В |
800−1000 |
|
ЖС6К |
0,13−0,2 |
≤ 0,4 |
≤ 0,4 |
10,5−12,5 |
4−5 |
3,5−4,5 |
2,5−3,0 |
5−6 |
4,5−5,5 |
− |
≤ 2,0 |
0,02В |
800−1050 |
||
|
|||||||||||||||
|
ВЖ36- |
≤ 0,08 |
≤ 0,5 |
≤ 0,5 |
10−12 |
− |
3,7−4,5 |
0,4−0,6 |
4,8−5,2 |
7−9 |
0,7−1,1 |
≤ 1,5 |
0,10В; |
≤ 900 |
|
|
Л1 |
|
|
|
|
|
|
|
|
|
|
|
≤ 0,01Се |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АНВ300 |
≤ 0,10 |
≤ 0,5 |
≤ 0,5 |
14−17 |
− |
− |
1,4−2,0 |
4,5−5,5 |
7−10 |
− |
− |
≤ 0,1В |
≤ 900 |
|
|
ВЖЛ8 |
0,1−0,2 |
≤ 0,7 |
≤ 0,5 |
14—17 |
− |
4,5−6 |
1,8−2,5 |
2,5−3,5 |
− |
− |
8−12 |
≤ 0,01Се; |
≤ 850 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≤ 0,06В |
(900−950)* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭИ893Л |
≤ 0,10 |
≤ 0,5 |
≤ 0,5 |
15−17 |
− |
3,5−4,5 |
1,2−1,6 |
1,2−1,6 |
9−10 |
− |
≤ 3,0 |
− |
700−850 |
|
|
ЭП99Л |
≤ 0,10 |
≤ 0,6 |
≤ 0,4 |
21−24 |
5−8 |
3,5−5,0 |
1,0−1,5 |
2,5−3,5 |
6−8 |
− |
≤ 5,0 |
≤ 0,005В; |
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≤ 0,002Се |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭИ765Л |
0,10−0,16 |
≤ 0,6 |
≤ 0,5 |
14−16 |
− |
3,0−5,0 |
1,0−1,4 |
1,7−2,2 |
4−6 |
− |
≤ 3,0 |
≤ 0,01В |
≤ 800 |
_________
* После алитирования.
513
В наиболее тяжелых условиях находятся лопатки турбин, которые работают при температурах 850−1050 °С. Они подвергаются значительным растягивающим напряжениям вследствие центробежных нагрузок, эти напряжения вызывают ползучесть деталей. Скоростной газовый поток высокой агрессивности и режим работы предопределяют возникновение переменных механических и термических нагрузок, вызывающих высокотемпературную и термическую усталость, активное развитие процессов газовой коррозии и эрозии. Сопловые лопатки работают при температурах до 1150 °С
инебольших напряжениях, а диски − при температурах 600−800 °С
иболее высоких рабочих нагрузках (до 500−600 МПа), поэтому жаропрочные сплавы, используемые для этих групп деталей, значительно различаются по составам и свойствам.
Литейные жаропрочные сплавы на никелевой основе широко применяются при изготовлении сопловых лопаток, сопловых венцов, цельнолитых роторов и рабочих лопаток газовых турбин различного назначения. Химический состав некоторых отечественных литейных сплавов приведен в табл. 23.93. На рис. 23.235 показано изменение жаропрочности ряда литейных сплавов в зависимости от температуры испытания.
Так как эти сплавы не подвергаются обработке давлением, они могут быть более легированными, следовательно, и более жаропрочными, чем деформируемые жаропрочные сплавы. Из-за большего разброса свойств, характерного для неоднородной литой структуры, запас прочности для литых деталей должен быть на
40−50 % больше, чем для деформируемых.
Сплавы для сопловых лопаток исходя из условий эксплуатации этих деталей, наряду с высокой жаропрочностью и жаростойкостью, должны обладать высокой термической стойкостью. Сплавы с мелкозернистой структурой лучше противостоят действию теплосмен, но крупнозернистые имеют лучшую длительную прочность при высоких температурах.
Большинство сплавов применяют в термически обработанном состоянии (закалка или закалка с последующим старением). Во избежание выгорания легирующих элементов (Сr, Ti, Al и В) терми-
514
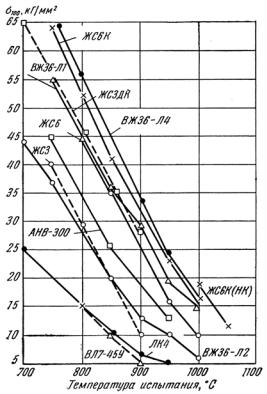
ческую обработку проводят либо в нейтральной (аргон, гелий) защитной атмосфере, либо в вакууме.
Рис. 23.235. Изменение длительной прочности литейных жаропрочных сталей и сплавов в зависимости от температуры испытания
Литые лопатки газотурбинных двигателей в некоторых случаях подвергают алитированию в сухих смесях или путем погружений в жидкий алюминиевый сплав с последующим диффузионным нагревом при высоких температурах. Алитирование (хромоалитирование) повышает сопротивление окислению поверхностных слоев и термостойкость детали в целом.
515
В литейных жаропрочных сплавах образуются те же упрочняющие фазы, что у деформируемых, но наблюдается несколько иное распределение фаз и легирующих элементов, связанное с особенностями литой структуры.
Междендритные объемы, как правило, обогащены примесями легкоплавких элементов, оксидами, сульфидами, другими легкоплавкими фазами. Разрушение при высоких температурах происходит в этих местах. По осям дендритов наблюдается обогащение более тугоплавкими элементами и фазами, образующимися в процессе застывания.
Более равномерному распределению легирующих элементов между твердым раствором, фазами и в объеме способствует применение высокотемпературного нагрева при закалке (до 1200 °С). Благодаря такому нагреву достигается более равномерное выделение упрочняющих фаз при последующем старении, а следовательно, повышаются механические свойства сплава (сочетание прочности и пластичности) и эксплуатационная надежность деталей. Выделение фаз может происходить не только при длительном старении, но для сложнолегированных сплавов с Ti, Al, W, Mo и в процессе не очень быстрого охлаждения (на воздухе) при закалке. Поэтому количество и форма распределения фаз, а значит и свойства сплава зависят от скоростей остывания отливки в конкретной форме и от режимов термической обработки.
При термической обработке величина зерна у литых сплавов практически мало изменяется и дендритная неоднородность в структуре, несмотря на гомогенизирующую обработку, полностью не устраняется. Весьма важно в результате термической обработки получить настолько стабилизированную структуру, чтобы при работе детали в условиях действия температуры и напряжений последующие структурные изменения были минимальными.
В зависимости от состава и режима термической обработки в литейных жаропрочных сплавах на никелевой основе образуются разные фазы.
Интерметаллидная γ′-фаза, распределенная относительно равномерно и в начальной стадии образования имеет кубическую форму. При высоком содержании титана или алюминия или суммы
516
(Al + Тi) γ′-фаза образуется даже при быстром охлаждении в процессе закалки от 1150−1200 °С, причем тем в большем количестве, чем сложнее легирован сплав (Ti + Al + Mo + W).
Наилучшее сочетание свойств пластичности и жаропрочности у большинства сплавов с интерметаллидным упрочнением достигается после охлаждения на воздухе.
Введение кобальта в литейные никелевые сплавы оказывает положительное влияние на повышение жаропрочности и пластичности, изменяет количество γ′-фазы и боридной фазы. Одновременно изменяется состав интерметаллидной фазы: часть никеля в γ′-фазе замещается кобальтом, тогда как содержание других элементов (Al, Ti, Mo, W, С) не меняется.
Карбидные фазы. В зависимости от легирования и термической обработки в литейных жаропрочных сплавах образуются карбидные фазы различного типа. Большая часть углерода связывается в первичные малорастворимые карбиды титана типа TiC, а в присутствии азота − в карбонитриды титана Ti(C, N). Карбиды титана образуют с никелем эвтектику, имеющую пониженную температуру плавления, что служит причиной их распределения в междендритных объемах.
Распределение карбидов и нитридов титана в литой структуре зависит от условий кристаллизации (температуры заливки и скоростей охлаждения). При заливке с высоких температур и медленном охлаждении карбиды и карбонитриды более грубые и, выделяясь по границам зерен, образуют сетку (каркас); при быстром охлаждении они выделяются в виде более мелких образований.
Кроме карбидов титана и карбонитридов, углерод в литейных никелевых сплавах образует двойные карбиды типа Ме1nМе2m С, где
Ме1n = Ni, Co, Fe, Si, a Ме2m = W, Mo, Nb, Cr.
Двойные карбиды и карбиды типа Сr23С6 выделяются преимущественно по границам зерен в виде сетки или оторочки, что отрицательно сказывается на пластичности сплавов. Форма распределения двойных карбидов зависит от режима термической обработки: чем выше температура закалки, тем грубее выделения.
517
Боридные фазы. Бор в оптимальных количествах оказывает положительное влияние на жаропрочные свойства никелевых литейных сплавов, образуя боридные фазы типа Сr3В2, в которые входят другие легирующие элементы (молибден, вольфрам): (Mo, W)nСrmВ2 или (Mo, W, Сr)3В2.
Бор образует ликвационные эвтектические скопления по границам зерен, что сказывается на пластичности сплавов и сообщает им чувствительность к перегревам. Поэтому бор влияет на свойства сплавов неоднозначно. При больших количествах бор снижает длительную прочность.
При выплавке жаропрочных сплавов и подборе шихты необходимо обращать внимание на чистоту сплавов и снижение содержания в них вредных примесей. Например, длительная прочность сплавов резко снижается при содержании > 0,001% Pb, > 0,05% Sn, > 0,015 P. Кремний также оказывает отрицательное влияние на жаропрочность сплавов и его содержание должно быть по возможности низким.
Современные никелевые жаропрочные сплавы работают по существу на пределе своих температурных возможностей, так как рабочие температуры часто достигают 0,8−0,85 температуры солидуса. Поэтому важнейшее значение в повышении температурного уровня современных жаропрочных сплавов, их надежности и долговечности придается освоению новых технологических процессов, таких как направленная кристаллизация, выращивание деталей в
монокристаллитном состоянии, использование сплавов, упрочнен-
ных дисперсными частицами оксидов, использование сплавов, ар-
мированных тугоплавкими проволоками, т.е. композитов.
Ряд положительных свойств сплавов на основе никеля − хорошая технологичность, высокая стойкость против радиационного распухания, жаропрочность и коррозионная стойкость в различных средах − позволяют рассматривать никелевые сплавы в качестве перспективных конструкционных материалов для активной зоны реакторов на быстрых нейтронах, первой стенки и бланкета термоядерных реакторов, использующих в качестве теплоносителя расплавы щелочных металлов и их солей. Тем не менее в ядерной
518
энергетике использование сплавов на никелевой основе пока ограничено. Они перспективны для оболочек твэлов реакторов с закритическими параметрами пара при температуре до 600 °С и высоких давлениях. Никелевые сплавы используют для изготовления направляющих каналов регулирующих стержней. Иногда в конструкциях твэлов и сборок для оболочек, матриц и других деталей применяют чистый никель. Есть данные об использовании сплавов на основе Ni в экспериментальном гомогенном реакторе, в котором в качестве теплоносителя и топлива использовались расплавы фтористых солей (KF−NaF− LiF−UF4 и др.). Кроме того, есть сведения о применении никелевых сплавов для основного оборудования энергоустановок с гелием в качестве теплоносителя. Так, матрицы трубопроводов зарубежных ВТГР, эксплуатирующиеся при температуре до 900−1000 °С, изготавливаются из жаропрочных никелевых сплавов инконель-617 (Х21Н70М9Ю); применяются и предполагаются применять сплавы инконель-625 (Х20Н65М9Б4), хасте- лой-S (Х15Н68ЮВ15), хастелой-X (Х20Н55М9), инконель-586 (Х25Н65МЮ) и нимоник 80А (Х20Н70ТЮ).
Отечественные исследования материалов для ВТГР привели к созданию и рекомендации для высокотемпературных узлов и «горячих» теплообменников сплавов ХН55МВ и ХН55МВЦ; для трубных систем парогенераторов установок с гелиевым теплоносителем разработан сплав 05Х21Н46М4Б и сталь 03X21Н32МЗБ, обладающие высокой жаропрочностью до 750 °С. Есть опыт использования в активной зоне реакторов на быстрых нейтронах сплава нимоника РЕ-16 (08Х17Н44М3ТЮ) и отечественных сплавов ЧС-42 (03Х20Н45М4БЧ) и ЧС-43 (03Х20Н45М4БРЦ).
Для корпусов реакторов малой энергетики и оболочек поглощающих элементов (ПЭЛ) считается перспективным сплав «Бочваллой» (или ХНМ-1 − см. табл. 23.89) для работы в воде при 300−350 °С. Этот сплав имеет ряд достоинств по сравнению со сталями: высокую стойкость к КРН (лучше, чем стали 00Х16Н15М3Б, 00Х20Н25Б, 00Х20Н40М5Б, Х13С2М2) и МКК, высокую остаточную пластичность после облучения до 10 сна, высокие пределы прочности и текучести, низкую температуру хрупко-вязкого пере-
519
хода (Тх = 150 170 С), которая намного лучше, чем у перлитных сталей, не требуется плакирование корпуса, не требуется отжиг после сварки.
В последнее время широко обсуждается вопрос о создании ядерных реакторов с использованием воды сверхкритического давления в качестве теплоносителя первого контура. Согласно оценкам твэлы и ТВС реакторов будут работать при следующих условиях: температура теплоносителя на входе и выходе 280 и 523 °С соответственно, максимальная температура оболочки твэла 650 °С, максимальная повреждающая доза до 40 сна, давление теплоносителя 25 МПа. На работоспособность оболочек твэлов и чехлов тепловыделяющих сборок (ТВС) ВВЭР с водой сверхкритического давления основное влияние оказывают распухание, радиационная ползучесть, радиационное охрупчивание, физико-химическое взаимодействие ядерного топлива с оболочкой, коррозия со стороны
теплоносителя.
В качестве кандидатов на материалы оболочки твэла и чехла ТВС могут рассматриваться циркониевые сплавы, аустенитная хромоникелевая сталь, а также высоконикелевые дисперсноупрочненные сплавы. Последние весьма перспективны в силу их исключительно высокой прочности, приемлемой ползучести, высокой жаропрочности и малого по сравнению с аустенитной сталью распухания.
Сплавы на основе Ni рассматривались как перспективные для термоядерных установок и реакторов.
Радиационная стойкость и применение жаропрочных никелевых сплавов в ЯЭУ
Радиационное упрочнение и охрупчивание свойственно не только аустенитным коррозионно-стойким сталям (см. 23.3.7), но и сплавам на основе никеля. В условиях нейтронного облучения при кратковременных механических испытаниях возникает резкое падение пластичности сплавов. На рис. 23.236 приведено изменение механических свойств жаропрочного никелевого сплава ХН77ТЮР, облученного нейтронами при 150 200 °С и испытанно-
520
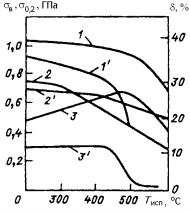
го при температурах до 800 °С. Видно, что при Тисп ≥ 600 °C происходит быстрое снижение относительного удлинения и предела
прочности.
Рис. 23.236. Механические свойства
необлученного (1−3) и облученного нейтронами до Фн = (1−3) 1024 м−2 при
150−200 °С (1′−3′) жаропрочного никелевого сплава ХН77ТЮР в зависимости от температуры испытания:
1, 1′ − σв; 2, 2′ − σ0,2; 3, 3′ − δ
На основании имеющихся результатов исследований считают, что причиной снижения механических свойств никелевых сплавов, так же как и хромоникелевых сталей, является накопление радиационных дефектов в структуре сплава, выделение вторичных фаз на дислокациях, границах зерен и субзерен, а также возникновение в результате ядерных реакций газообразных фаз (главным образом, гелия), накапливающихся на границах зерен, в вакансионных порах и других дефектах.
Нейтронное облучение сплавов на основе никеля увеличивает склонность их к разрушению по границам зерен при температуре выше 500−600 °С, т.е. приводит к ВТРО. При рассмотрении причины ВТРО распространенной является модель «гелиевых пузырьков», согласно которой гелий при повышенных температурах мигрирует к стокам (границам зерен, дислокациям и др.) и концентрируется на них в виде пузырьков. Приложенные растягивающие напряжения увеличивают равновесный радиус пузырьков, и по достижении некоторого критического напряжения пузырьки становятся нестабильными и начинают расти с некоторой скоростью. Рост и слияние пузырьков на границах, ориентированных перпендикулярно к приложенному напряжению, уменьшает прочность и способствует хрупкому разрушению материала по границам зерен. Дру-
521
гой взгляд на роль гелия в ВТРО заключается в том, что не только пузырьки являются причиной хрупкого разрушения, но и упрочнение материала внутри самих зерен в результате образования в них газовых пузырьков, вакансионных кластеров, частиц второй фазы, а также, возможно, торможением процессов полигонизации и рекристаллизации. В результате усиливается дисбаланс прочности тела зерна и его границ, приводящий к зернограничному разрушению облученного материала.
Следует отметить, что имеется и иная точка зрения на природу ВТРО, отрицающая роль гелия в высокотемпературном снижении пластичности металла, которая основывается на том, что ВТРО наиболее ярко проявляется в материалах, склонных к потере высокотемпературной пластичности в результате различной обработки даже без облучения. Например, в экспериментах по введению гелия бездефектным путем методом «тритиевого трюка» роль гелия не была установлена, а авторы считают, что ВТРО связано с изменением состояния примесей в металле и образованием выделений под облучением. Однако, при аналогичной же методике введения гелия в стали 304L и 309S, ванадиевый сплав, ниобий и его сплавы, сплавы титана был выявлен факт влияния гелия на высокотемпературное охрупчивание материалов.
Вцелом, большинство исследователей связывают ВТРО именно
свлиянием атомов гелия, образующихся в реакторе при облучении. В этих опытах было установлено, что влияние гелия на ВТРО является значительным, а в ряде случаев и определяющим, причем основной механизм такого влияния - накопление гелия при повышенной температуре на границах в виде цепочки пузырьков.
Основные черты явления ВТРО видны из рис. 23.237:
1) ВТРО проявляется в резком падении пластичности при
кратковременных испытаниях на растяжение при температуре
Т≥ 0,45Тпл;
2)у охрупченного материала не восстанавливаются исходные
свойства даже после высокотемпературного отжига, т.е. эффект является необратимым;
3) падение удлинения при высокотемпературных испытаниях сопровождается преимущественным разрушением по границам зерен;
522
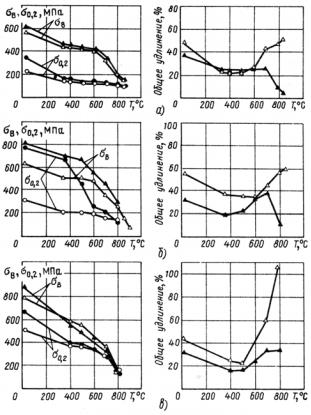
Рис. 23.237. Зависимость механических свойств образцов стали 0Х16Н15М3Б от температуры испытания (А.Г. Залужный):
а− до (U, {) и после (S, z) насыщения гелием на циклотроне до концентрации 10-2 ат.%; б − до (U, {) и после (S, z) облучения в реакторе до флюенса
1026 нейтр./м2 (Е > 0,1 МэВ); в − сталь с мелким зерном (3−5 мкм) до (U, {) и после (S, z) насыщения гелием на циклотроне до концентрации 10-2 ат.%
4) ВТРО проявляется только у поликристаллов; 5) ВТРО обнаруживается в материалах, склонных и без облучения к межзеренному разрушению при высокой температуре; 6) ВТРО наблюдается в экспериментах по облучению α-частицами никеля, высоконикелевых сплавов и хромоникелевой стали, однако не проявляется при
523
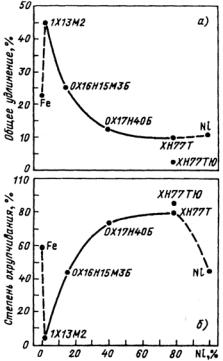
облучении этих материалов электронами; 7) ВТРО наблюдается независимо от того, происходило облучение при низкой (100 °С) или высокой температуре (до 800 °С); 8) ВТРО в температурном интервале его проявления не приводит к существенным изменениям прочностных свойств материала.
Пороговый флюенс нейтронов для проявления ВТРО зависит от материала (для никеля он составляет 1020−1021 м−2). Легирование аустенитных коррозионно-стойких сталей и никелевых сплавов (например, молибденом, ниобием) в значительной степени подавляет эффект. В более чистых по примесям (С, S, P) металлах и сплавах оно проявляется в меньшей степени.
На рис. 23.238 представлены зависимости общего удлинения и степени охрупчивания различных материалов, насыщенных гелием, от содержания никеля. Из рис. 23.238 видно, что все материалы склонны к ВТРО, за исключением ферритно-мартенситной стали 1Х13М2, причем никелевые сплавы больше склонны к вы-
сокотемпературному охруп-
чиванию, чем аустенитные коррозионно-стойкие стали.
Рис. 23.238. Влияние никеля на относительное удлинение (а) и степень охрупчивания (б) материалов, облученных α-частицами до концентрации
~10−3 ат.% Не при Тобл = 150 °С
и испытанных при Тисп = 800 °С
524
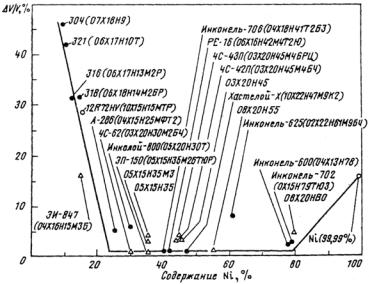
Наибольшую склонность к ВТРО проявили сплавы с высоким содержанием никеля, особенно дисперсионно-упарочняемые высоконикелевые сплавы типа ХН77ТЮ (см. рис. 23.216). Это дало основание полагать, что причиной ВТРО наряду с гелием являются и избыточные фазы, выделяющиеся в таких сплавах в процессе облучения и высокотемпературных испытаний. Облучение приводит к существенному снижению жаропрочности облученных никелевых сплавов.
В никелевых сплавах аналогично хромоникелевым аустенитным сталям наблюдается явление радиационного распухания, однако оно значительно меньше, чем у коррозионно-стойких аустенитных сталей. Особо низким распуханием обладают сплавы с содержанием Ni около 40−50 %. При соответствующем подборе легирующих элементов удается значительно расширить концентрационную область никеля в сплавах, когда они имеют очень малое распухание
(рис. 23.239).
Рис. 23.239. Сопротивляемость радиационному распуханию отечественных (U) и зарубежных (z) аустенитных хромоникелевых сталей и сплавов с различным содержанием никеля (А.М. Паршин)
525
Ряд ученых, в том числе А.М. Паршин, В.Ф. Зеленский и др., считают, что причина высокой стойкости никелевых сплавов против распухания заключается в формировании структур с непрерывным однородным распадом твердого раствора в высоконикелевых сплавах с сильно выраженным инкубационным периодом и определенной объемной дилатацией в системе, приводящих к усилению рекомбинации дефектов противоположного знака и к снижению склонности Fe−Сr−Ni-сплавов к распуханию. Высокую стойкость к распуханию имеют как гомогенные сплавы (например, типа Х20Н45М4Б), так и дисперсионно-тупрочняемые типа нимоник РЕ16 (06Х17Н43М4ТЮР). В этом сплаве поверхности высокодисперсных выделений γ′-фазы также являются дополнительными местами рекомбинации точечных дефектов.
Вместе с тем имеются данные о том, что высокое содержание никеля в сплавах само по себе не является гарантией слабого распухания. Так, хастеллой-X (10Х22Н47М9К2ВС), облученный в реакторе EBR-II при 590 °С до дозы 125 сна (флюенс нейтронов
2,5 1027 м−2), распух на 80 %.
Механизмы, по которым сдерживается распухание в высоконикелевых сплавах, постепенно прекращают действовать по мере набора флюенса. Это свидетельствует о том, что в процессе облучения изменяются свойства, происходит перестройка дефектной структуры и перераспределение химических элементов, а также образуются дефекты, способствующие развитию пористости, и исчезают дефекты, сдерживающие развитие пористости. Например, рост выделений второй фазы с увеличением флюенса сопровождается изменением степени их когерентности и форм. На этом этапе уже исчезает сдерживающее влияние второй фазы на распухание. Формирующиеся некогерентные границы крупных выделений могут являться местами зарождения пор и фактором, увеличивающим распухание.
В целом можно отметить, что высоконикелевые сплавы, обладая некоторыми преимуществами перед аустенитными сталями в отношении прочности, стойкости к радиационному распуханию, уступают им по высокотемпературной пластичности и комплексу физикомеханических свойств (меньше величина М = 1,6(1−ν)λσт/αE,
526
влияющая на допустимую толщину стенки конструкций, работающих под действием градиента температур).
В заключение следует отметить, что пока еще нет достаточного опыта эксплуатации никелевых сплавов в реакторах и поэтому ведутся исследования их свойств в условиях, аналогичных условиям работы в ЯЭУ и ТЯР. Следунт отметить в основном два направления: использование уже имеющихся и применяемых в технике жаропрочных сплавов (например, сплава нимоник РЕ-16, ЭП-125, ЭИ-437А, ЭИ-435 и др.) и разработка специальных сплавов для ядерной и термоядерной энергетики (например, сплавы типа хасте- лой-Х, хастелой-Н др. для использования в гомогенных реакторах типа MSRE, работающих на смеси расплавленных фтористых солей; сплавы типа Х20Н45М4Б и др. для реакторов на быстрых нейтронах с жидкометаллическими теплоносителями и ТЯР).
Основным фактором, ограничивающим широкое применение никелевых сплавов в реакторостроении, является их высокая стоимость по сравнению с жаропрочными коррозионно-стойкими сталями аналогичного назначения.
Контрольные вопросы
1.Обоснуйте выбор основных легирующих элементов с точки зрения создания основы для жаропрочного никелевого сплава. Приведите примеры.
2.Дайте состав «классического» нимоника и объясните причину его высокой жаропрочности.
3.Приведите условия выбора вспомогательных легирующих элементов и модификаторов в никеле. С какой целью эти элементы вводятся в
жаропрочный никелевый сплав? Какие примеси в никелевых сплавах являются вредными?
4.Пользуясь диаграммой состояния Ni−Сr (см. рис. 23.225), предложите сплав на основе никеля, являющийся однородным γ-твер-дым раствором с высоким сопротивлением окислению.
5. Предскажите структуру, фазовый состав и свойства сплава Ni−35 % Сr в состоянии термодинамического равновесия, наличие и тип
527
возможных фазовых превращений при закалке от 1300 °С; последующем отпуске при 800 °С.
6.Пользуясь диаграммами состояния Ni−Ti и Ni−Al (рис. 23.226), определите концентрационные области сплавов с дисперсионным твердением.
7.Объясните, чем вызвана эффективность упрочняющих η- и γ′-фаз в
никелевых сплавах? Какие из фаз: η-Ni3Ti, γ′-Ni3Al или γ′-Ni3(Al, Ti) являются более эффективными и почему?
8.Объясните, какие процессы происходят в закаленной дис- персионно-упрочняемой стали ХН77ТЮ в процессе последующего нагре-
ва при 550 °С; 700 °С; 850 °С.
9.Объясните роль Mo, W, Nb, Al, Ti, В и РЗМ в создании жаропрочных сплавов на основе никеля. Почему в таких сплавах содержания углерода сильно ограничено?
10.Какая морфология упрочняющих фаз наиболее эффективна в повышении жаропрочности никелевых сплавов и почему?
11.Предскажите структуру, фазовый состав и свойства сплавов Х20Н45М, Х17Н43М4ТЮР, ХН56ВМТЮ и ХН77ТЮР после закалки от
1100 °С, старения при 500 °С, 650 °С, 750 °С и 850 °С.
12. Пользуясь диаграммой распада сплавов типа Х20Н45М4Б (рис. 23.234), предскажите структуру, фазовый состав и свойства сплава 03Х20Н45М4БРЦ в состоянии термодинамического равновесия и объясните изменение структуры и свойств при закалке от 1200 °С, последующем длительном отпуске при 720 °С.
13.Чем вызвана высокая жаростойкость и коррозионная стойкость в пароводяных и жидкометаллических средах никелевых сплавов? Укажите температурные интервалы применимости никелевых сплавов в различных теплоносителях.
14.Как влияет нейтронное облучение на структуру, механические свойства и жаропрочность никелевых сплавов?
528
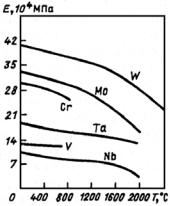
23.5. Конструкционные материалы на основе тугоплавких металлов с ОЦК решеткой
23.5.1. Особенности легирования тугоплавких металлов
Высокая температура плавления металлов Va и VIa подгрупп, большие значения энергии активации самодиффузии, слабая температурная зависимость модулей упругости (рис. 23.263), хорошая совместимость с жидкометаллическими теплоносителями и ядерным топливом стимулируют разработки на их основе сплавов, способных выдерживать достаточно большие механические нагрузки при повышенной температуре. Сечение захвата тепловых нейтронов у тугоплавких металлов (особенно у W и Та) сравнительно велико (см. табл. 23.1). Однако с ростом энергии нейтронов оно существенно уменьшается. Указанные достоинства делают тугоплавкие металлы и сплавы на их основе весьма перспективными материалами для использования в ядерной технике, в частности для изготовления оболочек твэлов в реакторах на быстрых нейтронах с жидкометаллическим теплоносителем, для первой стенки термоядерных реакторов.
Тугоплавкие металлы Va и VIa подгрупп вследствие изоморфности кристаллических решеток (ОЦК) и близости размеров атомных радиусов (разница не более 10 %) широко (часто неограниченно) растворимы один в другом в твердом состоянии. Это хорошо видно на рис. 23.264, на котором представлены диаграммы состояния сплавов систем V−Mo, Nb−Мо, V−Та. Исключением являются системы (например, Та−Сr − см. рис. 23.265, а), в которых различие атомных радиусов компонентов достигает 12−14 %, а взаимная растворимость ограничена в твердом состоянии. Наличие большой
529
растворимости компонентов в твердом состоянии дает возможность выбирать основные легирующие элементы для сплавов тугоплавких металлов из числа металлов Va и VIa подгрупп, а также металлов IVa подгруппы.
Рис. 23.264. Диаграммы состояния сплавов систем Mo−V (a), Nb−Мо (б)
иV−Та (в)
Втабл. 23.107 показаны наиболее подходящие основные и вспомогательные легирующие элементы для шести тугоплавких ОЦК
металлов, выбранные по критериям заданной растворимости α и коэффициенту распределения ω1. Как видно из табл. 23.107 и рис. 23.265, в системах Та−Cr, Zr−Mo и др. образуются промежуточные соединения (например, TaCr2, NbCr2, ZrCr2), существуют области твердых растворов, значительных по концентрации (см. рис. 23.264, в).
Следует обратить внимание на то, что кристаллические решетки ОЦК металлов изоморфны кристаллическим решеткам металлов IVa подгруппы (Zr, Ti) только при достаточно высокой температуре (выше температуры аллотропического превращения ГПУ'ОЦК). Поэтому даже для тех ближайших соседей по периоду, для которых атомные радиусы различаются не более чем на 10 %, неограниченная взаимная растворимость наблюдается лишь в высокотемпературной области (например, в системе Nb−Zr). При более низкой температуре соответствующие диаграммы состояния характеризу-
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 16.2.3.
530
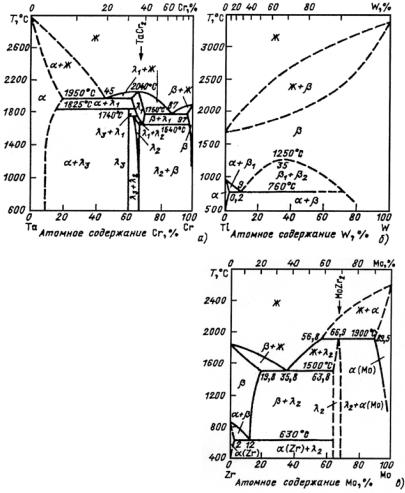
ются наличием двухфазных областей, образующихся в результате полиморфного превращения металла IVa подгруппы (например, системы Ti−W; Zr−Mo − рис. 23.265, б, в). В системе Ti−W, несмотря на малое различие атомных радиусов (около 4 %), диаграмма состояния характеризуется ограниченной взаимной растворимостью в твердом состоянии и наличием эвтектоида, образованного твердыми растворами на основе чистых компонентов (рис. 23.265, б).
Рис. 23.265. Диаграммы состояния сплавов систем Та−Cr (a), Ti−W (б)
и Zr−Mo (в)
531
|
|
|
|
Таблица 23.107 |
|
|
Легирующие элементы тугоплавких металлов |
|
|||
|
|
|
|
|
|
|
Основные |
Вспомогатель- |
|
Элементы, |
|
Металл |
Вредные примеси |
образующие |
|||
легирующие |
ные легирую- |
||||
|
элементы |
щие элементы |
|
химическое |
|
|
|
соединение |
|||
|
|
|
|
||
V |
α > 10, ω > 0,05 |
α > 1, ω > 0,05 |
α > 0,01, ω < 0,05 |
Be, Zr, Mn, |
|
|
Nb, Та, Сr, Мо, W, |
Zr, Al, Si, Ni, |
Н, О, N, Hg и др. |
Zn, Cd, Re, B, |
|
|
Ti, Fe, Mn и др. |
Be, P3M, Cu, Sn, |
|
Al, C, Si, N, О, |
|
|
|
В и др. |
|
H и др. |
|
Nb |
α >1 0, ω > 0,05 |
α > 1, ω > 0,05 |
α > 0,01, ω < 0,05 |
Be, Cr, Mn, |
|
|
V, Та, Сr, Мо, W, |
Al, Si, Be, P3M, |
О, Н, Sn, P, Bi, S и |
Fe, Ni, B, Al, |
|
|
Ti, Fe, Hf, Zr и др. |
Cu, Mn, В и др. |
др. |
C, Si О и др. |
|
Та |
α > 10, ω > 0,05 |
α > 1, ω > 0,05 |
α > 0,01, ω < 0,05 |
Be, Cr, Mn, |
|
|
V, Nb,Mo, W, Re, |
Cr, Fe, Ni, Al, |
Н, О, С, N, Sn, Р, |
Fe, Ni, B, Al, |
|
|
Ti, Hf, Zr и др. |
Si, Be |
Hg, Cu и др. |
C, Si N, О, Н и |
|
|
|
|
|
др. |
|
Сr |
α > 10, ω > 0,5 |
α > 1, ω > 0,15 |
α > 0,01, ω < 0,15 |
Zr, Hf, Nb, Ta, |
|
|
V, Мо, W, Re, Ti, |
Nb, Hf, Si, Be, |
О, S, Sc, К, N, С и |
Mn, Ni, B, Al, |
|
|
Fe, Mn, Ni, Al и |
Mg, Zr, Ta, Sn, |
др. |
C, Si, N, 0, H |
|
|
др. |
Zn, B, Cu, Y, La, |
|
и др. |
|
|
|
Sb и др. |
|
|
|
Мо |
α > 10, ω > 0,03 |
α > 1, ω > 0,035 |
α > 0,001, ω < 0,035 |
Be, Zr, B, Al, |
|
|
V, Nb, Ta, Cr, W, |
Zr, Ni, Si, Cu, |
Н, N, О, Pb, Bi, Sn, |
C, Si, N, O, S |
|
|
Re, Ti, Fe, Mn, Al, |
Zn, B, Sb, As, P |
Mg, С и др. |
и др. |
|
|
Hf и др. |
и др. |
|
|
|
|
|
|
|
|
|
W |
α > 10, ω > 0,35 |
α > 1, ω > 0,035 |
α > 0,001, ω < 0,035 |
Be, Zr, Fe, B, |
|
|
V, Nb, Ta, Cr, Mo, |
Zr, Ti, Be, Al, |
Н, N, О, S, Sn и др. |
C, Si, N, O, S, |
|
|
Re, Mn, Hf и др. |
Co, Bi, As и др. |
|
H и др. |
|
Во всех двойных сплавах тугоплавких металлов с металлами IVa подгруппы при различии атомных радиусов компонентов на 12 % и более образуются промежуточные соединения состава A2B, где А − металл Va или VIa подгруппы, В − металл IVa подгруппы. Это соединение образуется либо по перитектической реакции между жидкой фазой и твердым раствором на основе тугоплавкого ме-
талла (Mo2Zr, W2Zr, V2Zr, V2Hf − см. рис. 23.265, в), либо кристал-
лизацией из жидкой (Cr2Zr) или твердой (Cr2Ti) фазы. Большинство рассмотренных двойных сплавов при температуре
0,55−0,65 температуры плавления металла-основы сохраняют од-
532
нофазную структуру твердого раствора при содержании легирующего элемента до 10 % и более. Как известно, легирование благотворно влияет на жаропрочные свойства таких сплавов, если легирующий элемент повышает прочность межатомной связи в твердом растворе. Это требование обычно выполняется при легировании ме-
таллами с температурой плавления более высокой, чем у металла-
основы и, в первую очередь, наиболее тугоплавкими металлами, например такими, как ниобием, молибденом, танталом, вольфрамом.
В некоторых системах с промежуточными соединениями существует возможность дополнительного упрочнения сплава дис-
персными частицами второй фаз. Например, фазы Mo2Zr и W2Zr,
существующие соответственно до 1880 и 2175 °С, являются уп- роч-няющими в тройных сплавах Nb−Mo−Zr и Nb−W−Zr. Однако необходимо отметить, что при сравнительно невысокой температуре таким двухфазным сплавам, как правило, свойственна повышенная хрупкость, следствием чего является снижение их технологичности.
Повышение пластичности сплавов на основе Сr, Мо и W достигается легированием их рением, который является единственным элементом, резко повышающим пластичность в любом структурном состоянии (литом, рекристаллизованном и пр.). Диаграммы состояния этих сплавов однотипны − со стороны тугоплавкого металла располагается широкая область твердого раствора (рис. 23.266). Если в однофазной области увеличение концентрации Re в сплаве приводит к снижению температуры перехода в хрупкое состояние, то появление двухфазной структуры (α + σ) способствует его охрупчиванию (рис. 23.267). Введение рения в пределах растворимости увеличивает растворимость примесей, ослабляя упругую дилатацию решетки, способствует двойникованию как новому механизму пластической деформации VIa-металлов. Все это повышает пластичность металлов и известно как эффект рения.
В тугоплавкие металлы часто вводят редкоземельные элементы La, Се, а также Y (0,01−0,1 %). Растворимость их в тугоплавких металлах либо весьма мала, либо вообще отсутствует. Роль этих элементов, обладающих весьма высоким химическим сродством к примесям внедрения, состоит в раскисляющем или модифицирующем действии в процессе получения сплава.
533
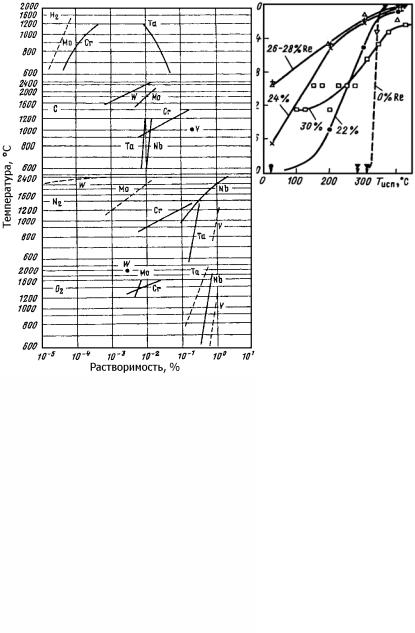
Рис. 23.266. Диаграмма состояния |
Рис. 23.267. Влияние концентрации |
сплавов системы W−Re |
Re в системе W−Re на температуру |
|
перехода вольфрама в хрупкое |
|
состояние |
Рис. 23.268. Растворимость примесей внедрения в тугоплавких металлах
534
Тугоплавкие металлы способны растворять небольшие количества углерода, кислорода, азота и водорода с образованием твердых растворов внедрения. Предельная растворимость этих элементов в металлах VIa подгруппы намного меньше, чем в металлах Va под-
группы (рис. 23.268).
Диаграммы состояния тугоплавких металлов с кислородом характеризуются наличием большого числа оксидов. Основные типы оксидов металлов Va подгруппы соответствуют составам МеО, МеO2, Ме2O5, а металлов VIa подгруппы − составам МеО, МеО2, МеO3. Кроме приведенных, известны оксиды промежуточных со-
ставов, например Сr2O3, Мо4О11, W18O49, V2O3, V3O5 и др. У металлов Va подгруппы установлено также существование субоксидов
типа Ме2O, Ме4O, Ме6O и др.
Однотипные оксиды, как правило, обладают сходными структорой и свойствами. При переходе от низших оксидов к высшим теплота образования, температура плавления и плотность снижаются, а относительное увеличение удельного атомного объема растет, например, от 20−40 % для оксидов типа МеО до 230−410 % для оксидов типа МеO3.
Оксиды металлов VIa подгруппы, как правило, менее устойчивы, чем оксиды металлов Va подгруппы. Они имеют меньшую теплоту образования и плавятся при более низкой температуре. Наименьшей устойчивостью обладают оксиды типа МеО3. Их характерной особенностью является склонность к сублимации даже при сравнительно невысокой температуре. Так, трехоксиды молибдена и вольфрама начинают сублимировать при температуре 500 и 1000 °С соответственно. Оксид Сr2O3 более стабилен и менее летуч.
Химическое сродство тугоплавких металлов к азоту значительно меньше, чем к кислороду. Основные типы нитридов тугоплавких металлов отвечают составам Me2N и MeN; известны также нитриды, менее богатые азотом, например V3N. Термическая устойчивость нитридов металлов Va подгруппы довольно высока, и плавятся они при температурах более 2000 °С, сравнимых с температурой плавления оксидов. Нитриды металлов VIa подгруппы значительно менее стойки и сравнительно легко диссоциируют при
535
нагреве. Так, нитрид W2N диссоциирует при 400 °С, а нитрид Mo2N − при 600 °С. Относительное увеличение удельного атомного объема при образовании нитридов тугоплавких металлов намного меньше, чем при образовании оксидов, особенно высших; для металлов Va подгруппы оно, как правило, не превышает 15−20 %, а для металлов VIa подгруппы 30−40 %.
Ванадий, ниобий, тантал и вольфрам образуют с углеродом кар-
биды типа Ме2С и МеС, а хром − карбиды Сr23С6, Сr7С3, Сr3С2. Карбиды тугоплавких металлов, за исключением карбидов хрома,
плавятся при значительно более высокой температуре, чем нитриды и оксиды. Наиболее тугоплавкими (Tпл > 3000 °С) являются карбиды молибдена, вольфрама и особенно ниобия и тантала (см. рис. 23.125 и табл. 23.41). Они обладают высоким сопротивлением пластической деформации и разрушению до температуры, приближающейся к 0,67Тпл. Например, для карбида NbC предел текучести при испытании на сжатие при температуре 1600 и 2000 °С равен соответственно примерно 400 и 200 МПа; даже при 2800 °С σт сохраняет значение около 30 МПа. Эти свойства карбидов делают их
наиболее эффективными упрочнителями тугоплавких металлов.
Использованию карбидов для этой цели благоприятствует и то, что растворимость углерода в тугоплавких металлах резко падает с понижением температуры. Это способствует сохранению двухфазной структуры и прочностных свойств металлов до весьма высокой температуры.
Для дисперсионного упрочнения тугоплавких металлов могут использоваться их соединения с бором − бориды, которые, как правило, плавятся при температуре несколько более низкой, чем карбиды, и более высокой, чем нитриды.
При легировании тугоплавких металлов высокоактивными в химическом отношении металлами IVa подгруппы (Ti, Zr и Hf) увеличивается термодинамическая стабильность карбидной фазы. При этом ее состав зависит от температуры. Например, в сплаве Мо + l,25 % Ti + 0,15 % Zr + 0,15 % С при температуре ниже
1400 °С образуется преимущественно карбид TiC, а при температуре выше 2100 °С − только карбид Мо2С, хотя последний обладает
536
значительно меньшей термодинамической прочностью по сравнению с карбидом титана. Возможно, это происходит из-за того, что распад пересыщенного твердого раствора, как правило, начинается с выделения примесных атомов на дислокациях, и когда концентрация примеси на дислокациях достигает предельного значения, происходит выделение второй фазы. Равновесная концентрация примеси на дислокациях описывается выражением
C = C0exp(−Eb/kT), (23.64)
где Eb − энергия связи примеси с краевой дислокацией.
В тугоплавких металлах для примесей внедрения из-за малых размеров октаэдрических межузлий в ОЦК решетке энергия взаимодействия примесного атома с дислокацией Eb весьма значительна. Так, для атомов С в Мо она составляет 0,65 эВ, а для примесей замещения 0,05−0,1 эВ, т.е. намного меньше. Поэтому в сплаве молибдена с Ti и С при достаточно высокой температуре на дислокациях должен выделяться главным образом углерод, что создает условия для преимущественного выделения карбида молибдена. При сравнительно низкой температуре, когда возможно обогащение локальных объемов атомами Ti, в сплаве создаются условия для выделения карбида титана. Из-за более высокой термодинамической прочности карбида титана равновесная концентрация углерода в твердом растворе для него существенно ниже, чем для карбида молибдена, который по мере выделения карбида титана растворяется.
Таким образом, увеличение содержания в сплаве легирующего элемента-карбидообразователя должно расширять температурный интервал существования его карбидов, а уменьшение содержания углерода должно снижать вероятность образования карбидов ме- талла-основы. Поэтому, регулируя состав сплава, можно изменять не только количество упрочняющей фазы, но и ее тип.
Дисперсионное упрочнение частицами тугоплавких соединений в настоящее время получило промышленное применение главным образом для двух тугоплавких металлов − Мо и Nb.
Необходимо подчеркнуть, что посредством легирования тугоплавких ОЦК металлов решается ряд задач, но одними из важных и специфических для этих металлов являются обеспечение стабиль-
537
ности физико-механических свойств при длительном действии нагрузки при высокой температуре (в реакторных сплавах − при больших флюенсах облучения) и достижение необходимой технологичности сплавов.
Сплавы на основе ванадия
Природный ванадий состоит из двух изотопов: стабильного 51V (99,75%) и слабо радиоактивного 50V (0,25%) (период полураспада τ1/2 > 1016 лет), т.е. для всех практических целей его можно считать стабильным. Известны 24 искусственных радиоактивных изотопа ванадия с массовым числом от 40 до 65 (а также 5 метастабильных
состояний). Из них наиболее стабильны 49V (τ1/2 = 330 сут) и
48V (τ1/2 = 15,974 сут).
Ванадий является хорошей основой для создания жаропрочных сплавов. Как наиболее легкий из всех тугоплавких ОЦК металлов V позволяет получить сплавы с удельной прочностью выше, чем на основе Ti, Fe, Ni, Nb. Ванадий обладает хорошими технологическими свойствами, имеет умеренное сечение захвата тепловых (см. табл. 23.1) и весьма низкое − быстрых нейтронов. К недостаткам V необходимо отнести высокую стоимость, сравнительно низкую температуру плавления (среди ОЦК металлов), существенную зависимость физико-механических свойств от содержания примесей внедрения и относительно высокую химическую активность.
Значительная растворимость в V ряда ОЦК металлов, его способность образовывать промежуточные фазы создают широкие возможности для разработки жаропрочных сплавов. Как видно из данных табл. 23.1074, для упрочнения твердого раствора могут быть использованы Nb, Ti, Та, W (несколько снижают температуру плавления ванадия − см. рис. 23.264, е), Mo, Re (повышают Тпл − см. рис. 23.264, в). Установлено, что при введении компонентов с атомным радиусом большим, чем у ванадия (Mo, Nb, Al, Ti, Zr), происходит увеличение температуры рекристаллизации, а при rMe < rV (Ni, Cr, Fe, Si) − снижение температуры рекристаллизации. Для дисперсионного упрочнения ванадия используют легирование сильными карбидообразователями (Zr, Ti) совместно с углеродом.
538
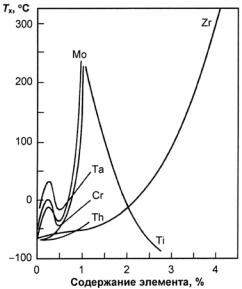
Для сохранения технологичности необходимо связать в соединения или вывести из V вредные примеси, и прежде всего Н, О и N. Это достигается путем легирования ванадия Ti, Nb, Zr, Cr и Y или редкоземельными элементами (La, Ce).
В одно время широко исследовались сплавы системы V−Zr−С (например, сплав ВЦУ) как перспективные для использования в ЯЭУ и ТЯР. Однако Zr сильно повышает температуру хрупковязкого перехода ванадия. В связи с этим следует предпочтение отдавать титану, понижающему Тх при концентрациях более 3% (рис. 23.269).
Рис. 23.269. Влияние элементов, образующих твердые растворы замещения, на температуру хрупко-вязкого перехода ванадия
В настоящее время разработано несколько перспективных сплавов, из которых, по-видимому, наибольшее значение имеют многокомпонентные сплавы на основе систем V−Ti и V−Nb.
При одинаковом содержании легирующих добавок титан как упрочнитель ванадия не имеет преимуществ перед более тугоплавкими элементами (Nb, Та, Mo, W и др.). Однако последние, обладая
539
высокой плотностью, в меньшей степени повышают удельную прочность ванадия. Кроме того, эти элементы, за исключением Nb, заметно снижают пластичность V, в то время как Ti благотворно влияет на нее.
Небольшие добавки Ti (3−7 %) резко повышают относительное удлинение и сужение поперечного сечения технического V при комнатной температуре. При более высокой концентрации Ti пластичность V несколько снижается. Однако она остается на достаточно высоком уровне даже при содержании 40−50 % Ti, что обеспечивает хорошую деформируемость сплавов. Оптимальное сочетание низкотемпературной пластичности (δ ≈ 25÷30 % при 20 °С) и кратковременной прочности при высокой температуре
(σв ≈ 500÷600 МПа при 700 °С) имеют сплавы с 10−20 % Ti.
Некоторого повышения кратковременной прочности сплавов системы V−Ti можно добиться путем дополнительного легирования тугоплавкими металлами − Cr, Mo, W, Nb и Та, а также Аl и особенно Si.
Сплавы V−Ti−Cr, V−Ti−Mo, V−Ti−W, V−Ti−Nb, V−Ti−Ta в ши-
роком интервале концентрации легирующих элементов являются однофазными твердыми растворами, если не считать возможного присутствия небольшого количества неметаллических включений, обусловленного наличием примесей в ванадии. Эти сплавы, как правило, обладают высокой пластичностью при комнатной температуре (δ ≈ 15÷30 %). В отличие от них ванадий-титановые сплавы с Аl и Si менее пластичны, что может быть связано с выделением вторых фаз, например (V, Ti)Al3 или (V, Ti)Si2.
Легирование титаном, повышая кратковременные прочностные свойства V, в то же время отрицательно сказывается на его жаропрочности (рис. 23.270). Это препятствует использованию двойных V−Ti сплавов для длительной работы при высокой температуре. Указанный недостаток можно несколько уменьшить дополнительным легированием тугоплавкими металлами, кремнием или алюминием, однако отмеченная выше закономерность сохраняется и в случае тройных сплавов. Поэтому содержание Ti в жаропрочных сплавах на основе V−Ti, по-видимому, целесообразно ограничивать.
540
В последнее время весьма интенсивно исследуются сплавы системы V−Ti−Cr, в частности, сплав V − 4% Ti − 4% Cr, в связи с перспективностью их использования как малоактивируемого жаропрочного конструкционного материала для ядерной и термоядерной техники. Прочностные свойства сплава V − 4% Ti − 4% Cr, особенно σв, остаются на достаточно высоком уровне вплоть до
700 °С (рис. 23.271).
Рис. 23.270. Влияние Ti на кратковременную (сплошные линии)
идлительную (пунктирные линии) прочность ванадия (1)
исплава V−20 % Nb (2) при 650 °С
Рис. 23.271. Временное сопротивление разрыву и предел текучести V (а) и сплава V − 4% Ti − 4% Cr (б) в зависимости от температуры испытаний (А.Н. Иванов, Л.М. Крюкова, В.М. Чернов)
541
Малолегированные сплавы V + 10% Ti + l% Nb (или Та) и V + 2,5% Ti + 1% Si, имеющие 100-часовую длительную прочность 380−480 МПа при 650 °С и 150−200 МПа при 800 °С, считают перспективными материалами для оболочек твэлов в реакторах с натриевым теплоносителем, работающих при 650−800 °С. К этой группе следует отнести сплав V + 2,5% Zr + 0,1% Y + 0,1% С, в котором достигается упрочнение твердого раствора в сочетании с карбидным упрочнением.
Ванадий-ниобиевые сплавы по прочности и жаропрочности превосходят ванадий-титановые, несколько уступая им в пластичности. Более высокую пластичность имеют сплавы, дополнительно легированные титаном. Подобно Ti влияет и Zr, однако цирконий ограниченно растворим в V (3−5 % при 500 °С) и после превышения предельной растворимости образует хрупкий интерметаллид V2Zr, снижающий пластичность и, следовательно, деформируемость сплавов. Поэтому содержание Zr в ванадиевых сплавах ограничивают 2−3 %.
Легирование ванадий-ниобиевых сплавов Ti или Zr в сочетании с добавкой С и В существенно повышает температуру рекристаллизации сплавов, по-видимому, в результате образования дисперсных частиц карбидов или боридов. Это же должно способствовать повышению жаропрочности, что отчасти находит подтверждение в приведенных на рис. 23.272 данных о влиянии углерода на длительную прочность сплавов V + 20 % Nb + 5 % Ti. Хотя в целом жаропрочность ванадиевых сплавов сравнительно невысока, по удельной кратковременной и длительной прочности при температуре 800−1000 °С они превосходят многие жаропрочные сплавы на основе железа и никеля.
Рис. 23.272. Длительная прочность сплава
V−20 % Nb − 5 % Ti,
содержащего 0,25 (1)
и 0,04 % С (2) при 1095 ° С
542
Большинство легирующих элементов, используемых для улучшения механических и жаропрочных свойств ванадия, как правило, способствует повышению его жаростойкости. Отличительной чертой ванадия по сравнению с другими металлами Va подгруппы является низкая температура плавления оксидной пленки (675 °С). Легирование ниобием, хромом, цирконием, титаном, алюминием и некоторыми другими элементами и особенно кремнием может значительно повысить ее. Лучшие по жаростойкости сплавы ванадия окисляются в десятки раз медленнее, чем нелегированный ванадий. Однако для этого необходимо ввoдить большие количества легирующих элементов (более 10 %), что обычно отрицательно влияет на пластические свойства сплавов.
Лишь сплавы с ниобием и титаном при некотором повышении жаростойкости сохраняют хорошую пластичность. В связи с этим наиболее рациональным способом увеличения ресурса работы ванадиевых сплавов в окислительной атмосфере при высокой температуре считают не легирование, а нанесение защитных по-
крытий.
Сплавы на основе ниобия
У ниобия имеет один стабильный природный изотоп 93Nb. При нейтронном облучении образуется целый ряд радиоактивных изотопов, среди которых изотопы с массовыми числами 91, 92 и 94 имеют очень большой период полураспада (τ1/2 = 104, 3(3,5) 107 и 2,03(16) 104 лет, что вызывает длительный спад наведенной актив-
ности (рис. 23.273).
Ниобий имеет достаточно высокую температуру плавления (2477 °С), невысокую плотность, хорошую пластичность и технологичность, позволяющую обрабатывать сплавы на его основе при комнатной температуре, имеет относительно небольшое сечение захвата нейтронов (см. табл. 23.1). К недостаткам Nb следует отнести его высокую химическую активность, низкую жаростойкость, значительное поглощение примесей внедрения, относительно высокую стоимость, наличие долгоживущих радиоактивных изотопов.
543
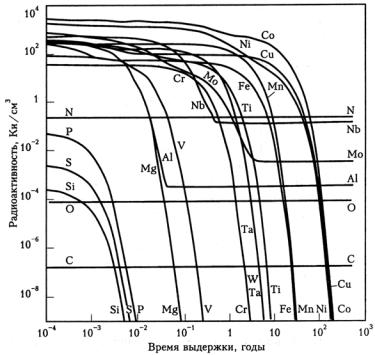
Значительная растворимость в Nb ряда тугоплавких металлов и его способность к образованию промежуточных фаз создают широкие возможности для разработки жаропрочных сплавов. Как видно из данных табл. 23.107, для упрочнения Nb могут быть ис-
пользованы V, Та, Cr, Mo, W, Ti, Fe, Mn, Al, Be, Ni и другие эле-
менты. Типичные диаграммы состояний системы сплавов ниобия с этими элементами представлены на рис. 23.274.
Рис. 23.273. Расчет спада радиоактивности отдельных компонентов аустенитной коррозионно-стойкой стали после гипотетического облучения в термоядерном реакторе до 9 МВт год/м2
Как и в случае других металлов Va подгруппы, для повышения прочностных характеристик Nb обычно легируют тугоплавкими металлами, образующими с ним твердые растворы, а также высокоактивными металлами IVa подгруппы. При одинаковом атомном
544
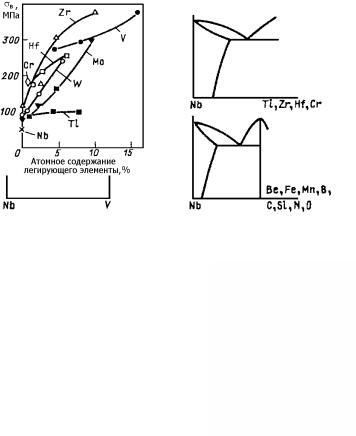
содержании легирующего элемента наиболее существенное повышение кратковременной прочности наблюдается при легировании хромом, ванадием и цирконием − элементами, наиболее отличающимися от Nb размерами атомов. Несколько менее значительно влияние добавок Mo, W и Hf. В наименьшей степени влияют на прочность Nb добавки Та и Ti − элементов, весьма близких к Nb по атомным размерам (рис. 23.275).
Рис. 23.274. Типичные схематические диаграммы состояния систем сплавов Nb с основными и вспомогательными легирующими элементами
Таким образом, при кратковременных испытаниях упрочнение Nb, по-видимому, определяется скорее размерным фактором, чем влиянием легирования на прочность межатомной связи в твердом растворе. Влияние Zr и Hf на прочность Nb связывают также с дополнительным упрочнением за счет выделения вторых фаз, образующихся при взаимодействии этих элементов с примесями внедрения, присутствующими в ниобии.
545
Рис. 23.275. Влияние легирующих добавок на предел прочности рекристаллизованного Nb
при 1095 °С
Роль прочности межатомной связи возрастает при длительных испытаниях, особенно высокотемпературных. В этих условиях наиболее высокими прочностными характеристиками обладают тугоплавкие сплавы, содержащие Mо, Hf, Та и W. Титан и тантал улучшают обрабатываемость сплавов ниобия.
С позиций упрочнения ниобиевые сплавы можно разделить на группы. В сплавах первой группы упрочнение достигается в результате комплексного легирования ниобия главным образом молибденом, вольфрамом и высокоактивными в химическом отношении металлами, чаще всего цирконием и титаном (табл. 23.108). Эти так называемые высоколегированные сплавы и могут успешно применяться при температуре до 1200−1250 °С. Они обладают достаточно хорошей деформируемостью, из них выпускают в промышленном и полупромышленном масштабе прутки, трубы, листы и другие полуфабрикаты.
Таблица 23.108
Состав и прочностные свойства отечественных и зарубежных ниобиевых сплавов первой группы при высокой температуре (в отожженном состоянии)
Марка |
Состав сплава, % |
1095 °C |
1200 °C |
|||
сплава |
σв, МПа |
σ100, МПа |
σв, МПа |
σ100, МПа |
||
|
||||||
ВН2А |
Nb + 4,5Mo + 0,7Zr + |
260 |
120 |
240 |
− |
|
СВ-752 |
+ (≤0,08C) |
|
|
|
|
|
Nb + 10W + 2,5Zr |
270 |
126 |
220 |
98 |
||
(США) |
|
|
|
|
|
|
FS-85 |
Nb + 27Ta + 12W + lZr |
320 |
120 |
220 |
75 |
|
(США) |
|
|
|
|
|
|
Е-50 |
Nb + 15W+ 5Mo + 5Ti + |
350 |
141 |
240 |
77 |
|
(США) |
+ 0,7Zr + (≤0,05C) |
|
|
|
|
|
D-41 |
Nb + 20W + 10Ti + 6Mo |
390 |
127 |
340 |
− |
|
(США) |
|
|
|
|
|
|
Как было установлено, высокая жаропрочность сплавов первой группы в значительной мере определяется присутствием в них дисперсных карбидов, что обусловлено наличием углерода. Это послужило основанием для создания второй группы сплавов, которые характеризуются повышенным содержанием углерода, а следова-
546
тельно, большим количеством упрочняющих карбидных частиц (табл. 23.109). Сплавы второй группы могут применяться до 1250−1300 °С, а при кратковременном использовании − до 1450−1500 °С. Их недостатком является пониженная пластичность при комнатной температуре и сравнительно низкая деформируемость.
Таблица 23.109
Состав и прочностные свойства ниобиевых сплавов второй группы при высокой температуре (в отожженном состоянии)
Марка |
Состав сплава, % |
|
1095 °C |
1200 °C |
|||
сплава |
σв, МПа |
σ100, МПа |
σв, МПа |
σ100, МПа |
|||
|
|||||||
ВН-3 |
Nb + 4,6Mo+l,4Zr + 0,12С |
450 |
|
160 |
250 |
− |
|
ВН-4 |
Nb + 6Mo + 0,72Zr + 0,lC + |
700 |
|
280 |
550 |
− |
|
|
+ 0,03 Се (La) |
|
|
|
|
|
|
D -43 |
Nb + 10W + l,7Zr+0.1C |
330 |
|
182 |
− |
84 |
|
(США) |
|
|
|
|
|
|
|
F-48 |
Nb + 10W + 5Mo + lZr + 0,lC |
450 |
|
246 |
350 |
119 |
|
(США) |
|
|
|
|
|
|
|
Установлено, что если в сплавах с малым содержанием Zr основной упрочняющей фазой является карбид ниобия Nb2C, в котором может растворяться до 6,8 % Zr, то в наиболее жаропрочных сплавах такой фазой является карбид циркония (Zr, Nb)C. В соответствии с этим наилучшими жаропрочными свойствами обладают сплавы, в которых атомные содержания Zr и С находятся примерно в соотношении 1:1.
Третья группа сплавов − это сплавы, содержащие Аl и Сr в количестве от 1 до 35 % в сумме. Эти элементы резко повышают жаростойкость ниобия. Так, скорость окисления сплава с 20 % Аl и 15 % Сr при 1000 °С составляет 0,3 г/(м2 ч), что на два−три порядка меньше, чем у нелегированного ниобия.
Несмотря на значительное снижение скорости окисления Nb при легировании, необходимо отметить, что сопротивление окислению наиболее жаростойких ниобиевых сплавов все же сравнительно невелико, и их нельзя использовать длительное время в обычной атмосфере без специальных защитных покрытий.
547
К четвертой группе относятся малолегированные сплавы с карбидным упрочнением. В качестве легирующего элемента используется Zr c отношением концентраций Zr и С примерно 10:1. Типичным представителем этой группы является сплав Nb с l % Zr, 0,1 % С и 0,1 % Y.
Эффективным упрочнителем сплавов Nb является и азот. Упрочнение осуществляют за счет образования дисперсных нитридов ZrN и упрочнения азотом твердого раствора (раствора внедрения), при этом в сплав вводят (0,3−0,5 %)N. Типичная термомеханическая обработка сплавов системы Nb−N состоит из закалки (температура 1700−2100 °C, выдержка 0,5−9 ч), последующей холодной деформации и старения. Время старения увеличивается при снижении температуры отжига: для Т = 1200÷1400 °С время выдержки
τ= 0,5÷8 ч; для Т = 1100÷1150 °С τ = 50 ч; для Т = 900÷1100 °С
τ≤ 1500 ч.
Впрактике создания жаропрочных материалов для температур
выше 1300 °С известны литейные сплавы Nb + 30 % Nb2C, представляющие собой композиционный материал с эвтектической структурой. Получаемые методом направленной кристаллизации
эти сплавы имеют σв, в пять раз превышающий предел прочности ниобия.
Сплавы на основе тантала
В природе тантал находится в виде двух изотопов: стабильного 181Та (99,99%) и радиоактивного 180Та (0,012%) с периодом полураспада τ1/2 > 1013 лет).
Тантал обладает всеми достоинствами своего аналога − ниобия, но имеет более высокую температуру плавления, имеет комплексом ценных свойств − достаточно хорошую пластичностью, прочность, свариваемость, коррозионную устойчивость при умеренных температурах, низкое давление пара, высокий коэффициент теплопередачи, небольшую работу выхода электронов, способность образовывать анодную пленку (Та2О5) с особыми диэлектрическими характеристиками, «уживаться» с живой тканью организма и др. По
548
сравнению с ниобием тантал более дорогой металл. Как видно из табл. 23.107, основными легирующими элементами для сплавов на основе Та (α > 10 %) является группа тугоплавких металлов. К числу вспомогательных элементов относятся Cr, Fe, Ni, Al, Si, Be и ряд других элементов, не приведенных в табл. 23.107 (вследствие неудовлетворения требованиям ЯЭУ).
Легирование тантала, как правило, приводит к повышению его прочности и снижению пластичности. Тем не менее многие сплавы тантала, даже высоколегированные, сохраняют хорошую пластичность вплоть до отрицательной температуры. Таковы двойные сплавы, содержащие до 15−20 % W или V, до 20−30 % Hf, до 30 % Ti, до 10 % Мо, до 50 % Nb; тройные сплавы, содержащие W и Hf, Nb и V, W и Zr, и др. Сохранение пластических свойств позволяет вводить в Та значительные количества легирующих элементов без резкого ухудшения его деформируемости, хотя при этом требуется существенно повышать температуру деформации (иногда до 1600 °С). Наиболее благоприятными технологическими свойствами (деформируемостью, свариваемостью и т.д.) обладают однофазные сплавы тантала.
Жаропрочность танталовых сплавов менее значительна, чем следовало бы ожидать исходя из его температуры плавления. Это связано с их химическим и фазовым составом: как правило, они представляют собой твердые растворы, содержащие 1−2 легирующих элемента из числа тугоплавких металлов, в первую очередь W
И Hf.
Вольфрам − единственный элемент, повышающий температуру плавления тантала. Он существенно увеличивает модуль упругости Та (примерно в 1,5 раза при атомном содержании 10 %) и его температуру рекристаллизации. Поэтому при легировании вольфрамом возрастают как кратковременные (табл. 23.110), так и длительные прочностные характеристики тантала. Например, 100-часовая прочность сплава Та + 10 % W при 1200 °С составляет 140 МПа, а при 1650 °С − 35 МПа вместо соответственно 28 и 7 МПа для нелегированного тантала. Поэтому сплавы с W считают перспективными материалами для использования при температуре вплоть до
1700 °С.
549

Таблица 23.110
Предел прочности Та и его сплавов σв, МПа,
при высокой температуре
Состав сплава, % |
1200 °С |
1370 °С |
|
1480 °С |
1650 °С |
||
Та* |
|
110 |
40 |
|
− |
− |
|
Та + 10W** |
290 |
160 |
|
|
|
80 |
|
|
− |
||||||
Та + 2W |
+ 2Нf* |
360 |
170 |
|
120 |
|
− |
Та + 2W |
+ 4Нf* |
530 |
190 |
|
140 |
|
− |
Та + 8W |
+2Нf* |
590 |
400 |
|
200 |
|
140 |
Та + 30Nb + 7,5V*** |
420 |
− |
|
210 |
|
70 |
|
|
|
|
|
|
|
|
|
__________
*Сплав деформирован и отожжен для снятия напряжений.
**Сплав в деформированном состоянии.
***Сплав в рекристаллизованном состоянии.
Жаропрочность сплава с 10 % W можно дополнительно повысить введением модифицирующих добавок Мо и Zr. Модифицированный сплав при 1920 °С имеет примерно такую же 10-минутную прочность, как и немодифицированный при 1650 °С, а его одночасовая прочность при температуре 1680 °С (160 МПа) на 15−20 % превосходит одночасовую прочность немодифицированного сплава при 1650 °С.
Некоторые тройные системы Та−W−Hf, например американский сплав T-111 (Та + 8 % W + 2 % Hf), также считают перспективными жаропрочными материалами, однако сведения об их жаропрочности ограничены. По имеющимся данным длительная прочность сплава T-111 при 1315 °С за время испытания до 20−30 ч сравнима с длительной прочностью двойного сплава Та + 10 % W.
Сплавы Та с Nb и V уступают по жаропрочности сплавам, содержащим вольфрам. Однако встречающиеся в литературе данные об исследовании этих сплавов, например сплава Та +30 % Nb + + 7,5 % V, применительно к изделиям ракетной и космической техники не дают оснований исключать их из числа перспективных танталовых сплавов, особенно если учесть их высокую технологичность и сравнительно небольшую плотность, которая почти в 1,5 раза ниже, чем у большинства других сплавов тантала.
550
Основные легирующие добавки, повышающие жаропрочность Та, мало влияют на его жаростойкость. Хотя некоторые из них (Nb, V, Hf, Zr) снижают скорость окисления Та при 1000−1200 °С в несколько раз, тем не менее для наиболее перспективных сплавов она по порядку величины сравнима со скоростью окисления нелегированного тантала.
Значительно более эффективны в этом отношении добавки Ti, Cr, Al, Si, Be, Fe, Co, Ni. Многие двойные, тройные и более сложные сплавы Та с этими элементами обладают весьма высокой жаростойкостью. Так, скорость окисления сплавов состава 50 % Та + + 40 % Ti + 10 % Al и 60 % Та + 30 % Ti + 5 % А1 + 5 % Сr при температуре 1400 °С в 300 раз ниже, чем у нелегированного тантала. Однако подобные высоколегированные сплавы склонны к охрупчиванию в результате образования интерметаллидов, что затрудняет их обработку. Кроме того, они имеют сравнительно низкую жаропрочность. Поэтому наиболее рациональным способом повышения жаростойкости Та и сплавов на его основе является на-
несение защитных покрытий.
Сплавы на основе хрома
Известны четыре стабильных природных изотопа хрома с массовыми числами 50, 52, 53 и 54. Доля самого распространенного изотопа 52Cr – около 84%
Хром открывает цепочку ОЦК тугоплавких металлов VIa подгруппы Периодической таблицы элементов. Его температура плавления, как видно из табл. 23.1, превосходит температуру плавления Fe и стали, а плотность немного ниже. Хром доступный, не очень дорогой элемент. Однако существенным недостатком хрома, как и других ОЦК металлов VIa подгруппы, является низкая пластичность при комнатной температуре, высокая температура перехода из хрупкого в вязкое состояние − Тх. Пластические характеристики зависят от способа получения и чистоты металла. По мере легирования хрома, особенно молибденом и вольфрамом, Тх повышается, а пластичность падает. Как видно из табл. 23.107, в выборе легирующих элементов для упрочнения Сr проблем нет.
551
Существующие сплавы на основе Сr можно разделить на три группы: мало-, средне- и высоколегированные (табл. 23.111).
Таблица 23.111
Состав и свойства некоторых сплавов на основе хрома при различной температуре
Марка |
Состав сплава, % |
T, С |
в, МПа |
т, МПа |
, % |
ак, |
сплава |
кДж/м2 |
|||||
ВХ-1И |
Сr + (до)1Y |
20 |
270 |
190 |
3 |
20 |
|
|
800 |
180 |
150 |
77 |
450 |
|
|
1000 |
80 |
40 |
70 |
250 |
ВХ-2И |
Сr + 0,15Ti + 0,2V + (до)1Y |
20 |
350 |
240 |
3 |
20 |
|
|
800 |
260 |
190 |
35 |
250 |
|
|
1000 |
180 |
80 |
32 |
250 |
ВХ-4 |
Cr + 32Ni + 0,15Ti + 0,25V |
20 |
950 |
800 |
8 |
150 |
|
+ + 2,5W |
800 |
530 |
290 |
12 |
250 |
|
|
1000 |
240 |
90 |
20 |
300 |
Сплавы первой группы обычно легируют элементамиупрочнителями из числа тугоплавких металлов Va и VIa подгрупп и элементами, высокоактивными по отношению к примесям внедрения, Ti, Zr, Y, La и др. Содержание каждой добавки, как правило, не превышает десятых долей процента.
Сплавы второй группы отличаются от малолегированных сплавов более высоким содержанием упрочнителей от одного до нескольких процентов каждого. В некоторые из этих сплавов дополнительно вводят от 0,1 до 1 % Y.
Сплавы третьей группы содержат до 30 40 % Ni или Со и не-
большие добавки тугоплавких металлов.
Жаропрочность малолегированных сплавов Сr довольно высока и превосходит жаропрочность многих сплавов на основе Fe и Ni. Так, 100-часовая прочность сплава ВХ-2И при 1000 °С составляет 60 МПа; этот сплав можно использовать для длительной работы при 1100 1200 °С. Еще более высокой жаропрочностью (до 120 МПа при 1000 °С за 100 ч) обладают среднелигированные
552
сплавы, содержащие 7−12 % W или Мо. Недостатком сплавов этих групп является пониженная пластичность при комнатной или даже более высокой температуре.
Высоколегированные сплавы Сr с Fe и Ni более пластичны при комнатной температуре и обладают более высокой кратковременной прочностью. Однако жаропрочность этих сплавов сравнительно невелика, и их максимальная рабочая температура не превышает 1000 °С. Необходимо отметить, что, по мнению ряда исследователей, дисперсионное упрочнение Сr перспективнее твердорастворного. Так, например, двухфазный сплав Сr − 2,5V − 0,8Се − 0,55N (фазы: Сr + CeN) показал лучшую пластичность, нежели высоколегированные сплавы хрома.
Сплавы хрома в отличие от сплавов на основе других тугоплавких металлов хорошо сопротивляются окислению. Однако в процессе длительного нагрева на воздухе при температуре выше 650−700 °С они охрупчиваются в результате насыщения азотом и образования нитридов. Легирование иттрием, повышая защитные свойства оксидной пленки, одновременно резко снижает количество поглощенного азота и предотвращает охрупчивание Сr при окислении на воздухе. Аналогичным образом влияет Ni в сплавe ВХ-4. Для предотвращения охрупчивания можно также использовать защитные покрытия.
Сплавы Сr удовлетворительно обрабатываются резанием, хорошо деформируются в горячем состоянии. Однако пластичность сварных соединений, полученных аргонно-дуговой сваркой, низка.
Из-за отсутствия низкотемпературной пластичности сплавы Сr пока еще не нашли широкого промышленного применения, и в настоящее время ведутся исследования, направленные на устранение этого недостатка. В последние годы наметилось новое направление в производстве хромсодержащих сплавов – легирование их азотом. Этот обычно вредный в металлургии газ образует с хромом прочные соединения – нитриды. Азотирование хромистых сталей повышает их износостойкость, позволяет уменьшить содержание дефицитного никеля в сталях. Быть может, этот метод позволит преодолеть и «необрабатываемость» сплавов на основе хрома.
553
Сплавы на основе молибдена
В природе Мо представлен семью стабильными изотопами с массовыми числами 92, 94−98 и 100, из которых наиболее распространен 98Мо (23,75 %). Образующийся при облучении наряду с другими изотоп 93Мо имеет τ1/2 = 3,5(7) 103 лет, что вызывает высокую наведенную активность и длительный ее спад (см. рис. 23.273).
Важными достоинствами Мо являются его высокие значения температуры плавления и модуля нормальной упругости при сравнительно небольшой плотности (см. табл. 23.1). Так как плотность Мо (10200 кг/м3) почти в два раза меньше плотности W (19300 кг/м3), то сплавы на основе Мо обладают значительно большей удельной прочностью (при температурах ниже 1370 °С). У Мо малый температурный коэффициент расширения; достаточно низкое сечение захвата тепловых нейтронов; Мо обладает хорошей термостойкостью, и для него характерна высокая коррозионная стойкость в большей части щелочных растворов, а также в серной, соляной и плавиковой кислотах при разных температурах и концентрациях.
К недостаткам Мо следует отнести низкие пластичность и сопротивление окислению; высокую хрупкость сварных швов; трудности обработки и дорогую технологию получения металла и изделий из него; упрочнение молибдена нагартовкой можно использовать лишь до 700−800 °С, при более высоких температурах происходит разупрочнение из-за возврата.
Молибден является хорошей основой для получения жаропрочных сплавов путем дисперсионного и твердорастворного упрочнения. Проблем с легированием нет (см. табл. 23.107), так как Мо образует широкие области растворимости с V, Nb, Та, Cr, W, Ti, a Zr, Hf, Mn, Fe и Re имеют в Мо достаточную растворимость. При разработке сплавов Мо проблема состоит в том, чтобы получить жаропрочный сплав достаточной пластичности и обрабатываемости. Это в значительной степени зависит от нейтрализации вредных примесей и, прежде всего, кислорода. В частности, известно, что с ростом в Мо кислорода, азота и водорода температура перехода от хрупкого к вязкому разрушению увели-
554
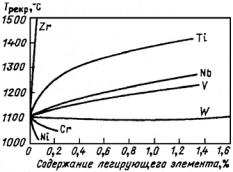
чивается от Тх = 4,2 К при CH,N,О < 10−4 % до Тх = 320÷420 К при
CH,N,О ≤12 10−4 %.
Выбор легирующих элементов для создания жаропрочных молибденовых сплавов путем упрочнения твердого раствора ограничен температурой плавления легирующих элементов − она не должна быть много ниже, чем у молибдена. К числу таких элементов относятся W, Re и с оговорками Nb. Легирование молибдена до 50 % W повышает температуру начала рекристаллизации до
1400 °С, а 47 % Re до 1250−1300 °С.
В качестве дисперсионного упрочнения применяют карбидное (нитридное) упрочнение, для чего одновременно с углеродом (азотом) в Мо вводят Ti, Nb, Zr и Hf − сильные карбидообразователи, причем эффект карбидного упрочнения возрастает в следующей последовательности: TiC, NbC, ZrC, HfC. Карбидное упрочнение позволяет повысить температуры рекристаллизации и рабочие темпе-
ратуры сплавов Мо до 1200−1500 °С (ZrC) и 1400−1700 °С (HfC).
Важно отметить, что, как видно из рис. 23.276, наиболее сильное влияние на температуру рекристаллизации оказывают небольшие добавки таких карбидообразователей, как Zr и Ti. Это свидетельствует о том, что дисперсные карбиды являются эффективными препятствиями для движущихся границ рекристаллизованных зерен. При введении в Мо карбидообразующих элементов предотвращается образование карбида молибдена Мо2С, способствующего охрупчиванию молибдена. Раскисляющее действие на Мо оказывают В, Al, Ni, Се и La.
Рис. 23.276. Влияние легирующих добавок на температуру рекристаллизации Трекр молибдена
555
Подчеркнем еще раз, что особенность легирования Мо состоит в том, чтобы уметь управлять распределением примесей внедрения и, в частности, образованием дисперсных частиц, их размерами и формой. Исследователями молибдена показано, что если объем (размер) решетки второй фазы больше, чем объем решетки молибдена, то возникает фазовый наклеп и склонность к хрупкому разрушению. Наиболее вероятны такие образования второй фазы с компонентами, имеющими размер атома больший, чем размер атома Мо (см. п. 23.5.2). К их числу относятся Nb, Zr, Та, Ti, причем объем ZrC на 60 % больше атомного объема карбида молибдена. Наиболее перспективными с позиций карбидного и твердосплавного упрочнения Мо считают Ti и Zr.
Для ряда химически активных компонентов с атомными радиусами, меньшими атомного радиуса Мо, возможно образование карбидов с объемами элементарной ячейки меньшими, чем объем ячейки карбида молибдена. Так, параметр решетки карбида V2C а = 0,2998 нм, а параметр решетки Мо2С а = 0,3012 нм. Возникающее небольшое размерное несоответствие ( 0,02 %) может сыграть положительную роль при термическом воздействии на сплав, способствуя меньшему уровню внутренних напряжений (например, в процессе сварки). При сварке различных молибденовых сплавов действительно отмечено, что молибден-ванадиевые сплавы относятся к лучшим с технологической точки зрения сплавам. По-видимому, это обусловлено тем, что меньший объем карбида V2C по сравнению с Мо2С создает меньшие внутренние напряжения (и снижает растрескивание) при сварке.
Сплавы Мо можно условно разбить на три категории: низко-,
средне- и высоколегированные.
Низколегированные сплавы содержат карбидообразующий элемент металл IV подгруппы (MeIV) и иногда определенное количество W и Re, например
Mo + (0,07 0,2) % MeIV + 0,004 % C + (0,5 5) % (W+Re).
Среднелегированные сплавы имеют ту же формулу, но количество карбидообразующего металла и углерода выше, например
Mo + (0,2 0,6) % MeIV + (0,01 0,25) % С + (0,5 5) % (W+Re).
556
Высоколегированные сплавы имеют большие концентрации тех же легирующих элементов, например
Мо + (0,6÷1,3) % MeIV + (0,3÷0,5) % С + (30÷50) % (W+Re).
Основными легирующими элементами группы MeIV во всех сплавах являются Ti и (или) Zr. Молибден-ниобиевые сплавы типа МТА с нитридным упрочнением имеют следующий состав:
Мо + (4,5÷5,1) % Ti + (0,4÷0,6) % N + (4÷16) % Nb.
Ряд сплавов молибдена и механические свойства некоторых из них приведены в табл. 23.112.
В качестве комментария к данным табл. 23.112 следует подчеркнуть, что поскольку механические свойства сплавов Мо существенным образом зависят от конкретной технологии получения и состояния материала, то приведеные в табл. 23.112 данные дают лишь представление об уровне свойств и в целом характеризуют высокий уровень жаропрочности сплавов. В этом отношении сплавы молибдена жаропрочнее сплавов на основе Сr, V и Nb, несколько превосходят даже сплавы на основе более тугоплавкого металла Та, особенно по удельным прочностным характеристикам.
Для упрочнения Мо и его сплавов применяют закалку с температур 2100−2200 °С и старение при 1300−1500 °С. Эффективным является деформирование закаленного сплава перед старением. При этом пластичность сплава несколько снижается, но прочность и жаропрочность возрастают. Например, 100-часовая прочность при 1200 °С сплава TZM, закаленного с 2070 °С и деформированного в процессе старения, возросла в 1,5 раза.
Из сплавов на основе Мо получают различные виды полуфабрикатов − прессованные и катаные прутки, тонкостенные трубы, листы, и т.п. При получении полуфабрикатов с применением многократной деформации промежуточные заготовки из малолегированных сплавов, таких, например, как ВМ1, подвергают высокотемпературной обработке для получения равновесной структуры, обеспечивающей хорошую деформируемость. Одновременно повышается стойкость сплавов против охрупчивания при рекристаллизационном отжиге.
557

Таблица 23.112
Состав и свойства некоторых отечественных и зарубежных молибденовых сплавов
558
Марка |
|
Состав сплава, % |
|
|
Механические свойства |
|
||
сплава |
Zr |
Ti |
C(N) |
Другие |
Т, °С |
σв, МПа |
δ, % |
σ100, МПа |
ЦМ1 |
− |
− |
0,01−0,03 |
− |
1200 |
− |
− |
40 |
ТСМ |
− |
− |
0,06−0,10 |
0,03−0,1Ni |
− |
− |
− |
− |
ЦМ6 |
0,1−0,2 |
− |
0,004 |
0,001−0,003В |
1100 |
420 |
− |
140 |
|
|
|
|
|
1600 |
90 |
− |
− |
|
|
|
|
|
20 |
|
|
|
ТZM (США) |
0,08−0,15 |
0,25−0,55 |
0,01−0,04 |
− |
940 |
− |
− |
|
TZC (США) |
0,15 |
0,25 |
0,15 |
− |
20 |
960 |
22 |
− |
|
|
|
|
|
1000 |
480 |
20 |
430 |
|
|
|
|
|
20 |
|
|
|
ВМ-1 |
0,08−0,18 |
0,03−0,15 |
0,005−0,025 |
0,6W |
800 |
10 |
− |
|
|
|
|
|
|
1000 |
420 |
14 |
320−330 |
|
|
|
|
|
1200 |
340 |
14 |
80−90 |
|
|
|
|
|
20 |
|
|
|
ВМ-2 |
0,25−0,40 |
0,02 |
0,02 |
0,2W |
750 |
10 |
− |
|
|
|
|
|
|
1000 |
520 |
10 |
370−380 |
|
|
|
|
|
1200 |
450 |
13 |
150−160 |
|
|
|
|
|
20 |
|
|
|
4604 |
− |
− |
0,01 |
0,8V |
600−700 |
21−58 |
− |
|
|
|
|
|
|
1000 |
250−300 |
16−18 |
− |
|
|
|
|
|
1300 |
150−200 |
9−10 |
50 |
|
|
|
|
|
1200 |
|
|
|
ЦВМ-30 |
0,05 |
0,05 |
0,004 |
30W, добавки В, |
− |
− |
250 |
|
|
|
|
|
Al |
1100 |
|
|
|
МР-47ВП |
− |
− |
0,004 |
47Re |
450 |
− |
− |
|
|
|
|
|
|
1200 |
350 |
− |
− |
|
|
|
|
|
1300 |
270 |
− |
− |
|
|
|
|
|
|
|
|
|
558
Сходного эффекта можно добиться, вводя в сплавы при плавке совместно с Ti и Zr углерод в количестве несколько большем, чем это нужно для раскисления Мо (например, 0,015 вместо 0,003−0,005 %). Добавка углерода, увеличивая количество карбидов, одновременно интенсифицирует распад пересыщенного твердого раствора и коагуляцию частиц.
Повышению пластичности сплавов Мо способствует также введение в них при плавке добавок редкоземельных элементов. Уменьшая скорость плавления слитка, они увеличивают не только длительность пребывания металла в расплавленном состоянии, но и длительность пребывания затвердевшей части слитка при высокой температуре. Поэтому литой металл как бы проходит термообработку при постепенно понижающейся температуре. При этом происходит распад пересыщенного твердого раствора, выделяются примеси внедрения в молибдене. Вместе в тем высокая температура создает условия для релаксации напряжений, возникающих при выделении частиц второй фазы. Благодаря этому пластичность литых молибденовых сплавов резко повышается, что позволяет производить их деформирование при менее высокой температуре и уменьшает вероятность образования трещин в процессе деформации.
Практически все сплавы Мо хорошо обрабатываются различными видами резания. При сварке деталей из молибденовых сплавов электронно-лучевым методом получается вакуумно-плотный, хорошо сформированный шов. Однако вплоть до последнего времени пластичность сварных соединений у молибденовых сплавов была относительно невысока по сравнению с основным металлом.
Сплавы на основе вольфрама
Природный вольфрам состоит из пяти стабильных изотопов
180W (0,135 масс.%), 182W (26,41%), 183W (14,4%), 184W (30,64%) и
186W (28,41%). В 2003 г. открыта чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180W, имеющего период полураспада 6 1014 (1,8 1018) лет. Искусственно созда-
559
ны и идентифицированы еще 27 радионуклидов. Образующиеся при нейтронном облучении изотопы имеют периоды полураспада от долей секунд до нескольких десятков суток, что приводит к быстрому спаду наведенной активности W (см. рис. 23.273).
Вольфрам − это металл с уникальными свойствами. Достоинства вольфрама: он имеет самую высокую температуру плавления и самое низкое давление насыщенного пара среди металлов, самый высокий модуль упругости и самый низкий коэффициент сжимаемости. Теплопроводность W составляет менее половины теплопроводности Сu, но она намного выше, чем теплопроводности Fe и Ni. To же самое относится и к электрической проводимости вольфрама. Он обладает высокой прочностью и твердостью при комнатной и повышенной температурах. Однако существенными недостатками W являются низкая пластичность и жаростойкость, относительно высокое сечение захвата тепловых нейтронов. Он дорог, имеет сложную технологию получения и обработки.
Легирование W является операцией, позволяющей улучшить его природные свойства, в частности, повысить жаропрочность и жаростойкость, увеличить пластичность, улучшить физические свойства. Как показывает анализ данных в табл. 23.107, вольфрам образует твердые растворы с целым рядом металлов, среди которых непрерывные ряды твердых растворов имеют место с Nb, Та и Мо. Тройные системы W с этими элементами также представляют собой непрерывные ряды твердых растворов. Из числа основных и вспомогательных легирующих элементов отметим следующие.
Молибден и ниобий − элементы, сравнительно мало понижающие температуру плавления вольфрама, существенно повышают его жаропрочность, особенно при температуре ниже 1900−2000 °С. Так, деформация за счет ползучести при 1650 °С за 5 ч для нелегированного W равна 4,5 %, в то время как для сплавов W + 12% Мо и W + 10% Nb она составляет соответственно 2,6 и 0,55 %.
Цирконий и титан − элементы, резко снижающие температуру плавления W, повышают его жаропрочность за счет образования дисперсных частиц карбидов. Их содержание в сплавах W обычно < 0,15 %, однако такие сплавы превосходят по прочности сплавы, легированные молибденом и ниобием (табл. 23.113). Еще более
560

высокими прочностными свойствами обладают сплавы W с повышенным содержанием С и сложнолегированные сплавы. Так, предел прочности сплава W + 0,9 % Nb + 0,018 % С при 1650 °С со-
ставляет 320−420 МПа; для сплава W + l,5 %Nb + 0,l % Zr + + 0,1 % Hf + 0,001 % С при 1650 °С он равен 540 МПа, а при
2200 °С − 230 МПа. Однако усложнение состава сплава и увеличение содержания углерода обычно приводят к снижению пластичности и росту температуры перехода в хрупкое состояние. Для указанных сплавов температура хрупко-вязкого перехода близка к 500 °С, в то время как для прессованных сплавов W + 5 %Мо, W + 15 % Mo, W + 0,5 % Nb она лежит в интервале 200−300 °С.
Поэтому обычно подбирают оптимальное содержание углерода и легирующих элементов.
Таблица 23.113
Свойства прутков из W и его сплавов при различной температуре
Состав сплава, % |
1650 °C |
|
1930 °C |
2200 °C |
||||
σв, МПа |
δ, % |
σв, МПа |
|
δ, % |
σв, МПа |
δ, % |
||
W* |
100 |
|
55 |
60 |
|
68 |
30 |
62 |
W + 5Мо* |
200 |
|
28 |
70 |
89 |
40 |
− |
|
W + 25Мо** |
220 |
|
15 |
80 |
48 |
30 |
− |
|
W + 0,5Nb* |
260 |
|
32 |
90 |
55 |
50 |
81 |
|
W + 0,07Тi** |
120 |
|
36 |
90 |
37 |
− |
− |
|
W + 0,12Zr** |
350 |
|
16 |
100 |
49 |
− |
− |
|
_________
*Прессованные прутки.
**Кованые прутки.
Хорошую технологичность наряду с высокой жаропрочностью имеют сплавы с рением, например сплав W + 30% Re, для которого даже после рекристаллизационного отжига температура перехода в хрупкое состояние ниже комнатной.
Одним из путей повышения прочности при одновременном снижении температуры хрупкого перехода W, по-видимому, может явиться введение в него легирующих добавок в виде дисперсных частиц оксидов, карбидов, нитридов. Так, введение ThO2, TiN, ZrО2
561

или ТаС в количестве до 1 % снижает температуру перехода Тх деформированного W, полученного методом порошковой металлургии, на 60−80 °С. Такие сплавы при температуре выше 1900 °С имеют повышенную прочность. Например, сплав W + 1 % ThO2 при температуре 1900−2400 °С в 2−4 раза превосходит по прочности сплав W + 25% Мо. В настоящее время разрабатываются для использования в ядерных реакторах сплавы систем W−Мо и W−Mo−Re с диоксидом тория, обладающие высокими прочностными и жаропрочными свойствами.
Применение W при высокой температуре препятствует его низкая жаростойкость. Легирование, как правило, несущественно влияет на нее. Хотя некоторые сплавы W, например сплавы системы W−Nb, окисляются в несколько раз медленнее, чем нелегиро-
ванный W, их нельзя использовать без защитных покрытий для длительной работы в кислородосодержащей среде при высокой температуре.
23.5.2.Пластичность тугоплавких металлов
иих обработка
Пластичность. Общей особенностью тугоплавких ОЦК металлов VIa подгруппы является низкая пластичность1, высокая температура перехода из хрупкого в вязкое состояние, что существенно затрудняет получение из них изделий путем механической обработки давлением.
Влияние температуры на пластичность графически можно представить так, как это показано на рис. 23.277, откуда видно, что пластические свойства материала с уменьшением температуры снижаются, т.е. материал переходит в хрупкое состояние. Этот переход осуществляется в интервале температуры, но обычно выбирают некоторое условное значение параметра пластичности, и температуру, которой соответствует это значение, называют
турой хрупко-вязкого перехода – Тх.
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. П. 6.5.
562

Рис. 23.277. Схема влияния температуры деформации на пластичность металлов, склонных к низкотемпературной хрупкости
Для ОЦК металлов VIa подгруппы недостаточная пластичность связана с особенностями электронного строения атомов и избыточной концентрацией примесей1. Напомним, что вследствие заполненности наполовину d-электронного уровня (для Мо: 4s24p64d55s1) эти металлы при высоком уровне сил межатомной связи имеют жесткую направленность связей, т.е., кроме металлической связи s-электронов, существует сильная ковалентная составляющая связи, действующая в ближнем порядке. К тому же решетка ОЦК металлов имеет малый размер октаэдрических пустот (0,154ra), т.е. мест возможного расположения примесей внедрения. Поэтому уровень растворимости примесей в металлах VIа подгруппы очень мал, и наличие их в решетке вызывает ее значительное искажение.
Механизм перехода металла из пластического состояния в хрупкое обязательно должен быть связан с общим или локальным повышением сопротивления пластической деформации. Действительно, для всех тугоплавких металлов, даже в виде зоннорафинированных монокристаллов с весьма малым содержанием примесей внедрения, при понижении температуры наблюдается интенсивный рост предела текучести (рис. 23.278). Предел текучести тем выше, чем выше стартовое напряжение большинства источников дислокаций. Хорошо известно, что повышение стартового напряжения источников, облегчая зарождение и рост трещин, должно повышать склонность металла к хрупкому разрушению. Поэтому вполне естественно, что рост предела текучести с понижением температуры сопровождается появлением хрупкости.
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. П. 6.5.
563
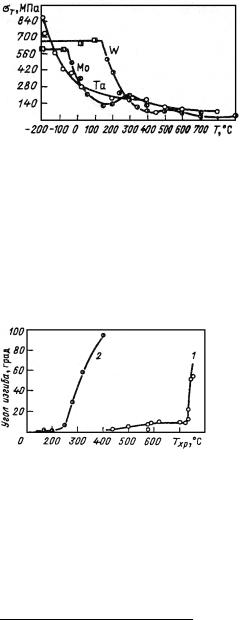
Рис. 23.278. Температурная зависимость предела текучестит тугоплавких металлов
По величине Тх в порядке ее возрастания тугоплавкие металлы технической чистоты можно расположить в следующий ряд: Та, Nb, V, Mo, Cr, W. Однако, строго говоря, в каждом конкретном случае температура хрупко-вязкого перехода зависит от многих факторов. Например, Тх существенно зависит от содержания в металле примесей внедрения: кислорода, азота, углерода, а для металлов Va подгруппы и водорода. Снижение содержания этих примесей уменьшает склонность тугоплавких металлов к хрупкому разрушению (рис. 23.279).
Рис. 23.279. Влияние содержания примесей внедрения на температуру хрупкого перехода вольфрама:
1 0,029 % С + 0,085 % О + + 0,014 % N+ 0,0004 % Н; 2 0,011 % С + 0,02 % О + + 0,012 % N+ 0,0001 % Н
На температуру хрупко-вязкого перехода сильно влияет напряженное состояние в металле, определяемое видом механических нагрузок1. Наиболее опасны растягивающие нормальные напряжения отрыва, ответственные за хрупкое разрушение. Отношение нормальных напряжений к касательным при сжатии минимально и равно 0,5; при кручении оно равно 1,0; при растяжении 2,0, а при испытании образцов с надрезом на ударную вязкость значительно превышает 2,0. С ростом этого отношения значениеТх увеличивается.
1 Физическое материаловедение. Т. 2. М.: МИФИ, 2007. Гл. 6.
564
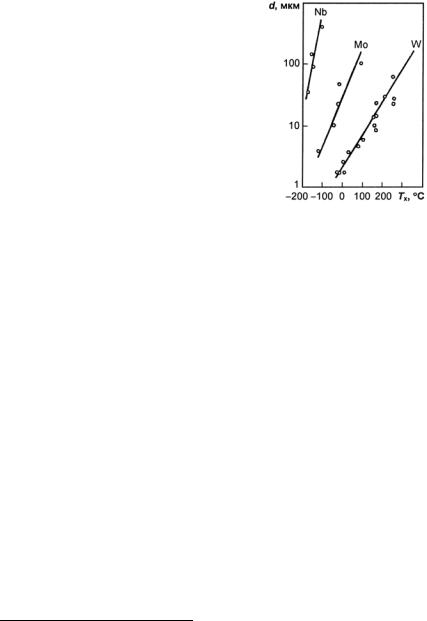
На температуру хрупкого перехода влияет структура сплава, величина и форма зерна, наличие включений второй фазы, степень их дисперсности и т.п. (рис. 23.280).
Как уже отмечалось, у металлов VIa подгруппы Тх значительно выше, чем у металлов Va подгруппы.
При деформации металлов с ОЦК решеткой различают два предела текучести − верхний и нижний. Первый из них соответствует напряжению, необходимому для движения дислокаций, взаимодействующих с примесными атомами, второй − напряжению, необходимому для скольжения дислокаций,
заблокированных примесями. Различие между верхним и нижним пределами текучести невелико. Это может свидетельствовать о том, что суммарный вклад примесных атмосфер в торможение дислокаций в металлах с ОЦК решеткой сравнительно невелик.
У поликристаллических металлов температура хрупко-вязкого перехода выше, чем у монокристаллов. Это связывают с особой ролью границ зерен в процессе разрушения. Считают, что при разрушении литых поликристаллических металлов технической чистоты, в том числе и тугоплавких, полученных направленной кристаллизацией с относительно небольшой скоростью плавления, зарождение трещин происходит в большинстве случаев на границе зерен, независимо от того, какой характер носит разрушение − ин-
теркриапаллитный или транскристаллитный. Повышенную веро-
ятность возникновения трещин на границах зерен связывают не только с барьерным действием границ по отношению к движущимся дислокациям, но и с повышенным содержанием примесей на границах1.
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. Гл. 6.
565
Действительно, авторадиографическое исследование выплавленного в вакууме молибдена, содержащего радиоактивный изотоп 14С, показывает, что внутри зерен углерод распределен относительно равномерно, а на границах зерен его концентрация повышена. Одновременно наблюдается обеднение углеродом приграничных участков зерен, свидетельствующее о том, что сегрегация углерода происходит главным образом в результате диффузии в твердом состоянии.
Обогащение границ зерен примесями может быть вызвано различными видами взаимодействия примесных атомов с дефектами кристаллической решетки, например с повышенной плотностью дислокаций на границах зерен и субзерен. Обогащение примесями узкой межзеренной зоны может ослаблять связь между соседними зернами и способствовать охрупчиванию металла. Есть основание считать, что при этом особенно важно, в каком состоянии примесь присутствует в металле. В тугоплавких металлах Va подгруппы, полученных вакуумной дуговой, а тем более электронно-лучевой плавкой, содержание примесей внедрения, как правило, меньше предельной растворимости, и эти металлы представляют собой насыщенные твердые растворы.
Тугоплавкие металлы VIa подгруппы, даже выплавленные в электронно-лучевых печах, содержат примеси внедрения в количестве, превышающем предельную растворимость при комнатной температуре, и при их охлаждении выделяются карбиды, нитриды, оксиды и другие фазы. На границах зерен, обогащенных примесями, вероятность выделения таких фаз особенно велика. Так, исследования микро- и субмикроструктуры литого Мо показывают, что наблюдаемая на автодиаграммах повышенная концентрация углерода на границах зерен обусловлена наличием дисперсных карбидных частиц. Такой металл имеет повышенную температуру хрупковязкого перехода в отличие, например, от Мо технической чистоты, закаленного от 2100−2200 °С и имеющего практически однофазную структуру − твердый раствор; закаленный Мо имеет при комнатной температуре относительное сужение площади поперечного сечения Ψ ≈ 90 %, т.е. пластичен.
566
Можно добавить, что последующий нагрев закаленного Мо до 900−1700 °С, приводящий к распаду пересыщенного твердого раствора и выделению частиц второй фазы, делает металл хрупким (Ψ ≈ 0 %). Эти факты показывают, что влияние примесей внедрения на хрупкость тугоплавких металлов проявляется наиболее ярко, когда они присутствуют в металле в виде второй фазы (на границах зерна).
В литом Мо, полученном вакуумной дуговой плавкой, вторая фаза выделяется в виде высокодисперсных частиц, расположенных главным образом по границам зерен; внутри зерен число частиц и их размеры во много раз меньше. Разрушение такого металла носит хрупкий интеркристаллитный характер. Добавка в Мо углерода (до 0,1 %) приводит к увеличению числа и укрупнению частиц как на границах, так и внутри зерен, где наряду с отдельными крупными частицами (более 10 мкм) выделяется множество высокодисперсных частиц (меньше 0,1 мкм). Это сопровождается снижением пластичности металла и повышением температуры хрупко-вязкого перехода. Одновременно изменяется характер разрушения: литой Мо, содержащий 0,04−0,06 % С, разрушается уже не чисто интеркристаллитно, а смешанно − интер- и транскристаллитно.
Приведенные факты свидетельствуют о существенной роли дисперсных частиц второй фазы в охрупчивании тугоплавких металлов и об их определяющем влиянии на характер разрушения. В основе этого может лежать торможение дисперсными частицами движущихся дислокаций. Этот механизм предполагает существование значительных напряжений около частиц, выделяющихся из пересыщенного твердого раствора. Во-первых, причиной возникновения таких напряжений при охлаждении или нагреве металла может быть различие коэффициентов термического расширения матрицы и частицы. Однако расчеты показывают, что в этом случае в тугоплавких металлах, содержащих карбиды и охлаждающихся, например, от 1400−2000 °С до комнатной температуры, термические напряжения не должны превышать 200−500 МПа. Во-вторых, значительно более высокие напряжения могут возникать из-за различия удельных атомных объемов матрицы и частицы (табл.
567

23.114). Можно предположить, что при выделении частиц второй фазы в результате различия удельных атомных объемов должны возникать очень большие напряжения и эти напряжения играют решающую роль в возникновении трещин в местах выделения дисперсных частиц второй фазы.
Таблица 23.114
Размерное несоответствие для карбидов молибдена, титана и циркония, выделяющихся в молибдене
|
Удельный |
Различие |
|
Удельный |
Различие |
|||||
Мате- |
удельных |
Мате- |
удельных |
|||||||
атомный объем, |
атомный объем, |
|||||||||
риал |
|
−6 |
3 |
атомных |
риал |
|
−6 |
3 |
атомных |
|
|
10 |
|
м /г-атом |
объемов, % |
|
10 |
|
м /г-атом |
объемов, % |
|
Мо |
|
|
15,6 |
− |
TiC |
|
|
20,3 |
30 |
|
Мо2С |
|
|
18,5 |
19 |
ZrC |
|
|
25,5 |
63 |
|
Расчеты показывают, что вблизи частицы напряжения должны достигать значений порядка теоретического предела прочности (0,05÷0,10G). Так, в Мо при выделении частиц карбида Мо2С при 1600 °С расчетное напряжение на границе раздела частицы с матрицей составляет 5600 МПа. Естественно, для карбидов титана и циркония эти напряжения должны быть еще больше.
Таким образом, при распаде пересыщенного твердого раствора примесей внедрения, несмотря на снижение упругой энергии металла в целом, в отдельных участках кристаллической решетки, где выделяются частицы второй фазы, упругая энергия резко повышена. Здесь возникают большие упругие деформации и соответствующие напряжения. Напомним1, это явление получило название локального фазового наклепа − локального, так как напряжения быстро убывают по мере удаления от частицы; например при r = 2R они снижаются в 8 раз (R − радиус частицы; r − расстояние от частицы).
Большие напряжения около выделившейся частицы должны приводить к пластической деформации матрицы и, следовательно,
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. Гл. 6.
568
релаксировать. Однако это происходит лишь в тех случаях, когда частица растает до определенного размера. Около частицы, когерентно связанной с матрицей, напряжения могут релаксировать либо путем выдавливания в решетку матрицы призматических дислокационных петель, либо путем инициирования работы источников дислокаций, расположенных вблизи частицы. В первом случае необходимо, чтобы напряжения были порядка теоретического предела прочности. Во втором случае требуется напряжение на несколько порядков меньшее, поэтому второй путь представляется более вероятным.
Теория локального фазового наклепа, связывающая низкотемпературную хрупкость тугоплавких металлов с большими внутренними напряжениями, возникающими при выделении и коагуляции частиц второй фазы из пересыщенного твердого раствора примесей внедрения, подтверждается при сопоставлении характера изменения механических свойств металла при термообработке и обработке давлением с характером изменения его микроструктуры. С позиций теории локального фазового наклепа склонность металлов к хрупкому разрушению должна увеличиваться в условиях, обеспечивающих рост внутренних напряжений около частиц второй фазы, и, наоборот, должна уменьшаться в условиях, обеспечивающих релаксацию этих напряжений.
Если металл находится в закаленном состоянии или представляет собой пересыщенный твердый раствор в начальной стадии распада, когда большинство выделившихся частиц имеет размеры намного меньшие критического, то при высокотемпературном отжиге он должен охрупчиваться, так как увеличение числа и размеров частиц в этом случае сопровождается ростом напряжений локального фазового наклепа. Если размеры большинства частиц, присутствующих в исходном материале, превышают критические, то при их коагуляции будет происходить релаксация напряжений локального фазового наклепа. В этом случае отжиг должен приводить к повышению пластичности металла, однако, лишь до тех пор, пока в последнем не образуются группировки частиц, внутри которых релаксация напряжений заторможена. Отжиг металла, содержащего такие группировки, приводит к увеличению числа частиц в них и к
569
постепенному растворению изолированных частиц, способных при коагуляции инициировать работу близлежащих источников дислокаций, должен возвращать металл в хрупкое состояние. Такое изменение свойств наблюдается при отжиге литого Мо, выплавленного с добавками углерода, в исходной структуре которого присутствуют достаточно крупные частицы второй фазы. При этом чем ниже температура отжига, тем медленнее растет пластичность в его начальной стадии и тем позже начинается охрупчивание, вызванное образованием группировок частиц (рис. 23.281). Это может быть связано с тем, что с понижением температуры скорость коагуляции уменьшается быстрее, чем скорость релаксационных процессов, препятствующих образованию и росту группировок частиц.
Рис. 23.281. Влияние длительности отжига при рaзличной температуре на пластичность литого Мо, содержащего 0,01 % С
Последнее подтверждается возможностью восстановления пластичности металла, охрупченного при длительном высокотемпературном отжиге, в результате повторного отжига при менее высокой температуре. Так, пластичность литого Мо с добавкой 0,01 % С, отожженного до полной хрупкости (δ = Ψ = 0) при 1400 °С в течение 100 ч, восстанавливается повторным отжигом при 1300 °С в течение 50 ч. При повышении температуры первого отжига от 1400 до 1600 °С из-за образования более крупных группировок частиц (а следовательно, из-за усиливающегося торможения релаксационных процессов внутри группировок) для восстановления пластичности путем повторного отжига при 1300 °С требуется более дли-
570

тельное время (150 ч). Повышение температуры повторного отжига до 1400 °С, способствуя интенсифации релаксационных процессов, сокращает время, необходимое для восстановления пластичности,
до 30−50 ч.
Наблюдаемая зависимость характера изменения пластичности при отжиге от исходной структуры металла показывает, что для повышения его пластичности в литом состоянии можно использовать легирование небольшим количеством примесей внедрения, например углеродом, который независимо от этого применяется при плавке тугоплавких металлов как раскислитель. Легирование, обеспечивая более полный распад пересыщенного твердого раствора в слитке, несколько охрупчивает металл. Однако последующий отжиг позволяет повысить его пластичность до уровня, недостижимого в случае нелегированного литого металла технической чистоты с практической однофазной структурой.
Обработка. Высокая температура плавления тугоплавких металлов, особенно Мо и W, их высокая реакционная способность и металлургия восстановления этих металлов из соединений стимулировали такие основные виды получения тугоплавких металлов, как порошковая металлургия и вакуумная плавка с последующей их обработкой давлением-прессованием, экструзией, ковкой, прокаткой1.
Спеченные и литые слитки металлов обычно подвергают первичной деформации на 75−80 %. При этом вытягиваются зерна, увеличивается плотность дислокаций и формируется ячеистая структура, снижается пористость. Первичная деформация включает в себя прессование и экструзию. Прессованию обычно предшествует высокотемпературный отжиг для снятия остаточных (например, при литье) напряжений и для распада пересыщенного твердого раствора (перестаривания) (табл. 23.115). Продолжительность отжига зависит от состояния сплава и равна 2−5 ч.
Вследствие низкой пластичности и высокой прочности сплавы тугоплавких металлов прессуются также при высоких температурах, но несколько ниже (на 100−200 °С) температуры отжига.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. Гл. 18.
571

Прессование и другие виды обработки давлением осуществляют в боксах или специальных цехах с контролируемой средой. В качестве такой среды могут применяться водород (для Мо и W), инертные газы (например, Аr), расплавы солей. Для защиты от окисления используют оболочки из стали, меди и других металлов, специальные смазки. При получении листа, фольг, проволоки и труб используют вторичное деформирование с постепенным снижением температуры обработки.
|
|
|
Таблица 23.115 |
|
Температура отжига тугоплавких металлов и их сплавов |
||
|
|
|
|
Металл |
Температура, °С |
Сплав |
Температура, °С |
Сr |
700−900 |
Cr−10W, Cr−55Fe |
1400−1600 |
Nb |
1000−1200 |
Nb−15W−5Mo−0,6Zr |
1450−1600 |
Mo |
1200−1300 |
Сплавы Mo |
1300−2200 |
W |
1300−1600 |
Сплавы W |
1800−2200 |
Поскольку обработка тугоплавких металлов давлением проводится при высокой температуре, она, так же как и термообработка, может существенно влиять на их СФС и пластические свойства. При всестороннем сжатии металла под действием внешней нагрузки внешнее давление суммируется с напряжениями локального фазового наклепа. В результате напряжение, действующее на источники дислокаций, повышается, они начинают генерировать дислокации и напряжения около частиц второй фазы частично релаксируют. Чем выше внешнее давление при деформации, тем ниже напряжения локального фазового наклепа в деформированном металле, и тем более высокой пластичностью он должен обладать. Степень деформации, которая с повышением внешней нагрузки в определенных пределах увеличивается, влияет на пластичность деформированного металла аналогичным образом: относительное удлинение прутков Mo с добавкой 0,01 % С, полученных прессованием при 1700 °С при увеличении степени деформации от 2,5 до 8,7 % возрастает от 9 до 22 % в продольном и от 0 до 6 % в поперечном направлениях.
572

Таким образом, регулируя содержание примесей внедрения в Мо и рационально сочетая термообработку и обработку давлением,
можно значительно снизить температуру хрупко-вязкого пере-
хода и обеспечить высокую пластичность при комнатной температуре.
Проблема хрупкости стоит особенно остро в связи с необходимостью получения деформируемых слитков и полуфабрикатов тугоплавких металлов − прутков, труб, листов и т.д., а также в связи с необходимостью получения достаточно прочных и пластичных сварных соединений. Низкая деформируемость и неудовлетворительная свариваемость, свойственные большинству сплавов тугоплавких металлов, и в первую очередь сплавам Сr, Мо и W, существенно сдерживают их производство и применение в современной технике.
Реальные пути преодоления этих трудностей открылись только после разработки принципиально новых способов производства и обработки, направленных на получение высокочистых металлов1. Были разработаны новые технологические процессы и создано соответствующее оборудование − вакуумные дуговые и электроннолучевые плавильные печи, вакуумные печи и печи с защитной атмосферой для термообработки и нагрева металла под деформацию, вакуумные прокатные станы и прессы и, наконец, целые цеха с защитной атмосферой для обработки тугоплавких металлов. Все это привело к быстрому росту производства тугоплавких металлов и сплавов. Одновременно расширяются работы по исследованию свойств тугоплавких металлов − коррозионной стойкости, прочности и жаропрочности, перехода из пластичного состояния в хрупкое, совместимости с другими материалами и др.
23.5.3. Окисление тугоплавких ОЦК металлов
Рассмотрим окисление тугоплавких ОЦК металлов по подгруппам периодической таблицы элементов Д.И. Менделеева.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. Гл. 17.
573

При температуре выше 400−600 °С тугоплавкие металлы интенсивно взаимодействуют с кислородом1. При этом образующаяся оксидная пленка не защищает от дальнейшего окисления (это не относится к оксидной пленке на хроме). Легирование позволяет резко снизить скорость окисления, но не дает возможности достичь достаточной жаростойкости. Кроме того, наиболее жаростойкие высоколегированные сплавы обладают повышенной хрупкостью и низкой температурой плавления. Поэтому при использовании тугоплавких металлов и сплавов на воздухе и в некоторых других кислород содержащих средах при высокой температуре применяют
защитные покрытия.
Характер взаимодействия металлов Va подгруппы с кислородом при температуре ниже температуры плавления оксидов в основных чертах соответствует общим закономерностям окисления: металлы адсорбируют кислород, растворяют его и образуют с ним оксиды. Дальнейшее окисление сопровождается ростом пленки, а также диффузией кислорода сквозь нее с последующим растворением его
вметалле и увеличением толщины слоя твердого раствора, расположенного под пленкой.
Впериод формирования сплошной пленки (1-я стадия, так называемый инкубационный период) окисление протекает быстро. Затем процесс поглощения кислорода замедляется благодаря защитному действию оксидной пленки, и последующее окисление (2-я стадия) происходит по параболическому закону. В дальнейшем пленка утрачивает защитные свойства и параболический закон окисления сменяется линейным (3-я стадия) (рис. 23.282). При прочих равных условиях окисление на воздухе обычно происходит медленнее, чем в чистом кислороде.
На стадии окисления по параболическому закону энергия активации окисления близка к энергии активации диффузии кислорода
вметалле (табл. 23.116). По-видимому, на этой стадии окисления скорость процесса определяется диффузией кислорода из пленки в металл.
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. Гл. 7.
574
Рис. 23.282. Кинетика окисления Nb при температуре 400 °С (а) и 1000 °С (б)
и давлении кислорода 2,7 (1); 20,0 (2); 65,9 (3) и 101,1 кПа (4)
Таблица 23.116
Энергия активации некоторых процессов для металлов Va подгруппы, кДж/моль
|
Окисление по |
Диффузия |
Азотирование по |
|
Металл |
параболическому |
параболическому |
Диффузия азота |
|
|
закону |
кислорода |
закону |
|
|
|
|
||
V |
128,5 |
121,4 |
131,4 |
144,9 |
|
(400−600 °С) |
− |
(600−900 °С) |
− |
Nb |
95,5 |
92,1 |
106,3 |
117,6 |
|
(200−375 °С) |
(375−425 °С) |
(400−850 °С) |
(585−645 °С) |
Та |
114,7 |
114,3 |
165,0 |
165,8 |
|
(250−450 °С) |
(155−355 °С) |
(500−850 °С) |
(360−622 °С) |
575
На скорость окисления Та и Nb существенно влияют их чистота и внутренние напряжения. Так, Nb чистотой 99,9 %, полученный иодидным рафинированием с последующей электронно-лучевой плавкой в вакууме, окисляется быстрее, чем Nb технической чистоты, а скорость окисления холоднокатаного Та при температуре выше 600 °С несколько больше, чем Та, отожженного в вакууме.
Высокотемпературное окисление V имеет свою специфику, связанную с низкой температурой плавления оксида V2О5 (675 °C). Этот оксид, обычно образующийся на поверхности пленки, при высокой температуре плавится и стекает с поверхности. Остающийся тонкий слой низших оксидов слабо препятствует дальнейшему окислению ванадия. Поэтому при температуре выше 675 °С ванадий окисляется значительно быстрее Nb и Та, хотя при меньшей температуре скорости окисления этих металлов сравнимы.
Установлено, что на 2-й стадии окисления Nb и Та образуется темная пленка, прочно сцепленная с поверхностью металла. Постепенное уменьшение скорости окисления по мере роста темной пленки свидетельствует о том, что она обладает высокими защитными свойствами. Затем на поверхности темной пленки появляются отдельные участки белого цвета, которые постепенно образуют сплошной слой белого оксида. В этот период окисление идет по линейному закону.
О причине различия защитных свойств наружного и внутреннего слоев пленки можно судить по результатам исследования их структуры методами электронографии и рентгенографии. Эти результаты показывают, что и подслой, и темная оксидная пленка имеют сложное строение. На границе с металлом обычно располагаются низшие оксиды типа МеО и МеО2, а наружная часть подслоя и темной пленки в зависимости от температуры и длительности окисления состоит из одной или двух модификаций высшего оксида типа Ме2O5.
Фазовый состав белой пленки и наружной части темного подслоя практически одинаков. Различие состоит лишь в том, что в подслое кристаллическая решетка сильно искажена из-за больших внутренних напряжений, возникающих в результате существенного различия удельных атомных объемов оксидов и металла. Отсюда
576

следует, что появление белого оксида и сопутствующий ему переход от параболического закона окисления к линейному связаны не с изменением типа образующихся оксидов, а скорее с изменением напряженного состояния оксидной пленки.
При исследовании линейной стадии окисления Nb при температуре 400−700 °С было установлено, что с повышением температуры толщина темного подслоя постепенно увеличивается. В интервале 600−612 °С это увеличение носит скачкообразный характер: повышение температуры всего на 12° приводит к возрастанию толщины подслоя почти в два раза. При этом скорость окисления снижается также в два раза. Этот факт свидетельствует о том, что скорость линейного окисления в существенной мере зависит от толщины подслоя.
Попытки повысить жаростойкость металлов Va подгруппы посредством легирования привели к определенным успехам1, однако их жаростойкие сплавы обладают низкой технологичностью. Поэтому в настоящее время единственным реальным путем, позволяющим обеспечить работоспособность металлов Va подгруппы и сплавов на их основе в окислительной атмосфере при высокой тем-
пературе, считают применение защитных покрытий.
При сравнительно невысокой температуре кинетика окисления Сr, Мо и W сходна с кинетикой окисления металлов Va подгруппы. Сначала они окисляются по параболическому (2-я стадия), а затем по линейному (3-я стадия) закону. Длительность 2-й стадии окисления сокращается с повышением температуры. У Сr эта стадия наиболее продолжительна. При 600, 1000 и 1300 °С она может длиться более 200, 100 и 20 ч соответственно, в то время как у W при температуре 700−1000 °С она заканчивается через 1−3 ч. Это объясняется более высокими защитными свойствами пленки оксида Сr2O3, образующегося при окислении хрома. Однако в некоторых случаях при достаточно высокой температуре, например 900−1100 °С, на кинетических кривых окисления Сr наблюдается постепенное увеличение скорости процесса, соответствующее, повидимому, началу переходного периода от параболического закона
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. Гл. 7.
577
окисления к линейному. Иногда при этом отмечается растрескивание пленки.
При окислении Мо и W ускорение процесса при переходе от параболической стадии к линейной не наблюдается. По-видимому, оно выражено менее ярко, чем у Сr, и проявляется лишь в определенном температурном интервале. На поверхности Мо и W обычно образуются оксиды типа МеО3. Однако более точные исследования показывают, что на границе раздела пленка−металл образуются оксиды, менее богатые кислородом. Так, при окислении W наблюдали пленку из двух слоев − наружного пористого и рыхлого слоя желтого цвета, состоящего из триоксида вольфрама и внутреннего плотного, хорошо сцепленного с металлом слоя, имеющего темную окраску и состав, промежуточный между WO2 и WO3. Переход от параболического закона окисления к линейному связывают с появлением рыхлого и пористого слоя на поверхности пленки. При достаточно высокой темпeратуре существенным фактором, определяющим кинетику окисления, по-видимому, является высокая летучесть оксидов (по крайней мере в случае Мо и W).
При высокой температуре, когда существенно интенсифицируется сублимация оксидов, окисление может сопровождаться не увеличением, а уменьшением массы окисляющегося металла. Например, это ярко выражено в случае МоO3 (рис. 23.283), летучесть которого особенно высока. При атмосферном давлении МоO3 начинает испаряться при температуре выше 500 °С, а около температуры плавления оксида скорость его испарения становится равной скорости образования. Выше этой температуры жидкий слой оксида не защищает металл от окисления, и оно становится катастрофическим. Так, при 980 °С толщина окисляющегося молибденового образца уменьшается со скоростью 0,5−1,25 мм/ч, т.е. лист Мо толщиной 25−60 мм за сутки может полностью перейти в газовую фазу.
При окислении W испарение оксида WO3 становится заметным при температуре выше 1000 °С. При окислении Сr потери массы не происходит, по крайне мере в изученном интервале температуры (500−1300 °С). Это может быть обусловлено меньшей летучестью
оксида Сr2О3.
578
Рис. 23.283. Кинетика изменения массы листового Мо в результате окисления при Т = 650 °С (а) и 700 °С (б):
1 − увеличение массы, которое теоретически должно происходить при окислении; 2 − изменение массы, наблюдаемое экспериментально; 3 − изменение массы за счет испарения оксида MoO3
Так же, как и для металлов Va подгруппы, увеличение давления кислорода, как правило, ускоряет окисление Сr, Мо и W. В соответствии с этим металлы Va подгруппы на воздухе обычно окисляются несколько медленнее, чем в чистом кислороде.
Основным путем повышения стойкости к окислению Сr, Мо и W, как и в случае металлов Va подгруппы, является нанесение за-
щитных покрытий.
Покрытия, защищающие металл от окисления при высокой температуре, должны, в первую очередь, являться надежным диффузионным барьером как для кислорода, так и для металла−подложки. Они также должны быть инертны по отношению к кислороду и защищаемому металлу. Кроме того, они должны иметь низкую упругость паров и температуру плавления, превышающую рабочую температуру. Покрытия при необходимости должны обладать достаточно высокими прочностью, термостойкостью, радиационной стойкостью и другими эксплуатационными характеристиками, определяемыми условиями работы конструкции. Наконец, весьма желательно, чтобы защитные покрытия обладали свойства-
579
ми самозалечивания нарушенной сплошности, которые могут проявляться в них в процессе эксплуатации.
Перспективными защитными покрытиями для тугоплавких ме-
таллов являются силицидные покрытия. Их наносят путем диффузионного насыщения металла кремнием из твердой, жидкой или газовой фазы, содержащей Si или его соединения. Фазовый состав и структура такого покрытия зависят от способа силицирования и условий, в которых оно производится. Обычно оно представляет собой слой дисилицида (соединений типа MeSi2), отделенного от металла тонким слоем менее богатого кремнием соединения типа Me5Si3. Иногда при длительном силицировании на границе раздела покрытия с металлом обнаруживают третий слой, состоящий из низшего силицида, например, типа Me3Si для Мо и W и типа Me4Si для Nb и Та. При нанесении покрытия из газовой фазы на его поверхности может присутствовать и слой кремния.
При контакте с окислительной средой дисилицид окисляется с образованием на поверхности стекловидной пленки диоксида кремния SiO2, которая надежно защищает металл и дисилицид от дальнейшего окисления. При нарушении сплошности покрытия Si интенсивно диффундирует к месту дефекта и окисляется с образованием новой пленки, обеспечивая таким образом самозалечивание покрытия.
Необходимо отметить, что при пониженном давлении кислорода (например, менее 0,7 кПа) высокотемпературное окисление дисилицидов сопровождается образованием оксида кремния SiO, который в указанных условиях легко испаряется. В этом случае защитная пленка SiО2 не появляется и происходит быстрое окисление покрытия.
Образование в ходе окисления стекловидной пленки диоксида кремния приводит к обеднению поверхностной части дисилицидного слоя кремнием, и здесь образуется еще один слой соединения типа Me5Si3. Одновременно происходит диффузия Si из покрытия в металл. Эти процессы приводят к постепенному истощению дисилицидного слоя и росту низших силицидов. Время существования дисилицидного слоя и определяет жаростойкость покрытия, так как низшие силициды окисляются значительно быстрее.
580
При постоянной температуре в интервале 1000−1600 °С силицидные покрытия могут обеспечивать защиту тугоплавких металлов от окисления в течение десятков и даже сотен часов. Однако в условиях резкой смены температуры силицидные покрытия быстро растрескиваются и утрачивают защитные свойства. Особенно склонны к растрескиванию толстые покрытия, поэтому увеличение толщины слоя дисилицида с целью повышения срока службы покрытия в условиях термоциклирования не приводит к положительным результатам.
Свойства силицидных покрытий можно существенно улучшить легированием. Силицидные покрытия, нашедшие в настоящее время промышленное или полупромышленное применение, как правило, кроме Si и материала подложки, содержат еще один или несколько легирующих элементов − В, С, Ti, Fe, Al, Cr, Nb, Mn, Be и др. В состав таких покрытий наряду с силицидами могут входить различные интерметаллиды, а также бориды, карбиды и т.п.
Кроме силицидных покрытий, в настоящее время разрабатываются многочисленные покрытия других типов − на основе алюминидов (типа МеАl3 для Nb и Та), бериллидов (ТаВе2 для Та), боридов (ZrB2 для Mo, Cr + борид циркония или титана для Та, Мо и W), оксидов (Аl203 для Nb и Та, ZrO2 для Мо) и многие другие. Некоторые из этих покрытий способны обеспечить кратковременную защиту тугоплавких металлов от окисления при очень высокой температуре.
Несмотря на определенные успехи в области разработки покрытий для тугоплавких металлов, остается много вопросов, которые приходится решать не только теоретическим, но и чисто эмпирическим путем.
23.5.4. Взаимодействие тугоплавких металлов с жидкометаллическими теплоносителями
Тугоплавкие металлы IVа, Va и VIa подгрупп Периодической системы элементов, и особенно V, Nb, Та, Мо и W, считают наиболее перспективными конструкционными материалами для использования в высокотемпературных установках с жидкометалличе-
581

скими теплоносителями1, в частности с щелочными металлами − Li, Na, К, эвтектическим сплавом Na−К. Это обусловлено, в первую очередь, малой растворимостью тугоплавких металлов в расплавах щелочных металлов, достаточно чистых по неметаллическим примесям (кислороду, азоту, углероду, водороду). Несмотря на значительный разброс имеющихся данных, как правило, растворимость не превышает долей процента даже при очень высокой температуре (табл. 23.117). Однако на практике не всегда можно обеспечить необходимую чистоту теплоносителя из-за того, что в реальных системах существуют неконтролируемые источники примесей, такие, например, как инородные материалы или натекание газов из окружающей атмосферы. В этих условиях коррозия тугоплавких металлов в расплавленных щелочных металлах, как правило, усиливается.
|
|
|
|
|
|
|
|
|
Таблица 23.117 |
|
Примерная растворимость тугоплавких металлов в Li, Na и K |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
Металл |
Li |
|
|
Na |
|
|
|
K |
||
|
Т, °С |
|
С, 10−4 % |
Т, °С |
С, 10−4 % |
Т, °С |
С, 10−4 % |
|||
Nb |
650 |
|
менее 5 |
400 |
|
менее 5 |
600 |
|
10−300 |
|
|
750 |
|
80 |
800 |
|
250 |
800 |
|
8−450 |
|
|
1000 |
|
900 |
1200 |
|
50 |
− |
1150 |
|
1000 |
|
|
|
|
|
|
110 |
|
|
||
Та |
725 |
|
19 |
325 |
|
0,03 |
800 |
|
413 |
|
|
1000 |
|
1850 |
525 |
|
2,9 |
− |
|
− |
|
Мо |
870 |
|
13 |
− |
|
|
− |
1000 |
|
3−4 |
|
980 |
|
140 |
− |
|
|
− |
1100 |
|
1−13 |
|
1200 |
|
300−1100 |
− |
|
|
− |
1200 |
|
13−14 |
W |
715 |
|
1050 |
− |
|
|
− |
− |
|
− |
|
1540 |
|
4000 |
− |
|
|
− |
− |
|
− |
Установлено, что при увеличении содержания кислорода и азота в щелочных металлах количество тугоплавкого металла, перешедшего в расплав, может возрастать. Обычно это связывают с тем, что указанные примеси увеличивают растворимость тугоплавких
1 Физическое материаловедение. Т. 2. − М.: МИФИ, 2007. Гл. 7.
582

металлов. Однако применение термина «растворимость» в данном случае условно, так как в настоящее время не выяснено, в каком виде присутствуют тугоплавкие металлы в загрязненных примесями расплавах щелочных металлов − в растворенном виде, в виде химических соединений с примесями или в другом. Незаисимо от этого влияние примесей может быть одной из причин существенного разброса экспериментальных данных по растворимости, полученных разными исследователями при неодинаковых условиях испытания.
Большинство экспериментальных данных показывает, что по влиянию на растворение и процессы переноса массы тугоплавких металлов в Na, K и их сплавах наиболее вредной примесью является кислород. Это влияние отмечалось главным образом при исследовании систем с V, Nb, Та, реже − систем с Мо и W. О влиянии исходного содержания кислорода на перенос Nb в жидкометаллическом теплоносителе можно судить по данным, приведенным в табл. 23.118.
Таблица 23.118
Концентрация Nb в Na и K, содержащих различное количество кислорода
Жидкий |
Т, °С |
Исходное содержание кислорода |
Концентрация ниобия |
металл* |
в жидком металле, 10−4 % |
жидком металле, 10−4 % |
|
K |
400 |
25 |
20 |
|
600 |
530 |
750 |
|
25 |
160 |
|
|
400 |
600 |
930 |
Na |
30 |
Ниже 5 |
|
|
|
710 |
32 |
________
* Исходное содержание Nb в жидком металле не превышало 5 10−4 %.
В Li примесь кислорода меньше влияет на растворение и перенос массы тугоплавких металлов. Более вредной примесью в Li является азот, который значительно увеличивает растворимость Сr, Мо и Nb.
583
Насыщение тугоплавких металлов примесями из жидкометаллического расплава в основных чертах сходно с их окислением. Оно приводит к образованию химических соединений, которые обычно присутствуют на поверхности твердого металла в виде пленки.
Для предотвращения указанных эффектов необходимо поддерживать в жидком металле низкую концентрацию примесей. В этом отношении наиболее эффективны «горячие» ловушки, в которых жидкий металл очищают от примесей геттером − высокоактивным
вхимическом отношении металлом (цирконием, титаном и др.). Так, в танталовом контуре с жидким Na применение горячей ловушки снижает потери массы Та при 650 °С за 50 ч примерно в 30 раз по сравнению с системой, в которой Na очищался от кислорода холодной ловушкой, т.е. путем осаждения твердых оксидов при низкой температуре. В первом случае концентрация кислорода
вNa была значительно ниже 10−3 %, в то время как во втором она составляла 4 10−3 %.
Иногда при перераспределении примесей из тугоплавких металлов в жидкий металл наблюдается охрупчивание твердого материала. Этот процесс может сопровождаться проникновением Li в твердый металл по местам с повышенным содержанием кислорода (по границам зерен и определенным кристаллографическим плоскостям) предположительно с образованием сложных оксидов, в состав которых входят атомы ниобия и лития. В результате, несмотря на общее обеднение твердого металла кислородом и снижение микротвердости участков, свободных от продукции коррозии, металл становится хрупким. Аналогичное явление наблюдалось и в
других системах, например Та−Li и Та−Na.
Одним из путей предотвращения проникновения Li в Nb и Та могла бы явиться более полная очистка их от кислорода. Экспериментально установлено, что концентрация кислорода на уровне 0,02−0,04 % вполне допустима. Однако в ряде случаев, например в сварных конструкциях, возможно дополнительное локальное загрязнение металла кислородом. Кроме того, очистка металла до такой и даже более низкой концентрации не исключает возможности диффузионного перераспределения кислорода из твердого металла в жидкий литий. Поэтому более эффективным путем повы-
584
шения коррозионной стойкости в подобных случаях, по-видимому, является легирование тугоплавких металлов элементами, резко понижающими термодинамический потенциал кислорода.
Для Nb и Та такими элементами являются Zr и Hf, которые связывают кислород в оксиды, обладающие достаточно высокой стойкостью в литии. Минимальное количество легирующего элемента, необходимое для полного подавления проникновения лития, определяется стехиометрией образующегося оксида и содержанием кислорода в сплаве. Так, при легировании Nb и Та цирконием или гафнием атомная концентрация последних в соответствии с формулами их оксидов (ZrО2 и НfО2) должна составлять не менее половины атомной концентрации килорода. Сплавы при этом необходимо подвергать такой термообработке, которая обеспечила бы выделение соответствующих оксидов из твердого раствора. Для сплавов Nb и Та эта термообработка состоит в отжиге при темпера-
туре 1300−1600 °С.
Цирконий и гафний обладают более высокой по сравнению с другими тугоплавкими металлами растворимостью в жидких щелочных металлах, поэтому содержащие их сплавы в несколько большей степени подвержены избирательному растворению и переносу массы. Однако степень развития этого процесса обычно невелика, и сплавы Nb и Та с Zr и Hf считают перспективными материалами для работы в контакте с жидкими щелочными металлами.
В реальных системах с жидкометаллическими теплоносителями возможно одновременное использование нескольких конструкционных материалов. Например, оболочки твэлов и другие детали, работающие в наиболее жестких условиях, могут быть изготовлены из тугоплавкого металла или сплава, а остальная часть контура − из стали. В этих условиях возможен концентрационный перенос массы как металлических компонентов, так и примесей.
Преимущественное направление процессов переноса массы в системах из разнородных материалов зависит от соотношения площадей их поверхностей, контактирующих с жидким металлом. Так, при испытании Nb при 816−927 °С в ампулах из коррозионностойкой аустенитной стали, содержащих жидкий Li, при соотношении площадей поверхностей стали и ниобия 10:1 доминирую-
585
щим процессом является перенос N и С из стали в ниобий. Перенос массы металлических компонентов Fe, Cr и Ni на Nb и Nb на сталь происходит в значительно меньшей степени. В результате протекающих процессов на поверхности Nb образуется хрупкая и твердая карбонитридная пленка, состоящая из двух слоев наружного со структурой Nb(C, N) и внутреннего со структурой Nb2(C, N). С ростом температуры испытания перенос массы усиливается и толщина пленки растет: от 5 мкм при 816 °С до 13 мкм при 927 °С за 500 ч. Одновременно увеличивается твердость металла под пленкой, возрастает прочность и снижается пластичность, что, по-видимому, связано главным образом с насыщением подпленочных слоев металла азотом.
При испытании стали в ампулах из Nb в соотношении площадей поверхностей стали и ниобия 1:10 происходит преимущественный перенос Nb на сталь с образованием на ее поверхности пленки, состоящей из Nb и его карбонитридов. Содержание азота и углерода в Nb изменяется незначительно, и пленка на его поверхности не образуется.
Аналогичные процессы могут происходить и в системах с разнородными тугоплавкими металлами, а также в системах с ядерным топливом. Примерами могут служить перенос Мо со стенки ампул из молибденового сплава на поверхность Re в среде жидкого Li с образованием тонкого слоя, состоящего из Мо и интерметаллида Mo2Re3, а также изотермический перенос углерода с сердечника твэла и карбидов урана через подслой жидкого Na на оболочку из сплава Nb + 1 % Zr, сопровождающийся образованием карбидного слоя на внутренней поверхности сердечника и обезуглероживания сердечника.
В неизотермических системах с разнородными конструкционными материалами процессы переноса массы под действием температурного градиента и процессы концентрационного переноса массы протекают одновременно. Например, в конвекционной петле с жидким Li, изготовленной из сплава Nb + 1 % Zr, содержавшей образцы из молибденового сплава (Мо + 0,5 % Ti + 0,1 % Zr + + 0,01 % С), которая проработала 3000 ч при температуре горячей зоны 1210 °С и максимальном перепаде температуры 150 °С, на-
586
блюдались следующие процессы: 1) термический перенос Zr, N и С из горячей зоны в холодную с отложением осадков карбида и нитрида циркония на поверхности обоих сплавов; 2) перенос С с молибденового сплава на ниобиевый во всех зонах петли; 3) перенос Мо на ниобиевый сплав и перенос Nb и Zr на молибденовый сплав в горячей зоне.
Наиболее реальным путем подавления процессов переноса массы является легирование. Например, введение 10 % W в сплав Nb + 1 % Zr в 2 3 раза уменьшает различие концентрации Zr по периметру конвекционной петли с жидким литием: одновременно значительно уменьшается степень термического переноса N и С, а также степень изменения массы в различных участках петли. Легирование хромоникелевой коррозионно-стойкой стали сильным нитридо- и карбидообразователем титаном резко снижает изотермический перенос N и С на ниобий.
Есть основания считать, что существующие сплавы на основе рассмотренных тугоплавких металлов в состоянии работать в контакте с расплавленными щелочными металлами при температуре до 1200 °С в течение (5 10) 103 ч без значительных коррозионных повреждений. При более высокой температуре срок службы таких систем ограничен либо коррозионными эффектами, либо явлением ползучести, развитию которых могут способствовать возрастание давления пара жидкого металла и снижение жаропрочных свойств материалов, вызванное, с одной стороны, повышением температуры, а с другой адсорбционным и коррозионным воздействием теплоносителя. Несомненно, что обоснованный выбор материалов и их сочетаний для рассматриваемых систем позволит значительно увеличить их ресурс и максимальную рабочую температуру.
23.5.5. Радиационная стойкость и применение тугоплавких металлов в ЯЭУ и ТЯР
Под действием облучения тугоплавкие металлы упрочняются, охрупчиваются, распухают и испытывают ускорение ползучести.
Радиационное упрочнение. Радиационное упрочнение металлов и сплавов зависит от флюенса нейтронов, температуры и соста-
587
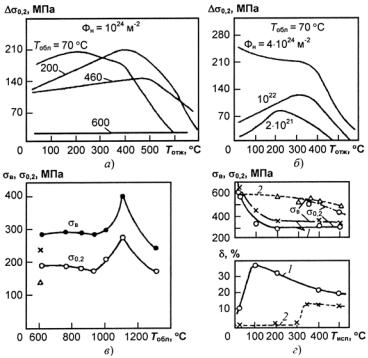
ва облучаемого сплава (металла), флакса нейтронов и, возможно, от их спектра. В качестве меры радиационного упрочнения применяют прирост предела текучести Δσт (см. п. 23.6.5). Наиболее общие особенности изменения прочностных характеристик V, Nb и Мо от флюенса нейтронов и температуры испытания (облучения) образцов представлены на рис. 23.284.
Рис. 23.284. Изменение механических свойств V, Nb и Мо при нейтронном облучении:
а, б − радиационно-термическое упрочнение ванадия при разных значениях Фн и То6л; в − температурная зависимость механических свойств облученного нейтронами ниобия, Фн = (3−4) 1023 м-2 (Е > 0,1 МэВ) (U, × − исходные значения
σ0,2 и σв соответственно); г − изменение механических свойств необлученного (1) и облученного до Фн = 8 1024 м-2 (2) Мо
в зависимости от температуры испытания
588
Зависимость радиационного упрочнения тугоплавких металлов от флюенса нейтронов Фн можно записать формулой
Δσт = АФнn , |
(23.65) |
где п − показатель степени, зависящий от флюенса и равный для V и Nb от 0,25 до 0,5; А − коэффициент пропорциональности.
При больших флюенсах (более 1023 м-2) наблюдается насыщение радиационного упрочнения вследствие ряда причин: перекрытия полей упругих напряжений при достижении определенной плотности радиационных дефектов; дислокационного каналирования, т.е. сметания дислокациями препятствий на своем пути; образования упорядоченной структуры дефектов. Важно отметить, что в ОЦК металлах наблюдают дополнительное упрочнение в процессе последующего отжига образцов, облученных до флюенса менее 1024 м−2 при сравнительно низких температурах облучения (менее
400 °С). Такое радиационно-термическое упрочнение (РТУ) для V
показано на рис. 23.284, a и б. Применительно к Nb и его сплавам РТУ было обнаружено на образцах, облученных при 70 °С, при отжиге при 150 и 300 °С, причем эффект такого упрочнения явно зависит от содержания в металле О2 и С (рис. 23.284, в).
Явление РТУ может быть вызвано образованием при отжиге дополнительных центров закрепления дислокаций вследствие скопления дефектов, покинувших стоки, стабилизации кластеров радиационных дефектов примесями, коагуляции вакансий в поры. У ванадия РТУ при 160−200 °С наблюдали при малых флюенсах (до 1022 м−2) и низких (ниже 460 °С) температурах облучения (рис. 23.284, а), оно отсутствует после облучения нейтронами до флюенса 4 1024 м−2 (рис. 23.284, б). Значение РТУ может достигать 200−250 МПа, зависит от содержания примесей внедрения, в частности, для V − кислорода, для Nb − кислорода, углерода, азота. В сплавах V с добавками Ti и в сверхчистом ванадии РТУ не наблюдали. Таким образом, наиболее вероятный механизм РТУ − миграция примесей внедрения к радиационным дефектам, их стабилизация и увеличение эффективности как барьеров движущимся дислокациям.
589
Радиационное упрочнение V и его сплавов зависит от температуры облучения и химического состава. Сплавы системы V Ti, облученные до флюенса 1,4 1025 м 2 при 50 100 °С, испытывают значительное радиационное упрочнение, которое снимается в процессе отжига при температурах около 650 °С. Заметный отжиг эффекта упрочнения в сплавах V Ti, V 10 % Ti 5% Cr начинается при 400 °С и завершается при 650 750 °С. Добавки в ванадий О2 от 0,006 до 0,316 % увеличивают радиационное упрочнение при комнатной температуре испытания, но при 600 700 °С независимо от количества кислорода происходит полное восстановление свойств. В отличие от низкотемпературного высокотемпературное облучение (более 500 °С), как правило, приводит к незначительному изменению свойств V и сплава V 20 % Ti.
Однако при облучении сплавов V 10 % Cr, V 9 % Cr
3,3 % Fe l,3 % Zr при 500 600 °С до флюенса 3,3 1025 м 2 на-
блюдали и упрочнение, и снижение пластичности сплавов. Значительное упрочнение и снижение пластичности наблюдали в сплаве V 3 % Ti 1 % Si, облученном при 640 °С до флюенса 1026 м 2. При облучении сплава V 2,5 % Zr 0,35 % С (с дисперсионным упрочнением) при 150 1080 °С до флюенса 7 1026 м 2 показано, что до 400 °С упрочнение зависит от флюенса, а при температурах выше 500 °С происходит стабилизация механических свойств на уровне, лучшем исходных.
Радиационное упрочнение сплавов ниобия велико ( = = 400 450 МПа) при сравнительно низких температурах (до 400 °С) и мало ( 0) при То6л > 400 °С. Исключение установлено на Nb технической чистоты, у которого прирост в и 0,2 (см. рис. 23.284, в) установлен после облучения (Фн 4 1023 м 2) при 1100 °С. Возможно, это упрочнение обусловлено образованием пор как стопоров дислокаций при облучении нейтронами до флюенса, большего порогового (около 1,5 1025 м 2) для порообразования. Сплав Nb l % Zr после облучения при 450 °С в реакторе EBR-II до Фн = (3,0 3,7) 1026 м 2 (Е > 0,1 МэВ) испытал радиационное упрочнение в 100 300 %. Прирост прочности и микротвердости облученного ниобия и его сплавов Nb l % Zr, 5ВМЦ определяется перераспределением
590
примесей внедрения и изменением кинетки порообразования, зави-
сит от температуры облучения и флюенса и достигает 115 % (То6л = = 425 С, Фн = 2,5 1026 м 2).
Сплав Nb 1 % Zr испытывает меньший прирост посравнению с чистым Nb.
Радиационное упрочнение в Мо развивается аналогично процессам в V и Nb. Очень высокое радиационное упрочнение при Тобл = 635 °С и Фн = 3,5 1025 м 2 (Е > 0,1 МэВ) обусловлено высокой концентрацией малых ( d = 1,5 нм) пор (петель) высокой плотности ( v = 3,5 1023 м-3), для которых упрочнение
= 2 Gb(ρv di)1/2, |
(23.66) |
i |
|
где параметр, характеризующий взаимодействие движущейся дислокации со стопором ( = 0,5); G модуль сдвига; b вектор Бюргерса.
Важно отметить, что образованный при облучении сплава Мо Zr В гелий (атомное содержание 0,009 %) по реакции 10В(n, )7Li не оказывает влияния на упрочнение при сравнительно невысоких (150 950 °С) температурах облучения. Упрочнение сплава
Мо 0,11 % Zr 0,002 % В при Фн 1025 м 2 составило: при Тобл = = 150 °С = 270 350 МПа, при Т = 550 °С = 420 430 МПа,
при Тобл = 950 °С = 54 58 МПа. В процессе облучения молибдена, как и других ОЦК металлов, упрочнение означает рост и пре-
делов текучести и прочности. Однако первый растет быстрее и происходит сближение значений 0,2 и в по мере роста флюенса
(см. рис. 23.284).
Изменение свойств тугоплавких металлов при облучении имеет обратимый характер: оно устраняется последующим отжигом при высокой температуре, близкой к (0,4 0,5)Тпл. Так, свойства Мо, облученного нейтронами до флюенса 2 1026 м 2, практически восстанавливаются после отжига при температуре выше 1000 °С, а свойства W, облученного до (1,4 80) 1023 м 2, при температуре около 1350 °С. В связи с этим можно предположить, что при рабочей температуре, близкой к температуре рекристаллизации, влияние облу-
591
чения на механические свойства тугоплавких металлов будет сравнительно небольшим.
Радиационное охрупчивание. С ростом флюенса пластичность металлов снижается. Облучение приводит также к повышению температуры перехода тугоплавких металлов из пластичного состояния в хрупкое. Например, облучение Мо и W нейтронами до флюенса 5 1023 м 2 (Е 1 МэВ) увеличивает температуру перехода соответственно на 60 и 120 °С. Радиационное охрупчивание проявляется в снижении равномерного относительного удлинения ( р), а по мере роста флюенса в наступлении стадии сосредоточенной деформации (пластическая нестабильность) и полного устранения пластической деформации, при которой разрушение материала происходит до наступления стадии пластической деформации.
У тугоплавких металлов наблюдается температурная зависимость охрупчивания: низкотемпературное (НТРО) и высокотемпературное (ВТРО). Явление НТРО проявляется одновременно с радиационным упрочнением в температурном интервале ниже Тх. Для ванадия это около 200 °С, причем имеются многочисленные данные о том, что облученные нейтронами до Фн 1,4 1025 м-2 сплавы ванадия с твердорастворным и дисперсионным упрочнением не обнаруживают НТРО при испытании выше 400 °С. Для облученных сплавов молибдена при Т Тх установлено полное отсутствие пластичности, причем малая пластическая деформация наблюдается до 800 °С, после которой наблюдали увеличение относительного удлинения ( ).
Явление ВТРО было обнаружено на сплаве с твердорастворным упрочнением типа V 14 % Nb, облученном при 750 °С нейтронами до флюенса 4 1025 м-2. Причину возникновения ВТРО в сплавах ванадия связывают, как и в аустенитных сталях и никелевых сплавах (см. п.п. 23.6.7 и 23.7.5), с нарушением баланса прочности тела зерна и границ зерен из-за ослабления последних цепочками выделившихся на них пор, возможно, стабилизированных гелием. Косвенно о роли гелия судят по результатам специально проведенных экспериментов, когда гелий вводили в сплавы на ускорителях, или другими методами. В сплавах V с дисперсионным упрочнением
592
ВТРО не установлено, т.е. при температурах облучения выше 400 °С такие сплавы не охрупчиваются.
Ниобий и его сплавы не подвержены ВТРО. Низкотемпературное охрупчивание обнаружено на Nb технической чистоты после
облучения нейтронами (Тобл = 100 °С, Фн = 2,9 1024 м-2) только при температуре жидкого азота, при этом δ = 0. При комнатной температуре облучение вызвало снижение относительного удлинения в 6 раз. Сплав Nb−1 % Zr, облученный при 450 °С нейтронами до Фн = 3,6 1026 м-2 при δо6щ = 12÷17 %, имел δр < 1 %. Снижение пластичности сплавов ниобия связывают с наличием примесей внедрения.
Распухание. Тугоплавкие металлы с ОЦК структурой имеют традиционно низкое распухание при нейтронном обучении по сравнению с ГЦК металлами. При флюенсе быстрых нейтронов около 1026 м-2 распухание V, Nb и Мо при температурах от 450 до 790 °С не превышало 1−2 %. Максимум вакансионного распухания V и его сплавов наблюдается в интервале температур 550−600 °С, причем при Фн = 1,4 1026 м-2 распухание достигало 2 %.
Известные в литературе данные по распуханию ванадия и его сплавов сведены в табл. 23.119, из которой видно, что легирующие добавки снижают распухание ванадия, причем наиболее эффективны добавки титана.
Введение Ti (в пределах 3−20 %) в V увеличивает не только сопротивление распуханию, но снижает эффект радиационного упрочнения и охрупчивание. В определенной степени это связано с действием таких термически стабильных фаз, как TiO и TiO2.
Распухание Nb и его сплавов при облучении нейтронами достигает наибольшего значения при температуре 750−800 °С. Максимальное распухание после облучения до Фн = 2,3÷1027 м−2 для чистого металла составило 0,5 %, а для сплавов 2,5 %. Это свидетельствует о высокой стойкости Nb к распуханию. Есть мнение, что распухание Nb претерпевает насыщение, зависящее от температуры и флюенса. Например, при Тобл = 800 °С насыщение наступает при повреждающей дозе около 20 сна, а при 675 °С − при 50 сна.
593

|
|
|
|
Таблица 23.119 |
Распухание сплавов ванадия при облучении нейтронами |
||||
|
|
|
|
|
Сплав |
Т, °С |
Фн, 1022 м−2 |
V/V,% |
Примечание |
Технический V |
550 |
3,6 |
0,9 |
− |
Зонноочищенный V |
550 |
3,6 |
0,8 |
− |
Технический V |
450 |
3,5 |
0,05 |
Примеси внедрения |
|
|
|
|
С1 = 0,003% и |
|
|
|
|
С2 = 0,2%, но распуха- |
|
|
|
|
ние одинаковое |
V − 1 % Ti |
530 |
1,1 |
Поры |
− |
V − 1 % Ti − 0,55 % О2 |
620 |
2,5 |
1,4 |
− |
V − 5 % Ti − 15 % Cr |
450 |
3,6 |
Нет |
− |
|
550 |
3,6 |
Поры |
− |
|
600 |
3,6 |
Нет |
− |
V−Cr |
500 |
1,1 |
1,0 |
− |
V − 2,5 % Zr − 0,35 % С |
530 |
0,19−0,7 |
Нет |
Роль дисперсных |
|
|
|
|
выделений |
|
610 |
0,19−0,7 |
” |
То же |
|
760 |
0,19−0,7 |
” |
” |
|
920 |
0,19−0,7 |
” |
” |
|
550−600 |
1,0 |
2,0 |
− |
В Nb эффективной добавкой является |
цирконий. Сплав |
|||
Nb − 1 % Zr является более стойким к распуханию, чем Nb, причем роль циркония связывается с усилением рекомбинации вследствие захвата вакансий его атомами, т.к. атомный радиус Zr больше атомного радиуса ниобия. Приведенные выше данные относятся к нейтронному облучению. При ионном облучении результаты несколько иные. Так, известны данные по облучению Nb ионами Та3+ с энергией 7,5 МэВ до высоких флюенсов. При уровне поврежде-
ния 10 сна распухание Nb было 4,5% при Тобл = 800°С и 8−10 %
при То6л = 900 °С.
Применение тугоплавких металлов и их сплавов в ядерной и других отраслях техники основано на отмеченных выше достоинствах этих металлов, но в то же время жестко ограничено присущими и трудноустранимыми недостатками.
594
В настоящее время максимальные значения рабочей температуры таких сплавов, как правило, достигают 0,55−0,65 температуры плавления металла-основы. По жаропрочности и, в частности, по удельной жаропрочности при этих температурах сплавы на основе тугоплавких металлов не имеют конкурентов. Не исключено, что максимальные значения рабочей температуры для них, как и для дисперсионно-твердеющих сплавов на основе никеля, могут быть доведены до (0,6−0,8)Тпл.
Тугоплавкие металлы хорошо противостоят воздействию жидких щелочных металлов, применяющихся в ядерной энергетике в качестве теплоносителей, пленок на эмиттерах в термоэмиссионных преобразователях. Они обладают хорошей совместимостью с ядерным топливом, особенно Та и W; при этом наилучшая совместимость наблюдается в системах с неметаллическим топливом, например диоксидом, монокарбидом и сульфидом урана. Однако наиболее перспективными для применения в ядерных реакторах являются V, Nb и их сплавы, что обусловлено благоприятным сочетанием их жаропрочных, коррозионных и ядерных характеристик с технологическими свойствами − деформируемостью, свариваемостью и др.
Из Nb и его сплавов можно изготавливать оболочки твэлов, трубопроводы, пароперегреватели, детали насосов и др. В настоящее время уже накоплен значительный опыт эксплуатации ниобиевых контуров с K, Na, Li при температуре до 1100 °С в течение нескольких сот и даже тысяч часов. Разрабатываются сплавы Nb, пригодные для использования при температуре до 700 °С в пароперегревателях реакторов с водяным охлаждением.
Ванадий. Считается, что среди радиационно-стойких сплавов ванадия для работы с литиевым охлаждением предпочтение следует отдавать сплавам V−Ti−Сr. Действительно, для проекта энергетического термоядерного реактора DEMO широко исследуется сплав V−4 % Cr–4 % Ti (проект США). В российском проекте DEMO наряду со сплавами V−Ti−Сr рассматриваются сплавы системы V−(5÷10) % Ti. В качестве перспективных исследуются сплавы V с W или в комбинации W с Ti (Япония, Китай).
595
Достоинство сплавов системы V−Ti−Сr как конструкционного материала ядерных и термоядерных реакторов − быстрый спад наведенной активности после облучения в реакотре (см. рис. 23.273 и 23.285). Ванадий, хром и титан имеют быстрый спад наведенной активности (см. рис. 23.273), вследствие чего спад мощности дозы облучения ванадиевого сплава до допустимого уровня происходит значительно быстрее, чем малоактивируемой мартенситной стали 10Х9ВФ (см. рис. 23.285), поскольку у основы стали − железа достаточно длительный период спада радиоактивности (см.
рис. 23.273).
Рис. 23.285. Спад мощности дозы облучения с течением времени для разных композиций малоактивируемых материалов
Черная металлургия − основной потребитель V (до 95 % всего производимого металла) как легирующего элемента сталей и сплавов (см. п. 23.6). Так, стали для корпусов ядерных реакторов обязательно содержат V (см. п. 23.6.5). Ванадийсодержащие стали широко применяют в военной технике: для изготовления коленчатых валов корабельных двигателей, отдельных деталей торпед, авиамоторов, бронебойных снарядов и т.д.
596
Новым потребителем выступает быстро развивающаяся промышленность титановых сплавов − некоторые титановые сплавы содержат до 13 % V. Разрабатываются различные по составу жаропрочные и коррозионно-стойкие сплавы на основе V с добавлением Ti, Сr, Nb, W, Zr и Al, применение которых ожидается в авиационной, ракетной и атомной технике. Интересны сверхпроводящие сплавы и соединения V с Ga, Si и Ti. Чистый металлический V используют в атомной энергетике (оболочки для тепловыделяющих элементов, трубы) и в производстве электронных приборов.
Хлорид ванадия применяется при термохимическом разложении воды в атомно-водородной энергетике (ванадий-хлоридный цикл «Дженерал Моторс», США).
Пятиоксид ванадия широко применяется в качестве положительного электрода (анода) в мощных литиевых батареях и аккумуляторах, ванадат серебра в резервных батареях − в качестве катода.
Соединения V применяют в химической промышленности как катализаторы, в сельском хозяйстве и медицине, в текстильной, лакокрасочной, резиновой, керамической, стекольной, фото- и кинопромышленности.
Ниобий или его сплавы являются перспективными для оболочек урановых и плутониевых тепловыделяющих элементов, контейнеров и труб для жидких металлов.
Соединение Nb3Sn и сплавы ниобия с титаном и цирконием применяются для изготовления сверхпроводящих соленоидов. В связи со строительством термоядерных реакторов (начало стройки ITER в 2008 году в ядерном центре Кадараш во Франции) и расширением термоядерной энергетики в ближайшие 8−12 лет потребуются очень большие количества ниобия для сверхпроводящих обмоток.
Исключительная стойкость ниобия и его сплавов с танталом в перегретом паре 133Cs делает его одним из наиболее предпочтительных и дешевых конструкционных материалов для термоэмиссионных генераторов большой мощности.
Из сплавов ниобия изготовляют детали летательных аппаратов (для ракетостроения, авиационной и космической техники); детали электрических конденсаторов; «горячую» арматуру электронных
597
(для радарных установок) и мощных генераторных ламп (аноды, катоды, сетки и др.); коррозионно-устойчивую аппаратуру для химической промышленности.
Ниобий применяется как легирующая добавка в сталях и никелевых сплавах, им легируют другие цветные металлы, в том числе уран. Ниобий применяют в криотронах − сверхпроводящих элементах вычислительных машин.
Ниобий и сплавы с танталом во многих случаях заменяют тантал, что дает большой экономический эффект (ниобий дешевле и почти вдвое легче, чем тантал).
Оксид Nb2O5 − катализатор в химической промышленности; используется в производстве огнеупоров, керметов, специальных стекол и т.д.
Карбид ниобия в сплаве с карбидом циркония и карбидом 235U является важнейшим конструкционным материалом для твэлов твердофазных ядерных реактивных двигателей.
Ниобий используется также в магнитных сплавах, а нитрид ниобия − для производства сверхпроводящих болометров (приборы для измерения энергии излучения).
Тантал находит применение ядерной энергетике. Из него изготовляют теплообменники для ядерно-энергетических систем (тан-
тал наиболее из всех металлов устойчив в перегретых расплавах и парах 133Cs).
Пятиоксид тантала используется в атомной технике для варки стекла, поглощающего γ-излучение. Один из наиболее широко применяемых составов такого стекла 2 % SiO2 − 82 % PbO (глет) −
14% BO − 2 % Ta2O5.
Ядерный изомер 182m2Та, накапливающийся в конструкционных
материалах атомных реакторов, может наряду с 178m2Hf служить источником γ-лучей и энергии при разработке оружия и специальных транспортных средств.
Тантал применяют в электронике, химическом машиностроении, в металлургии (производство жаропрочных сплавов, коррози- онно-стойких сталей), в медицине; в виде ТаС его применяют в производстве твердых сплавов.
598

Около 35−45 % всего производимого тантала, используется в виде порошка при изготовлении танталовых конденсаторов (танталовые конденсаторы обладают намного большим сроком службы по сравнению с алюминиевыми электролитическими) и других электронных приборов (аноды, сетки, катоды и другие детали электронных ламп); 20−25 % Та применяется в виде карбидов (ТаС входит в состав некоторых твердых сплавов: смеси карбидов вольфрама и тантала марки с индексом ТТ1 для тяжелейших условий металлообработки и ударно поворотного бурения крепчайших материалов − камня, композитов); 15−20 % Та − в виде проката, а также присадок к сталям и сплавам.
Из Та изготовляют коррозионно-устойчивую аппаратуру для химической промышленности, фильеры в производстве искусственного волокна, лабораторную посуду, тигли для плавки металлов (например, редкоземельных) и сплавов, нагреватели высокотемпературных печей,
Тантал применяют в качестве геттера.
Впроизводстве боеприпасов тантал используют для изготовления металлической облицовки перспективных кумулятивных зарядов, улучшающей бронепробиваемость.
Вхирургии листы, фольгу, проволоку из Та применяют для изготовления протезов, скрепления костей, нервов, наложения швов и др.
Нитрид TaN используют в виде устойчивых к истиранию по-
крытий, а ТаSi2 − при изготовлении структур металл−оксид−полупроводник, защитных и противоотражательных покрытий.
Чрезвычайно твердый и устойчивый к окислению на воздухе до 1650 °C бериллид тантала применяется в авиакосмической технике.
Хром − важный компонент во многих легированных сталях (в частности, коррозионно-стойких), а также и в ряде других сплавов. Он используется в качестве износоустойчивых и гальванических покрытий (хромирование). Поскольку Cr хорошо сопротивляется окислению на воздухе и устойчив действию кислот, его часто наносят на поверхность других материалов для защиты их от коррозии.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 22.3.2.
599
Хром применяется в производстве сплавов, незаменимых для изготовления сопел мощных плазмотронов и в авиакосмической промышленности.
Молибден перспективен для применения как конструкционный материал в энергетических ядерных реакторах в связи со сравнительно малым сечением захвата тепловых нейтронов (см.
табл. 23.1).
До 70−80 % добываемого Мо идет на производство легированных сталей. Остальное количество применяется в форме чистого металла и сплавов на его основе, сплавов с цветными и редкими металлами, а также в виде химических соединений. Металлический Мо − важнейший конструкционный материал в производстве электроосветительных ламп и электровакуумных приборов (радиолампы, генераторные лампы, рентгеновские трубки и другие); из Мо изготовляют аноды, сетки, катоды, держатели нити накала в электролампах. Молибденовые проволока и лента широко используются в качестве нагревателей для высокотемпературных печей.
После освоения производства крупных заготовок Мо стали применять (в чистом виде или с легирующими добавками других металлов) в тех случаях, когда необходимо сохранение прочности при высоких температурах, например, для изготовления деталей ракет
идругих летательных аппаратов. Для предохранения Мо от окисления при высоких температурах используют покрытия деталей силицидом молибдена, жаростойкими эмалями и другие способы защиты.
Для изготовления обшивки головных частей ракет и самолетов тугоплавкие металлы и сплавы на их основе используют в двух вариантах. В одном из вариантов эти металлы служат лишь тепловыми экранами, которые отделены от основного конструкционного материала теплоизоляцией. Во втором случае тугоплавкие металлы
иих сплавы служат основным конструкционным материалом. Среди тугоплавких металлов Мо занимает второе место после вольфрама и его сплавов по прочностным свойствам, однако по удельной
прочности при температурах ниже 1350−1450 °С Мо и его сплавы занимают первое место. Таким образом, наибольшее распространение для изготовления обшивки и элементов каркаса ракет и сверх-
600
звуковых самолетов получают Мо и Nb и их сплавы, обладающие большей удельной прочностью до 1370 °С по сравнению с Ta, W и сплавами на их основе.
Из Мо изготовляют сотовые панели космических летательных аппаратов, теплообменники, оболочки возвращающихся на землю ракет и капсул, тепловые экраны, обшивку кромок крыльев и стабилизаторы в сверхзвуковых самолетах.
В очень тяжелых условиях работают некоторые детали прямоточных ракетных и турбореактивных двигателей (лопатки турбин, хвостовые юбки, заслонки форсунок, сопла ракетных двигателей, поверхности управления в ракетах с твердым топливом). При этом от материала требуется не только высокое сопротивление окислению и газовой эрозии, но и высокая длительная прочность и сопротивление удару. При температурах ниже 1370 °С для изготовления данных деталей используют Мо и его сплавы.
Молибден − перспективный материал для оборудования, работающего в среде серной, соляной и фосфорной кислот. В связи с высокой стойкостью молибдена в расплавленном стекле его широко используют в стекольной промышленности, в частности для изготовления электродов для плавки стекла.
Внастоящее время из молибденовых сплавов изготовляют пресс-формы и стержни машин для литья под давлением алюминиевых, цинковых и медных сплавов. Высокая прочность и твердость сплавов молибдена при повышенных температурах обусловили их применение в качестве инструмента при горячей обработке сталей и сплавов давлением (оправки прошивных станов, матрицы, пресс-штемпели).
Коэффициент теплового расширения молибдена почти одинаков
скоэффициентом расширения стекла, поэтому его применяют для электрических контактов, впаиваемых в стекло. Из оксида молибдена делают электроды стекольных ванн при варке оптического стекла.
Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров.
Втехнике используются некоторые соединения молибдена. Так,
MoS2 − смазочный материал для трущихся частей механизмов; его
601
применяют при изготовлении нагревателей для высокотемпературных печей; Na2MoO4 используют в производстве красок и лаков; оксиды молибдена − катализаторы в химической и нефтяной промышленности.
Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термоЭДС 780 мкВ/К). Трехоксид молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Вольфрамовые сплавы обладают многими замечательными качествами. Так называемый тяжелый металл (из вольфрама, никеля и меди) служит для изготовления контейнеров, в которых хранят радиоактивные вещества. Его защитное действие на 40 % выше, чем у свинца. Этот сплав применяют и при радиотерапии, так как он создает достаточную защиту при сравнительно небольшой толщине экрана.
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях веществ. Стабильный изотоп 184W применяется как компонент сплавов с 235U, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространtнных изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 10−28 м−2).
Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
Более половины (58 %) всего потребляемого W используется в производстве карбида вольфрама, почти четверть (23 %) – в различных сплавах и сталях. На изготовление вольфрамового «проката» (нитей для ламп накаливания; электрических контактов; электродов для водородной сварки, заменяя платину; для нагревателей высокотемпературных электропечей, работающих при температуре свыше 3000 °С; термопар, роторов в гироскопах оптических пирометров; для катодов рентгеновских трубок; электровакуумной аппаратуры; радиоприборов; выпрямителей и гальвонометров и т.д.)
602
приходится 8 % произведимого металла, а оставшиеся 9 % используются при получении пигментов и катализаторов.
На практике чаще всего применяются сплавы вольфрама не с одним каким-либо металлом, а с несколькими. Таковы, в частности, кислотостойкие сплавы вольфрама с хромом и кобальтом или никелем (амалой); из них делают хирургические инструменты. Лучшие марки магнитной стали содержат вольфрам, железо и кобальт.
Вольфрам – непременная составная часть лучших марок инструментальной стали. Они устойчивы к истиранию, не дают трещин, сохраняют твердость вплоть до температуры красного каления. Инструмент из них не только позволяет резко интенсифицировать процессы металлообработки (скорость обработки металлических изделий повышается в 10...15 раз), но и служит намного дольше, чем тот же инструмент из другой стали.
Вольфрам находит широкое применение в производстве жаропрочных сталей и сплавов в качестве легирующей добавки, в твердых сплавах (твердый сплав победит на 90 % состоит из карбида вольфрама WC в кобальтовой матрице), в электротехнике, в производстве кислотоупорных и специальных сплавов, в химической промышленности.
Из вольфрамовой стали и других сплавов, содержащих вольфрам или его карбиды, изготовляют танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей.
Благодаря высокой плотности вольфрам используется для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полета баллистических ракет (до 180 тыс. об/мин).
Вольфрам входит в состав ряда износоустойчивых сплавов, используемых для покрытия поверхностей деталей машин (клапаны авиадвигателей, лопасти турбин и другие).
Вольфрам используют в качестве электродов для аргонодуговой сварки.
Сплав карбида вольфрама с 16 % кобальта настолько тверд, что может частично заменить алмаз при бурении скважин.
603
Псевдосплавы вольфрама с медью и серебром – превосходный материал для рубильников и выключателей электрического тока высокого напряжения: они служат в шесть раз дольше обычных медных контактов.
В 1975 г. было обнаружено еще одно весьма полезное свойство вольфрама. Как оказалось, поверхность вольфрамовой пленки, осажденной из газовой фазы, отлично поглощает солнечную энергию, испуская при этом совсем немного тепла. В гелиотехнических установках вольфрамовая пленка может работать даже в условиях поверхности Меркурия, раскаленной до 300−400 °C. Большинство материалов в таких условиях теряет с инфракрасным излучением большую часть поглощенной энергии, но вольфрамовая пленка надежно работает и при более высокой температуре (около 500 °C). Как оказалось, это свойство объясняется своеобразным строением такой пленки. Она покрыта тончайшими волосками-дендритами и в этом «мехе» хорошо задерживаются солнечные лучи. Он же препятствует инфракрасному излучению.
В последние годы важное практическое значение приобрели некоторые химические соединения вольфрама. Сульфид WS2 применяется как высокотемпературная (до 500 °C) смазка. Трехоксид вольфрама находит применение для производства твердого электролита высокотемпературных топливных элементов. Дителлурид WTe2 применяется для преобразования тепловой энергии в электрическую (термоЭДС около 57 мкВ/К). Фосфорновольфрамовая гетерополикислота применяется для производства лаков и ярких, устойчивых на свету красок. Раствор вольфрамата натрия Na2WO4 придает тканям огнестойкость и водонепроницаемость. Вольфраматы щелочноземельных металлов, кадмия и редкоземельных элементов применяются при изготовлении лазеров и светящихся красок.
Металлы Va и VIa подгрупп имеют небольшую работу выхода электронов. Поэтому наиболее тугоплавкие из них и, в первую очередь W и Мо, которые выделяются высокой прочностью и хорошими теплофизическими свойствами, используют для изготовления катодов термоэмиссионных преобразователей ядерной энергии, бортовых источников питания в космических и других летательных
604
аппаратах. Из тугоплавких металлов делают также и другие узлы и детали термоэмиссионных преобразователей энергии − коллекторы, экраны, трубопроводы, резервуары для щелочных металлов и т.п.
Применению тугоплавких металлов при высокой температуре в глубоком вакууме, в том числе и в космических условиях, благоприятствует то, что все они, кроме Сr, имеют низкую упругость пара, особенно W (у Сr давление пара велико даже в твердом состоянии, поэтому в вакууме он подвержен испарению при температуре, значительно меньшей, чем температура плавления).
Контрольные вопросы
1.Опишите основные достоинства и недостатки ОЦК металлов Va и VIa подгрупп таблицы химических элементов Д.И. Менделеева.
2.Каковы цели, направления и особенности легирования тугоплавких металлов?
3.В чем достоинства и недостатки V? Опишите принципы легирования V.
4.Как влияет Ti на структуру и свойства ванадия.
5.Назовите их достоинства и недостатки сплавов системы V−Nb.
6.Каковы перспективы использования V и сплавов на его основе в
ЯЭУ.
7.Опишите достоинства, недостатки Nb и принципы его легирования.
8.Как влияет Zr на структуру и свойства ниобия?
9.Перечислите достоинства и недостатки сплавы системы
Nb−Zr−Mo(W).
10.В чем заключаются проблемы жаростойкости сплавов ниобия?
11.Приведите классификация сплавов ниобия.
12.Достоинства и недостатки Та, принципы легирования. 13.Сплавы системы Та−W, их достоинства и недостатки. 14.Применение сплавов тантала.
15.Назовите достоинства, недостатки Сr и принципы еголегирования. 16.Какие возникают проблемы при использовании сплавов на основе
хрома?
17.Перечислите достоинства, недостатки Мо и принципы его легирования.
18.Назовите достоинства и недостатки сплавов системы Mo−Zr−Ti. 19.Какова роль углерода в сплавах на основе молибдена?
605
20.Как влияет Re на механические свойства Mo? В чем заключается суть рениевого эффекта.
21.Приведите типичные режимы термообработки сплавов молибдена. 22.Назовите достоинства, недостатки W и принципы еголегирования. 23.Перечислите области применения сплавов вольфрама.
24.В чем заключаются механизмы охрупчивания тугоплавких ОЦК металлов?
25.Опишите направления и способы повышения пластичности ОЦК металлов.
26.В чем заключаются особенности технологии обработки ОЦК металлов давлением?
27.Перечислите основные стадии окисления тугоплавких ОЦК метал-
лов (V, Nb, Mo).
28.Назовите способы повышения жаростойкости ОЦК металлов.
29.Приведите сравнительную характеристику совместимости с Li и Na тугоплавких металлов: V, Nb, Mo.
30.Перечислите основные факторы, определяющие совместимость V, Nb и Мо с натрием и литием.
31.На примере диаграмм состояния систем сплавов Nb−Мо, Мо−Zr и W−Ti предскажите структуру и свойства сплавов Nb − 5 % Мо, Mo − 2 % Zr и W − 10 % Ti после закалки от 1600 °С; в состоянии термодинамического равновесия.
32.Предскажите структуру и механические свойства сплава V − 2,5 % Zr − 0,3 % С (п® сравнению с V) в состоянии термодинамического равновесия при 20 °С.
33.Предскажите структуру сплава V − 20% Ti в состоянии закалки с температуры 1000 °С.
34.Предскажите структуру сплава Мо − 0,4 % Zr − 0,1 % С в состоянии термодинамического равновесия при 20 °С и 1300 °С.
35.Предскажите структуру и фазовый состав сплава Мо − 10 % W при
1700 °С.
36.Обоснуйте легирующий комплекс пластичного сплава на основе Мо и его обработку.
37.Обоснуйте легирующий комплекс ванадия для получения жаропрочного сплава.
38.Обоснуйте легирующий комплекс для получения пластичного и жаропрочного сплава на основе ниобия.
39.Охарактеризуйте радиационную стойкость тугоплавких металлов и сплавов.
606
23.6.Реакторный графит
23.6.1.Конструкционный графит и его свойства
Графит − материал, который одним из первых был применен в ядерной технике и область применения которого продолжает расширяться до настоящего времени. Это объясняется весьма удачным сочетанием физических и химических свойств графита (см. табл. 23.1), дающих ему преимущества перед многими другими материалами. Так, сечение захвата тепловых нейтронов графита составляет около 0,0036 10−28 м2, он имеет относительно высокую прочность, в отличие от других материалов не уменьшающуюся, а возрастающую с увеличением температуры вплоть до 2500 °С. Графит обладает устойчивой кристаллической решеткой, оставаясь в твердом состоянии даже при очень высоких температурах (более 3500 °С). Именно последние обстоятельства сделали графит привлекательным для применения в качестве конструкционного материала и материала замедлителя высокотемпературных реакторов с газовым охлаждением (ВТГР), а также защитного экрана первой стенки термоядерного реактора.
Поэтому знакомство с основными свойствами графита представляет довольно большой интерес.
Графит представляет собой одну из кристаллических модификаций углерода. В периодической системе Д.И. Менделеева углерод расположен в IV группе элементов, имеет порядковый номер 6. Существует два стабильных изотопа с массовыми числами 12 (98,892 %) и 13 (1,108 %).
В природе углерод встречается в виде кристаллических (алмаз и графит) и аморфных (каменный уголь и некоторые другие ископаемые) модификаций. Графит − наиболее стабильная кристаллическая модификация углерода. При атмосферном давлении графит сублимируется при температуре около 3700 °С, расплавить графит возможно только под давлением выше 10 МПа. На рис. 23.286 приведена диаграмма состояния углерода по Банди. Тройная точка для графита соответствует давлению 10,5 МПа и температуре около
3700 °С.
607
Графит имеет гексагональную структуру: атомы углерода расположены в вершинах правильных плотноупакованных шестиугольников, аналогичных бензольным кольцам. Такие плоскости называют базисными. Каждый атом в базисной плоскости связан с тремя соседними, расположенными от
Рис. 23.286. Диаграмма него на расстоянии 0,1415 нм. состояния углерода Энергия связи между ними состав-
ляет 712 кДж/г-атом.
Базисные плоскости в кристалле графита уложены параллельно друг другу, однако порядок их чередования может быть различным, что обусловливает наличие двух кристаллических модифика-
ций графита − гексагональной и ромбоэдрической (рис. 23.287).
Для первой из них характерно такое смещение атомных слоев относительно друг друга, при котором каждый третий слой повторяет первый, т.е. чередование АВАВАВ... . Соседние слои смещены так, что под центром и над центром каждого гексагона находится атом углерода в прилегающем слое. Эта структура отвечает гексагональному кристаллу с четырьмя атомами, приходящимися на элементарную ячейку, и относится к пространственной группе Д4 с параметрами элементарной ячейки а = 0,2456÷0,2461 нм и с =
=0,6696÷0,6708 нм.
Вромбоэдрической структуре каждый четвертый слой повторяет первый АВСАВС... . Ромбоэдрическая структура обычно встречается в природном графите, в котором ее содержание может достигать 30 %. В искусственных графитах она практически не наблюдается. Силы взаимодействия между базисными плоскостями малы и имеют характер ван-дер-ваальсовских. Энергия связи в направлении, перпендикулярном к плоскости базиса, составляет от 4 до 18 кДж/г-атом, а расстояние между базисными плоскостями (между слоями) 0,3354 нм.
Всем видам искусственного и природного графита свойственны различные устойчивые дефекты структуры. В зависимости от сте-
608
пени регулярности и характера дефектов механические, физические и другие свойства графитовых материалов изменяются в весьма широком диапазоне. Наряду с обычно принятыми дефектами структуры, винтовыми и краевыми дислокациями, дислокационными петлями, двойниками и дефектами чередования слоев (упаковки) в графите к дефектам относят и химические дефекты − внедрение посторонних атомов в решетку графита. Наиболее распространенные химические дефекты − это атомы В, О, S, N, Р.
Рис. 23.287. Кристаллическая структура графита:
а− расположение кристаллографических плоскостей (002), (100), (112) в кристалле графита; б − взаимное расположение графитовых слоев
вгексагональной решетке (последовательность АВАВАВ); в − взаимное расположение графитовых слоев в ромбоэдрической решетке
(последовательность ABCABC); г − взаимное расположение слоев
втурбостратной укладке (отсутствие периодичности)
Впромышленности широко применяют искусственные углеродные материалы, которые подразделяют на следующие группы.
1. Коксы и угли, представляющие собой нелетучие остатки термического разложения твердых и жидких органических материалов. В зависимости от сырья эти материалы называют каменноугольными, нефтяными и липековыми коксами.
609
2.Углекерамические материалы, являющиеся композицией кок-
сов и углей, связанных битумом. Последний после термообработки
−обжига − цементирует основу.
3.Пневматолиты − материалы, образующиеся в результате термического разложения газов и паров (сажи, пироуглероды, пирографиты).
4.Искусственные графиты, получающиеся в результате высокотемпературной обработки (графитации) исходных материалов и их композиций.
В качестве конструкционных материалов в реакторостроении применяют в основном искусственные графиты. Их изготавливают по так называемой электродной технологии из шихты, представляющей собой механическую смесь, состоящую примерно из 75 % кокса различного гранулометрического состава (наполнитель) и 25 % каменноугольного пека (связующее). Исходное сырье, его подготовка, ведение технологического процесса самым существенным образом влияют на структуру и свойства графита. Поэтому технологию получения искусственного графита следует рассматривать как важнейший этап формирования его свойств.
Технология получения искусственного графита. Технология получения искусственного графита сложилась в конце XIX века и в основных своих чертах сохранилась до нынешнего времени.
При производстве искусственного графита в качестве наполнителя чаще всего используют нефтяной кокс (иногда пековый) и в качестве связующего − каменноугольный пек. Иногда в качестве связующего или пропитывающего вещества могут применять некоторые синтетические смолы.
Основные технологические этапы производства искусственного графита следующие: предварительное дробление кокса; прокаливание кокса; размол и рассев кокса по фракциям; подготовка связующего; приготовление углеродной массы; формирование заготовок; обжиг заготовок; графитация заготовок; рафинирование.
Предварительное дробление. На заводы поступают крупные куски углеродистого сырья, которые необходимо довести до размеров от 3 до 40 мм.
610
Прокаливание. Все сырьевые материалы, кроме природного графита и сажи, прокаливают без доступа воздуха при температуре
1100−1300 °С.
Прокаливание существенным образом влияет на формирование свойств получаемых материалов. При прокаливании происходит разложение органических веществ кокса, удаление летучих веществ и влаги, завершаются в основном процессы образования плоских углеродных сеток. Процесс прокаливания сопровождается усадкой, которая составляет 13−14 % для пиролизного кокса и около 25 % для крекингового. Одновременно растут пикнометрическая плотность, общая пористость, прочность, а содержание водорода снижается в 10 раз.
Размол и рассев по фракциям, составление шихты. При произ-
водстве искусственного графита используют порошки углеродных материалов различной крупности, что обеспечивает их более плотную упаковку. Для получения порошков прокаленные коксы измельчают, а затем рассеивают по фракциям. Частицы различных углеродных материалов различаются размерами и формой (сферическая форма частиц у сажи, пластинчатая у природного графита и непрокаленного кокса и т.п.), при этом форма пластинок зависит от природы кокса. В состав шихты входит примерно 25 % частиц крупного помола (0,4−0,8 мм) и 15 % − тонкого (0,15 мм и меньше).
Подготовка связующего. Каменноугольный пек представляет собой остаток после разгонки смолы по фракциям; в зависимости от соотношения фракций его твердость и температура размягчения может быть различной. Наибольшее распространение в электродной и электроугольной промышленности получил пек, имеющий температуру размягчения 65−70 °С и плотность 1200−1300 кг/м3. Перед использованием пек расплавляют и выдерживают при постоянной температуре для придания ему однородности.
Смешение. Чтобы приготовить однородную массу, компоненты, заданные рецептурой, смешивают. Однородность смеси сыпучих материалов достигается многократным пересыпанием. После перемешивания сухой шихты ее нагревают до температуры 90−130 °С, а затем вводят связующее в расплавленном состоянии. Одновременно производят тщательное перемешивание. В процессе перемеши-
611
вания при повышенной температуре достигается однородность массы и смачивание связующим зерен наполнителя, что обеспечивает их связывание закоксовавшимся наполнителем в процессе последующего обжига заготовок.
Формование. В промышленности формование готовой массы производят в основном двумя методами: выдавливанием через мундштук пресса и прессованием в пресс-форму. Реже применяют гидропрессование.
При формовании выдавливанием массу загружают в контейнер пресса и выдавливают через мундштук при давлении 40−100 МПа. Проходя через мундштук, масса подвергается равномерному обжатию.
При прессовании масса непосредственно загружается в прессформу, которая определяет форму и размеры изделия. Позволяя получать крупные изделия (диаметром до 1500 мм), этот метод обладает тем недостатком, что по высоте изделия могут иметь заметную разноплотность, зависящую от их высоты, что ограничивает последнюю величину. При гидропрессовании масса загружается в контей- нер-пресс-форму, изготовленный из эластичного материала, и подвергается всестороннему обжатию внешним давлением жидкости.
При различных способах формования свойства материала, в частности анизотропия, получаются различными. Например, анизометричные (имеющие в различных направлениях различные размеры) частицы при выдавливании ориентируются длинной осью вдоль оси прессования, короткая ось при этом ориентируется хаотически. При прессовании в пресс-форму, наоборот, вдоль оси прессования преимущественно ориентируется короткая ось частиц. Степень анизотропии при выдавливании больше, чем при прессовании в пресс-форму, так как путь, проходимый частицей при выдавливании, больше, чем при прессовании. Наиболее изотропными и равноплотными изделия получаются при гидропрессовании.
Обжиг. Для превращения связующих веществ (пека, смолы и т.п.) в кокс необходим обжиг отформованных («зеленых») изделий, который осуществляется нагреванием до 1000−1300 °С. Режим обжига должен обеспечить максимальное образование кокса из связующего, чем будут обусловлены максимальные прочность изде-
612
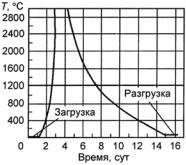
лия и связывание зерен наполнителя. Так как в процессе обжига происходят превращения в связующем, связанные с изменением объема, и выход летучих веществ, то режим нагрева подбирается таким, чтобы превращение связующего в кокс прошло наиболее полно и вместе с тем не произошло деформаций (пока еще заготовка пластична) или растрескивания заготовки вследствие градиента объемных изменений. Наибольшие изменения объема и максимальный выход летучих веществ происходят до температуры 500−600 °С, и в этом диапазоне подъем температуры должен осуществляться наиболее медленно. При более высоких температурах завершается превращение связующего в кокс, химические процессы постепенно затухают, усадка уменьшается.
Графитация. Процесс превращения углеродных материалов в графит начинается при температуре около 1800 °С и завершается в основном при температуре 2400−2800 °С. Температура, при которой завершается процесс и полнота протекания графитации, зависит, с одной стороны, от требований, предъявляемых к изделию, с другой стороны, от графитируемости используемого кокса и связующего.
Графитация производится в спе- |
|
циальных электрических печах со- |
|
противления, где нагревательным |
|
элементом являются сами заготовки |
|
и графитовая засыпка, которая ис- |
|
пользуется для защиты заготовок от |
|
окисления. Цикл графитации состо- |
|
ит из загрузки, относительно быст- |
|
рого нагревания, выдержки при |
|
максимальной температуре и мед- |
|
ленного охлаждения. Время проте- |
Рис. 23.288. Температурный |
кания цикла обычно около двух не- |
режим графитации |
дель. Типичный график температурно-временного режима графитации показан на рис. 23.288.
Рафинирование. Графит, используемый в ядерной технике в качестве конструкционного материала активной зоны, должен обладать высокой чистотой. С целью достижения такой чистоты графит подвергается рафинированию. Обычно очистка графита произво-
613
дится в процессе графитации использованием реакционных газов − хлора или фтора (в последнем случае используется фреон, при термическом разложении которого образуется фтор), дающих с примесными атомами летучие соединения.
После галоидной очистки количество примесей в реакторном графите ничтожно. Обычно количество примесей (зольность) графита не превышает нескольких тысячных долей процента.
Характерный состав примесей реакторного графита:
Примесь ……………….. |
В |
Са |
Fe |
H2 |
Mn |
Ti |
V |
P3M |
Концентрация, 10−6 % … |
0,03 |
60 |
15 |
15 |
0,1 |
17 |
23 |
0,1 |
Перечисленные примеси увеличивают эффективное сечение захвата нейтронов в среднем на 0,4 10−28 м2.
Как уже говорилось выше, свойства искусственного графита самым существенным образом зависят от исходного сырья и его предварительной обработки.
Другим широко применяемым способом влияния на свойства графита является пропитка полуфабриката различными веществами (импрегнатами), в качестве которых используются каменноугольный пек, фенолформальдегидные смолы, фуриловый спирт и др. При проведении операции пропитки материал нагревают до требуемой температуры (при пропитке каменноугольным пеком − до 250 °С), загружают в автоклав, вакуумируют, а затем в автоклав под давлением нагнетают импрегнат. После пропитки полуфабрикат подвергают повторному отжигу. Таких пропиток может быть несколько, однако наиболее эффективна первая пропитка. В результате пропитки плотность можно повысить на 10−20 %, прочность на 50−80 % и электро- и теплопроводность на 10−15 %.
Пористость конструкционного графита. Если рассматривать материалы, изготовленные по сходной технологии, например, описанной выше электродной, то свойства графита в значительной мере определяются двумя факторами − его пористостью и совершенством кристаллической структуры.
Пористость обычно определяют из соотношения
ε = 1 − ρb/ρр, |
(23.67) |
614
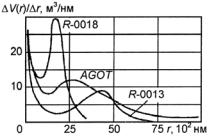
где ρb и ρр − соответственно объемная и пикнометрическая плотность материала.
Типичная дифференциальная кривая распределения пор по размерам показана на рис. 23.289. Первый пик распределения, расположенный в области 2 нм, обусловлен порами, расположенными на стыках кристаллов. Поры большого размера представляют собой поры в коксе наполнителя и связующего, образующиеся в процессе формирования структуры кокса, а также трещины, образующиеся в процессе термообработки за счет анизотропии теплового расшире-
ния и градиентов объемных из- |
|
|
менений. |
|
|
Изучение свойств графита |
|
|
показало, что существуют кор- |
|
|
реляции, описывающие измене- |
|
|
ния свойств графита при изме- |
|
|
нении плотности в определен- |
|
|
ном диапазоне значений по- |
|
|
следней. |
Рис. 23.289. Дифференциальные |
|
Так, газопроницаемость в за- |
||
кривые зависимости распределения |
||
висимости от пористости может |
объема V пор от их радиуса r для |
|
быть выражена степенным урав- |
ядерного графита различных марок |
уравнением |
|
K = Aεn, |
(23.68) |
где A − коэффициент пропорциональности; показатель |
степени |
n ≈ 3,5. |
|
Для электросопротивления, Ом·м, была найдена зависимость
ρэ = ρэ1620(6200/ρ) − 2800, |
(23.69) |
где ρэ1620 − удельное электросопротивление при значении плотности 1620 кг/м3; ρ − плотность, кг/м3.
Теплопроводность и модуль упругости могут быть выражены
линейными уравнениями |
|
1 − λ/λ0 = Kλ(1 −ρ/ρ0) = Kε; |
(23.70) |
1 − Е/Е0 = KЕ(1 −ρ/ρ0) = Kε; |
(23.71) |
В этих уравнениях значения Kλ для теплопроводности и KЕ для модуля упругости составляют соответственно 2,3 и 2,8; Е0 и ρ0 − модуль упругости и плотность «беспористого» материала;
λ0 = 0,2 Вт/(м·К).
615
Связь свойств графита с пористостью иногда дают и уравнения другого типа, например, для электросопротивления:
ρэ = ρ0э ехр(арε), |
(23.72) |
где ρ0э − электросопротивление беспористого материала; ар − по-
стоянная. Аналогичными уравнениями могут быть описаны и другие свойства.
Поскольку речь идет об описании свойств в относительно узком диапазоне изменения плотности, то могут быть предложены и другие уравнения, однако все они имеют чисто описательный характер, и в них не заложен какой-либо физический смысл.
Особое место среди свойств занимает коэффициент термического расширения, для которого наблюдается связь не с общей пористостью, а только с закрытой пористостью, в состав которой входят главным образом поры, размещенные на границах кристаллитов. Так как такие поры анизометричны, т.е. имеют различные размеры в разных направлениях, то для коэффициента теплового расширения имеет значение и ориентация пор. Выявление закономерностей влияния пористости на коэффициент теплового расширения имеет особое значение для понимания механизма радиационного повреждения графита, и вопрос этот заслуживает отдельного рассмотрения.
Кристаллическая структура углеродных материалов. Важ-
нейшим фактором, определяющим физические свойства углерод-
ных материалов, является степень совершенства кристаллической структуры, которая обусловлена, прежде всего, температурой окончательной обработки графита и природой используемых при его производстве сырьевых материалов.
Структура неграфитированного углерода во многом аналогична структуре графита. Эта такая же, как у графита, слоистая структура, состоящая из слоев, в которых существует двумерная упорядоченность. Эти слои уложены небольшими пакетами, внутри которых нет азимутальной упорядоченности между плоскостями; они повернуты относительно друг друга на небольшие углы (или смещены на небольшие расстояния). Диаметр таких пакетов обычно составляет около 2 нм. Структуры, состоящие из параллельно уло-
616
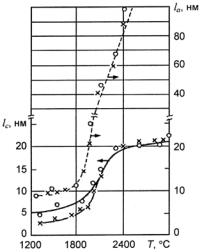
женных слоев, между которыми нет азимутальной упорядоченности, соответствующей трехмерному порядку, получили название турбостратных. Межслоевое расстояния для таких структур составляет 0,344 нм (для выражения степени графитации принимается несколько меньшая величина 0,3425 нм − см. ниже). Турбост-
ратные |
структуры |
образуются при температуре около |
|
1600−1700 °С. |
|
||
При |
термической |
обработке |
|
увеличиваются высота пакетов lc |
|||
и их диаметр lа (рис. 23.290). В |
|||
процессе роста пакетов происхо- |
|||
дит |
существенная переориента- |
||
ция графитовых слоев, прибли- |
|||
жающая структуру к трехмерно- |
|||
му |
порядку, соответствующему |
||
структуре графита. Этот процесс |
|||
происходит при температуре вы- |
|||
ше 2000 °С и протекает с боль- |
|||
шей или меньшей степенью пол- |
|||
ноты в зависимости от исходного |
|||
сырья. В этом отношении исход- |
|||
ные |
материалы для |
получения |
|
графита подразделяются на гра- |
Рис. 23.290. Изменение высоты lc |
|
фитируемые (мягкие) и негра- |
и диаметра lа кристаллитов |
|
(областей когерентного рассеяния) |
||
фитирумые (жесткие) углерод- |
в зависимости от температуры |
|
ные материалы. |
|
обработки материалов на основе |
Графитируемые |
материалы |
нефтяных коксов КПГ (±) |
получаются, как правило, из ма- |
и ГР-280 (|) |
|
|
||
лоокисленных веществ, богатых водородом. К таким веществам относятся нефтяные и пековые коксы, используемые для производства искусственного графита.
К плохо графитируемым веществам относятся, например, сажа, гидратцеллюлозное волокно. Для таких веществ температура начала образования трехмерной упорядоченности может быть смещена в область более высоких, чем 2000 °С, температур.
617
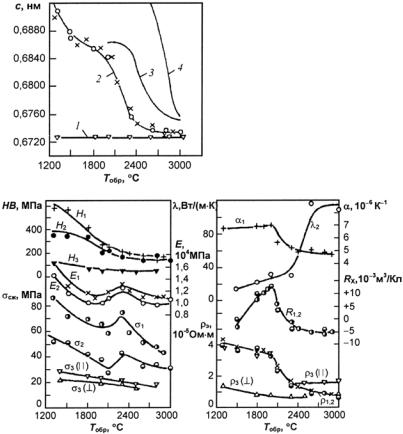
Характерные стадии процесса графитации для материалов различного типа показаны на рис. 23.291 на примере изменения параметра кристаллической решетки.
Рис. 23.291. Изменение параметра кристаллической решетки с в зависимости от температуры
обработки:
1 − материал на основе природного графита (ЕР); 2 − графиты на основе нефтяных коксов КПГ (±) и ГР-280 (|); 3 − термоантрацит; 4 − гидратцеллюлоза
Рис. 23.292. Изменение физико-механических свойств углеродных материалов в зависимости от температуры обработки:
НВ − твердость; σсж − предел прочности при сжатии; Е − модуль упругости; λ − коэффициент теплопроводности; ρэ − удельное электросопротивление; αt − коэффициент теплового расширения и RХ − коэффициент Холла (вид материала указан в нижнем индексе: 1 − КПГ; 2 − ГР-280; 3 − EP).
Для материала ЕР даны значения в перпендикулярном ( ) и паралельном (||) оси прессования направлениях
618
Существуют различные способы выражения степени графитации материала, но чаще всего используется соотношение
γ = (0,3425 − d0002)/(0,3425 − 0,3356), (23.73)
где γ − степень графитации; d0002 − измеренное межслоевое расстояние для рассматриваемого материала; 0,3425 и 0,3356 нм − крайние значения межслоевого расстояния соответственно для материала при отсутствии трехмерного упорядочения и для полностью графитированного материала.
Процесс графитации сопровождается изменением физических и механических свойств материала (рис. 23.292), причем температурные интервалы изменения их не совпадают, что указывает на сложность и многостадийность процесса упорядочения кристаллической структуры графита.
Так как степень графитации, как оказалось, в значительной мере определяет радиационную стойкость графита, эта величина контролируется при его производстве. В связи с тем, что удобно использовать неразрушающий контроль, для этой цели выбрано электросопротивление, которое достаточно чувствительно к степени графитации материала, и измерение его легко может быть реализовано.
23.6.2. Физические свойства графита
Электросопротивление. В самом общем виде электросопротивление графита можно характеризовать соотношением
ρэ = Аρ/l, (23.74)
где Аρ − фактор, учитывающий влияние пористости, текстуры и температуры измерения; l − средняя длина свободного пробега электронов.
Для монокристалла графита электропроводность вдоль базисных плоскостей намного (на несколько порядков) больше, чем в перпендикулярном им направлении. Для графитированных мате-
риалов характерна обратная пропорциональность электросопро-
тивления от размера кристаллов (областей когерентного рассеяния) la (рис. 23.293). Это указывает на то, что основными центрами рассеяния электронов проводимости являются границы кристаллитов.
619
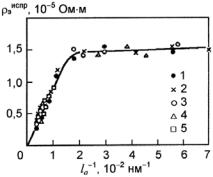
Для материалов с низким совершенством кристаллической структуры (термообработка ниже 2000 °С) электросопротивление слабо зависит от размера кристаллитов. Это связывают с тем, что с понижением степени совершенства увеличивается дырочная проводимость, которая компенсирует увеличение рассеяния электронов проводимости. Следовательно (см. рис. 23.293), изменение электросопротивления обозначает довольно четкую границу между графитированным и неграфитированным материалом. Это и дает возможность использовать электросопротивление для контроля степени графитации при производстве реакторного графита.
Рис. 23.293. Зависимость приведенного к нулевой пористости усредненного электросопротивления ρэиспр углеродных материалов от диаметра кристаллитов (полуфабрикаты 1−4 обработаны при температуре 1300−3000 °С):
1 − Гр-280; 2, 3 − прессованные материалы на основе кокса КНПС; 4 − композиции нефтяного кокса с термоантрацитом; 5 − промышленные
марки графита
Теплоемкость. Теплоемкость графита в отличие от других свойств мало зависит от технологии изготовления той или иной марки, хотя и зависит от степени совершенства кристаллической структуры, уменьшаясь с увеличением степени графитации.
Удельная теплоемкость графита при −250 ÷ −210 °С изменяется примерно пропорционально квадрату температуры и при температурах существенно выше 1700 °C достигает значения, отвечающего закону Дюлонга и Пти [около 68 Дж/(г-атом К)].
620
Характер изменения теплоемкости графита от температуры представлен на рис. 23.294. Такие отличия в закономерностях изменения теплоемкости графита от температуры для большинства других твердых тел, как полагают, обусловлены тем, что графит ведет себя как двумерный кристалл.
Типичные значения удельной теплоемкости для искусственного графита в зависимости от температуры:
Т, °С |
Ср, Дж/г-атом К |
25 |
8,72 |
230 |
14,67 |
430 |
18,56 |
730 |
21,54 |
1030 |
23,34 |
1330 |
24,43 |
1730 |
25,35 |
2230 |
26,23 |
Рис. 23.294. Удельная теплоемкость графита в интервале 0−5 К:
1 − графитированная сажа;
2− искусственный графит; 3 − природный графит
Теплопроводность. Для графита характерна довольно высокая теплопроводность при относительно низкой электропроводности, что обусловлено тем, что электронная компонента теплопроводности не велика и определяющей является фононная компонента.
Это позволяет для описания теплопроводности графита применить уравнение Дебая
λ= AСрlv, |
(23.75) |
где λ − теплопроводность; А − геометрический фактор; Ср − теплоемкость; l − средний свободный пробег фонона; v − скорость распространения упругих колебаний, обусловливающих передачу тепловой энергии.
В общем случае Ср и l зависят от температуры, при этом теплоемкость с температурой растет (см. рис. 23.294), а длина свободного пробега уменьшается. Для количественного рассмотрения температурной зависимости среднего свободного пробега фонона можно ее представить согласно теории Дебая состоящей из двух
компонент: |
|
1/l = 1/l1 + 1/l2, |
(23.76) |
621 |
|

где l1 − средний свободный пробег, связанный с рассеянием на собственных тепловых колебаниях решетки (он уменьшается ~1/T) и l2 − средний свободный пробег, связанный с рассеянием на границах кристаллитов, который не зависит от температуры. В результате зависимость теплопроводности графита от температуры имеет максимум, положение и величина которого зависят от соотношения ξ = l2/l1. Графиты с большей степенью совершенства (степенью графитации) обладают большим значением l2 и, следовательно, большей теплопроводностью.
На рис. 23.295 представлена серия кривых, иллюстрирующих температурную зависимость теплопроводности графита различной степени совершенства, характеризуемой параметром ξ, который изменяется от 6,0 до 0,03. Следует отметить, что изменения параметра ξ могут быть связаны не только со степенью графитации, но возникновением структурных несовершенств, вызванных другими причинами, например облучением.
Рис. 23.295. Зависимость коэффициента теплопроводности от температуры измерения для графитированных материалов с различным значением параметра ξ
В этом случае следует рассматривать соотношение
1/l = 1/l1 + 1/l2 + 1/l3, (23.77)
где l3 − длина свободного пробега, связанная с рассеянием на дефектах решетки.
Конструкционные графиты обладают, как правило, заметной пористостью и анизотропией. Поэтому в формулу Дебая следует ввести поправки, учитывающие пористость и текстуру.
В общем случае выражение для теплопроводности можно записать следующим образом:
1/λϕ = qϕε(1/l1 + 1/l2 + 1/l3)/ACpv, |
(23.78) |
где λϕ − теплопроводность в направлении под углом φ к оси текстуры; qφ − фактор, учитывающий анизотропию; ε − фактор, учитывающий пористость [см. выражение (23.67)].
622
К сожалению, попытки рассчитать поправочные коэффициенты теоретическим путем не привели до сих пор к положительным результатам и пока они получаются эмпирическим путем на основе обработки экспериментальных данных.
Коэффициенты теплопроводности различных марок графита для различных температур измерения приведены в табл. 23.120 (см. также табл. 23.1).
Таблица 23.120
Коэффициент теплопроводности графита
|
|
Т, °С |
Направление относительно прессоваоси- *ния |
100 |
200 |
300 |
|
500 |
800 |
|
|
Темпера- |
|
|
λ, Вт/(м К), |
|
|
||
Марка |
Плотность, |
тура гра- |
|
|
|
|
|||
|
|
при температуре, °С |
|
||||||
графита |
ρ, кг/м3 |
фитации |
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
ВПП |
1900−1950 |
2800 |
|
136 |
123 |
112 |
|
93 |
74 |
|
|
|
|
195 |
166 |
143 |
|
116 |
93 |
Реак- |
1770 |
2500 |
|
− |
93 |
86 |
|
72 |
57 |
торный |
|
|
|
|
64 |
58 |
|
49 |
40 |
графит |
|
|
|
|
|
|
|
|
|
ГР-280 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КПГ |
1770 |
2500 |
|
128 |
116 |
105 |
|
84 |
71 |
МПГ-6 |
1720 |
2500 |
|
95 |
87 |
81 |
|
72 |
62 |
ГМЗ |
1650 |
2400 |
|
122 |
107 |
97 |
|
79 |
63 |
|
|
|
|
95 |
84 |
74 |
|
60 |
49 |
__________
* − параллельно оси формования; − перпендикулярно оси формования.
Коэффициент теплового расширения. Коэффициенты тепло-
вого расширения решетки графита вдоль осей с и а (соответственно αс и αа) сильно различаются вследствие различных величин частоты и, следовательно, температуры для колебаний вдоль этих направлений. Из графиков, представленных на рис. 23.296, видно, что тепловое расширение решетки до 700 °С происходит только по оси с и сопровождается небольшим сжатием по оси а. При более высоких температурах коэффициент теплового расширения вдоль оси с в несколько раз превышает таковой вдоль оси а. Макроскопические коэффициенты теплового расширения монокристалла графита (или
623
совершенного по структуре пирографита) практически совпадают. Тепловое расширение поликристаллического искусственного графита имеет более сложный характер и сильно зависит от сырья и технологии изготовления.
Рис. 23.296. Термическая деформация и коэффициенты теплового расширения (αс и αа) кристаллической решетки графита.
Получено при исследовании монокристаллов графита
В общем случае тепловые деформации поликристаллического тела можно рассчитать по тепловому расширению решетки, если известны текстурные коэффициенты. Например, для произвольного направления в поликристаллическом графите
αϕ = Fαc+(1 − F)αa, (23.79)
где F − текстурный коэффициент, представляющий собой долю нормалей к базисной плоскости (0002), ориентированных в направлении ϕ. Однако рассчитанные таким образом коэффициенты теплового расширения оказываются существенно большереальных
для поликристаллического графита. Это связано с наличием своеобразной ориентированной пористости в искусственном графите, образующейся на стадиях коксования и графитации. Эта пористость в значительной мере аккомодирует тепловое расширение кристаллов.
Для учета этой аккомодации были предложены различные модели, наиболее распространенная из них − термодинамическая модель, предложенная Симмонсом. Согласно этой модели тепловое расширение по основным направлениям (параллельно и перпендикулярно оси формования) связывается с коэфициентами теплового расширения решетки также через текстурные параметры, которые учитывают не только ориентацию кристаллитов, но и фактор аккомодации:
624
α = Аαс + (1 − А)αа; α = Вαс + (1 − В)αа. |
(23.80) |
Параметры А и В определяются экспериментально и в общем
случае равны |
|
А = (α − αа)/(αс − αа); В = (α − αа)/(αс − αа). |
(23.81) |
С учетом того, что коэффициент αа = 0 при 400°С (см. рис.
23.296), расчет существенно упрощается, а именно: |
|
А = (α /αс)400 °С; В = (α /(αс) 400 °С. |
(23.82) |
Расчеты, проведенные с использованием полученных таким образом коэффициентов, дают удовлетворительные результаты до температуры, несколько превышающей 1000 °С. При более высокой температуре расчет дает заниженное по сравнению с измеренным значение. Это связано с тем, что с повышением температуры ориентированная пористость частично закрывается, т.е. происходит постепенное «заполнение» аккомодационного объема и способность к аккомодации температурных кристаллитов уменьшается. Различие между расчетным и экспериментальным значениями коэффициента теплового расширения для реакторного графита показано на рис. 23.297.
Рис. 23. 297. Температурная зависимость коэффициентов теплового расширения (α и α ) английского реакторного графита марки PGA:
± − расчетные значения α и α , полученные при постоянных (независимых от температуры) текстурных коэффициентах; | и U − экспериментальные значения α и α соответственно
Значения коэффициента теплового расширения для некоторых марок отечественного реакторного графита приведены в табл. 23.121.
625

Таблица 23.121
Коэффициент теплового расширения реакторного графита, 10−6 град−1
Марка |
|
|
|
|
|
|
Температура, °С |
|
|
|
|
|
|
||||
|
20 |
|
200 |
|
|
400 |
|
|
600 |
|
800 |
||||||
графита |
|
|
|
|
|
|
|
||||||||||
α |
|
α |
α |
|
α |
|
α |
|
α |
|
α |
|
α |
α |
|
α |
|
|
|
|
|
|
|
|
|
||||||||||
ГР-280 |
2,9 |
|
4,4 |
3,8 |
|
5,2 |
|
4,4 |
|
5,7 |
|
4,8 |
|
6,0 |
5,1 |
|
6,1 |
(РБМК) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б-15М |
3,5 |
|
4,6 |
4,5 |
|
5,7 |
|
4,9 |
|
6,2 |
|
5,3 |
|
6,5 |
5,4 |
|
6,7 |
ГПР-2 |
4,0 |
|
4,9 |
4,6 |
|
5,6 |
|
5,1 |
|
6,2 |
|
5,5 |
|
6,5 |
5,8 |
|
6,5 |
ВПГ |
3,4 |
|
5,1 |
4,3 |
|
5,6 |
|
4,8 |
|
6,1 |
|
5,1 |
|
6,3 |
5,3 |
|
6,4 |
23.6.3. Механические свойства графита
Модуль упругости. Графит обладает существенной анизотропией упругости. Так, упругие константы монокристалла составляют:
С11 = 116 104 МПа − перпендикулярно оси с; С33 = 4,7 104 МПа − параллельно оси с;
С44 = 0,23 104 МПа − сдвиг в направлении, перпендикулярном оси с;
С12 = 29 104 МПа С13 = 10,9 104 МПа
Макроскопический модуль поликристаллического графита не так сильно различается для различных направлений и по значению существенно меньше большинства упругих констант. Так, значения модуля упругости при комнатной температуре для отечественного реакторного графита составляет для направления, параллельного оси формования, примерно 0,65 104 МПа; перпендикулярного направления 0,5 104 МПа.
Ближе всего указанные значения находятся к величине С44. На самом деле, анализ показывает, что упругие свойства поликристиллического графита определяются константой сдвига, а пластичность − смещением по базисным плоскостям. Это заключение подтверждается характером диаграммы напряжение − деформация при сжатии с повторными циклами, типичный образец которой показан на рис. 23.298.
626
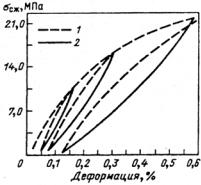
Из рисунка следует, что на диаграмме весьма затруднительно выделить строго линейный участок, который соответствовал бы чисто упругой области, т.е. даже при относительно малых напряжениях присутствует пластическая деформация, часть которой является обратимой при снятии нагрузки (при длительных выдержках после снятия нагрузки большая часть остаточной деформации исчезает). Это свидетельствует о том, что в упругую деформацию определенный вклад вносит перемещение дислокаций
в плоскости базиса, деформация является, по существу, квазиупругой.
Учитывая это обстоятельство, необходимо различать модуль упругости динамический, определяемый по частоте собственных колебаний при малых амплитудах, и статический, определяемый чаще всего как усредненный при относительно больших деформациях.
Коэффициент Пуассона, вычисленный из соотношения модуля нормальной упругости и модуля сдвига, составляет для графита
0,23−0,27.
Прочность. Графит относится к числу хрупких материалов. Считается, что при его разрушении реализуется модель Гриффитса, согласно которой условие для распространения трещины определяется соотношением
σ = (2γЕ/πl)1/2, |
(23.83) |
где Е − модуль упругости; γ − удельная энергия образования свободной поверхности; l − длина трещины. Это определяет наличие корреляции между модулем упругости и разрушающим напряжением, зависящим от размера трещины. Хотя из уравнения (23.83)
627
следует, что прочность должна быть пропорциональна  E , реально для графитов с однородной технологией изготовления и из близкого по качеству сырья часто σ прямо пропорциональна Е:
E , реально для графитов с однородной технологией изготовления и из близкого по качеству сырья часто σ прямо пропорциональна Е:
σсж = εЕ. (23.84)
Прочность графита существенно зависит от вида нагружения. Максимален предел прочности на сжатие, а при одноосном растяжении или изгибе он существенно (примерно в 3−4 раза) ниже.
Уникальной особенностью графита является увеличение прочности с увеличением температуры вплоть до 2500 °С. При этом увеличение предела прочности может достигать 200 % по сравнению с комнатной температурой. При дальнейшем нагреве прочность снижается, достигая при 3000 °С значения при комнатной температуре. Данные о механических свойствах наиболее распространенных марок реакторного графита приведены в табл. 23.122.
|
|
|
|
Таблица 23.122 |
|
Модуль упругости и прочность реакторного графита |
|||||
|
|
|
|
|
|
Марка графита |
Продольное направление |
Поперечное направление |
|||
σсж, МПа |
Е, ГПа |
σсж, МПа |
|
Е, ГПа |
|
|
|
||||
ГР-280 |
34 |
6,5 |
24 |
|
5,0 |
ГРП2-125 |
59,2 |
12,0 |
58,9 |
|
8,5 |
МПГ-6 |
100 |
10,5 |
100 |
|
10,5 |
ГР-1 |
70 |
11 |
84 |
|
12 |
AXF-5Q (POCO) |
150 |
14 |
150 |
|
14 |
Ползучесть графита. Закономерности ползучести графита аналогичны таковым для металлических материалов, но проявляются только при очень высоких температурах. При относительно низкой (до 1500 °С) температуре для графита характерна затухающая ползучесть, определяемая чаще всего логарифмической зависимостью от времени. При этом деформации незначительны и обычно не принимаются во внимание. При низкотемпературной ползучести деформация частично обратима при снятии нагрузки. Процесс возврата также происходит по логарифмическому закону от времени. При более высокой температуре (2000 °С и выше) проявляются все
628
три стадии ползучести − переходная, установившаяся и ускоренная, приводящая к разрушению.
Деформация ползучести чаще всего описывается степенной зависимостью от напряжения и экспоненциальной от температуры. Например, для графита марки ЕСА была предложена зависимость для скорости ползучести вида
εп = K(σ/σв)3,8exp(−Q/RT), |
(23.85) |
где энергия активации Q в интервале температуры 2400−2800 °С имеет значение около 420 кДж/моль. Ползучесть графита, так же как и остальные механические свойства, структурно-чувствительна и зависит от технологии и температуры обработки.
23.3.4. Коррозионная стойкость графита
Конструкционный графит активных зон ядерных ректоров находится под постоянным воздействием химически активных по отношению к углероду примесей в теплоносителе или газе, заполняющем кладку активной зоны. Диапазон температур, при которых функционируют графитовые элементы активных зон различных реакторов, простирается от 300 до 1250 °С. В высокотемпературной части этой области активно происходят реакции окисления графита при взаимодействии с такими примесями в теплоносителе, как О2, Н2О, СО2, Н2. Вступая при высокой температуре во взаимодействие с графитом (поверхностное или объемное), примеси вызывают коррозионное разъедание его структуры, что ведет к деградации прочностных свойств и снижению теплопроводности. Так, трехпроцентная потеря массы образца реакторного графита, происшедшая при взаимодействии с примесными в гелии парами воды, при 1000 °С приводит к 30−50 %-ному изменению таких его свойств, как динамический модуль упругости, удельное электросопротивление, коэффициент термического расширения. При выгорании 5 % по массе графит снижает на 50 % пределы прочности на сжатие и растяжение.
Вместе с тем, коррозия графита ведет к появлению в теплоносителе газоохлаждаемого реактора углеродосодержащих газов (СО2,
629
СО, СН4), которые могут взаимодействовать с материалами контура, вызывая их охрупчивание (например, вследствие науглероживания).
Коррозия материала протекает на фоне изменения его структуры и свойств, вызванного влиянием реакторного облучения: изменения микропористости и плотности вакансионных образований на поверхности монокристалла; относительного увеличения суммарной поверхности кристаллитов, перпендикулярной их базовой плоскости; возникновения внутренних напряжений, ведущих, как показывают эксперименты, к росту скорости реакции коррозии. Параллельно идет процесс радиолиза примесей в теплоносителе, ведущий к появлению дополнительных коррозионноактивных ионов и радикалов. Указанные процессы, дополняя и ускоряя друг друга, ведут к потере работоспособности графитовых конструкционных элементов активной зоны ядерных реакторов.
Имеются экспериментальные данные, показывающие, что сочетание дозированного коррозионного воздействия и радиационного эффекта может отодвинуть окончательную деградацию прочности графита в сторону больших флюенсов нейтронов. Этот эффект может найти свое применение для «оживления» выработавших свой ресурс графитовых кладок активных зон.
Кинетика коррозии графита, как следует из общих соображений, должна зависеть от таких его структурных параметров, как пористость и спектр размеров пор, наличие и концентрация примесей, размер и совершенство кристаллитов, степень дефектности его пограничных поверхностей. Экспериментально установлено, что наличие в графите около 0,1 % таких примесей, как Fe, Сu, Cd, Mn и др., резко ускоряет реакции окисления.
Элементарный акт коррозионного взаимодействия включает в себя диффузию коррозионно-активной молекулы через пограничный ламинарный слой газа к поверхности графита, диффузию в объеме открытой поры в глубь материала, сорбцию и собственно химическую реакцию (возможно, через промежуточную стадию), десорбцию и его диффузию вовне графита. Таким образом, для полного описания процесса коррозии конкретного изделия надо
630
знать параметры перечисленных элементарных процессов в их зависимости от температуры, концентрации и вызванного коррозией изменения микроструктуры графита (вскрытие замкнутой пористости, увеличение диаметров пор и степени дефектности поверхностей монокристаллов). Но и в этом случае описание процесса будет носить достаточно эффектный характер, так как скорости реакций, происходящих на базовых поверхностях монокристалла и на его гранях (1120) и (1010), различаются в 4−100 раз, а на обозначенных гранях на 15 %. В упомянутых случаях изменяется также и порядок реакции.
В области низких температур, где из двух стадий − диффузия реагента и собственно химическая реакция − наиболее медленной, диктующей интегральную скорость процесса, является химическая реакция, коррозия более или менее равномерно захватывает внутренние области пористого тела. При высокой же температуре реагент вступает во взаимодействие с материалом при первых соударениях, его концентрация резко падает с продвижением вглубь и в реакции участвует лишь его поверхностный слой.
Взаимодействие графита с кислородом осуществляется с участием одновременно трех гомогенных и гетерогенных реакций:
С + O2 → СО2;
С + O2 → 2СО; (23.86)
2СО + О2 → 2СО2.
Поэтому для расчета кинетических параметров каждой из реакций (23.86) результаты экспериментов по исследованию коррозии графита должны включать не только данные по скорости массоотдачи образца, но и состав газовой смеси на выходе из химического реактора. Это позволит оценить вклады первых двух реакций в наблюдаемый процесс коррозии. Окисление графита возможно еще за счет реакции
С + СО2 → 2СО, |
(23.87) |
однако вклад этой реакции, как правило, очень мал, так как она идет со значительно меньшей скоростью, чем предыдущие. Взаимодействие графита с другой наиболее вероятной примесью в инертном теплоносителе − водородом:
631
С + 2Н2 → СН4 |
(23.88) |
заметно активируется при температурах, не реализуемых в современных реакторах. Из этого, однако, не следует, что водород не играет заметной роли в процессах коррозии. Будучи продуктом окисления графита парами воды, он ингибирует эту реакцию. То же относится и к некоторым другим соединениям, являющимся реагентами реакций коррозии. Это обстоятельство позволило выработать рекомендации по созданию «ингибированного» теплоносителя для использования в реакторе AGR (Великобритания), в котором в основном газе (СО2) содержались примеси оксида графита, металла, воды и водорода.
При исследовании кинетики коррозии реакторного графита используется ограниченный круг эспериментальных методик, описанных ниже.
Термогравиметрия. Исследуется скорость потери массы образца, подвешенного к коромыслу чувствительных весов. При этом образец находится в муфеле, позволяющем поддерживать постоянной его температуру и температуру омывающей его газовой среды, содержащей реакционноспособную примесь. В варианте методики исследуется изменение скорости массоотдачи образца при линейном по времени изменении температуры в рабочей зоне муфеля. Входными расчетными параметрами при обработке результатов эксперимента являются температура, концентрация реагента, расход газовой смеси, скорость массоотдачи, геометрические размеры образца и муфеля.
Хроматография. Исследуется состав газовой смеси на входе и выходе химического реактора с помещенным в него образцом. Контролируемыми параметрами являются температура в реакторе, расход газовой смеси, концентрация в ней реагента и продуктов реакции. Крайне желательно одновременное использование двух перечисленных методик.
Порометрия. Исследуется удельная поверхность, пористость, спектр распределения пор по размерам и изменение указанных параметров по сечению образца, претерпевшего коррозионный отжиг в контролируемых условиях. Для этого используются методы ртутной порометрии, низкотемпературной адсорбции газов, рентгенов-
632
ская томография. Возможно также применение метода электронной микроскопии (сканирующий режим) с последующим компьютерным анализом изображений.
Применяются также методики непосредственного наблюдения в электронном микроскопе процесса травления в тлеющем разряде монокристалла графита, что позволяет, в частности, установить разницу реакций на поверхностях (1120) и (1010) кристалла.
В заключение остановимся на влиянии внутриреакторного облучения на степень коррозионной стойкости графита. В проведенных исследованиях обнаружено, что при достижении флюенса облучения графита марки Б-15 значения, соответствующего максимальной объемной усадке материала, температурный порог реакции взаимодействия углерода графита с водяным паром снижается на 200−250 °С по сравнению с необлученным материалом. При этом реакция в интервале 540−1000 °С идет со значительно (вплоть до трех порядков величины) более высокими скоростями, чем в случае необлученного графита.
Обычный реакторный графит, облучаемый примерно при 500−700 °С, достигает максимальной усадки в диапазоне флюенсов (1,0−1,5) 1026 м−2. Несколько ранее набора указанного флюенса наряду с процессами частичного закрытия микропор из-за роста кристаллитов в направлении оси с начинается растрескивание границ областей с различным преимущественным направлением укладки монокристаллов. В первую очередь растрескиваются границы микрообластей, принадлежащих зернам наполнителя и связующего, сформированных из монокристаллов с сильно различающимися размерами кристаллитов. С ростом флюенса этот процесс захватывает границы микрообластей внутри отдельных зерен. Это приводит к росту открытой в макропоры относительной поверхности кристаллитов, перпендикулярной базовым плоскостям. Известно, что реакционная активность монокристалла на этих гранях по меньшей мере в 20 раз выше, чем на базовой поверхности. Отсюда понятен рост скорости коррозии по мере роста степени нарушения исходной структуры при облучении.
633
23.6.5. Влияние облучения на свойства конструкционного графита
Радиационные дефекты в графите
Для того чтобы получить лучшее представление о механизме изменения свойств конструкционного графита под облучением, целесообразно сначала рассмотреть особенности образования и поведения дефектов в монокристалле графита.
Особенностью графита по сравнению со многими другими материалами является пространственное разделение дефектов разного типа: вакансии образуются и накапливаются в гексагональных слоях, внедренные атомы − в межслоевом пространстве. Это затрудняет аннигиляцию дефектов и определяет многие особенности его поведения под облучением и, в частности, необратимую деградацию структуры при больших флюенсах нейтронов.
Согласно экспериментальным данным образующиеся в результате облучения внедренные атомы весьма под вижны (энергия активации миграции около 0,1 эВ) и уже при температуре существенно ниже комнатной образуют небольшие скопления, состоящие из двух−трех атомов (псевдомолекулы). Существует точка зрения, что псевдомолекулы из трех атомов уже достаточно устойчивы; энергия активации их миграции составляет около 1 эВ. Эти образования существуют до температуры порядка 200 °С. При дальнейшем повышении температуры происходит коалесценция мелких скоплений с образованием сначала более крупных скоплений, а затем дислокационных петель, размер которых увеличивается с увеличением температуры.
На рис. 23.299 показаны возможные конфигурации скоплений внедренных атомов. В отличие от металлов искажения кристаллической решетки, вызываемые внедренными атомами, не уменьшаются при образовании скоплений, а вначале увеличиваются и только по достижении некоторого количества атомов в комплексе искажения начинают монотонно уменьшаться при дальнейшем увеличении числа атомов в комплексе. Это положение иллюстрирует рис. 23.300, где приведен график изменения вклада внедренных атомов в расши-
634
рении параметра решетки графита в зависимости от числа атомов в комплексе. В соответствии с данными, приведенными на рис. 23.300, максимальные искажения кристаллической решетки вызывают комплексы, в которые входит 6 внедренных атомов.
Рис. 23.299. Проекция атомов углерода на плоскость базиса. Помечены плоскости типа А и В, стрелками выделена элементарная ячейка, показаны несколько типов комплексов из межузельных атомов
Полагают, что до темпера- |
|
|||
туры 500−600 °С вакансии ма- |
|
|||
ло подвижны (энергия актива- |
|
|||
ции миграции около 3 эВ) и |
|
|||
сохраняются в виде одиночных |
|
|||
дефектов или небольших скоп- |
|
|||
лений. При более высокой |
|
|||
температуре |
начинается |
ми- |
|
|
грация вакансий и образование |
|
|||
их скоплений и дислокацион- |
|
|||
ных петель вакансионного ти- |
Рис. 23.300. Зависимость вклада |
|||
па. Диффузия вакансий проис- |
||||
межузельных атомов в расширение |
||||
ходит в базисной плоскости, и |
||||
решетки графита по оси с от числа |
||||
часть их выходит на боковую |
||||
атомов в комплексе |
||||
поверхность |
кристалла, |
так |
|
|
|
|
|
635 |
|
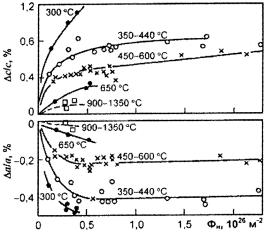
что, по-видимому, в кристалле графита создается избыток внедренных атомов в виде экстраплоскостей.
Накопление радиационных дефектов вызывает изменение физи- ко-механических свойств графита. Эти изменения весьма существенны и в конечном итоге приводят к деградации свойств графита как консфукционного материала.
Кристаллическая структура. Изменение кристаллической структуры графита при облучении проявляется в увеличении размера элементарной ячейки вдоль кристаллографической оси а и сокращении вдоль оси с; уменьшении размеров кристаллитов; снижении степени упорядоченности. Изменения тем больше, чем ниже температура облучения. Скорость изменения наибольшая в начальной стадии облучения, затем постепенно уменьшается и наступает насыщение, при этом предельный уровень ее понижается с повышением температуры. Например, изменения параметров решетки в зависимости от флюенса для реакторного графита показан на рис. 23.301.
Рис. 23.301. Зависимость относительного изменения параметров кристаллической решетки с и а от флюенса при различной температуре
В том же интервале флюенса, в котором происходят основные изменения параметра кристаллической решетки, происходит и изменение размеров кристаллитов, при этом уменьшение размеров может достигать до 50−100 % в зависимости от температуры облучения.
636
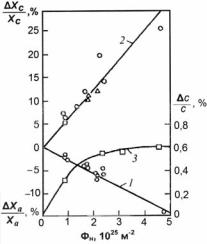
Изменение линейных размеров. На первый взгляд, казалось бы, что должна быть прямая связь между изменением размеров кристаллическои ячейки и макроскопическими размерами. Однако такая прямая связь существует только при низких температурах облучения, когда образующиеся комплексы малоподвижны и не происходит их укрупнение. В области температур, представляющих практический интерес (выше 300 °С), кинетика изменения линейных размеров монокристаллов грфафита (или совершенного пирографита) вовсе не соответствует кинетике изменения размеров кристаллической ячейки.
|
В отличие от изменения раз- |
||
|
меров |
кристаллической |
ячейки, |
|
которое относительно быстро (в |
||
|
зависимости от температуры) |
||
|
достигает насыщения, наблюда- |
||
|
ется монотонный рост линейных |
||
|
размеров кристаллов до высоких |
||
|
флюенсов, при этом изменения |
||
|
могут достигать десятков про- |
||
|
центов, в то время как измене- |
||
|
ние параметра кристаллической |
||
|
решетки может достигать всего |
||
|
доли процента (рис. 23.302). |
||
|
Такое резкое различие в из- |
||
|
менении размеров кристалличе- |
||
Рис. 23.302. Изменение линейных |
ской ячейки и макроскопиче- |
||
размеров (Ха и Xс) и параметра |
ских линейных размеров обу- |
||
решетки с образца пирографита |
словлено тем, что в области |
||
при температуре облучения |
температуры, где может проис- |
||
900−1000 °С: |
ходить рост скоплений, |
образу- |
|
1 − Ха/Xа; 2 − Хс/Xс; 3 − с/с |
ются |
дислокационные |
петли, |
|
|||
которые, сливаясь, могут образовывать достаточно большие экстраплоскости. Последние и обусловливают постоянный рост кристалла в направлении оси с. Изменение параметра решетки при этом вызывается только областью краевой дислокации, охватывающей экстраплоскость. Так как суммарная длина дислокацион-
637
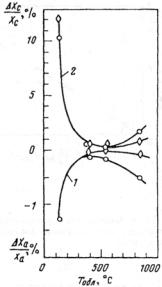
ных петель в результате их коалесценции достигает насыщения, то достигает насыщения и изменение параметра кристаллической решетки.
Конечно, постоянный рост кристалла в направлении оси с за счет внедренных дислокационных петель должен был бы компенсироваться сжатием, обусловленным захлопывающимися вакансионными дисками. Но экспериментальные результаты показывают, что количество вакансий, находящихся в петлях, меньше, чем количество внедренных атомов (из-за выхода части вакансий на боковые поверхности кристалла). Таким образом, коменсация оказывается лишь частичной.
Количество вышедших из кристалла вакансий увеличивается с увеличением подвижности последних или с уменьшением длины их диффузии. Это согласуется с экспериментальными результатами исследования влияния на радиационный рост температуры и размеров кристаллов, представленными на рис. 23.303. В этих экспериментах были использованы образцы с различной температурой обработки, различающиеся размерами кристаллитов в несколько
раз. Нетрудно видеть, что, начиная с температуры 500 °С, когда вакансии становятся подвижными, происходит разделение кривых для пирографитов с различными размерами зерна.
Рис. 23.303. Зависимость линейных размеров образцов пирографита различной степени совершенства вдоль осей с и а от температуры облучения:
1 − Ха/Xа; 2 − Хс/Xс;
− совершенный графит (Тобр = 2700 °С);
| − несовершенный графит (Тобр = 2100 °С);
Фн = 4 1024 м−2;
Скорость радиационной деформации пирографита с меньшим размером кристаллов оказывается выше. Аналогичный эффект об-
638
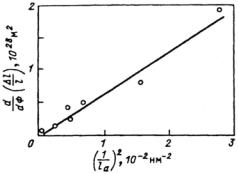
наруживается и для поликристаллического материала. На рис. 23.204 показана зависимость скорости изменения размеров поликристаллического графита от размера кристаллитов. Видно, что скорость изменения обратно пропорциональна квадрату размеров кристаллитов.
Подводя итог сказанному, можно сделать заключение, что в области температур практического использования графита (выше 400−500 °С) под облучением происходит изменение линейных размеров с практически постоянной скоростью, которая увеличивается с ростом температуры и уменьшением размеров кристаллитов.
Рис. 23.304. Зависимость скорости усадки графита, обработанного при различной температуре, от размера кристаллитов
Характер изменения макроскопических линейных размеров поликристаллического реакторного графита носит существенно более сложный характер, чем изменение размеров монокристалла или ориентированного пирографита, что связано с особенностями его структуры, позволяющими частично аккомодировать объемные изменения кристаллов.
На рис. 23.305 представлены типичные кривые изменения линейных размеров конструкционного реакторного графита ГР-280 в зависимости от флюенса для различных температур облучения. Можно видеть, что вначале происходит уменьшение линейных размеров графита в направлениях как перпендикулярном, так и параллельном оси формования, т.е. осуществляется объемная усадка, что, вообще говоря, противоречит данным изменениям размеров монокристалла. Это происходит потому, что часть радиационного изменения линейных размеров аккомодируется специфически ориентированной пористостью так же, как и при тепловом расшире-
639
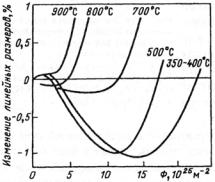
нии. Постепенно эта ориентированная пористость заполняется и усадка переходит в распухание, которое продолжается до весьма больших флюенсов и может достигать десятков процентов. Это распухание, получившее в отечественной литературе название вторичного распухания, сопровождается глубокими необратимыми структурными изменениями и изменениями свойств, которые в конечном итоге приводят к ухудшению характеристик графита как конструкционного материала.
Рис. 23.305. Кривые изменения линейных размеров графита в зависимости от флюенса для различных температур облучения
Изменения структуры и свойств, приводящие к деградации материала, связаны главным образом с силовым взаимодействием испытывающих радиационный рост кристаллитов, приводящим к «внутреннему» разрушению материала.
Флюенс, при котором происходит переход графита от усадки к распуханию, уменьшается с увеличением температуры. Качественно это можно объяснить тем, что при повышении температуры часть аккомодационного объема заполняется за счет теплового расширения кристаллов, так как часто доля аккомодационного объема, заполняемая за счет радиационных деформаций, с повышением температуры уменьшается. При этом, соответственно, уменьшается и максимальная величина усадки.
Изменение физических свойств
Теплоемкость. Из общих соображений можно предположить, что вследствие увеличения неупорядоченности кристаллической
640

структуры графита под облучением его теплоемкость должна увеличиваться. Действительно, облучение вызывает некоторое увеличение теплоемкости, в особенности при низкой температуре (до 200 °С). Это увеличение может составлять несколько процентов. Однако в области температур практического использования (выше 300 °С) увеличение теплоемкости незначительно и обычно не принимается во внимание. При постепенном нагреве графита, облученного при низкой температуре, можно обнаружить явление, выражающееся как бы в резком уменьшении теплоемкости (она может стать даже отрицательной). Это уменьшение кажущееся и обусловлено выделением так называемой запасенной энергии (энергия Вигнера)1.
Запасенная энергия. Деформации кристаллической решетки, вызванные радиационными дефектами, повышают ее внутреннюю энергию. При определенных условиях эта запасенная энергия может выделяться, приводя к разогреву графита. При облучении в области низких температур (до 150−200 °С) запасенная энергия может быть весьма большой и достигать 2,1−2,9 МДж/кг. Быстрое выделение такой энергии может привести к саморазогреву графита до температуры, превышающей 1500 °С, и вызвать тяжелые последствия. Например, в Уиндскейле в 1957 г. неконтролируемое выделение запасенной энергии привело к пожару в атомном реакторе.
Выделение запасенной энергии происходит при нагреве облученного графита до температуры, несколько превышающей температуру облучения. Для графита, облученного при низкой температуре, существует несколько температурных уровней выделения запасенной энергии. Наиболее интенсивное выделение энергии происходит при температуре 180−200 °С, затем уже значительно меньшая энергия выделяется при 380−410 °С и около 700 °С.
Кинетика накопления запасенной энергии описывается уравнением
Е = Е∞[1 − ехр(−K0ϕτ)], |
(23.89) |
где Е∞ − максимальная запасенная энергия, зависящая от температуры; ϕ − плотность потока быстрых нейтронов; τ − время облучения; K0 − постоянная.
1 Физическое материаловедение. Т. 5. − М.: МИФИ, 2008. П. 22.1.5.
641

Насыщение в накоплении запасенной энергии наступает обычно при флюенсе (2−3) 1025 м−2. Накопление запасенной энергии быстро уменьшается с ростом температуры. Характер температурной зависимости накопления запасенной энергии показан на рис. 23.306, где представлены значения запасенной энергии, отнесенные к флюенсу 1024 м−2.
Теплопроводность. В результате об-
лучения теплопроводность графита падает, при этом кинетика изменения теплопроводности в начальный период облучения аналогична кинетике накопле-
ния запасенной энергии: быстрое падение теплопроводности в начальный период с последующим достижением насыщения. Уровень насыщения зависит от температуры: чем выше температура, тем меньше относительное уменьшение теплопроводности. Зависимость относительного изменения теплопроводности от температуры облучения для состояния насыщения представлена на рис. 23.307. Состояние насыщения продолжается до тех пор, пока не начнется вторичное распухание, обозначающее начало внутреннего разрушения графита. С этого момента начинается второй этап не-
прерывного падения теплопроводности.
Рис. 23.307. Влияние температуры на относительное изменение термического сопротивления реакторного графита.
Флюенс быстрых нейтронов от 2 1024 м−2 до 13 1024 м−2
Электрическая проводимость. Хотя соотношение между элек-
тро- и теплопроводностью графита при изменении под действием
642
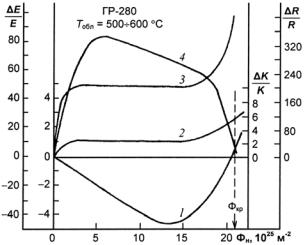
облучения не сохраняется вследствие различия механизма переноса в этих процессах, но кинетика изменения электропроводности подобна кинетике изменения теплопроводности и характеризуется стадиями начального падения, состояния насыщения и вторичного падения, связанного с деградацией структуры. Типичная кривая изменения электросопротивления графита ГР-280 в процессе облучения при наиболее характерной для конструкционного графита температуре 500−600 °С приведена на рис. 23.308, где совмещены также кривые изменения теплосопротивления, модуля упругости и изменения объема.
Рис. 23.308. Зависимость относительного изменения линейных размеров и физических свойств графита от флюенса:
1 − изменение объема V/V; 2 − тепловое сопротивление K/K (отн. ед.); 3 − электросопротивление R/R; 4 − модуль упругости Е/Е
Коэффициент теплового расширения. Изменение коэффици-
ента теплового расширения имеет такие же тенденции роста и последующего падения по достижении флюенса, соответствующего вторичному распуханию. При облучении в области температур практического использования графита в энергетических реакторах 300−600 °С рост коэффициента теплового расширения происходит
643
на 20 30 % при флюенсе нейтронов (1,5 2) 1026 м 2 с последующим плавным падением.
Имеются различия в поведении графита различных марок. Так, для традиционных реакторных графитов (ГР-280) рост коэффициента теплового расширения продолжается вплоть до 2 1026 м 2, в то время как для более плотных и обладающих в исходном состоянии более высоким коэффициентом теплового расширения пропитанных графитов падение коэффициента теплового расширения начинается значительно раньше. Это различие становится понятным с позиций рассмотренного выше представления об аккомодационном объеме.
Изменение механических свойств
Прочностные характеристики. При обсуждении свойств не-
облученного графита уже говорилось, что для него характерно наличие корреляции между модулем упругости и прочностью. Эта корреляция сохраняется и после облучения. Поэтому изменения упругих и прочностных свойств под действием облучения рассмотрим совместно.
Как уже отмечалось выше, графит является квазиупругим материалом, в котором значительная часть упругой деформации представляет собой, по существу, обратимую пластическую деформацию. Облучение, вызывая возникновение в кристалле скоплений дефектов, являющихся эффективными стопорами дислокаций, существенно увеличивает модуль упругости и соответственно прочность материала.
При низких температурах облучения (80 100 °С) прочность и модуль упругости увеличиваются в 2 3 раза. Это увеличение происходит в начальный период облучения, после чего достигается насыщение. Так же как и для других свойств, уровень насыщения зависит от температуры, снижаясь с увеличением последней, но даже при температуре 900 °С увеличение прочности составляет 20 30 %. Соотношение между модулем упругости и прочностью не во всем диапазоне температур одинаково. В общем случае действует соотношение
644

σобл/σисх = (Еобл/Еисх)n, |
(23.90) |
где п = 1 при температуре облучения ниже 300 °С и п = 1/2 при температуре облучения выше 400 °С. Изменения прочности и модуля упругости для различных сортов графита существенно различаются (табл. 23.123).
Так же как и для других свойств графита, прочность и модуль упругости падают после достижения флюенса, соответствующего началу вторичного распухания (см. рис. 23.308).
Таблица 23.123
Изменение модуля упругости и прочности реакторного графита под облучением
Марка графита |
Продольное направление |
Поперечное направление |
|||
|
|
|
|
||
σсж, МПа |
Е, ГПа |
σсж, МПа |
Е, ГПа |
||
|
|||||
ГР-280 |
34/42 |
6,5/10 |
24/30 |
5,0/7,5 |
|
ГРП2-125 |
59,2/75 |
12,0/18 |
59,9/74 |
8,5/13 |
|
МПГ-6 |
100/125 |
10,5/16 |
100/125 |
10,5/16 |
|
ГР-1 |
70/88 |
11/16 |
84/105 |
12/18 |
|
AXF-5Q (POCO) |
150/170 |
14/20 |
150/170 |
14/20 |
|
|
|
|
|
|
|
Примечание. В числителе приведены значения для необлученных образцов, в знаменателе − для облученных при температуре 800−1000 °С до флюенса нейтронов, соответствующего начальному участку стабилизации радиационного прироста прочностных характеристик.
Радиационная ползучесть. Облучение резко стимулирует процесс ползучести графита, которая в типичных реакторных условиях становится ощутимой уже при комнатной температуре. Радиационная ползучесть, т.е. ползучесть, стимулированная облучением, обычно описывается простым уравнением, в котором линейно связаны деформация ε, интенсивность потока быстрых нейтронов ϕ, напряжение σ и время τ:
ε = Kσϕτ, |
(23.91) |
645
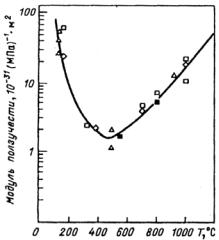
где K − коэффициент, зависящий от температуры, называемый ко-
эффициентом (модулем) радиационной ползучести.
Коэффициент радиационной ползучести имеет сложную зависимость от температуры, характеризуемую минимумом в области 400−500 °С (рис. 23.309), что совпадает с минимумом на кривой зависимости скорости радиационного роста от температуры.
Рис 23.309. Зависимость изменения коэффициента (модуля)
радиационной ползучести графита от температуры
Механизм деградации и критерии работоспособности графита
Как следует из рассмотренного, область вторичного распухания характеризуется ухудшением всех физико-механических свойств графита, определяющих его эксплуатационную надежность, т.е. происходит постепенная деградация структуры и свойств графита.
Механизм деградации обусловлен силовым взаимодействием элементов структуры поликристаллического материала, происходящим на разных структурных уровнях. Взаимодействие на уровне отдельных кристаллитов связано с зависимостью скорости их роста от размеров. Так как реальные графитовые материалы обладают широким распределением кристаллитов по размерам, то в соседстве друг с другом могут оказаться кристаллиты с сильно различающимися размерами, в результате чего на границе между ними воз-
646
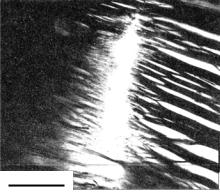
никают значительные несовместимые деформации, которые приводят к растрескиванию.
Аналогичное взаимодействие может возникнуть между группами кристаллитов, как имеющими различные размеры (например, наполнитель и связующее, которое, как правило, более мелкозернистое, чем наполнитель), так и различным образом ориентированные. В последнем случае силовое взаимодействие возникает вследствие резкой анизотропии роста кристаллитов.
Взаимодействие усиливается по мере роста кристаллитов и заполнения аккомодационного объема, и, наконец, в области вторичного распухания растрескивание становится настолько интенсивным, что начинается массовое растрескивание на различных структурных уровнях, приводящее к деградации свойств. Как следует из рис. 23.308, интенсификация вторичного распухания и деградации наиболее важных свойств графита (прочности и теплопроводности) происходят в одной и той же области флюенса. Поэтому в качестве критерия работоспособности графита был предложен флюенс, при котором объем графита после усадки приходит в исходное состояние. Этот флюенс был назван критическим флюенсом.
Для иллюстрации изменений, происходящих в структуре графита, на рис. 23.310 представлен электронно-микроскопический снимок реакторного графита после облучения до флюенса, близкого к критическому, на котором наглядно виден характер внутреннего разрушения структуры графита.
Рис. 23.310. Трансмиссионная электронная микроскопия реакторного графита
после облучения:
Фн = 5 1025 м−2, Тобл = 900 °С
1 мкм
647
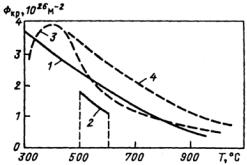
Существуют и другие подходы к оценке предела работоспособности графита, например по падению прочности, при котором устанавливается определенный допустимый уровень прочности по допустимому значению радиационной деформации. Однако во всех случаях предельные значения флюенса не будут слишком сильно отличаться от критического, так как процесс вторичного распухания и деградации свойств после его достижения развиваются очень быстро.
Как можно видеть из рис. 23.305, переход от усадки к распуханию с увеличением температуры смещается в сторону меньших флюенсов.
На рис. 23.311 представлена зависимость критического флюенса от температуры, построенная по результатам многочисленных исследований реакторных графитов, полученных по традиционной технологии и из традиционного сырья, из которой следует, что в области, характерной для использования графита в ядерных энергетических установках (400−1200 °С), критический флюенс изменяется почти в 5 раз. К таким традиционным графитам, выпускаемым отечественной промышленностью, относятся графит марки ГР-280 и различные его модификации (ГРП2-125, ГРП1-280).
Рис. 23.311. Зависимость критического флюенса от температуры:
1 − для традиционного реакторного графита (ГР-280); 2 − в условиях облучения (за 30 лет) блоков кладки РБМК-1000; 3 − в типичных условиях облучения отражателя высокотемпературного реактора с газовым охлаждением (выходная температура теплоносителя 950 °С); 4 − для радиационно-стойкого графита на основе непрокаленного кокса
648
Характеристики этих марок графита позволяют их использовать в реакторах канального типа РБМК-1000 в течение 30 и более лет. Вместе с тем очевидно, что этот тип графита не может полностью удовлетворять требованиям использования в высокотемпературных реакторах.
23.6.6. Применение графита в ЯЭУ и ТЯР
Как было показано выше, графит подвержен довольно сильному радиационному повреждению при облучении нейтронами, и изменение его физико-механических свойств весьма сложным образом зависит от температуры и флюенса. Это обстоятельство ограничивает диапазон использования графита в атомной технике. Тем не менее, именно графит дает наиболее простой путь применения атомной энергии в области технологии, например, для производства высокопотенциального тепла в химической и металлургической промышленности. В настоящее время наиболее широко он используется в качестве материала блоков замедлителя и отражателя уран-графитовых реакторов канального типа, а в будущем − в качестве блоков отражателя высокотемпературных газоохлаждаемых реакторов и оболочек твэлов и ТВС этих реакторов. Существуют перспективы использования графита (и других углеродных материалов) как конструкционного материала термоядерных установок, например, в качестве конструктивных элементов дивертора. Это делает целесообразными усилия по совершенствованию графита, повышению его радиационной стойкости, и здесь, как показывают исследования последних лет, существуют определенные резервы. Графит и другие углеродные материалы используются не только в ядерной технике, но и получают все большее распространение в других областях техники, и прежде всего там, где требуется высокая прочность при высоких температурах, термопрочность, высокая теплопроводность, т.е. в наиболее передовых технологиях, в частности аэрокосмической.
Графит для высокотемпературного использования. Темпера-
турные режимы работы графита в высокотемпературных реакторах охватывают широкий диапазон значений от 300 °С (верхний отра-
649
жатель) до 1200 °С (оболочка твэлов) и флюенсов от 2 1025 до 4 1026 м−2. При этом в некоторых точках отражателя могут совпадать высокие температуры и относительно высокие флюенсы. Типичные температурные режимы отражателя газоохлаждаемого реактора с температурой газа на выходе 950 °С совмещены с зависимостью критического флюенса от температуры на рис. 23.311. Нетрудно видеть, что температурные режимы отражателя в значительной мере выходят за область, ограниченную кривой критического флюенса для традиционных графитов.
К сожалению, как в отечественной, так и зарубежной практике пока еще не создано промышленных технологий, которые позволяли бы получать графит, полностью удовлетворяющий отмеченным требованиям. Поэтому можно говорить лишь о принципах создания новых типов графита и об опытных технологиях, которые бы демонстрировали достигнутые результаты.
Тем не менее на основе изложенных сведений можно представить основные направления разработки графита повышенной радиационной стойкости.
Одним из условий является однородность структуры. Оптимальным является отсутствие связующего, которое вносит значительную долю мелкокристаллической фракции. Зерна наполнителя также желательно иметь с максимально узким распределением кристаллитов по размерам. Вместе с тем для повышения прочности и изотропности графит должен быть мелкозернистым и частицы кокса максимально изометричными.
В наибольшей степени приближаются к этим требованиям материалы на основе непрокаленного кокса, мелкозернистые, высокопрочные и более изотропные, чем традиционные реакторные графиты. Особенность такого графита заключается в том, что поверхность частиц непрокаленного кокса сохраняет высокую способность к спеканию и обеспечивает высокую прочность границ при минимальном количестве связующего.
Из отечественных материалов к таким можно отнести графит МПГ-6, применяемый в электронной промышленности, и графит ГР-1, разработанный применительно к высокотемпературным реакторам. Будучи более плотным и обладая поэтому меньшим аккомо-
650
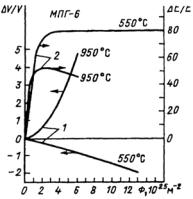
дационным объемом, графит МПГ-6 при высоких температурах быстрее переходит в стадию распухания, чем традиционный реакторный графит, но при этом не теряет прочность так быстро, как обычный реакторный графит (рис. 23.312), и, таким образом, сохраняет работоспособность, несмотря на высокую скорость распухания.
Графит ГР-1 является промежуточным вариантом между графитом на непрокаленном коксе и традиционным реакторным графитом, так как наполнитель на основе непрокаленного кокса используется в обычном традиционном технологическом процессе. Этот графит также обеспечивает повышенную радиационную стойкость.
На рис. 23.311 нанесена кривая, описывающая критический флю-
енс графита ГР-1, сравнение кото- |
Рис. 23.312. Изменение линейных |
|
рой с положением кривой для ус- |
размеров (объема) (1) |
|
ловий работы грфафита в высоко- |
и модуля упругости (2) графита |
|
МПГ-6 при двух температурах |
||
температурном реакторе показы- |
||
облучения |
вает, что этот графит может обеспечить работоспособность отражателя.
Альтернативным направлением разработки радиационно стойких материалов для высокотемпературных реакторов является технология связывания графита пироуглеродом (ГСП). Этот тип материала также обеспечивает высокую радиационную стойкость.
Для сравнения в табл. 23.124 приведены данные о свойствах отечественных и некоторых зарубежных конструкционных графитов, которые демонстрируют преимущества высокопрочных изотропных графитов.
В термоядерных реакторах будущего, включая создаваемый ИТЭР, в качестве тугоплавкого и термостойкого экранного материала дивертора (и первой стенки) планируется использовать графитовые материалы. Отбор необходимых сортов графита прово-
651

дится на основе требований, предъявляемых к экранным материалам первой стенки и дивертора. Такой материал должен иметь высокое сопротивление радиационной эрозии (проявлять минимальное загрязнение плазмы), сублимации (испарению) при перегреве поверхности (например, в условиях срыва плазмы), термоудару и термоциклированию, радиационному формоизменению (распуха-
нию, усадке, ползучести и охрупчиванию), быть совместимым с изотопами водорода, иметь минимальные наведенную радиоактивность и изменение изотопного состава, приемлемые технологичность и стоимость, минимальную токсичность, обеспечивать надежное соединение с теплоотводящими материалами.
Таблица 23.124
Физико-механические и теплофизические свойства блочных графитов
Материал |
Плот- |
Динами- |
Предел |
Предел |
Тепло- |
Коэффи- |
Крити- |
|
ность |
ческий |
прочно- |
прочно- |
провод- |
циент |
ческий |
|
ρ, кг/м3 |
модуль |
сти на |
сти на |
ность λ, |
теплового |
флю- |
|
|
упруго- |
сжатие |
растяже- |
Вт/(м К) |
расшире- |
енс |
|
|
сти Един, |
σсж, МПа |
ние |
|
ния αt, |
Фкр, |
|
|
104 МПа |
|
σв, МПа |
|
10−6 K−1 |
1026 м−2 |
|
|
|
|
|
|
(при |
(при |
|
1710 |
|
|
|
|
400 °С) |
600°С) |
ГР-280 |
0,65/0,50 |
34/24 |
7,6/6,0 |
103/89 |
3,2/4,9 |
2 |
|
ГРП2-125 |
1850 |
1,20/0,85 |
59/59 |
15,0/8,0 |
160/100 |
3,9/5,2 |
2 |
ГРП2-280 |
1800 |
1,0/0,9 |
50/45 |
10/8 |
130/100 |
3,9/5,2 |
2 |
МПГ-6 |
1780 |
1,05/1,05 |
100/100 |
31,0/33 |
108/125 |
7,3/6,6 |
> 2,5 |
ГР-1 |
1740 |
1,05−1,1 |
70 |
13−15 |
65−86 |
6,8/6,7 |
> 2,5 |
|
|
1,1−1,3 |
60−84 |
15−18 |
83−90 |
|
|
ГСП |
1710 |
1,21 |
114 |
− |
62 |
5,2 |
− |
(40%РуС) |
|
|
|
|
|
|
|
PX2AN |
1800 |
0,9 |
80/82 |
25/23 |
134 |
5,2/5,6 |
3,5 |
ATR-2E |
1755 |
1,04/9,0 |
58,9/57,5 |
13,5/11,2 |
117/107 |
4,9/5,3 |
3,5 |
PGA |
1750 |
1,12/0,51 |
31/31 |
10/6 |
− |
− |
− |
АGОТ |
1720 |
− |
422/42 |
10/− |
− |
2,2/3,8 |
− |
Примечание. В числителе − значение свойства в направлении, параллельном оси формирования графитового блока; в знаменателе − в перпендикулярном.
652
Графиты и материалы на основе графитов являются перспективными с точки зрения сформулированных выше требований. Выбор графитов проводился последовательно, начиная с анализа свойств реакторных графитов и квазиизотропных мелкозернистых графитов.
Мелкозернистые (квазиизотропные) графиты. В орбиту ана-
лиза попали российские графиты марок МПГ-6, МПГ-8, МИГ, ПГИ, ГСП и др., которые имеют ряд положительных свойств, включая высокую теплопроводность (λ = 130/97 Вт/м К), низкие плотность (ρ = 1800 кг/м3) и коэффициент термического расширения (α = 4,5/5,5 10−6 К−1), а также западные графиты POCO-AXF- 5Q, ЕК-98, IG-430, ISO-630, PD-330S (λ = 80 Вт/м К, ρ = 1860
кг/м3). Однако эти графиты имеют недостатки, включая высокие коэффициенты химического распыления (S = 0,12 ат./ион D+ с энергией 300 эВ при 600 °C) и эрозии при срывах плазмы (при энерговыделении 5 МДж/м2 S = 0,3 мкг/j cм2), склонны к радиаци- онно-усиленной сублимации (РУС) при T > 1200 К, в процессе осаждения после распыления захватывают изотопы водорода (тритий), имеют высокотемпературное окисление и ухудшение те-
плопроводности при нейтронном облучении Δλ/λ = (27−74) %. При температуре облучения выше 1000 °C происходит вторич-
ное распухание (0,1−0,5) %. Для устранения перечисленных недостатков проводили легирование графита бором, кремнием и титаном, наносили покрытия из вольфрама, бора, кремния и титана, разработали композиты. Таким образом, был создан новый вид графитов, а именно: легированные рекристаллизованные графиты и композиты.
Легированные рекристаллизованные графиты. При анализе легированных рекристаллизованных графиов выявлены сорта с высокой теплопроводностью: РГТ-91 (<7,5% Ti) с λmax = 600 Вт/м К;
РГТ-91 (7,5% Ti + 0,1% B) с λmax =350 Вт/м К; РГТ-91 (7,5% Ti + + 0,2−0,75% B) с λmax = 230−280 Вт/м К; S2508 (3,5% B) с λ = 100 Вт/м К; Gb120 (20% B) с λ=40 Вт/м К и УСБ-15 (15% B +
+ SiC) с λ = 20 Вт/м К. Этот класс графитов прошел испытания в качестве лимитера термоядерной установки TEXTOR, которые по-
653
казали, что у графита РГТ-91 отсутствует химическое распыление и РУС до 2000 °С. Эти материалы слабо проницаемы для изотопов водорода (особенно УСБ-15), так как бор замедляет диффузию, если замещает углерод в решетке. Распухание при флюенсе нейтронов 1026 м−2 было не более 0,7 %, причем отсутствует вторичное распухание, распыление (S < 0,1 ат./ион D+ с энергией 300 эВ при 500 °С) ниже распыления нелегированных графитов. При облучении происходит снижение теплопроводности, модуля Юнга до 30−75 % (лучший РГТ-90). Эрозия РГТ-91 при срывах плазмы с удельным энерговыделением 30 МДж/м2 S ≈ 0,12 мкг/j cм2. Покрытия на РГТ сильно эродировали при срывах плазмы с коэффициентом до S ≈ 0,88 мкг/j cм2 (для графита марки УСБ-15
S ≈ 0,23 мкг/j cм2).
С/C-композиты. Исходные С/С-композиты характеризуются высокими коэффициентами захвата трития, химическим распылением и радиационно-стимулированной сублимацией при высоких температурах, радиационным формоизменением, имеются проблемы по соединению с медными сплавами и другие недостатки. Анализ этих недостатков приводит к необходимости искать пути их минимизации или вести поиск и разработку новых материалов, свойства которых должны удовлетворять весьма жестким требованиям к материалам первой стенки ТЯР. В частности, легирование C/С-композитов осуществляют пропиткой (Si, Ti, B). В результате пропитки (например, Si→SiC) улучшается термомеханическое поведение, снижается пористость и удержание трития, возрастает сопротивление окислению и снижается химическое распыление. Лучшие сорта российских С/С-композитов типа УАМ-92 имеют следующие свойства:
УАМ-92-5D λ20°C = 425 Вт/м К, α ≈ (0,54÷0,8) 10-6 1/К, σсж = (105÷150) МПа, ρ = (1,90÷1,93) 103 кг/м3;
УАМ-92-5D, легированный бором: λ = 330 Вт/м К;. УАМ-92-3D, легированный хромом: λ = 430 Вт/м К.
В табл. 23.125 приведены структура и свойства некоторых российских и зарубежных графитовых материалов. Перспективные композиты зарубежного производства, легированные бором и
654

кремнием, имеют свойства при 20 и 800 °С, представленные в табл. 23.126.
|
|
|
|
|
|
|
Таблица 23.125 |
||
|
Российские и зарубежные углеродсодержащие материалы |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
Струк- |
ρ, 103 |
λ20°С, |
α, |
Прочность на: |
|
Е, 103 |
|
Марка |
|
сжатие |
растяжение |
|
|||||
|
|
тура |
кг/м3 |
Вт/м К |
10-6 К−1 |
σсж, |
σр, |
|
МПа |
|
|
3d |
|
|
|
МПа |
МПа |
|
|
А-05 |
|
1,8 |
344 |
1,11 |
88/165 |
54/9 |
|
20 |
|
|
|
3d |
|
|
|
( / ) |
( / ) |
|
|
SEP N112 |
|
1,95 |
292 |
2,0 |
− |
57/42 |
|
28/20 |
|
|
|
3d |
|
|
|
|
|
|
|
CX 2002 |
|
1,65 |
400 |
1,9/7 |
− |
− |
|
− |
|
УАМ-92-5 |
5d |
1,91 |
390 |
~0 |
105 |
65 |
|
34 |
|
|
3d |
|
|
|
|
|
|
|
|
УАМ-92-3 |
1,93 |
360 |
~0 |
150 |
430 |
|
20 |
||
|
|
− |
|
|
|
|
|
|
|
РГТ-91 |
|
2,26 |
600 |
10/3,1 |
40/90,6 |
34,5/70 |
|
34 |
|
|
|
|
|
|
(20÷1000оС) |
( / ) |
( / ) |
|
|
|
|
|
|
Таблица 23.126 |
|
Свойства С/С-композитов западного производства |
|||||
|
|
|
|
SEP NS31 |
|
Свойства |
Темпера- |
DunlopCl |
SEP NB31 |
|
|
|
тура, °С |
z/x/y* |
z/x/y* |
z/x/y* |
|
Теплопровод- |
20 |
430/102/76 |
323/117/115 |
304/100/91 |
|
ность, Вт/м К |
800 |
198/53/37 |
154/58/55 |
145/55/48 |
|
Теплоемкость, |
20 |
693 |
720 |
760 |
|
Дж/кГ К |
800 |
1790 |
1820 |
1720 |
|
Коэффициент |
20−400 |
−1,32/0,07/3,08 |
0,4/1/2,1 |
0,4/1,7/3,3 |
|
термического |
20−700 |
−0,72/0,61/3,41 |
0,5/1,2/2,7 |
0,5/1,2/4,2 |
|
расширения, |
(1000) |
|
|
|
|
10-6 К-1 |
|
|
|
160/40/25 |
|
Предел проч- |
20 |
− |
130/30/19 |
|
|
ности, МПа |
|
|
|
0,14/0,22/0,22 |
|
Относитель- |
20 |
− |
0,14/0,3/− |
|
|
ное удлине- |
|
|
|
|
|
ние,% |
|
|
|
|
|
|
|
655 |
|
|
|

Свойства |
Темпера- |
DunlopCl |
SEP NB31 |
SEP NS31 |
|
тура, °С |
z/x/y* |
z/x/y* |
z/x/y* |
Модуль Юнга, |
20 |
− |
107/15/12 |
120/55/40 |
ГПа |
1000 |
− |
107/20/12 |
|
Плотность, |
20 |
1880 |
1880 |
2000 |
кг/м3 |
|
|
|
5 |
Пористость,% |
20 |
6,63 |
8 |
|
Технология |
− |
3d – направле- |
3d, |
3d, |
производства |
|
ния укладки |
z: пек P25 |
z: пек P25, |
|
|
волокон |
(27%), |
x: полимер- |
|
|
(x, y, z), |
x, y: полимер- |
ные волокна |
|
|
z: пек P120, |
ные волокна |
(PAN), |
|
|
x: полимерные |
(PAN), |
пропитка |
|
|
волокна |
графитизация |
10 ± 2% Si |
|
|
(PAN), |
при 2800 °C |
|
|
|
графитизация |
|
|
|
|
при 2450 °C |
|
|
* Направления измерения свойств.
С/С-композиты испытаны на формоизменение при нейтронном облучении и эрозию при срывах плазмы, прошли испытания в термоядерных установках TEXTOR, T-60, Tore Supra. При нейтронном облучении возрастают механические свойства и коэффициент термического расширения, снижается теплопроводность λ на (9−81)%. При срывах плазмы (энерговыделение 30 МДж/м2) эрозия составила от S = 0,09 мкг/Дж см2 до S = 0,13 мкг/Дж см2 (УАМ-93-3D легированный B).
Контрольные вопросы
1.Изобразите диаграмму состояния углерода. Почему в обычных условиях углерод может существовать только в твердом или газообразном состоянии?
2.Опишите кристаллическую структуру графита, покажите различия между гексагональной и ромбоэдрической структурой. Что такое турбостратная структура? Рассчитайте степень графитации углеродного материала, имеющего межслоевое расстояние с = 0,338 нм.
656
3.Опишите корреляционные уравнения, связывающие свойства угле-
родных материалов и их плотность. Рассчитайте теплопроводность графита, имеющего плотность 1650 кг/м3.
4.Почему для графита не выполняется соотношение Видемана-Франца между электропроводностью и теплопроводностью? Как зависит теплопроводность графита от степени его совершенства? Какой структурный фактор является определяющим?
5.Почему макроскопические тепловые деформации графита существенно отличаются от рассчитанных по тепловым деформациям кристаллической решетки? Рассчитайте, пользуясь температурной зависимостью параметров решетки графита и уравнением Симмонса, коэффициент теплового расширения графита при температуре 800 °С, если известно, что
при 400 °С α = 5,6 10−6 и α = 4,4 10−6. Сверьте результаты с табл. 23.124.
6.Почему для графита динамический модуль упругости отличается от статического? Каким образом модуль упругости графита связан с его прочностью? Почему в отличие от многих других материалов облучение вызывает резкое увеличение модуля упругости графита?
7.Как зависит скорость радиационного роста кристаллитолв графита от их размера?
8.В чем заключается явление «аккомодации» изменений размеров кристаллитов в поликристаллическом материале? Как можно объяснить уменьшение объема поликристиллического графита, если объем отдельных кристаллитов увеличивается?
9.Что такое деградация структуры графита, какой механизм деградации, в чем она выражается?
10.Рассчитайте запасенную графитом энергию при облучении нейтро-
нами до флюенся 5 1024 м−2 при температуре 200 и 500 °С.
11. Какие углеродные материалы планируются использовать в ТЯР? Каковы их особенности и свойства?
657
Список использованной литературы
1.Абрамович М.Д., Вотинов С.Н,, Иолтуховский А. Г. Радиационное материаловедение на АЭС. − М.: Энергоатомиздат, 1984.
2.Авторадиография поверхностей раздела и структурная стабильность сплавов /
С.З. Бокштейн, С.С. Гинзбург, С.Т. Кишкин и др. − М.: Металлургия, 1987.
3.Алесковсхий В.Б. Химия твердых веществ: Учебное пособие. − М.: Высшая школа, 1978.
4.Алюминий: Свойства и физическое металловедение: Справочник / У.Х. Энто-
ни, Ф.Р. Эштон, М.Э. Болл и др./Пер. с англ./Под ред. Дж. Е. Хэтча. − М.: Металлургия, 1989.
5.Банных О.А., Блинов В.М. Дисперсионно-твердеющие немагнитные ванадийсодержащие стали. − М.: Наука, 1980.
6.Барабаш О.М., Коваль Ю.Н. Структура и свойства металлов и сплавов: Кри-
сталлическая структура металлов и сплавов: Справочник. − Киев: Наукова думка, 1986. − 598 с.
7.Бескоровайный Н.М., Иолтуховский А.Г. Конструкционные материалы и жидкометаллические теплоносители. – М.: Энергоатомиздат, 1983.
8.Бескоровайный Н.М., Калин Б.А., Платонов П.А., Чернов И.И. Конструкци-
онные материалы ядерных реакторов. − М.: Энергоатомиздат, 1995. − 704 с.
9.Бокий Г.Б. Кристаллохимия. − М.: Наука, 1971.
10.Болдырев В.В., Дяхов Н.З., Чупахин А.П. Химия твердого тела. − М.: Зна-
ние, 1982.
11. Взаимодействие окислов металлов с углеродом / В.П. Елютин, Ю.А. Павлов, В.П. Полякова и др. − М.: Металлургия, 1976.
12.Воздействие мощного ультразвука на межфазную поверхность металлов / В.И. Добаткин, Г.И. Эскин, О.В. Абрамов и др. − М.: Наука, 1986.
13.Волынова Т.Ф. Высокомарганцовистые стали и сплавы. − М.: Металлургия, 1988. − 343 с.
14.Гельд П.В., Рябов Р.А. Водород в металлах и сплавах. − М.: Металлургия,
1974.
15.Гельд П.В., Рябов Р.А., Мохрачева Л.П. Водород и физические свойства
металлов и сплавов. − М.: Наука, 1985.
16.Герасимов В.В., Монахов А.С. Материалы ядерной техники. − М.: Энерго-
издат, 1982.
17.Глазов В.М., Лазарев В,Б., Жаров В.В. Фазовые диаграммы простых ве-
ществ. − М.: Наука, 1980.
18.Гольдштейн М.И., Грачев С.В., Векслер Ю.Г. Специальные стали. − М.: Металлургия, 1985. − 408 с.
19.Гольдштейн М.И., Литвинов B.C., Бронфин Б.М. Металлофизика высоко-
прочных сплавов. − М.: Металлургия, 1986. − 312 с.
20. Горынин И.В., Чечулин Б.Б. Титан в машиностроении. − М.: Машиностроение, 1990.
658
21.Грибков В.А., Григорьев Ф.И., Калин Б.А., Якушин В.Л. Перспективные ра- диационно-пучковые технологии обработки материалов. − М.: 2001. − 528 с.
22.Григорович В.К. Жаропрочность и диаграммы состояния. − М.: Металлур-
гия, 1969. − 324 с.
23.Гуляев А.П. Металловедение. − М.: Металлургия, 1986. − 544 с.
24.Гуляев Б.Б. Синтез сплавов. − М.: Металлургия, 1984. − 160 с.
25.Девятых Г.Г., Еллиев Ю.Е. Введение в теорию глубокой очистки веществ.
−М.: Наука, 1981.
26.Дементьев Б.А. Ядерные энергетические реакторы. − 2-е изд. − М.: Энергоатомиздат, 1990. − 352 с.
27.Деформационное упрочнение и разрушение поликристаллических метал-
лов / В.И. Трефилов, В.Ф. Моисеев, Э.П. Печковский и др. − Киев: Наукова думка, 1989.
28.Егоров М.Е., Дементьев В.И., Дмитриев В.Л. Технология машиностроения.
−М.: Высшая школа, 1977.
29.Ефименко С.П. Высокоазотистые стали: Свойства и перспективы практиче-
ского применения. − М.: Черная металлургия / ЦНИИинформ. и техн.-эконом. иссл. черной металлургии, 1990.
30.Жаропрочные и жаростойкие стали и сплавы на никелевой основе: Сборник трудов / Под ред. О.А. Банных. − М.: Наука, 1984.
31.Жуков А.П., Малахов А.И. Основы металловедения и теории коррозии. − М.: Высшая школа, 1991.
32.Займовский А.С., Калашников В.В., Головнин И.С. Тепловыделяющие эле-
менты атомных реакторов. − М.: Атомиздат, 1966. − 520 с.
33.Займовский А.С., Никулина А.В., Решетников Ф.Г. Циркониевые сплавы в ядерной энергетике. − М.: Энергоатомиздат, 1994. − 256 с.
34.Захаров A.M. Диаграммы состояния двойных и тройных систем. − М.: Металлургия, 1978.
35.Зеленский В.Ф., Неклюдов И.М., Черняева Т.П. Радиационные дефекты и
распухание металлов. − Киев: Наукова думка, 1988.
36.Ибрагимов Ш.Ш., Кирсанов В.В., Пятилетов Ю.С. Радиационные повреждения металлов и сплавов. − М.: Энергоатомиздат, 1985.
37.Игнатов В.А., Рыбин В.В., Щербина Н.Б. Новая технология термической
обработки сварных соединений хромистых сталей. − Л.: ДДНТП, 1990.
38.Кадек В.М., Кукурс O.K., Пурин Б.А. Защита металлов от коррозии. − Рига: Лиесма, 1981.
39.Калин Б.А., Скорое Д.М., Якушин В.Л. Проблемы выбора материалов для
термоядерных реакторов: Радиационная эрозия. − М.: Энергоатомиздат, 1985.
40.Калин Б.А., Чернов И.И., Шишкин Г.Н. Диаграммы состояния и структура конструкционных материалов ядерных реакторов: Учебное пособие. − М.: МИФИ, 1989. − 82 с.
41.Камерон Ч. Ядерные реакторы / Пер. с англ. − М.: Энергоатомиздат, 1987.
659
42.Кирсанов В.В., Суворов А.Л., Трушин Ю.В. Процессы радиационного дефектообразования в металлах. − М.: Энергоатомиздат, 1985.
43.Кишкин С.Т. Будущее конструкционных материалов. − М.: Знание, 1989.
44.Коллиер Дж., Хьюитт Дж. Введение в ядерную энергетику / Пер. с англ. − М.: Энергоатомиздат, 1989. − 253 с.
45.Коллингз Е.В. Физическое материаловедение титановых сплавов. − М.: Металлургия, 1988. − 224 с.
46.Конструкционные материалы АЭС / Ю.Ф. Баландин, И.В. Горынин, Ю.И.
Звездин и др. − М.: Энергоатомиздат, 1984. − 280 с.
47. Конструкционные материалы ядерных реакторов: Учебное пособие. Ч. 1: Ядерные и теплофизические свойства, основы коррозии и жаропрочности / Н.М. Бескоровайный. Ю.С. Беломытцев, М.Д. Абрамович и др. − М.: Атомиздат, 1972.
48. Конструкционные материалы ядерных реакторов: Учебное пособие. Ч. 2: Структура, свойства, назначение / Н.М. Бескоровайный, Ю.С. Беломытцев, М.Д. Абрамович и др. − М.: Атомиздат, 1977. − 256 с.
49.Крестов Г.А., Березин Б.Д. Основные понятия современной химии. − Л.:
Химия, 1986.
50.Кутепов A.M., Жихарев А.С. Конструирование и расчет теплообменных
аппаратов. − М.: МИХМ, 1983.
51.Лазарев В.Б., Соболев В.В., Шаплыгнн И.С. Химические и физические свойства простых оксидов металлов. − М.: Наука, 1983.
52.Ланская К.А., Куликова Л.В., Яровой В.В. Микролегирующие и примесные
элементы в низколегированной хромомолибденованадиевой стали. − М.: Металлургия, 1989.
53.Ласкорин Б.Н., Чалов В.И. Базотходное производство в металлургии. − М.: Металлургия, 1988.
54.Лахтин Ю.М., Леонтьев В.П. Материаловедение. − М.: Машиностроение,
1980.
55.Литий в термоядерной и космической энергетике XII века / В.Н. Михайлов,
В.А. Евтихин, И.Е. Люблинский и др. − М.: Энергоатомиздат, 1999. − 528 с.
56.Лякишев Н.П., Плинер Ю.Л., Лаппо С.И. Боросодержащие стали и сплавы.
−М.: Металлургия, 1986.
57.Ма Б.М. Материалы ядерных энергетических установок / Пер. с англ. − М.: Энергоатомиздат, 1987. − 408 с.
58.Мартин Дж., Доэрти Р. Стабильность микроструктуры металлических сис-
тем / Пер. с англ. − М.: Атомиздат, 1978.
59.Масленков С.Б. Жаропрочные стали и сплавы: Справочник. − М.: Металлургия, 1983.
60.Материаловедение / Под. Общ. ред. Б.Н. Арзамасова. − М.: Машинострое-
ние, 1986. − 384 с.
61.Материаловедение и проблемы энергетики / Дж. Синфельд, М. Симанд,
Дж. Хоув и др. / Пер. с англ. − М.: Мир, 1982.
660
62.Металлургия тугоплавких металлов: Сб. статей. − М.: ОНТИ подотрасли,
1975.
63.Многослойная сталь в сварных конструкциях / Б.Е. Патон, Б.И. Медовар,
А.К. Цыкуленко. − Киев: Наукова думка, 1984.
64.Молибден в ядерной энергетике / В.С. Емельянов, А.И. Евстюхин, Г.А. Мочалов и др. − М.: Атомиздат, 1977.
65.Николаев Г.А., Фридляндер И.Н., Арбузов Ю.П. Свариваемые алюминие-
вые сплавы. − М.: Металлургия, 1990. − 296 с.
66.Новиков И.И. Теория термической обработки металлов. − М.: Металлургия, 1986. − 480 с.
67.Новиков И.И., Строганов Г.Б. Новиков А.И. Металловедение, термообра-
ботка и рентгенография. − М.: МИСИС, 1994. − 480 с.
68.Основы материаловедения / И.И. Сидорин, Г.Ф. Косолапов, В.И. Макарова
идр. − М.: Машиностроение, 1976. − 436 с.
69.Павлов И.М., Ушаков Е.В., Дробышева Е.К. Хладноломкость и структура
вольфрама. − М.: Наука, 1984.
70.Папиров И.И. Структура и свойства сплавов бериллия: Справочник. − М.: Энергоиздат, 1981.
71.Паршин A.M. Структура, прочность и радиационная повреждаемость кор-
розионно-стойких сталей и сплавов. − Челябинск: Металлургия, 1988.
72.Патон Б.Е. Наука. Техника. Прогресс. − М.: Наука, 1987.
73.Пикеринг Ф.Б. Физическое металловедение и разработка сталей / Пер. с
англ. − М.: Металлургия, 1982.
74.Применение алюминиевых сплавов: Справочник / Б.М. Альтман, А.Ф. Белов, И.В. Горынин и др. − М.: Металлругия, 1985.
75.Радиационное повреждение стали корпусов водо-водяных реакторов / Н.Н.
Алсксеенко, А.Д. Амаев, И.В. Горынин и др. / Под общ. ред. И.В. Горынина. − М.: Энергоиздат, 1981.
76.Рудман П.С., Стринджер Дж., Джаффи Р.И. Устойчивость фаз в металлах и сплавах / Пер. с англ. − М.: Мир, 1970. − 408 с.
77.Садовский В.Д., Маханек Г.В. Сталь. − М.: Наука, 1990.
78.Садовский В.Д., Фокина Е.А. Остаточный аустенит в закаленной стали. −
М.: Наука, 1986.
79.Самойлов А.Г., Волков В.С., Солонин М.И. Тепловыделяющие элементы
ядерных реакторов: Учебник для вузов. − М.: Энергоатомиздат, 1996. − 400 с.
80. Седов В.М., Заводский М.И. Технико-экономические основы разработки ядерной энергетики: Учебное пособие. − Л.: Изд-во Ленингр. техн. ин-та, 1985.
81. Соединения переменного состава и их твердые растворы / Г. П. Швейнин, С.И. Алямовский, Ю.Г. Зайнулин и др. − Свердловск: Изд-во Уральского НЦ АН СССР, 1984.
82. Справочник по ядерной энерготехнологии / Ф. Ран, А. Адамантиадес, Дж. Кентон и др. / Пер. с англ. / Под ред. В.А. Легасова. − М.: Энергоатомиздат, 1989.
661
83.Структура и коррозия металлов и сплавов: Атлас (справочник) / И.Я. Сокол, И.Я. Ульянин, Э.Г. Фельдгандлер и др. / Под ред. Е.А. Ульянина. − М.: Металлургия, 1989.
84.Структура и радиационная повреждаемость конструкционных материалов.
Ч2. / Под ред. И.В. Горынина и А.М. Паршина. − М.: Металлургия, 1996. − 168 с.
85.Счастливцев В.М. Изменение структуры стали при лазерной обработке. − Челябинск: Изд-во ЧПИ, 1989.
86.Субботин В.И., Ивановский М.Н., Арнольдов М.Н. Физико-химические основы применения жидкометаллических теплоносителей. − М.: Атомиздат, 1970.
87.Титановые сплавы в машиностроении / Б.Б. Чечулин, С.С. Ушаков, И.Н.
Разуваева и др. / Под ред. Г.И. Капырина. − М.: Машиностроение, 1977.
88.Третьяков Ю.Д. Твердофазные реакции. − М.: Химия, 1978.
89.Трефилов В.И., Мильман Ю.В., Фирстов С.А. Физические основы прочно-
сти тугоплавких металлов. − Киев: Наукова думка, 1975.
90.Уайэтт Л.М. Материалы ядерных энергетических установок / Пер. с англ. − М.: Атомиздат, 1979.
91.Уманский Я.С., Скаков Ю.А. Физика металлов. Атомное строение метал-
лов и сплавов: Учебник для вузов. − М.: Атомиздат, 1978.
92.Утевский Л.М., Гликман Е.Э., Кирк Г.С. Обратимая отпускная хрупкость стали и сплавов железа. − М.: Металлургия, 1987.
93.Фридляндер И.Н. Алюминиевые деформируемые конструкционные спла-
вы. − М.: Металлургия, 1979.
94.Фрост Б. Твэлы ядерных реакторов / Пер. с англ. − М.: Энергоатомиздат, 1986. − 248 с.
95.Химическая технология теплоносителей ядерных энергетических устано-
вок: Учебное пособие / В.М. Седов, А.Ф. Нечаев, В.А. Доильницын и др. − М.: Энергоатомиздат, 1985.
96.Химушин Ф.Ф. Жаропрочные стали и сплавы. − М.: Металлургия, 1969. −
752 с.
97.Цыканов В.А., Давыдов Е.Ф. Радиационная стойкость тепловыделяющих
элементов ядерных реакторов. − М.: Атомиздат, 1977.
98.Чернов И.И., Калашников А.Н., Калин Б.А., Бинюкова С.Ю. Материалы с особыми физическими свойствами: Учебное пособие. − М.: МИФИ, 2005. − 224 с.
99.Чернов И.И., Калин Б.А., Бинюкова С.Ю., Стальцов М.С. Влияние легирования и термической обработки на структуру и свойства циркония: Учебное посо-
бие. − М.: МИФИ, 2007. − 84 с.
100.Шульц М.М., Писаревский A.M., Полозова И.П. Окислительный потенциал: Теория и практика. − Л.: Химия, 1984.
101.Ягодин Г.А., Раков Э.Г., Третьякова Л.Г. Химия и химическая технология в
решении глобальных проблем. − М.: Химия, 1988.
102. Ядерные энергетические установки / Б.Г. Ганчев, Л.Л. Калишевский, Р.С. Демешев и др. / Под общ. ред. Н.А. Доллежаля. − 2-е изд. − М.: Энергоатомиздат, 1991.
662
Предметный указатель
Аккомодационный объем 626, 642, 649 Активность
катодная 42 коррозионная 364
наведенная 227, 295, 544, 596
−вольфрама 560
−железа 596
−молибдена 554
−титана 596
−хрома 596 химическая 72, 380, 459
−ванадия 538, 596
−мишметалла 380
−ниобия 543
−теллура 459
Аустенит: 224, 230, 232, 234−239, 319 остаточный 235, 239, 241, 355, 356, 358
переохлажденный 235 титановый 93
Бейнит 236, 240, 264 Бериллиды 73, 75, 79, 581, 599
Бериллий: 16, 60, 64, 68−75, 79, 86
вязкость разрушения 76 жаропрочность 81 коррозионная стойкость 75, 87 красноломкость 72, 79 магниетермический 69 металлокерамический 69, 80
− свойства 81 механические свойства 70, 76, 77, 81, 84
свойства 68
−анизотропия 70
−напряжение сдвига 70, 74
−пластичность 69, 71, 72, 75, 76, 79, 83
− − технологические методы повышения 80
применение 85, 86 − в атомной технике 86
радиационная стойкость 87
текстура 69−71, 77, 83
технологичность 71, 86 хладноломкость 72, 87 электролизный 68
Бериллиоз 71 Бёмит 38
Водородное охрупчивание:
титана 88, 89, 108
циркония 187, 194 перлитных сталей 296
Высокотемпературное радиационное охрупчивание 466, 467, 470, 522
Вюстит 286 Вязкость
разрушения 76, 96, 98, 108, 109, 195, 196, 221, 241, 266−269, 276, 285, 301, 304, 335, 356, 367, 371, 394, 564
Гематит 286
Гидриды: 88, 89, 104, 111, 157, 174−180
ориентация 176−178, 182 − − влияющие факторы 177
переориентация 176−179 Гидрирование:
локальное 184 Графит: 607
графитация 610, 613, 614, 617, 619 − степень 619−621, 623
влияние облучения на свойства 635
−вторичное распухание 655
−изменение кристаллической структуры 637
−изменение линейных размеров 653
−изменение физических свойств 642
−− запасенная энергия 642
−− коэффициент теплового расширения 645
−− теплоемкость 642
−− теплопроводность 643
−− электрическая проводимость
644
−изменение механических свойств
646
−− ползучесть 647
−− прочность 646, 647
−радиационные дефекты 635
для высокотемпературного использования 651
искусственный 608−611, 614, 617, 621, 622, 625
−технология получения 610 коррозионная стойкость 630−633
−влияние облучения 634 легированный 655−657 механические свойства 627
−модуль упругости 627, 629
−ползучесть 629
663
−прочность 628
окисление 630−632, 655
−высокотемпературное 655 ползучесть 629, 630
пористость 610, 614−616, 626, 633, 641
применение 609, 652 − в атомной технике 607, 610, 651, 652
радиационная стойкость
−ползучесть 647
−распухание 645
−− вторичное 646, 649, 650, 655 реакторный 607, 634, 653
−кристаллическая структура 616
−усадка 634
физические свойства 620
−коэффициент теплового расшире-
ния 624−627
−теплоемкость 621
−теплопроводность 622, 624
−электросопротивление 620 Графитизация 278
Деполяризация: водородная 40, 428 кислородная 39, 43, 428
Деформация: 30, 35, 43, 71, 74, 126, 210, 565, 571, 625, 628, 642
Бейна 237, 238 пластическая 33, 72−74, 76, 89, 90, 95, 207, 438, 443, 533, 592
ползучести 125, 150, 201, 202, 324, 560, 630
радиационная 639, 642 радиационного роста 206, 210
холодная 95, 122, 137, 168, 186, 196, 204, 403, 407−409, 437, 548
Диаграмма Шеффлера 255 Дюралюмины: 22−25, 43
механические свойства 24 химический состав 24
Жаропрочность 222, 263−265 Жаростойкость 290, 291, 347 Жидкотекучесть 221
Железо 216, 286, 364
вредные примеси 219, 221 жидкотекучесть 221 легирующие комплексы 220, 222, 267
легирующие элементы 219, 220, 228, 247, 253, 254, 267, 268
−вспомогательные 219, 220
−основные 219, 220
−модификаторы 219, 220
−пластификаторы 220 перитектоидные сплавы 218 пористость 221
−усадочная 221 склонность к трещинам 221 эвтектоидные сплавы 218
Замедленное гидридное растрескивание
178
Защитные покрытия 286, 443, 509, 543, 547, 551, 553, 562, 574, 577, 579, 580, 599
Зоны Гинье-Престона 25, 54
Композиционные материалы: 188 на основе алюминия 51, 85
−изготовление
−− твердофазными методами 51
−− жидкофазными методами 51
−− методами порошковой метал-
лургии 51 на основе бериллия 76, 86
на основе магния 51, 66 на основе никеля 51 на основе ниобия 548 на основе титана 51, 85
с использованием бериллия 85, 86 С/C-композиты 656
Коррозионное растрескивание под напряжением:
магния 60 аустенитных сталей 428, 437−445
−способы борьбы 438, 510
−хлоридное 438
магния 60 мартенситно-стареющих сталей 359 никеля 511
титана 103, 104
циркония 184, 185 − способы борьбы 187
Коррозия: 220, 253, 277, 286, 288, 296, 485, 520
в жидкометаллических теплоносителях
361−367
внутритвэльная 451−463 водородная 104 газовая 514
межкристаллитная 40, 43, 220, 320, 397, 428, 431, 445, 456, 457−461 местная 39, 40, 429 нодулярная 164, 172, 173, 453 общая 39, 40, 164, 359, 361, 428
питтинговая 360 равномерная 359, 360 щелевая 430
664
фреттинг-коррозия 169, 170 электрохимическая 287, 371, 433
язвенная 40, 359, 360, 429, 430
Коэффициент: анизотропии 125−129, 205 запаса 301
излучения на гладкой поверхности 14 интенсивности напряжения 301
− критический 301 ионизации 233 Пуассона 15, 628
радиационного охрупчивания 304−308 радиационной ползучести 647 распределения легирующего элемен-
та 20, 90, 91, 219−221, 530, 482−484, 539
сжимаемости 560 структурный 204 текстурный 625
теплопроводности 619, 623, 624 термического расширения 119, 293, 350, 554, 567, 601, 616, 619, 624−627, 630, 645, 655, 658
технологические 20 Хилла 127 Холла 619
Холта−Ибрагима 127 эквивалентности к никелю 255 эквивалентности к хрому 255
Красноломкость 72, 73, 79, 82, 83 Критическая длина трещины: 182, 195, 196
влияние облучения 197 Кристаллизация: 30, 62, 501, 517
направленная 518, 548 неравновесная 29
Магнетит 286
Мартенсит: 95, 218, 235−240, 260, 266, 276, 284, 322, 336
деформации 107 закалки 249 замещения 350 остаточный отпуска 341 отпущенный 261
Наклеп:
фазовый 556, 568
−локальный 568, 569, 572
Напряжения: 89, 99, 521 внешние 177, 443
внутренние 104, 175, 240, 443, 497, 556, 569, 576, 631
интенсивность 180, 195
−критическая 181
когерентные 389
концентраторы 22, 69, 86, 268 коэффициент интенсивности 301 критические
−для двойникования 74
−для пирамидального скольжения 73 нормальные 121
окружные 126, 181, 453
осевые 126
остаточные 109, 126, 177, 181, 186, 259, 276, 443, 571
−закалочные 261
−технологические 419, 571 Пайерлса−Набарро 282 посадочные 69 равномерное распределение 69
растягивающие 175−177, 299, 437, 438, 443, 514 релаксация 187, 339, 559, 569
сдвига 70, 74
сжатия 50, 74, 191
термические 293, 567 упругие 26, 589
Окисление:
алюминия 21, 35, 37, 38
бериллия 82
ванадия 543, 575, 576 вольфрама 562, 577−579 графита 630−632, 655, 656 железа 221, 286−288 магния 56, 60, 62−65
−в углекислом газе 63, 64
−влияние облучения 66
молибдена 554, 577−579 никеля 485, 487, 484, 509
−влияние легирования 509, 510
ниобия 547, 575−577
сталей 291
−аустенитных 290, 371, 417, 453, 454−457
−− межзеренное 452, 456, 458
−перлитных 288
−хромистых 288−290, 318, 320, 322, 345
−− межзеренное 365
тантала 551, 575, 576
титана 103 тугоплавких металлов 573−578
− защита от окисления 572, 577, 579, 580, 581
хрома 553, 577−579, 599 циркония 151−157, 160, 169, 190−192
−в углекислом газе 152
−влияние облучения 172
665
Перенос:
атомов 153, 291, 365, 456, 510
кислорода 365
массы 361, 364, 445−448, 452, 456, 462, 511, 583, 585−587 углерода 362, 363, 447, 511, 586, 587
Переход:
фазовый 88, 92, 99, 101, 118 хрупко-вязкий 72, 73, 76, 195, 281, 283, 284, 301, 312, 345, 353, 533, 534, 539, 551, 561, 562−566
– сдвиг температуры 76, 295, 301, 304, 312, 554, 561, 592
Перитектика 18, 21, 56, 90, 219
Перитектоид 131, 218, 332
Перлит: 234, 235, 245, 259, 260, 264, 266, 268, 271, 282
волокнистый 278 зернистый 240 пластинчатый 236
Плакирование 42, 52, 187, 295, 296
Пленка:
защитная 41, 45, 62, 65, 102, 152, 158, 169, 288−290, 438, 485, 576, 577
Показатель:
ориентации гидридов 177
текстурный 119, 121–123, 129
Покрытия антикоррозионные 42, 187, 295, 296
защитные 509, 547, 551, 553, 562, 574, 577, 579–581, 599, 600, 655
Ползучесть диффузионная 76
радиационная 143, 198, 647
– механизмы 198
термическая 29, 58, 88, 107, 120, 124−126, 187, 197, 199, 201, 202, 203, 324, 244, 387, 514, 560, 629, 630
Полиморфизм 118, 120
Пористость: 20, 60, 571, 611, 614, 633, 656
газовая 484 ориентированная 641
радиационная 473, 475, 476, 546
усадочная 221 Порошковая металлургия 35, 45, 51, 69, 106, 502, 562, 571
Превращение:
мартенситное 96, 99, 100, 101, 118, 133, 139, 224, 236, 238, 239, 261, 317, 318, 335, 349, 350
– влияние легирования 354 перлитное 235, 284
полиморфное 120, 131, 151, 261, 262, 531
эвтектоидное 218, 245
Продукты деления 184, 185, 187, 451, 452−455, 459, 461
газообразные 453
Прокаливаемость 220, 226, 265–268, 276, 291, 293, 294
Пустоты: октаэдрические
−в ГЦК решетке 232, 233, 237
−в мартенсите 237
−в ОЦК решетке 231, 232 тетраэдрические
−в ГЦК решетке 232, 233
−в ОЦК решетке 231, 232, 237, 299
Радиолиз 172, 173, 428 Рафинирование 17, 77, 79, 80, 270, 576 Рекристаллизация: 31, 55, 66, 122, 156, 259, 261, 501, 538, 555
фазовая 98
Силумины 31, 32 Сильхромы 320, 322
Сорбит: 234−236, 261, 264, 336
зернистый 285 отпуска 283
Сплавы: алюминия
–высокопрочные 24, 32, 50, 66
–деформируемые 19, 20, 22, 27, 28, 44, 47, 51
–классификация по технологии изготовления 19
–ковочные 24, 50
–коррозионная стойкость 36−46, 54
–– влияние легирования 36
–– влияние облучения 54
–– межкристаллитная коррозия 43 легирующие комплексы 21
–легирующие элементы 21, 34, 41, 42, 54
–– вредные примеси 20
–– вспомогательные 20, 21
–– модификаторы 20
–– основные 20, 30, 32
–литейные 19, 20, 51
–металлокерамические 35
–механические свойства 24, 47
–модифицирование 30–32
–ползучесть 29
–применение 17, 18, 32, 41, 46, 48– 52
–– в атомной технике 47, 48
–радиационная стойкость 52
–– распухание 54
–– упрочнение 52–54
666
–спеченные 19
–структура 22, 26−28, 31–33, 39, 42, 44
–– влияние легирования 18
–технологичность 22, 34
–упрочнение 20–27, 29, 30, 32, 36
–химический состав 24, 47
–эвтектические 22, 31, 32, 86 бериллия 68, 85, 87
–коррозионная стойкость 75, 85, 87
–красноломкость 72, 73, 79, 82, 83
–легирующие элементы 76
–охрупчивание 72
–ползучесть 76
–порошковые 87
–применение 80, 85–87
–– в атомной технике 68, 86
–структура 74–76
–– влияние легирования 75
–упрочнение 73, 78, 79, 83
–хладноломкость 72
ванадия
–жаростойкость 543
–коррозионная стойкость 595, 597
–легирующие элементы 538–540, 542, 543, 597
–радиационная стойкость
–– распухание 593, 594
–– упрочнение 588, 590
–применение 596, 597
–– в атомной технике 595, 596 вольфрама
–жаростойкость 562
–легирующие элементы 560, 561
–– вспомогательные 560
–– основные 560
–механические свойства 561
–применение 602–604
–– в атомной технике 604
–радиационная стойкость
–– упрочнение 591
магния
–деформируемые 61
–легирующие элементы 56, 59, 60
–– вредные примеси 57
–– вспомогательные 56
–– основные 56
–коррозионное растрескивание под напряжением 60
–коррозионная стойкость 56, 60, 62, 64, 65
–литейные 61
–механические свойства 61, 67
–модифицирование 60
–применение 51, 60, 65, 66
667
–– в атомной технике 66, 67
–структура 56–58
–– влияние легирования 56
–охрупчивание 55
–радиационная стойкость 66
–упрочнение 58
–химический состав 61, 67 молибдена
–классификация 556
–коррозионная стойкость 554
–легирующие элементы 554–557
–– влияние на температуру рекристаллизации 555
–– основные 557
–механические свойства 557. 558
–радиационная стойкость
–– распухание 593
–– упрочнение 588, 591
–пластичность 570
–применение 600–602
–– в атомной технике 600, 604
–охрупчивание 570
–химический состав 557, 558
никеля
–высокотемпературное радиационное охрупчивание 522–525
–гетерогенные 486
–гомогенные 486
–– легирование 486
–коррозионная стойкость 485, 486, 509–512, 518
–– в жидкометаллических теплоносителях 511
–легирующие комплексы 484, 486, 503
–легирование 482, 484, 485, 494– 501, 503, 517
–– влияние на структуру и свойст-
ва 489
–– влияние на длительную проч-
ность 496, 500
–– вредные примеси 482–484
–– вспомогательные 483
–– модификаторы 483
–– основные 482, 483, 487
–литейные 513–517
–– химический состав 513
–механические свойства 489, 492, 493, 508, 516
–нихромы 486, 491, 494–496, 500
–окисление 485, 510, 515
–– влияние легирования 485, 487, 494, 509, 510
–охрупчивание 504, 511
–– высокотемпературное радиационное 521–525
–применение 51, 511, 520
–– в атомной технике 490, 491, 520, 527
–радиационная стойкость 520
–– охрупчивание 520−525
–– ползучесть 520
–– распухание 520, 525, 526
–– упрочнение 520, 521
–ферронихромы 494, 495
–химический состав 484–486, 489, 490, 491, 513
ниобия
–жаростойкость 547
–коррозионная стойкость 595
–легирующие элементы 545–548
–– влияние на механические свойства 545
–– вспомогательные 545
–– основные 545
–литейные 548
–механические свойства 546, 547
–применение 595, 597, 598
–– в атомной технике 595, 597
–радиационная стойкость
–– распухание 593, 594
–– упрочнение 588, 590, 591
–химический состав 546, 547 тантала
–жаростойкость 551
–коррозионная стойкость 548, 599
–легирующие элементы 549
–– влияние на механические свойства 549
–– основные 549, 551
–механические свойства 550
–применение 598, 599
–– в атомной технике 598
титана
–деформируемые 104, 105
–– механические свойства 105
–– химический состав 105
–классификация 93
–коррозионная стойкость 88, 96, 102, 103, 107
–– водородная коррозия 104
− коррозионное растрескивание под напряжением 103, 104
–легирующие комплексы 91
–легирующие элементы 90, 93, 97, 101, 108
–– вредные примеси 91
–– основные 90–92, 104
–литейные 104, 106
668
–– механические свойства 106
–– химический состав 106
–мартенсит 95, 99, 102, 107
–механические свойства 95–97, 105, 106
–модифицирование 91
–охрупчивание 92, 97, 100
–ползучесть 88, 107
–порошковые 104
–применение 51, 96, 104–107
–– в атомной технике 96, 107, 108
–радиационная стойкость 96, 108
–– охрупчивание 108, 111
–– распухание 108, 111, 112
–– упрочнение, 108–111
–структура 93–96, 98–100, 105
–термическая обработка 99
–технологичность 96, 107
–упрочнение 89, 92, 95, 102
–фазовый состав 99
–химический состав 95–97, 105, 106
–эвтектические 103
хрома 551
–жаропрочность 552
–классификация 552
–легирующие элементы 551–553
–механические свойства 552
–охрупчивание 553
–применение 599, 600
–химический состав 552 циркония
–жаропрочность 139
−− влияние легирования 128
–коррозионная стойкость 117, 133, 134, 149, 151, 152, 156–169, 171, 172, 189, 190, 192
−− влияние примесей и легирую-
щих элементов 156, 158, 159, 161, 166
−коррозионное растрескивание под напряжением 185
–легирующие элементы 130, 133, 134, 156, 158, 162, 165, 166, 192
–механические свойства 120, 139, 140, 144, 145, 150, 166, 194, 195, 196
−− влияние легирования 128
−охрупчивание 140, 177
−ползучесть 124−126, 139−142, 199, 200, 291
−− анизотропия 125
−− влияние текстуры 204
−применение 117, 120, 201
−− в атомной технике 117, 143, 158, 165, 174
−радиационная стойкость
−− радиационная ползучесть 143, 149, 150, 197−199, 201, 202, 205
−− радиационно-водородное охрупчивание 194
−− радиационный рост 197,
206−211
−− радиационное упрочнение 194
−структура
−− влияние легирования 128
– химический состав 145, 150 Стали:
атомной техники 223
−классификация 223
аустенитные 16, 224, 265, 370 466, 467, 470
−гетерогенные 417, 420
−гомогенные 394
−диаграмма распада
−коррозионная стойкость 371, 399, 426, 430
−− в воде и паре 380, 426−430
−− в жидкометаллических теплоносителях 445−451
−− при взаимодействии с продуктами деления ядерного топлива
451−463
−− щелевая коррозия 431
−коррозионное растрескивание под напряжением 428, 437−445
−− влияние легирования 442
−легирование 373, 379−381,
383−386, 388, 389, 391, 393, 394, 397, 405, 417, 420, 425, 434, 435
−− влияние на структуру и свойст-
ва 379, 388
−− влияние на длительную проч-
ность 379, 426
−межкристаллитная коррозия 397, 428, 431−436, 445, 456, 457
−− влияние легирования434
−механические свойства 395, 396
−общая коррозия 428
−охрупчивание 371, 412, 415, 465
−− высокотемпературное радиационное 466, 470
−ползучесть 387, 417, 450, 451
−применение 464
−− в атомной технике 464
–радиационная стойкость
−− охрупчивание 451, 466, 470
−− распухание 469, 473–476
− с интерметаллидным упрочнением
420
669
−− легирование 420, 425
−− термическая обработка 426
−с карбидным упрочнением 417
−− легирование 417
−стабилизация
−− аустенитной структуры 373, 380, 397
−− для предотвращения межкристаллитной коррозии 434
−термообработка 395, 396, 426
−химический состав 374−378
−щелевая коррозия 430
−щелочная хрупкость 443 высококачественные 225, 226 высоколегированные 216, 225, 260, 265
гомогенные 394 горячеломкость 268
доэвтектоидные 223, 258−260, 262, 318
жаростойкие 263, 264 жаропрочные 263, 264 заэвтектоидные 223, 318 инструментальные 225 качественные 225 классификация 222, 223 конструкционные 216, 221−223, 225−228, 249, 261, 265, 272, 333
коррозионно-стойкие 318, 319, 325, 346 маркировка 222, 225−228 мартенситные
–радиационная стойкость низколегированные 216, 225, 260, 263, 269, 281, 282
–применение 270
обыкновенные 225 особовысококачественные 225, 227, 272 перлитные 269
−вредные примеси 270
−коррозионная стойкость 286, 288
−легирование 269, 276−278,
281−283, 285, 288, 289, 291
−механические свойства 273−275, 282
−окисление 289−291
−охрупчивание 269
−− водородное 296, 308−310
−− радиационно-водородное 296, 300
−− тепловое 269
−применение 270, 273−275
−− в атомной технике 273−275, 280, 291, 292, 294
−радиационная стойкость 301
−− остаточное охрупчивание 312, 313
−− радиационное охрупчивание
303−308, 310, 311
−− радиационное упрочнение 302, 303, 305
−реакторные 280
−структура 270
−термическая обработка 283
−химический состав 270, 272
синтерметаллидным упрочнением 377, 394, 420
скарбидным упрочнением 377, 394, 417, 419
среднелегированные 216, 225, 260 теплоустойчивые 263
−применение 267
темическая обработка 283
углеродистые 218, 220, 225, 225, 235, 239, 242, 260, 263−265, 269, 319
− применение 270
упрочняющие фазы 249, 250, 256, 341, 342, 419
−бориды 249, 251
−интерметаллиды 249, 257, 258, 347, 380, 391, 415, 416, 420
−− геометрически плотноупако-
ванные фазы 258, 380, 391,
420−426
−− фазы Лавеса 258, 331, 333, 393, 415, 420−422, 425, 426
−− электронные соединения 258
−− σ-фазы 258, 415, 416
−карбиды 249, 250, 257, 355, 380, 415, 418
−карбонитриды 415
−нитриды 249, 251, 257, 380
−оксиды 249, 252
−силициды 249
−сульфиды 249, 416
−фосфиды 249
хромистые 313, 325, 327, 346
−двухфазные 339
−дисперсно-упрочняемые 342
−− механические свойства 343
−− термическая ползучесть 344
−− химический состав 342
−коррозионная стойкость 313, 318, 321, 338, 344, 359−361, 368
−− в жидкометаллических теплоносителях 361−367
−− межкристаллитна коррозия 363
670
−легирование 317, 318−326, 329−331, 334, 337, 361, 364
−− влияние на ползучесть 324
−− влияние на структуру и свойст-
ва 317
−− жидкофазное 366
−− поверхностное 366
−легирующие комплексы 324, 336, 337
−мартенситно-стареющие 347, 350
−− классификация 350, 351
−− легирование 347, 350, 353−355
−− механические свойства 353
−− применение 368
−− упрочнение 354
−− химический состав 351, 352
−мартенситные 223, 224, 271, 314, 319, 321, 327, 338
−− классификация 321
−− коррозионная стойкость 359
−− легирование 329
−− механические свойства 327, 328
−− применение 367, 368
−− химический состав 325
−механические свойства 323, 327, 328
−313, 367, 368
−− в атомной технике 321, 325,
326, 363, 367−369
–радиационная стойкость 369, 370
−− охрупчивание 370
−− распухание 370
−− упрочнение 340, 369
−химический состав 323−326
–ферритно-мартенситные 315, 327, 339, 342, 344
−− жаропрочность 340
−− дисперсно-упрочняемые 342, 344
−− коррозионная стойкость 359
−− легирование 339
−− механические свойства 327, 328
– – микроструктура 340
−− применение 368, 369
−− химический состав 325
−ферритные 315, 344
−− жаростойкость 347
−− коррозионная стойкость 359
−− легирование 345, 437
−− механические свойства 346
−− применение 345, 346
эвтектоидные 318, 223, 234, 235
Старение: двухступенчатое 419
деформационное 89, 199, 200 естественное 24, 50, 52 искусственное 24−26, 58
мартенсита 337, 340, 350
непрерывный распад 262 прерывистый распад 263
Структура:
мартенситная 99, 322, 324 мартенситно-троститная 266 мартенситоподобная 96, 349 перлитная 269, 270 перлитоподобная 236, 263 сорбитообразная 322
Термическая обработка закалка 24, 58, 61, 95, 97−102, 138, 141,
168, 196, 204, 226, 258, 260−262, 266, 277, 283, 284, 314, 323, 327, 333, 338, 345, 346, 350, 353, 388, 396, 426, 492, 493, 497, 514
−двойная 396, 426, 427
−на мартенсит 261, 356
нормализация 260, 262, 273−275, 283, 346
отжиг
−нормализационный 262
−рекристаллизационный 99, 122
−стабилизирующий 99
−1-го рода 98, 259
−2-го рода 98, 259, 262
отпуск 322, 327
−высокий 261
−высокотемпературный 322, 335, 336
−низкий 261
−средний
патентирование 260, 262 улучшение 261
Тугоплавкие металлы: вредные примеси 532 жаростойкость 574
−влияние легирования 574, 577 коррозионная стойкость
−в жидкометаллических теплоноси-
телях 583−587, 595
легирование 529, 532, 533, 536, 571, 587
−вспомогательные легирующие элементы 530, 532
−основные легирующие элементы
530, 532
−особенности 529
обработка 562, 571
окисление 573
охрупчивание 533, 565–567, 569, 570, 574
пластичность 533, 562, 570
– влияние легирования 533 ползучесть 560, 587 применение 587, 595−605
– в атомной технике 587, 594−598, 600, 604
радиационная стойкость 585
−охрупчивание 592
−− высокотемпературное 592, 593
−− низкотемпературное 592, 593
−ползучесть 587
−распухание 593, 594
−упрочнение 587−591
−− радиационно-термическое 589
Тростит: 235, 264, 266
игольчатый 236 отпуска 240
Ударная вязкость 76, 96−98, 108, 109,
241, 266−268, 277, 298, 304, 335, 356, 366, 371, 394
Фазы:
боридные 257, 542
внедрения 247, 248, 250, 385
интерметаллидные 257, 331, 388, 405−407, 415, 421 карбидные 88, 157, 220, 234, 235, 240,
242, 243, 246, 247−250, 257, 285, 331, 336, 385, 386, 397, 399, 405, 418, 433, 536, 542, 547, 561, 566, 568, 598
−вторичные 223, 421
−коагуляция 250, 270, 465
−коалесценция 279, 337
−первичные 223, 397, 421, 425
−с волокнистой морфологией 277
−свободная энергия образования
248
−со сложной кристаллической решеткой 249
−специальные 243, 320, 322, 380
−сфероидизация 270, 278
−хромистые 220, 243, 245, 318, 345, 357, 382, 383, 385, 403−406, 410, 412, 413, 425
−цементитного типа 243, 277 карбонитридные 331, 397
−первичные 397, 421, 425
−вторичные 421
671
мартенитные 102 |
Цементит: 233 |
мартенситоподобные 109 |
легированный 243 |
нитридные 246−248, 257, 561, 566 |
|
− первичные 397 |
Эвтектика 218 |
оксидные 561, 566 |
Эвтектоид 218 |
промежуточные |
Эвтектоидная точка 287 |
Феррит: 223, 230, 234, 235 |
Эквивалент |
хромистый 242, 317 |
никеля 254 |
Фреттинг-коррозия 169, 170 |
хрома 254 |
Хладноломкость 72 |
Эффект рения 533 |
|
Редактор Е.Н. Кочубей
Подписано в печать 21.10.2008. |
Формат 60×84 |
1/16 |
|
Объем 42,0 п.л. |
Уч. изд. л. 42,0. |
Тираж 150 экз. |
|
Изд. № 1/29. |
|
Заказ |
|
Московский инженерно-физический институт |
|
||
(государственный университет). 115409, Москва, Каширское шоссе, 31. Типография издательства «Тровант», г. Троицк Московской обл.
672
