
0dd9726 / Методические рекомендации к формированию практических навыков по физической и коллоидной химии
.pdfГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КУРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И
СОЦИАЛЬНОМУ РАЗВИТИЮ
КАФЕДРА ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
КФОРМИРОВАНИЮ ПРАКТИЧЕСКИХ НАВЫКОВ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
КУРСК – 2005 г.
|
|
2 |
УДК |
541.1 + 541.18] (072) |
Печатается по разрешению |
ББК |
24.5 + 24.6 (я 7) |
редакционно-издательского |
|
|
совета КГМУ |
Методические рекомендации к формированию практических навыков по физической и коллоидной химии. /Курск: КГМУ, 2005 – 41 стр.
Составители:
Зав. кафедрой физической и коллоидной химии доцент В.В.Новиков, старшие преподаватели И.В.Гармашова, Г.Т.Клыкова, О.И.Оксененко.
Под редакцией доцента В.В.Новикова
Рецензенты: зав. кафедрой общей химии КГМУ, профессор, д.ф.н. Хабаров
А.А.
зав. кафедрой неорганической и аналитической химии КГСХА, профессор, д.х.н. Жукова Л.А.
© Курский государственный медицинский университет, 2005 г.
|
3 |
|
|
|
|
СОДЕРЖАНИЕ |
|
|
|
|
|
|
|
Стр. |
|
|
|
|
|
Введение …………………………………………………… |
|
|
|
……4 |
Определение температуры плавления вещества |
|
|
|
|
капиллярным методом………………………………………… |
|
|
|
……5 |
Экстрагирование иода из водного раствора ор- |
|
|
|
|
ганическим растворителем……… |
……………………… |
|
.................9 |
|
Определение температуры кипения жидкости |
|
|
|
|
капиллярным методом…………………… |
…………… |
……… |
......12 |
|
Приготовление буферного раствора с заданным |
|
|
|
|
значением рН…………………………………………………… |
|
|
|
….15 |
Измерение буферной емкости……………………………… |
|
....18 |
||
Потенциометрическое определение рН раствора |
|
|
|
|
с помощью стеклянного электрода…………………………… |
|
|
….20 |
|
Определение поверхностного натяжения |
|
|
|
|
жидкости по методу наибольшего давления отрыва |
|
|
|
|
пузырьков воздуха (метод П.А.Ребиндера)…………………........25 |
|
|
||
Деионизация воды методом ионообменной коло- |
|
|
|
|
ночной хроматографии………………………………………… |
|
|
|
….29 |
Получение устойчивых коллоидных растворов…………........31 |
||||
Определение порога коагуляции коллоидного |
|
|
|
|
раствора электролитом………………………………………… |
|
|
|
…..34 |
Определение вязкости жидкости капиллярным |
|
|
|
|
вискозиметром……………………… |
………………………… |
|
|
…...36 |
Рекомендуемая литература……………………………………..41
4
ВВЕДЕНИЕ
Изучение физической и коллоидной химии на фармацевтическом и биотехнологическом факультетах направлено как на усвоение теоретических представлений о свойствах материи, закономерностей физико-химических явлений и процессов в различных системах, так и на обоснование оптимального использования физико-химических методов исследования применительно к задачам фармации и биотехнологии. В настоящем пособии излагаются те методы, которые широко применяются на практике в химических и смежных лабораториях. Включены методы, хорошо проверенные на практике, в том числе рекомендованные Фармакопеей XI издания.
При усвоении методов полезно придерживаться обобщенного алгоритма, предлагаемого кафедрой:
1.Назначение метода (область применения).
2.Физическое (физико-химическое) явление, лежащее в основе метода.
3.Основная физическая (физико-химическая) закономерность, описывающая это явление.
4.Принцип метода.
5.Принципиальное устройство прибора, установки.
6.Непосредственно измеряемая величина. Этапы ее нахождения.
7.Способы установления определяемых величин (уравнения, расчеты, графики, и т.п.)
8.Основные преимущества, особенности метода, его недостатки и ограничения.
9.Источники ошибок.
10.Использование метода в фармации, технологии, биологии, медицине. В зависимости от конкретного содержания и специфики того или иного ме-
тода отдельные положения могут потребовать более подробной расшифровки.
5
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ КАПИЛЛЯРНЫМ МЕТОДОМ.
Температурой плавления вещества называют температуру, при которой твердая фаза переходит в жидкую, причем обе фазы находятся в равновесии и характеризуются одинаковой величиной давления пара.
Определение точки плавления является одним из способов контроля чистоты и идентификации вещества, определения молярной массы растворенного вещества методом криометрии.
Каждое чистое вещество характеризуется определенной точкой плавления. Точность определения точки плавления в обычных условиях составляет ± 0,5 К. Более точное определение точки плавления проводят, как правило, при помощи графиков плавления (± 10-2 К).
Смеси различных веществ по-разному ведут себя при плавлении или кристаллизации в зависимости от растворимости этих веществ или способности смешиваться. Смеси, образующие твердые растворы, не имеют резко выраженной точки плавления. Такие смеси плавятся (кристаллизуются) в интервале температур. Системы, компоненты которых, находясь в твердом состоянии, нерастворимы, называются неизоморфными смесями. В отличие от чистых компонентов большинство таких смесей плавятся так же не при постоянной температуре, а в определенном интервале температур, который определяется составом системы. Нижний предел температуры, при которой начинается плавление такой системы, называется эвтектической температурой.
При плавлении многих органических веществ наблюдается окрашивание расплава или выделение газа. Температура, при которой происходят эти процессы, называется точкой разложения. Аморфные вещества и полимеры, в отличие от кристаллических веществ, не характеризуются конкретной температурой плавления, но характеризуются областью размягчения.
При практическом измерении температуры плавления руководствуются следующим определением: "Под температурой плавления вещества подразумевается интервал температур между началом плавления – появлением первой капли жидкости и концом плавления – полным переходом вещества в жидкое состояние" (Государственная Фармакопея XI, т.I. М., "Медицина", 1987, с. 16.).
Если температуру плавления измерять капиллярным методом, в котором исследуемое вещество находится в стеклянном капилляре, а ртутный резервуар термометра опущен в масляную баню, в момент полного плавления вещества в капилляре температуры бани и внутри капилляра могут не совпадать. Для точного определения температуры плавления в этом случае измеряют температуру исчезновения последнего кристалла при нагревании и температуру появления
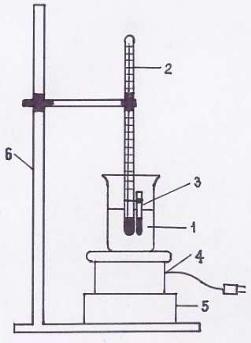
6
первого кристалла при охлаждении. Если эти температуры не совпадают (и разница не превышает 20С), за температуру плавления принимают их среднее арифметическое значение.
Рисунок 1. Установка для определения температуры плавления капиллярным методом.
Установка (рис. 1) состоит из водяной, масляной, парафиновой, глицериновой или сернокислотной бани в зависимости от ожидаемой температуры плавления вещества (1); термометра (2); стеклянного капилляра (3), заполненного исследуемым веществом; плитки (4); подставки (5); штатива (6).
Исследуемое вещество помещают в капилляр диаметром 1 мм и длиной 6 см, запаянный с одного конца. Заполнение капилляра веществом проводят так: небольшое количество хорошо измельченного вещества помещают на чистую поверхность и, прикасаясь открытым концом капилляра к веществу, вводят его в капилляр небольшими порциями.
Затем перемещают вещество к запаянному концу, постукивая этим концом по твердой поверхности, либо бросая капилляр запаянным концом вниз в вертикально расположенную стеклянную трубку высотой не менее 50 см. Операцию повторяют насколько раз, пока высота слоя вещества не будет равна 3 мм. Необходимо, чтобы столбик вещества в капилляре был плотным без видимых разрывов.
Подготовленный таким образом капилляр с помощью резинового кольца укрепляют на термометре так, чтобы столбик вещества в капилляре находился на уровне середины ртутного резервуара термометра, а резиновое кольцо при погружении термометра с капилляром в баню не касалось нагревательной жидкости. Термометр с капилляром закрепляют в лапке штатива и опускают в предварительно нагретую баню. При этом термометр не должен касаться дна и сте-
7
нок бани, а уровень жидкости в бане должен быть выше резервуара термометра примерно на 5 мм.
Баню медленно нагревают со скоростью примерно 1,50С в минуту. Отмечают температуру (t1), когда в капилляре исчезает последний кристаллик исследуемого вещества. Затем отключают плитку, заменяют ее на подставку, следя за тем, чтобы капилляр, закрепленный на термометре, не извлекался из бани. Отмечают температуру (t2), когда в капилляре появится первый кристалл. Если разница в температурах t1 и t2 превышает 20С, опыт следует повторить, уменьшая скорость нагревания и охлаждения.
Температуру плавления рассчитывают по формуле:
t пл. |
= |
t1 + t 2 |
|
||
|
2 |
|
Источники ошибок
Быстрый и неравномерный нагрев (плохо воспроизводимые результаты). Процессы агломерации и разложения принимаются за плавление (ошибка
в определении начала плавления).
Вещество плохо измельчено и недостаточно высушено.
При плавлении следует обращать внимание на выделение воды из гидратированных соединений.
В некоторых случаях необходимо учитывать полиморфные превращения кристаллов. Разница между точками плавления различных кристаллических модификаций достигает 20 К.
Использование неотградуированного термометра.
Вопросы для самоконтроля.
1.Физико-химическое определение понятия "температура плавления".
2.Определение понятия "температура плавления" по Фармакопее.
3.Какую температуру принимают за температуру плавления для смеси веществ, которая плавится в широком интервале температур?
4.Какие величины измеряются непосредственно в опыте при определении температуры плавления капиллярным методом?
5.Почему при измерении температуры плавления капиллярным методом в опыте определяют две величины: температуру исчезновения последнего кристалла при нагревании и температуру появления первого кристалла при охлаждении?
6.Какая из двух температур: температура исчезновения последнего кристалла
при нагревании t1 или температура появления первого кристалла при охлаждении t2 может быть выше? Почему?
7.Если температура исчезновения последнего кристалла при нагревании t1 и температура появления первого кристалла при охлаждения t2 не одинаковы, то какая разница в значениях этих температур допустима?
8
8.Если при измерении температуры плавления капиллярным методом, t1 и t2 отличаются между собой более чем на 2 градуса, как добиться допустимой разницы температур?
9.Если в капилляре последний кристалл при нагревании исчезает при температуре t1, а первый кристалл при охлаждении появляется при температуре
t2 (t1 ¹ t2), то, как по этим двум температурам следует определить tпл? 10.Установка для определения температуры плавления капиллярным методом. 11.Параметры капилляра, используемого при определении температуры плав-
ления. Требования к его заполнению.
12.Почему при заполнении капилляра веществом следует следить за тем, чтобы столбик вещества был плотным без видимых разрывов? Как это достигается?
13.Если при расплавлении вещества в капилляре появился пузырек воздуха, как от него освободиться?
14.Требования к закреплению капилляра на термометре.
15.Требования к закреплению термометра с капилляром при погружении их в масляную баню.
16.Основные этапы определения температуры плавления капиллярным методом.
17.С какой скоростью следует нагревать масляную баню?
18.Какое требование следует соблюдать при перенесении масляной бани с термометром и капилляром с плитки на подставку?
19.С какими целями измеряют температуру плавления вещества?

9
ЭКСТРАГИРОВАНИЕ ИОДА ИЗ ВОДНОГО РАСТВОРА ОРГАНИЧЕСКИМ РАСТВОРИТЕЛЕМ
Экстрагирование – процесс извлечения вещества, растворенного в одном растворителе, другим растворителем (экстрагентом), который не смешивается с первым и лучше растворяет извлекаемое вещество.
Экстрагирование можно использовать для: выделения вещества из смеси; очистки раствора вещества от примесей; разделения смеси на компоненты, определения некоторых физико-химических параметров экстрагируемого
вещества.
Экстрагирование основано на законе распределения Нернста, согласно которому, если состояние молекул экстрагируемого вещества одинаково в обеих фазах и оно не вступает в химическое взаимодействие с растворителями при постоянной температуре
K= CЭ
Ср
где СЭ – концентрация извлекаемого вещества в экстракте;
Ср – концентрация извлекаемого вещества в рафинате;
К– коэффициент распределения.
Используя закон распределения, можно рассчитать массу вещества, оставшегося после однократной экстракции в первом растворителе (mр) и перешедшего в экстрагент (mЭ) при добавлении экстрагента в один прием по формулам:
|
|
|
m р = m |
0 |
|
|
|
V1 |
|
; |
|
|
|
|
|
|
V |
|
|
, |
|
|||
|
|
|
|
|
|
|
m = m 1 − |
1 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
+ kV |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
1 |
2 |
|
|
Э |
|
|
|
V + kV |
|
|
|
|||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m0 – |
масса извлекаемого вещества в исходном растворе; |
|
|
|
|
|
|
|||||||||||||||||
V1 – |
объем исходного раствора; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
V2 - объем экстрагента; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
К - коэффициент распределения. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
При многократной экстракции, когда экстрагент добавляется по частям, со- |
|||||||||||||||||||||||
ответствующие величины рассчитывают по уравнениям: |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
= m |
|
|
|
V |
|
|
n |
|
|
|
|
|
|
V |
|
|
n |
|
|||
|
m |
|
|
|
|
|
|
1 |
|
|
|
m = m |
1− |
|
|
|
|
|
, |
|||||
|
|
|
|
|
|
|
|
|
K(V / n) +V |
|||||||||||||||
|
|
р |
0 |
K(V / n) +V |
|
|
Э |
|
0 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
2 |
|
1 |
|
|
|
|
|
|
|
|
2 |
1 |
|
|
||||
где
n – число экстракций
V2/n – объем одной порции экстрагента
Последовательность проведения процесса экстрагирования
1. Контакт исходного раствора и экстрагента.
10
а) В колбу с притертой пробкой внести, отмерив цилиндром, 25 мл раствора J2 в воде и добавить, отмерив пипеткой, 10 мл органического растворителя – выбранного экстрагента.
б) Колбу плотно закрыть пробкой и в течение 15 минут встряхивать. При встряхивании придерживать пробку, изредка осторожно ее открывая.
2.Механическое разделение образовавшихся двух равновесных фаз – экстракта и рафината.
а) Содержимое колбы перенести в делительную воронку с хорошо притертым и слегка смазанным вазелином краном на 20 минут до полного расслоения.
б) Отделить экстракт от рафината, открыв пробку делительной воронки и слив нижний водный слой (рафинат) через кран, а затем слой экстракта
вотдельные сухие колбы.
3.Сделать вывод о результатах экстрагирования.
а) Сопоставить окраску исходного водного раствора и рафината. б) Сопоставить окраску растворов рафината и экстракта.
Источники ошибок
Высокие потери вещества в процессе встряхивания с растворителями. Рекомендации: многократное встряхивание с небольшими порциями растворителя эффективнее, чем однократная экстракция большим объемом растворителя.
Длительное расслоение при близкой плотности фаз. Рекомендации: если органическая фаза легче воды, в водную фазу добавляют хлорид натрия, если органическая фаза тяжелее воды, ее следует разбавить чистым растворителем.
Образование эмульсий. Рекомендации: делительную воронку осторожно покачивают, а затем ее выдерживают длительное время с целью лучшего расслоения; иногда фазы расслаиваются быстрее, если профильтровать всю смесь.
Вопросы для самоконтроля
1.Определение процесса "экстрагирование".
2.Назначение метода.
3.Закономерность, лежащая в основе экстрагирования (словесная и математическая формулировка закона распределения).
4.Что называют: "экстрагентом", "экстрактом", "рафинатом"?
5.Требования, предъявляемые к экстрагенту. Чем обусловлены требования:
∙экстрагент должен иметь низкую вязкость;
∙экстрагент должен существенно отличаться по плотности от первого растворителя?
6.Оптимальные условия проведения процесса экстрагирования.
7.Уравнения для расчета массы экстрагируемого вещества, оставшегося в первом растворителе или перешедшего в экстрагент в результате однократной, двухкратной или многократной экстракций.
