
- •Механика
- •Оглавление
- •Глава 1. Кинематика материальной точки
- •Глава 2. Динамика
- •Глава 3. Работа и энергия
- •Глава 4. Законы сохранения в механике
- •Глава 5. Механические волны
- •Глава 6. Молекулярное движение
- •Глава 7. Основы термодинамики
- •Глава 1. Кинематика материальной точки
- •Кинематика поступательного движения
- •Понятия и определения
- •Модуль вектора ускорения
- •1.2. Уравнения движения
- •1.2.1 Равномерно, прямолинейно движение.
- •1.2.2 Ускоренное, прямолинейное движение
- •1.2.3 Кинематика вращательного и колебательного движения Вращательное движение
- •При постоянной угловой скорости , угловой путь и угол поворота определяется из равенств:
- •Колебательное движение
- •Для самостоятельного изучения
- •1.3.1 Модуль касательного и нормального ускорения.
- •1.3.2 Равномерное криволинейное движение.
- •Сложение гармонических колебаний
- •1.4 Задания для самоконтроля знаний.
- •Глава 2. Динамика
- •2.1 Законы Ньютона.
- •2.2. Динамика поступательного движения тела
- •2.3. Динамика вращательного движения
- •2.4. Динамика колебательного движения
- •2.5. Принцип относительности Галилея. Неинерциальные системы отсчета
- •2.6 Для самостоятельного изучения
- •2.6.1. Понятие силы. Равнодействующая сила
- •2.6.2. Силы гравитационного взаимодействия
- •2.6.3.Силы трения
- •2.6.4.Сила вязкого трения и сопротивления среды.
- •2.6.5.Сила упругости. Закон Гука.
- •6. Колебания математического и физического маятников
- •2.7. Задания для самоконтроля знаний
- •Глава 3. Работа и энергия
- •3.1. Работа. Мощность
- •3.2. Энергия поступательного движения (кинетическая энергия)
- •И всегда положительна в любой системе отсчета.
- •3 Dr.3. Энергия взаимодействия (потенциальная энергия)
- •3.4. Работа и энергия вращательного движения
- •3.5. Энергия колебательного движения
- •3.6. Для самостоятельного изучения
- •3.6.1. Потенциальная энергия тела относительно поверхности Земли
- •3.6.2. Работа силы тяжести
- •3.6.3. Потенциальная энергия пружины
- •3.6.4. Потенциальный барьер и яма
- •3.7. Задание для самоконтроля знаний.
- •Лекция 6
- •Глава 5. Законы сохранения в механике
- •5.1 Закон сохранения импульса
- •5.2 Закон сохранения момента импульса
- •При составлении равенства (5.5) учтено, что и.
- •5.3 Закон сохранения энергии
- •5.4 Для самостоятельного изучения
- •5.4.2 Абсолютно неупругий удар
- •5.5. Задание для самоконтроля знаний
- •Глава 6. Механические волны
- •6.1 Продольные и поперечные волны
- •6.3.Задания для самоконтроля знаний.
- •Глава 7.Молекулярное движение
- •7.1 Размеры и масса молекул
- •7.2. Движение и столкновение молекул газа
- •7.3 Давление и температура.
- •7.4 Скорость и энергия молекул [распределение Максвелла]
- •7.5 Диффузия, внутреннее трение, теплопроводность.
- •7.6 Давление идеального газа на стенку
- •7.7 Уравнение состояния идеального газа
- •Глава 8. Основы термодинамики
- •8.1. Термодинамическая система. Внутренняя энергия идеального газа
- •8.2. Работа и теплопередача
- •8.3. Первое начало термодинамики, термодинамические изопроцессы.
- •8.4 Теплоемкость
- •8.5 Обратимые и необратимые процессы. Термодинамическая вероятность. Энтропия.
- •8.6 Изменение энтропии в изопроцессах
- •8.7 Тепловая машина. Цикл Карно.
- •8.8. Для самостоятельного изучения
- •1. Второе начало термодинамики
- •Вес тела – сила, приложенная к опоре или подвесу, которые удерживают тело от свободного падения. При неподвижной опоре (подвесе) или при их равномерном движении вес тела равен силе тяжести.
- •Второй закон Ньютона - ускорение , материальной точкой в инерциальной системе отсчета прямопропорционально действующей силе, обратно пропорционально массе и совпадает по направлению с силой.
- •Вес тела – сила, приложенная к опоре или подвесу, которые удерживают тело от свободного падения. При неподвижной опоре (подвесе) или при их равномерном движении вес тела равен силе тяжести.
7.7 Уравнение состояния идеального газа
Опытным путем было получено
отношение![]() ,
которое равно постоянной велечине.
,
которое равно постоянной велечине.
При условии, что газ имеет Р = 1,01∙105Па,
Т = 273 К, V = 22,4·10-3 м3/моль (нормальные условия).
![]() .
.
Полученное значение называется универсальной газовой постоянной и обозначается R. В соответствии с принятым обозначением для одного моля газа
![]() .
.
Для идеального газа молярной массой μ и массой M
![]() (7.16)
(7.16)
где ν – число молей в газе массой М.
Уравнение (7.16) носит название уравнения Менделеева-Клапейрона. Преобразуем его, умножив числитель и знаменатель на число Авогадро
![]()
где k = R/NА = 8,31/6,023·1023 = 1,38·10-23Дж/К постоянна Больцмана,
N = ![]() NA
— число молекул в
газемассой М.
NA
— число молекул в
газемассой М.
Учитывая приведенные выше обозначения и определение концентрации n = N/V, запишем
![]()
![]() 7.17)
7.17)
Давление идеального газа зависит только от концентрации молекул и температуры газа, но не зависит от массы молекул. В случае механической смеси газов, не вступающих в химические реакции, давление определяется по формуле Р = nkT,
где n=n1+n2+n3+…ni – суммарная концентрация смеси.
Приравняем правые части уравнений (7.15.)(7.17):
![]()
и определим энергию поступательного движения молекулы
![]() 7.18)
7.18)
Средняя кинетическая энергия хаотического движения молекул идеального газа прямо пропорциональна его абсолютной температуре и является мерой интенсивности теплового движения молекул. Соответственно температура
![]()
Лекция 9
Глава 8. Основы термодинамики
8.1. Термодинамическая система. Внутренняя энергия идеального газа
Термодинамическая система (ТС) - это совокупность макроскопических тел обменивающихся энергией в форме работы и тепла как друг с другом, так и внешней средой.
Внутренняя энергия системы Uскладывается из внутренних энергий тел, входящих в данную систему и является однозначной функцией параметров ее состоянияP,V,T:U=f(P,V,T).
Изменение внутренней энергии ΔUпри переходе системы из одного состояния в другое не зависит от вида процесса (ΔU=U2 –U1). Если система совершает круговой процесс, то изменение ее внутренней энергии не происходит.
Внутренняя энергия идеального газа складывается из хаотического поступательного, вращательного и колебательного движения молекул.
Внутренняя энергия одного моля идеального
газа равна произведению средней энергии
одной молекулы
![]() и числа АвогадроNA:
и числа АвогадроNA:
![]() .
.
Внутренняя энергия произвольной массы М идеального газа
![]() .
(8.1)
.
(8.1)
где μ – молярная масса; М/ μ – число молей.
Внутренняя энергия идеального газа зависит только от его температуры.
8.2. Работа и теплопередача
Обмен энергией между (ТС) и окружающими ее телами может проходить в двух формах: макроскопической (в форме работы) и микроскопической (в форме теплопередачи, или теплооборота).
Работа– это мера обмена энергией между рассматриваемой (ТС) и окружающими ее телами, в результате которого изменяются ее параметрыP,V,T. Так, при расширении (ТС) совершает работу против внешних сил и отдает свою энергию. В качестве примера рассмотрим расширение газа в цилиндре с поршнем (рис. 7.1). Предположим, что газ расширяется равновесно, т. е. в любой момент времени внешнее давление Рвнпрактически равно давлению газа под поршнем Р. При перемещении поршня наdх силаFсовершает работуdА =Fdх и создает давление на поршень. Работа газаdА =Fdx=РSdx= РdV, гдеdV– приращение объема при перемещение поршня площадьюSнаdx. При изменении объема газа отV1доV2работа
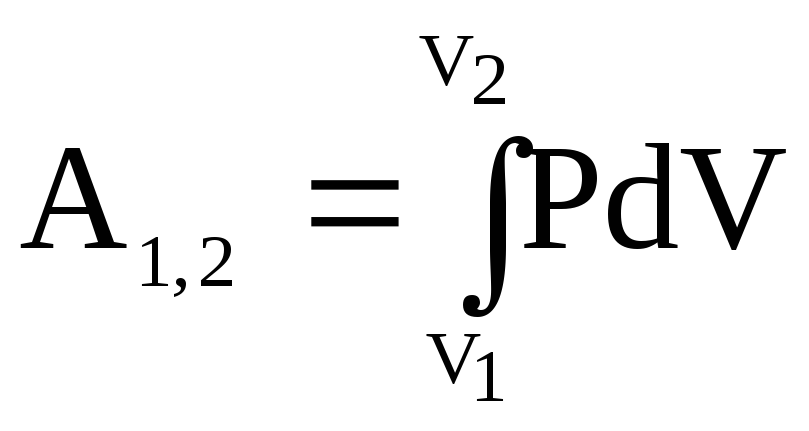 .
(7.2)
.
(7.2)
П риращение
объема может быть как положительным
(dV>0), так и отрицательным
(dV<0). В первом случае
совершается работа над внешними телами
(отдается им часть энергии), во втором
– внешние тела совершают работу
риращение
объема может быть как положительным
(dV>0), так и отрицательным
(dV<0). В первом случае
совершается работа над внешними телами
(отдается им часть энергии), во втором
– внешние тела совершают работу
(ТС система энергию извне).
Состояние ТС, при котором все ее параметры при неизменных внешних условиях изменяются во времени, называется равновесным. Равновесное состояние на РV-диаграмме изображается точкой
(рис. 8.2, 8.3).
b
Переход ТС из одного равновесного
состояния в другое изображается линией.
Работа dА, совершенная ТС
при изменении ее объема наdV,
равна площади заштрихованной полоски
(рис 8.2.). Полная работа перехода ТС из
первого положения во второе А1,2равна площади криволинейной трапеции
под кривой 1,2. Работа зависит от направления
перехода системы из одного состояния
в другое. Так, если ТС переходит из
состояния 1 в состояние 2 один раз по
пути а), а другой по путиb(рис. 7.3), то А1a2![]() А1b2(не равны площади под кривыми перехода).
А1b2(не равны площади под кривыми перехода).
Процесс, при котором ТС, пройдя некоторую
последовательность состояний, вновь
возвращается в исходное, называется
круговым процессом(циклом). Работа,
совершаемая ТС за цикл, отличается от
нуля (Ац![]() 0).
Если цикл идет по часовой стрелке
(1a2c1), то
Ац>0, против часовой стрелки
(1b2c1) Ац<0.
В первом случае ТС отдает энергию, во
втором получает.
0).
Если цикл идет по часовой стрелке
(1a2c1), то
Ац>0, против часовой стрелки
(1b2c1) Ац<0.
В первом случае ТС отдает энергию, во
втором получает.
Теплопередача – процесс передачи энергии неупорядоченного движения молекул от одних тел к другим.
Теплопередача осуществляется либо путем непосредственного взаимодействия частиц системы с частицами среды при их случайных столкновениях, либо путем обмена электромагнитным излучением (лучеиспускание).
Энергия, полученная или отданная ТС в процессе теплообмена, называется количеством теплаδQ.
В зависимости от того, в какой форме
система обменивается энергией с внешними
телами, она может быть замкнутой и
адиабатически замкнутой. В замкнутой
системе отсутствует теплообмен (δ Q= 0) и не совершается работа (А = 0), т.е.
имеет место полная энергетическая
изоляция. В адиабатически замкнутой
системе отсутствует теплообмен (δQ= 0), но совершается работа (А![]() 0).
0).
