
- •Лекция № 7
- •Свойства кислот
- •Перевозка кислот ж/д транспортом
- •Перевозка солей
- •Перевозка солей
- •Элемент Даниэля–Якоби
- •Электрохимическая цепь
- •Измерение ЭДС цепи
- •Стандартный водородный электрод
- •Направление протекания ОВР
- •Задачи
- •Задачи
- •Уравнение Нернста
- •Задача
- •Химические источники тока
- •Химические источники тока
- •Электролиз
- •Электролиз растворов
- •Закон Фарадея
Лекция № 7
Количественные характеристики ОВР
Гальванический элемент

ОВР
Окислительно-восстановительные реакции (ОВР) – реакции, которые идут с изменением с.о. атомов
Степень окисления (с.о.) – заряд, который приписывается атому, считая его ионом
Окислитель (Ox) – принимает электроны. Восстановитель (Red) – отдает электроны
Ox1 + ne– → Red1
Red2 – ne– → Ox2
Ox1 + Red2 Red1 +Ox2
Свойства кислот
Fe 2HCl FeCl2 H2
2Cr 3H2 SO4 разб. Cr2 (SO4 )3 3H2
Ag HNO3конц . AgNO3 NO2 H2O Cu 2H 2SO4конц . CuSO4 SO2 2H2O

Перевозка кислот ж/д транспортом
Кислота |
Цистерны |
HCl |
гуммированные |
HCl (18-25%) ингибированная |
покрытые изнутри |
|
кислотоустойчивой эмалью |
H3PO4 |
из нержавеющей стали |
HNO3 |
с котлом из алюминия |
кислотный меланж (HNO3, 89% / |
из низколегированной |
H2SO4, 7,5% / оксиды азота, 0,3%) |
углеродистой стали |
HNO3разб. |
из коррозионностойкой |
|
нержавеющей стали |
H2SO4 100% (Тзам. 10,3ºС), олеум |
с котлом из нержавеющей стали с |
|
обогревательным устройством |
H2SO4 разб., аккумуляторная (30- |
сернокислотные стальные |
39%) |
|
Перевозка солей
В крытых вагонах в бумажных или полиэтиленовых мешках или специальных контейнерах
Нельзя рядом располагать цистерны и вагоны с веществами, которые энергично взаимодействуют друг с другом
Соли вызывают коррозию стальных вагонов. Защита – полимерные покрытия, стеклоткани
Опасность воспламенения, взрыва:
KClO3
KClO4
NH4 NO3
KCl KClO4
KCl 2O2
N2 1/ 2O2 2H2O

Перевозка солей
Соль |
Перевозка |
NH4NO3 |
пятислойные мешки с двумя |
|
битумированными слоями |
NH4Cl, (NH4)2SO4 |
бумажные мешки |
Ca3(PO4)2, Ca(H2PO4)2 |
битумированные или |
|
полиэтиленовые мешки |
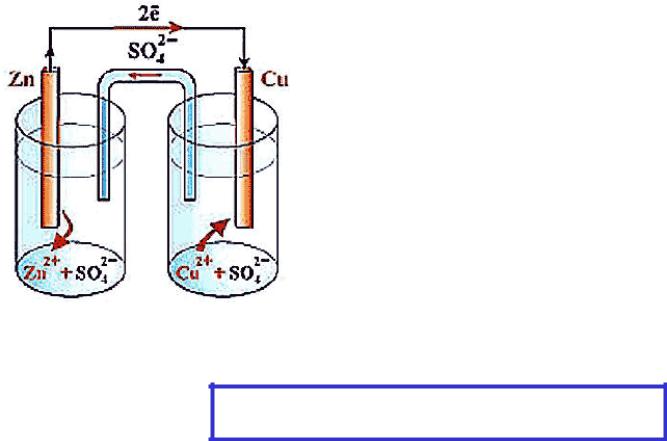
Элемент Даниэля–Якоби
Электрод, на котором происходит процесс окисления – анод
Zn0 – 2e– → Zn2+
Электрод, на котором происходит процесс восстановления – катод
Cu2+ + 2e– → Cu0
CuSO4 + Zn → ZnSO4 + Cu

Электрохимическая цепь
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ |
|
Химический |
(ОВР протекает самопроизвольно) |
|
источник |
|
|
|
|
|
|
A(–) Zn | ZnSO4(C1) || KCl || CuSO4(C2) | Cu (+)K |
|
тока |
|
|
|
ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА |
|
|
|
(ОВР идет в направлении, |
|
|
Электролиз |
противоположном самопроизвольному) |
|
|
|
|
|
||
|
|
||
A(+) Cu | CuSO4(C1) || KCl || ZnSO4(C2) | Zn |
(–)K |
|
|
|
|
|
|

Измерение ЭДС цепи
E = К – А = Ox – Red
Электродвижущая сила (ЭДС) – максимальная работа, совершаемая электрохимической цепью при перемещении единичного (–)-заряда по внешней цепи от анода к катоду.

Стандартный водородный электрод
(р=1 атм) H2, Pt | H+ (a=1) 2H+ + 2e– → H2
0 (H+/H2) = 0 В
(р=1) H2, Pt | H+ (a=1) || Ox (a=1) | Red (a=1)
0 (Ox/Red) > 0 ОВР идет самопроизвольно в прямом направлении
0 (Ox/Red) < 0 ОВР идет самопроизвольно в обратном направлении
