
БХ / Метод 2008 / Занятие АО 1
.docЛабораторно-практическое занятие №18
Тема: Биологическая ценность пищевых белков, процессы переваривания белков и всасывание аминокислот. Общие пути обмена аминокислот (реакции декарбоксилирования, дезаминирования, трансаминирования).
Цель: Изучить процессы переваривания белков в желудочно-кишечном тракте, выработать представления об общих путях превращения аминокислот в организме.
Значение: Белки – важнейшие пластические компоненты диеты, незаменимые источники биогенного азота, необходимые для роста и регенерации. В то же время белки – носители чужеродной антигенной информации и должны гидролизоваться при переваривании, утрачивая антигенность, иначе их неполное расщепление приведет к пищевой аллергии, либо аутоаллергическим эксцессам. Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются катаболизму, а так же специфическим реакциям. Катабализм большенства аминокислот начинается с отщепления ά-аминогруппы в результате двух типов реакций: трансаминирования и дезаминирования. Некоторые аминокислоты могут подвергаться декарбоксилированию. Амины, образовавшиеся в этих реакциях, часто являются биологическиактивными веществами.
Исходный уровень:
1.Строение аминокислот, их классификация.
2. Уровни организации белковой молекулы, типы связей.
3. Классификация, физико-химические свойства белков.
4. Биологическая роль белков, ферментов в организме.
5. Классификация и номенклатура ферментов.
6. Активация зимогенов.
7. Этапы катабализма, их взаимоотношение с биоэнергетическими процессами.
8. Печень, почки, особенности строения и функции.
Вопросы для самоподготовки
-
Содержание белков в важнейших пищевых продуктах животного и растительного происхождения. Пищевые белки как источники аминокислот в организме.
-
Виды азотистого баланса. Азотистое равновесие.
-
Норма белка в питании, белковый минимум.
-
Факторы, определяющие биологическую ценность пищевых белков. Заменимые и незаменимые аминокислоты.
-
Роль соляной кислоты желудочного сока.
-
Заболевания, обусловленные отсутствием или избытком соляной кислоты в желудочном соке (ахлоргидрия, гипохлоргидрия, гиперхлоргидрия).
-
Протеолитические ферменты (протеиназы) желудочного, панкреатического и кишечного соков (пепсин, трипсин, химотрипсин), их функции, субстратная специфичность (избирательность гидролиза пептидных связей).
-
Проферменты протеиназ и механизмы их превращения в ферменты.
-
Роль экзопептидаз (карбоксипептидаза, аминопептидаза, дипептидаза) в образовании дипептидов и свободных аминокислот .
-
Продукты переваривания белков в желудочно-кишечном тракте и их всасывание.
-
Роль печени как диспетчера аминокислот в организме.
-
Гниение белков в кишечнике. Продукты гниения и пути их обезвреживания в печени.
-
Общие пути распада аминокислот в организме.
-
Декарбоксилирование аминокислот, образование биогенных аминов (гистамин, серотонин, -аминомасляная кислота, катехоламины) и их функции.
-
Дезаминирование аминокислот в тканях и его виды. Биологическое значение. Роль пиридоксина в дезаминировании.
-
Трансаминирование аминокислот. Биологическая роль. Роль витамина В6 в реакциях трансаминирования, механизм реакций. Специфичность аминотрансфераз.
Лабораторная работа
18.1. Обнаружение крови в желудочном соке
Особое значение в диагностике и установлении эффективности терапии болезней ЖКТ имеет исследование желудочного содержимого. При некоторых заболеваниях желудка (язва желудка, рак и др.), которые провоцируют повреждение местных сосудов, в желудочном соке может появиться кровь. Реакция на кровь в желудочном соке основана на окислении бензидина пероксидазой крови при участии пероксида водорода.
Ход работы
В пробирку внесите 1 мл исследуемого желудочного сока, 5 капель 0,2% спиртового раствора бензидина и 5 капель 1% раствора пероксида водорода. При наличии крови развивается синее окрашивание – образуется дифенохинондиимин (продукт окисления бензидина).
18.2. Реакция на молочную кислоту в желудочном содержимом
При отсутствии соляной кислоты, обладающей бактерицидными свойствами, в желудке могут развиться процессы брожения, сопровождающиеся накоплением короткоцепочечных (молочной, уксусной и масляной) кислот. Их обнаружение в желудочном содержимом свидетельствует о глубокой гипохлоргидрии или ахлоргидрии.
Ход работы
Для приготовления реактива на молочную кислоту к 1,5 мл 1% раствора фенола добавьте несколько капель 1% раствора хлорного железа и взболтайте. Реактив окрашивается в фиолетовый цвет. Разведите его водой до слабой окраски. В три пробирки налейте по 10 – 15 капель этого реактива, затем в 1-ую пробирку добавьте по каплям 1% раствор молочной кислоты, во 2-ю – исследуемый желудочный сок, в 3-ю - раствор соляной кислоты (контроль). В 1-ой пробирке наблюдается желто-зеленое окрашивание (окраска обусловлена образованием молочнокислого железа). Во 2-ой пробирке желто-зеленое окрашивание разовьется в случае наличия в желудочном содержимом молочной кислоты. В 3-ей пробирке раствор обесцвечивается.
18.3. Определение активности аланин-аминотрансферазы
Аланин-аминотрансфераза (АЛТ) (L-аланин: 2-оксоглутаратаминотранс-фераза) - присутствует в большинстве органов: печени, почках, скелетных мышцах, миокарде, поджелудочной железе. Максимальное количество данного фермента обнаруживается в тканях печени и почек. Его активность в сыворотке (плазме) крови здоровых людей значительно ниже, чем в тканях; при патологии (особенно при заболеваниях печени) активность АЛТ в сыворотке крови существенно повышается. В клетках этот энзим содержится в двух изоформах - цитозольной и митохондриальной, но содержание митохондриального фермента и вероятность его экскреции незначительны, поэтому основная доля плазматической активности АЛТ обусловлена действием цитозольного изоэнзима. Пиридоксальфосфат служит его коферментом. Аланинаминотрансфераза обратимо катализирует реакцию переноса амино- и кетогрупп между L-аланином и остатком -кетоглутаровой кислоты :
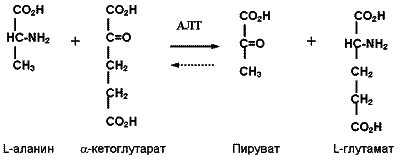
Химизм указанной реакции положен в основу большинства методов определения активности фермента в плазме / сыворотке крови. Для определения активности аланинаминотрансферазы существуют две группы методов: по конечной точке (колориметрические методы с использованием различных красителей) и кинетические (в основном, базирующиеся на методе Варбурга по считыванию восстановления/окисления НАДФН при 340 нм - в ультрафиолетовом спектре). Последние пользуются наибольшей популярностью в современной лаборатории. Метод основан на следующей реакции: пируват, образующийся в результате переаминирования аланина и α-кетоглутарата восстанавливают в лактат путем окисления НАДН+Н+, катализируемого НАД-зависимой лактатдегидрогеназой.
П ируват
+ НАДН+Н+
лактатдегидрогеназа Лактат + НАД+
ируват
+ НАДН+Н+
лактатдегидрогеназа Лактат + НАД+
Уменьшение концентрации НАД·Н при этой реакции ведет к снижению оптической плотности раствора при 340 нм в первые 2-3 минуты реакции и отражает активность АЛТ.
В норме активность фермента в сыворотки крови не должна превышать 45Ед/л.
Контроль выполнения лабораторной работы
1. Можно ли с помощью реакции (18.1) выявить наличие крови в моче?
2. С какой целью в реактив, полученный в работе 18.2, добавляют молочную и соляную кислоты?
3. Почему нормальный желудочный сок не дает положительную реакцию на лактат?
4. Для чего используется пероксид водорода в бензидиновой пробе?
5. Какой принцип лежит в основе определения активности АЛТ?
6. Какова в норме активность АЛТ плазмы.
