
LM / 16
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
________________________________________________________
КАЗАНСКАЯ ГОСУДАРСТВЕННАЯ АРХИТЕКТУРНО-СТРОИТЕЛЬНАЯ АКАДЕМИЯ
Кафедра физики
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНЫМ РАБОТАМ ПО ФИЗИКЕ для студентов специальностей
060811, 060815, 240400, 290300, 290600, 290700, 290800, 291000, 550100
Раздел. Молекулярная физика
Лабораторная работа № 16
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗОВ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЕМЕ
Казань
2001
УДК 530.1
Составители: Ченборисова Л.Я., Заводов И.А. Под редакцией В.В. Алексеева, Л. И. Маклакова
Методические указания к лабораторным работам по физике для студентов специальностей 060811, 060815, 240400, 290300, 290600, 290700, 290800, 291000, 550100.
Лабораторная работа № 16. ″Определение отношения теплоемкостей газов при постоянном давлении и объеме". /Казанская государственная архитектурно-строительная академия. Составители: Ченборисова Л.Я., Заводов И.А. (под редакцией В.В. Алексеева, Л.И. Маклакова). Казань, 2001 г. − 9 с.
В данных методических указаниях представлен весь материал, включая сами задания, теоретические пояснения и справочные данные для выполнения лабораторной работы.
Рецензент: доцент кафедры молекулярной физики Казанского госуниверситета Г. Г. Пименов
© Казанская государственная архитектурно-строительная академия, 2001 г.
Данная лабораторная работа относится к разделу физики «Термодинамика», который рассматривает свойства термодинамических систем, в данном случае воздуха.
Термодинамической системой называется всякая физическая система, состоящая из большого числа частиц – атомов и молекул, которые находятся в беспорядочном тепловом движении и, взаимодействуя между со-
бой, обмениваются энергиями. Такими системами являются газы, жидкости и твердые тела. Состояние системы характеризуется параметрами, такими как температура Т, объем V и давление Р.
Рассмотрим простейшую термодинамическую систему — идеальный газ. Идеальным газом называют газ, в котором можно пренебречь силами притяжения между молекулами и их собственным объемом. Реально су-
ществующие газы обладают свойствами идеального газа при небольших давлениях и не слишком низких температурах. Воздух при обычных условиях ведет себя как идеальный газ.
Состояние некоторой массы идеального газа М определяется через упомянутые выше параметры системы с помощью уравнения Менделее- ва-Клапейрона:
PV = |
М |
RT, |
(1) |
|
|||
|
μ |
|
|
где μ — молярная масса (масса одного моля газа), R — универсальная газовая постоянная.
Одной из важнейших характеристик системы является теплоемкость.
Теплоемкостью С называется физическая величина, численно равная количеству теплоты, необходимой для нагревания системы на 1 градус. Ма-
тематически теплоемкость записывается как
С = |
dQ |
, |
(2) |
|
dT |
||||
|
|
|
||
|
|
|
3 |
где dQ — подводимое к системе количество теплоты, нагревающее ее на dT градусов.
Ясно, что количество теплоты, необходимое для нагревания системы на 1 градус, зависит от массы вещества. Поэтому вводят понятие удельной и молярной теплоемкости. Удельная теплоёмкость с численно равна количеству теплоты, необходимому для нагревания единицы массы вещества на один градус. В случае молярной теплоемкости Сμ берётся масса 1 моля. Между двумя типами теплоёмкости существует взаимосвязь
Сμ = μ с
Теплоемкость газов зависит от условий нагревания. Эта зависимость может быть установлена на основе первого закона термодинамики. Если газу сообщить некоторое количество теплоты, то он нагревается и, при этом за счет расширения совершает работу против внешних сил. Первый закон термодинамики утверждает: теплота, сообщенная системе, расходуется на увеличение ее внутренней энергии dU и на совершение работы dA против внешних сил:
|
|
dQ = dU + dA. |
(3) |
|||
Подставляя это выражение в (2) , получим |
|
|
||||
|
|
С = |
dQ |
= dU |
+ dA . |
(4) |
|
|
|
dT |
dT |
dT |
|
|
|
|
|
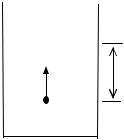
Определим выражение работы |
dA |
|
|
|
|
при расширении газа, находящегося под |
|||
|
|
|
поршнем в цилиндре (рис.1). Если при |
|||
|
|
|
||||
|
|
|
нагревании газ расширяется и поршень |
|||
|
dV F |
d h |
||||
|
под действием силы F сдвигается на рас- |
|||||
|
|
|
стояние dh, то работа равна |
|
||
|
|
|
|
|||
|
S |
|
|
dA = F·dh = p· S·dh или |
|
|
|
|
|
|
dA = p·dV, |
(5) |
|
Рис. 1 |
где |
p = |
F |
– давление газа; S – площадь |
|
|
|||||
|
|
|
S |
|
|
|
поршня; dV =S·dh – приращение объема. |
||||
Подставляя (5) в (4), получим общее выражение для теплоемкости: |
|
||||
C = dQ |
= dU |
+ P dV |
(6) |
||
dT |
dT |
|
dT |
|
|
4
Рассмотрим выражение теплоемкостей в зависимости от условий нагревания газа или, иначе говоря, от типа происходящего процесса. В термодинамике различают четыре различных процесса: изохорический , изобарический, изотермический и адиабатический.
1. Изохорический процесс. Изохорическим называется процесс нагревания или охлаждения газа при постоянном объеме ( V = const ). Это означает, что dV = 0. Как следует из (5), элементарная работа dA = p·dV . Поэтому, для изохорического процесса dA = 0 и все сообщаемое газу тепло идет на увеличение его внутренней энергии.
dQ = dU
Таким образом, исходя из уравнения (6), мы получаем выражение для теплоемкости, которая называется теплоемкостью при постоянном объеме и обозначается как СV:
C = dU . |
(7) |
V dT
2. Изобарический процесс — процесс, происходящий при постоянном давлении (Р = const, dР = 0). Уравнение (6) для изобарического процесса с учетом (7) запишется:
C |
P |
=C |
+ P dV |
(8) |
|
|
V |
dT |
|
||
|
|
|
|
|
|
Величина СP называется теплоемкостью при постоянном давлении. Рассмотрим вид этого уравнения для случая идеального газа. Из уравнения
(1) для одного моля газа (М = μ) имеем:
P·V = R·T
Продифференцируем обе части этого равенства по Т. Тогда
P dVdT = R ,
поскольку P = const . Подставляя это в (8), находим выражение, называе-
мое уравнением Майера,
СμP = CμV + R |
(9) |
Отметим, что уравнение Майера справедливо только для молярных теплоемкостей.
Из (9) следует, что СμP > СμV . Это объясняется следующим образом. Из первого закона термодинамики (уравнение 3) следует, что при изобарическом процессе теплота, сообщенная газу, идет не только на нагрева-
5
ние газа, но и на совершение газом работы при его расширении. При постоянном же объеме газ не расширяется и поэтому работы не совершает. Тогда все подводимое газу тепло идет только на его нагревание. Следовательно, чтобы нагреть газ на один градус при постоянном давлении потребуется большее количество теплоты, чем при постоянном объеме. В силу этого теплоемкость СP при постоянном давлении больше, чем теплоемкость СV при постоянном объеме.
Необходимо отметить, что для твердых и жидких тел, вследствие их малого теплового расширения, теплоемкости СP и СV практически равны.
3. Изотермический процесс. Процесс, протекающий при постоянной температуре, называется изотермическим. Так как Т = const, то dT = 0 и
dQ = dA, |
(10) |
т.е. внутренняя энергия газа остается постоянной и все подводимое тепло идет на выполнение работы. Ясно, что понятие теплоемкости при постоянной температуре смысла не имеет.
4. Адиабатический процесс. Процесс называется адиабатическим, если он протекает без теплообмена с окружающей средой (dQ = 0). Для такого процесса первый закон термодинамики (уравнение 3) имеет вид :
dA = - dU = - C·dT, |
(11) |
т.е. работа совершается газом только за счет изменения внутренней энергии. Отсюда P·dV = - C·dT. Поэтому при адиабатическом расширении температура газа понижается, а при сжатии — повышается. Адиабатический процесс описывается уравнением Пуассона (уравнение адиабаты):
P·V γ = сonst, |
(12) |
где γ = СP/CV — показатель адиабаты или называемый также коэффициент Пуассона.
С точки зрения молекулярно-кинетической теории теплоемкость газа зависит от числа степеней свободы молекул газа. Числом степеней свобо-
ды i молекул называют число независимых механических движений, в ко-
торых они могут участвовать. Например, атом может двигаться относительно трех координатных осей X, Y и Z, и поэтому он обладает тремя степенями свободы поступательного движения ( i = 3 ); жесткая двухатомная молекула может двигаться поступательно и при этом вращаться относительно двух осей. Следовательно, она обладает пятью степенями свободы
(i = 5 ).
Молярная теплоемкость газа CμV при постоянном объеме находится по формуле:
6
СμV= |
i |
R . |
(13) |
|
2 |
||||
|
|
|
Тогда молярная теплоемкость газа Сμρ при постоянном давлении равна
CμP= CμV + R = |
i + 2 |
R |
(14) |
|
|||
2 |
|
|
|
Из (13) и (14) следует, что отношение γ теплоемкостей при постоянном давлении и объеме равно
γ = |
i + 2 |
. |
(15) |
|
|||
|
i |
|
|
Следует подчеркнуть, что, согласно классической теории, газы, независимо от их природы, должны обладать одинаковыми теплоемкостями, если число степеней свободы их молекул одинаково. Учитывая, что воздух состоит в основном из двухатомных газов (кислород, азот), можно подсчитать теоретическое значение γ.
ОПИСАНИЕ УСТАНОВКИ
Установка состоит из большого стеклянного сосуда, в верхней части которого имеется кран-клапан, насоса и манометра. Они соединены между собой резиновыми шлангами и представляют собой единую герметическую систему. Насос служит для накачивания воздуха в сосуд, манометр — для измерения избыточного (над атмосферным) давления в сосуде. С помощью крана-клапана сосуд соединяется с атмосферой. Если накачать в сосуд немного воздуха, то давление и температура воздуха в сосуде повысятся. Затем, вследствие передачи тепла через стенки сосуда, температура воздуха в сосуде понизится до комнатной, а давление P в сосуде станет равным P = Рo + Р1, где Рo — атмосферное давление, а Р1 — избыточное давление, измеряемое манометром.
Откроем кран-клапан на очень короткое время. Держим его открытым до тех пор, пока уровни в обоих коленах манометра не сравняются. В этом случае давление внутри сосуда станет равным атмосферному. Вследствие кратковременности процесса расширение воздуха в сосуде можно считать адиабатическим, так как приток тепла в сосуд через его стенки очень мал. Адиабатическое же расширение воздуха приводит к его охлаждению. Затем воздух в сосуде начинает нагреваться до комнатной температуры за счет получения тепла через его стенки. Это приводит к тому, что давление воздуха в сосуде увеличивается и становится равным Рo + Р2 , где P2 – избыточное давление в сосуде , измеряемое по тому же манометру.
7
Можно показать, что отношение γ теплоемкостей при постоянном давлении и объеме связано с избыточными давлениями Р1 и Р2 соотношением
γ = |
|
P1 |
. |
(16) |
|
P |
− P |
||||
|
|
|
|||
|
1 |
2 |
|
|
|
Но Р1 = ρ·g·h1 и Р2 = ρ·g·h2, где |
ρ |
— плотность жидкости, залитой в |
|||
манометр; g — ускорение свободного падения; h1 и h2 — разность уровней столбика жидкости в коленах манометра в начале и конце опыта соответственно.
Тогда из формулы (16) получаем |
|
|
|||
γ = |
|
h1 |
. |
(17) |
|
h |
− h |
||||
|
|
|
|||
|
1 |
2 |
|
|
|
ПОРЯДОК ВЫПОЛНЕНИЯ
1.Осторожно накачать воздух в сосуд до тех пор, пока разность уровней жидкости в манометре не достигнет примерно 15 — 20 см. Дождаться стабильного положения уровней и произвести отсчет разности уровней в обоих коленах манометра.
2.Быстрым нажатием сверху открыть кран-клапан на такое время, чтобы уровни в манометре выровнялись и сразу закрыть кран, отпустив клапан. Когда давление окончательно установится, записать разность уровней.
3.Повторить опыт не менее 5 раз. Для каждого раза вычислить γn по формуле (17)
Результаты измерений записать в таблицу.
Таблица |
|
|
γn |
|
№ |
разность уровней |
среднее |
||
|
|
|
|
значение |
|
h1 |
h2 |
|
γср |
1
2
3
4
5
Подсчитать погрешность измерения γcp по формулам прямых измерений (смотрите методическое указание «Основы обработки результатов измерений»).
8
4.Учитывая, что воздух состоит в основном из двухатомных газов (кислород, азот), подсчитать теоретическое значение γ теор по формуле (15).
5.Объяснить основные причины, вызывающие отклонение экспериментального значения от теоретического.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что такое термодинамическая система и параметры состояния ?
2.Какой газ называется идеальным?
3.Запишите уравнение Менделеева-Клапейрона. В чем смысл этого уравнения ?
4.Дайте определения теплоемкости, удельной и молярной теплоемкости.
5.Сформулируйте первый закон термодинамики.
6.Запишите выражение работы при расширении газа , находящегося под поршнем.
7.Запишите 1 закон термодинамики для изопроцессов.
8.Почему теплоемкость газа при постоянном давлении больше теплоемкости газа при постоянном объеме?
9.Выведите уравнение Майера.
10.Дайте определение адиабатического процесса. Запишите уравнение Пуассона.
11.Почему при адиабатическом расширении газа его температура изменяется ?
12.Что называется числом степеней свободы? Чему оно равно для двухатомного газа?
13.Выразите коэффициент Пуассона через число степеней свободы. Чему он равен для воздуха (приблизительно)?
14.Укажите причину разногласия теоретического и экспериментального значений коэффициента Пуассона для воздуха.
9
