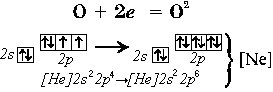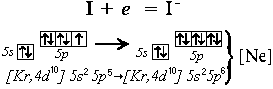- •Кафедра химии и экологии в строительстве
- •Общие методические указания
- •Контрольная работа
- •Раздел 1. Моль. Эквиваленты и эквивалентные массы простых и сложных веществ. Закон эквивалентов.
- •Основные физические величины
- •Основные понятия
- •1.2. Теоретическая часть.
- •Эквиваленты и молярные массы эквивалентов
- •Контрольные задания
- •Раздел 2. Строение атома и периодическая система элементов д.И.Менделеева
- •2.1. Электронная структура атома.
- •Электроотрицательности элементов по шкале л. Полинга
- •Примеры образования ионов за счет отдачи или присоединения электронов атомами
- •Контрольные задания
- •Раздел 3. Химическая связь
- •Примеры электронных формул атомов
- •Сравнение видов химической связи.
- •Метод валентных связей
- •Метод молекулярных орбиталей
- •Контрольные задания
- •Раздел 4. Основные классы неорганических соединений. Классификация сложных неорганических веществ.
- •Оксиды и их классификация.
- •Основания. Свойства и классификация оснований. Щелочи.
- •Амфотерные основания.
- •Соли. Названия и классификация солей.
- •Соли. Получение и химические свойства.
- •Контрольные задания
- •Раздел 5. Основы химической термодинамики. Общие закономерности протекания химических процессов
- •Внутренняя энергия и энтальпия
- •Термохимия. Термохимические уравнения. Термохимические расчёты
- •Энергия гиббса
- •Контрольные задания
- •Контрольная работа № 2
- •Раздел 6. Основы химической кинетики
- •Химическая кинетика и катализ.
- •Химическое равновесие.
- •Контрольные задания
- •Раздел 7. Способы выражения концентрации растворов. Свойства растворов. Температура кипения и замерзания растворов.
- •Контрольные задания
- •Раздел 8. Окислительно-восстановительные реакции.
- •Классификация. Различают четыре типа окислительно-восстановительных реакций.
- •Контрольные задания
- •Раздел 9. Гидролиз солей.
- •Водородный показатель (рН): в воде всегда присутствует немного катионов водорода и гидроксидионов, которые образуются в результате обратимой диссоциации:
- •Контрольные задания
- •Раздел 10. Коллоидные растворы Общие сведения
- •Классификация дисперсных систем.
- •Свободная поверхностная энергия и устойчивость дисперсных систем.
- •Образование высокодисперсных систем.
- •Внутренняя структура коллоидных частиц
- •Свойства коллоидных растворов
- •Оптические свойства коллоидных растворов
- •Молекулярно-кинетические свойства коллоидных растворов
- •Электрические свойства коллоидных растворов
- •Коагуляция
- •Контрольные задания
- •Варианты контрольных заданий
Примеры образования ионов за счет отдачи или присоединения электронов атомами
|
Na0 – e- = Na+
[He]3s1→[He] 3s0 |
F0 + e- = F-
|
|
Ba0 – 2e- = Ba2+
[He]6s2→[He] 6s0 |
O0 + 2e- = O2-
|
|
Al0 – 3e- = Al3+
[Ne]3s2 3p1→[Ne] 3s03p0 |
I0 + e- = I-
|
|
Mn0 – 2e- = Mn2+
|
N0 + 3e- = N3-
|
Контрольные задания
Определите количество протонов и нейтронов в ядре атома платины.
При бомбардировке нейтронами изотопов
 B
и
B
и
 Mn
выделяется частица
и образуются изотопы
Mn
выделяется частица
и образуются изотопы
 Li
и
Li
и
 V.
Составьте в полной и сокращенной формах
уравнения протекающих ядерных реакций.
V.
Составьте в полной и сокращенной формах
уравнения протекающих ядерных реакций.
Электрон в атоме характеризуется набором квантовых чисел: n = 3, l = 1, ml = 0. Какая форма записи отражает энергетическое состояние электрона?
Какой энергетический подуровень заполняется электронами раньше: 5s или 4d; 6s или 5p и почему?
Составьте электронные формулы атомов элементов № 20 и № 53. На каких энергетических уровнях и подуровнях находятся валентные электроны?
Определите, каким элементам соответствуют приведенные электронные структуры:
а) …. 4s2 3d6,
б) …. 6s2 5d1 4f7,
в) …. 5s2 4d10 5p2?
Заряды ядер элементов в периодической системе непрерывно увеличиваются, а свойства простых веществ повторяются периодически. Как это объяснить?
Почему водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в то же время в скобках в первой. Приведите примеры реакций, доказывающих двойственную химическую природу водорода.
Чем обусловлена высокая химическая активность щелочных металлов? Составьте электронные схемы строения атомов натрия и цезия. У какого из этих элементов ярче выражены металлические свойства и почему?
Составить электронные формулы атомов элементов с порядковыми номерами 16 и 22. Показать распределение электронов этих атомов по атомным электронным орбиталям.
Составить электронную и электронно-графическую формулы атома кремния в нормальном и возбужденном состояниях.
Какой подуровень заполняется в атоме электронами после заполнения подуровня 4р? Ответ объяснить.
Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составить формулы соединений данных элементов, отвечающих этим степеням окисления.
У какого из элементов четвертого периода – марганца или брома сильнее выражены металлические свойства?
При бомбардировке нейтронами изотопов
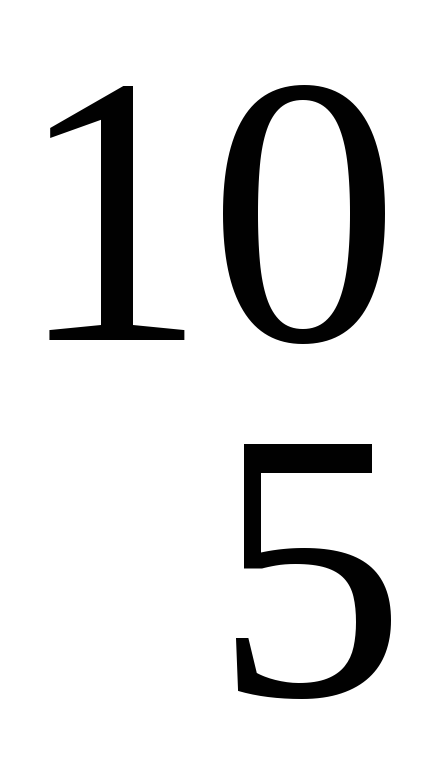 B
и
B
и
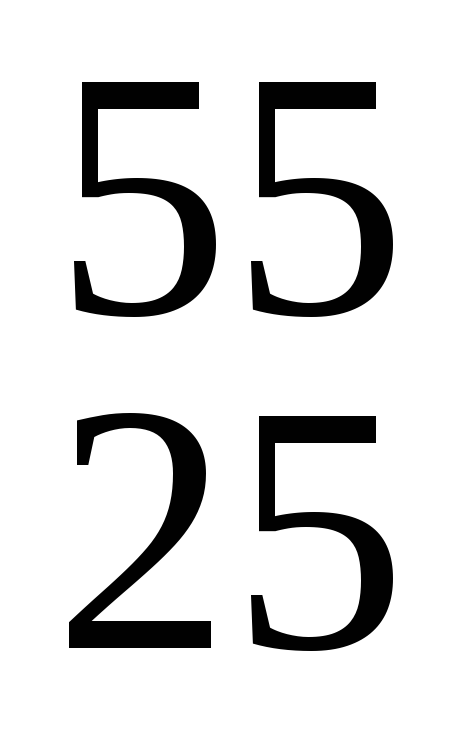 Mn
выделяется a-частица
и образуются изотопы
Mn
выделяется a-частица
и образуются изотопы
 Li
и
Li
и
 V.
Составьте в полной и сокращенной формах
уравнения протекающих ядерных реакций.
V.
Составьте в полной и сокращенной формах
уравнения протекающих ядерных реакций.
Электрон в атоме характеризуется набором квантовых чисел: n = 3, l = 1, ml = 0. Какая форма записи отражает энергетическое состояние электрона?
Какой энергетический подуровень заполняется электронами раньше: 5s или 4d; 6s или 5p и почему?
Составьте электронные формулы атомов элементов № 20 и № 53. На каких энергетических уровнях и подуровнях находятся валентные электроны?
Составить электронную формулу элемента с порядковым номером 82. По форме записи определить, в каком периоде и группе находится данный элемент, и какому семейству он принадлежит. Составить графическую схему заполнения электронами валентных орбиталей атома этого элемента в нормальном и возбужденном состояниях.
Напишите электронные формулы атомов углерода и серы и формулы соединений их с кислородом и водородом.
Изобразите электронные и электронно-графические формулы атомов 5В и 21Sc. Укажите валентные электроны. К какому семейству относятся атомы данных элементов?
Рассчитайте среднюю массу атома хлора.
Из какого числа атомов состоят 1г и 1 см3 магния?
Указать возможные степени окисления элемента 9F? Докажите на основании электронной конфигурации данного атома.
Указать возможные степени окисления элемента 32Ge? Докажите на основании электронной конфигурации данного атома.
Какой инертный газ и ионы каких элементов имеют одинаковую электронную конфигурацию с частицей, возникающей в результате удаления из атома кальция всех валентных электронов?
Могут ли электроны иона Аl3+ находиться на следующих орбиталях: а) 2р; б) 1р; в) 3d?
Напишите электронную конфигурацию атома неона в первом возбужденном состоянии.
Каков состав ядер изотопов 12C и 13C, 14N и 15N?
У какого из перечисленных ниже соединений наименее выражены кислотные свойства?
А) HNO3, б) H3PO4, в) H3AsO4, г) H3SbO4.