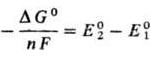- •5 Уравнение Нернста
- •6 Электродвижущая сила (эдс)
- •7Схема гальванического элемента (протекание процесса хорошо рассматривается на примере нитрата серебра AgNo3)
- •8 Электролиз (отличие от гальванического элемента, энергия Гиббса)
- •13) Закон Генри
- •14) Закон действующих масс для разбавленных растворов
- •15) Полимерные растворы электролитов
- •16)Теория Аррениуса (теория электролитической диссоциации)
- •17. Закон Стокса
- •18. Закон Ома для растворов электролитов
- •19. Электропроводность электролитов
- •20. Активность сильных электролитов
- •21 Способы определения активности электролитов
- •22 Типы электродов:
- •23 Как рассчитать стандартный потенциал:
21 Способы определения активности электролитов
Существует шесть основных экспериментальных способов определения активности электролитов:
Измерение давления пара растворенного вещества.
Определение коэффициента распределения между двумя несмешивающимися растворителями.
Измерение давления пара растворителя.
Определение температур замерзания.
Измерения растворимости в присутствии посторонних солей.
Измерения электродвижущих сил.
22 Типы электродов:
Обратимые и не обратимые
На обратимых электродах при изменении направления тока протекает та же реакция, но в обратном направлении. На необратимых электродах при перемене направления тока возникает новый химический процесс.
По природе окислителей и восстановителей, которые участвуют в электродном процессе, обратимые электроды подразделяются на следующие классы: а) Электроды 1-го рода – металл в контакте с раствором своей соли. Эти электроды являются основой конструкций большинства гальванических элементов.
б) Электроды 2-го рода – на поверхность металла наносится слой его труднорастворимой соли, а раствор содержит анионы этой соли. Используются для определения произведения растворимости (ПР) солей.
в) Электроды 3-го рода (окислительно-восстановительные электроды) – платиновая пластина, погруженная в раствор смеси веществ, содержащей химический элемент в различных степенях окисления. С помощью таких электродов определяются электрохимические потенциалы окислительно-восстановительных реакций.
г) Ионообменные (ионоселективные) электроды – мембранные конструкции, содержащие растворы солей, ионы которых могут проходить сквозь мембрану. Применяются для измерения концентраций ионов.
23 Как рассчитать стандартный потенциал:
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейкивытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установленводородный электрод, для которого этот потенциал принят равным 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0,036 В
Fe2+ + 2e− → Fe(тв) −0,44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0,77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
И еще
Для любой электродной р-ции, включающей перенос n электронов,электродный потенциалопределяется ур-нием:
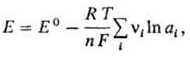
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F-постоянная Фарадея, аi-термодинамич. активностьчастиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электронывходят в левую часть ур-ния, напр. AgCl + е : Ag + С1-). Значения стандартных потенциалов для ряда электродных процессовв водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалыметалловиводорода, расположенные в порядке их возрастания, составляютэлектрохимический ряд напряжений.
Стандартный
потенциал определяется либо
непосредственными измерениями эдс
соответствующих электрохим. цепей с
экстраполяцией на бесконечно разб.
р-ры, либо расчетом - по данным о стандартных
значениях измененияэнергии
Гиббсахим. р-ции DG0.
В последнем случае р-цию представляют
в виде суммы двух (или более) электродных
р-ций, одна из к-рых -окис-лит.-восстановит.
р-ция с искомым стандартным потенциалом ![]() ,
а другая-с известным стандартным
потенциалом .
,
а другая-с известным стандартным
потенциалом .![]() .
Если в условной схеме ячейки
1-йэлектродзаписан
слева, то
.
Если в условной схеме ячейки
1-йэлектродзаписан
слева, то