
- •от автора
- •СОКРАЩЕНИЯ, ВСТРЕЧАЮЩИЕСЯ В ЛЕКЦИЯХ
- •Аминокслоты и белки
- •Нуклеотиды
- •Витамины
- •Ферменты
- •Углеводы
- •Липиды
- •Гормоны
- •СТРОЕНИЕ, СВОЙСТВА И КЛАССИФИКАЦИЯ АМИНОКИСЛОТ И БЕЛКОВ
- •КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
- •По абсолютной конфигурации молекулы
- •По оптической активности
- •По участию аминокислот в синтезе белков
- •АМИНОКИСЛОТЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •СТРОЕНИЕ И СВОЙСТВА ПЕПТИДНОЙ СВЯЗИ
- •ФУНКЦИИ БЕЛКОВ
- •УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВОЙ СТРУКТУРЫ
- •Первичная структура
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Амфотерность
- •Влияние рН на заряд белка
- •Растворимость
- •МЕТОДЫ ОСАЖДЕНИЯ БЕЛКОВ
- •Денатурация
- •Обратимое осаждение
- •Высаливание
- •Осаждение водоотнимающими средствами
- •Изменение рН
- •СВОЙСТВА БЕЛКОВЫХ РАСТВОРОВ
- •КЛАССИФИКАЦИЯ БЕЛКОВ
- •А. По функции
- •Б. По строению
- •1. По форме молекулы
- •2. По количеству белковых цепей в одной молекуле
- •3. По химическому составу
- •КЛАССИФИКАЦИЯ ПРОСТЫХ БЕЛКОВ
- •Альбумины
- •Глобулины
- •Гистоны
- •Протамины
- •Коллаген
- •Эластин
- •СТРОЕНИЕ И КЛАССИФИКАЦИЯ СЛОЖНЫХ БЕЛКОВ
- •Нуклеопротеины
- •Фосфопротеины
- •Липопротеины
- •Хромопротеины
- •Гемопротеины
- •Цитохромы
- •Флавопротеины
- •Металлопротеины
- •Гликопротеины (гликоконъюгаты)
- •Гликопротеины
- •Протеогликаны
- •Гликопротеины
- •Протеогликаны
- •ВИТАМИНЫ, ИХ КОФЕРМЕНТНЫЕ ФОРМЫ, ФУНКЦИИ
- •Общая характеристика
- •ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
- •Источники
- •Суточная потребность
- •Метаболизм
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Гипервитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Гипервитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Антивитамины
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины В1
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины В2
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •ФЕРМЕНТЫ, СВОЙСТВА, КЛАССИФИКАЦИЯ, РЕГУЛЯЦИЯ АКТИВНОСТИ
- •ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
- •МЕХАНИЗМЫ КАТАЛИЗА
- •ТИПЫ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •СХОДСТВО И ОТЛИЧИЯ ФЕРМЕНТОВ И НЕОРГАНИЧЕСКИХ КАТАЛИЗАТОРОВ
- •Сходство
- •Отличия
- •СТРОЕНИЕ ФЕРМЕНТОВ
- •Изоферменты
- •Мультиферментные комплексы
- •ПРИНЦИПЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ
- •СВОЙСТВА ФЕРМЕНТОВ
- •СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
- •Механизмы специфичности
- •ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
- •Необратимое ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •ЭНЗИМОПАТОЛОГИИ
- •ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ И ИХ ИНГИБИТОРОВ В МЕДИЦИНЕ
- •Энзимодиагностика
- •Энзимотерапия
- •Использование ингибиторов ферментов
- •КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
- •НОМЕНКЛАТУРА ФЕРМЕНТОВ
- •I класс. Оксидоредуктазы
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •V класс. Изомеразы
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •а. Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Анаболизм
- •Катаболизм
- •I этап
- •II этап
- •III этап
- •ОСНОВНЫЕ ИСТОЧНИКИ ЭНЕРГИИ В КЛЕТКЕ
- •ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ
- •Регуляция пируватдегидрогеназного комплекса
- •ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
- •Регуляция ЦТК
- •ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
- •Краткая характеристика
- •Принцип работы дыхательной цепи
- •Ферментные комплексы дыхательной цепи
- •I комплекс, НАДН-KoQ-оксидоредуктаза
- •IV комплекс, цитохром с – кислород-оксидоредуктаза
- •V комплекс
- •Работа комплексов дыхательной цепи
- •Регуляция окислительного фосфорилирования
- •РАЗОБЩИТЕЛИ
- •ИНГИБИТОРЫ ФЕРМЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ
- •Расчет энергетической ценности коэффициента Р/О при окислении некоторых аминокислот
- •ГИПОЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ
- •ИСПОЛЬЗОВАНИЕ АТФ И ЕГО ПРЕДШЕСТВЕННИКОВ В МЕДИЦИНЕ
- •ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
- •АЗОТИСТЫЙ БАЛАНС
- •ВНЕШНИЙ ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
- •Желудок
- •Регуляция желудочного пищеварения
- •Соляная кислота
- •Пепсин
- •Гастриксин
- •Двенадцатиперстная кишка и тонкий кишечник
- •Регуляция кишечного пищеварения
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Карбоксипептидазы
- •Аминопептидазы
- •Дипептидазы
- •Толстый кишечник
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ БЕЛКА У ДЕТЕЙ
- •ТРАНСПОРТ АМИНОКИСЛОТ ЧЕРЕЗ МЕМБРАНЫ
- •НАРУШЕНИЕ ПРОЦЕССОВ ПЕРЕВАРИВАНИЯ БЕЛКОВ
- •Пищевые аллергии
- •Целиакия
- •Гниение белков в кишечнике
- •ДЕТОКСИКАЦИОННЫЕ СИСТЕМЫ ПЕЧЕНИ
- •Микросомальное окисление
- •Конъюгация
- •Образование животного индикана
- •ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ
- •Судьба аминокислот в клетке
- •Превращение аминокислот по радикалу
- •Превращение аминокислот по карбоксильной группе
- •Гистамин
- •Физиологические эффекты
- •Серотонин
- •Физиологические эффекты
- •Физиологические эффекты
- •Дофамин
- •Физиологические эффекты
- •Обезвреживание биогенных аминов
- •Превращение аминокислот с участием аминогруппы
- •Типы дезаминирования
- •Окислительное дезаминирование
- •Прямое окислительное дезаминирование
- •Непрямое окислительное дезаминирование (трансдезаминирование)
- •Механизм трансаминирования
- •Дезаминирование
- •Энзимодиагностика с помощью аминотрансфераз
- •Роль трансаминирования и трансдезаминирования
- •Обмен и роль креатина
- •ОБРАЗОВАНИЕ И УБОРКА АММИАКА
- •ОСНОВНЫЕ ИСТОЧНИКИ АММИАКА В ОРГАНИЗМЕ
- •СВЯЗЫВАНИЕ АММИАКА
- •ТРАНСПОРТ АММИАКА
- •Глюкозо-аланиновый цикл
- •УДАЛЕНИЕ АММИАКА ИЗ ОРГАНИЗМА
- •Синтез мочевины
- •Синтез аммонийных солей
- •ГИПЕРАММОНИЕМИИ
- •Наследственные формы
- •Приобретенные формы
- •ГИПОТЕЗЫ ТОКСИЧНОСТИ АММИАКА
- •ЧАСТНЫЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ И ИХ НАРУШЕНИЯ
- •ПУТИ ИСПОЛЬЗОВАНИЯ ЦИСТЕИНА
- •Цистиноз
- •Цистиноз ранний нефропатический
- •Цистиноз нефропатический поздний
- •Цистиноз доброкачественный взрослых
- •Основы лечения
- •ПУТИ ИСПОЛЬЗОВАНИЯ ГЛИЦИНА И СЕРИНА
- •ВЗАИМОСВЯЗЬ ОБМЕНА ГЛИЦИНА, СЕРИНА, ЦИСТЕИНА И МЕТИОНИНА
- •Гомоцистеинемия
- •ПУТИ ИСПОЛЬЗОВАНИЯ ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ КИСЛОТ
- •ОБМЕН ФЕНИЛАЛАНИНА И ТИРОЗИНА
- •Катаболизм фенилаланина и его нарушения
- •Фенилкетонурия I (классическая)
- •Фенилкетонурия II
- •Обмен тирозина и его нарушения
- •Тирозинемия типа I
- •Тирозинемия типа II
- •Тирозинемия новорожденных
- •Алкаптонурия
- •Альбинизм
- •Паркинсонизм
- •Лейциноз (болезнь мочи с запахом кленового сиропа)
- •Изовалератацидемия
- •ОБМЕН ТРИПТОФАНА
- •Синдром Хартнупа (триптофанурия)
- •СТРОЕНИЕ И ОБМЕН НУКЛЕОТИДОВ
- •ВНЕШНИЙ ОБМЕН НУКЛЕОПРОТЕИНОВ
- •ПУРИНОВЫЕ НУКЛЕОТИДЫ
- •Синтез пуриновых оснований и нуклеотидов
- •Регуляция синтеза пуриновых нуклеотидов
- •Внутриклеточная регуляция
- •Лекарственная регуляция
- •Распад пуриновых нуклеотидов
- •Реутилизация пуриновых оснований
- •НАРУШЕНИЕ ОБМЕНА ПУРИНОВЫХ ОСНОВАНИЙ
- •Подагра
- •Основы лечения
- •Мочекаменная болезнь
- •Основы лечения
- •Синдром Леша-Нихана
- •ПИРИМИДИНОВЫЕ НУКЛЕОТИДЫ
- •Синтез пиримидиновых оснований и нуклеотидов
- •СИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ
- •Синтез тимидилтрифосфата
- •Регуляция синтеза пиримидинов
- •Физиологическая регуляция
- •Лекарственная регуляция
- •Распад пиримидиновых оснований
- •Реутилизация пиримидиновых оснований
- •НАРУШЕНИЕ ОБМЕНА ПИРИМИДИНОВЫХ ОСНОВАНИЙ
- •Оротатацидурия
- •Наследственная форма
- •Приобретенная форма
- •НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •МАТРИЧНЫЕ БИОСИНТЕЗЫ
- •ОСНОВНОЙ ПОСТУЛАТ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
- •СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
- •Строение дезоксирибонуклеиновой кислоты
- •Строение хроматина
- •Строение рибонуклеиновых кислот
- •РЕПЛИКАЦИЯ ДНК
- •ПОВРЕЖДЕНИЯ И РЕПАРАЦИЯ ДНК
- •ТРАНСКРИПЦИЯ
- •Стадии транскрипции
- •Инициация
- •Элонгация
- •Терминация
- •Процессинг РНК
- •Процессинг предшественника рРНК
- •Процессинг предшественника мРНК
- •Процессинг предшественника тРНК
- •Регуляция транскрипции
- •Прокариоты
- •Лактозный оперон
- •Триптофановый оперон
- •Эукариоты
- •Внутриклеточная регуляция
- •Лекарственная регуляция
- •Ингибирование
- •Активация
- •ГЕНЕТИЧЕСКИЙ КОД
- •Свойства биологического кода
- •АДАПТОРНАЯ РОЛЬ ТРАНСПОРТНЫХ РНК
- •ТРАНСЛЯЦИЯ
- •Инициация
- •Элонгация
- •Терминация
- •Полирибосомы
- •Посттрансляционная модификация белков
- •Фолдинг белков
- •Лекарственная регуляция трансляции
- •ГЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ
- •СТРОЕНИЕ И ОБМЕН УГЛЕВОДОВ
- •ФУНКЦИИ УГЛЕВОДОВ
- •КЛАССИФИКАЦИЯ
- •Моносахариды
- •Производные моносахаридов
- •Дисахариды
- •Полисахариды
- •Гомополисахариды
- •Гетерополисахариды
- •ИСПОЛЬЗОВАНИЕ УГЛЕВОДОВ В БИОЛОГИИ И МЕДИЦИНЕ
- •ВНЕШНИЙ ОБМЕН УГЛЕВОДОВ
- •Ротовая полость
- •Желудок
- •Кишечник
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ УГЛЕВОДОВ У ДЕТЕЙ
- •Нарушения переваривания дисахаридов
- •Роль целлюлозы в пищеварении
- •ПЕРЕНОС ГЛЮКОЗЫ ЧЕРЕЗ МЕМБРАНЫ
- •Всасывание в кишечнике
- •Транспорт из крови через клеточные мембраны
- •РЕАКЦИИ ВЗАИМОПРЕВРАЩЕНИЯ САХАРОВ
- •Превращение галактозы
- •Нарушения превращения галактозы
- •Превращение фруктозы
- •Нарушения превращения фруктозы
- •Эссенциальная фруктозурия
- •Наследственная фруктозурия
- •СУДЬБА И ИСТОЧНИКИ ГЛЮКОЗЫ В КЛЕТКЕ
- •Фосфорилирование-дефосфорилирование глюкозы
- •МЕТАБОЛИЗМ ГЛИКОГЕНА
- •Синтез гликогена
- •Мобилизация гликогена
- •Регуляция обмена гликогена
- •Активация фосфорилазы гликогена
- •Ковалентная модификация
- •Кальций-зависимая активация
- •Аллостерическая активация
- •ГЛИКОГЕНОВЫЕ БОЛЕЗНИ
- •Гликогенозы
- •Печеночные гликогенозы
- •Мышечные гликогенозы
- •Смешанные гликогенозы
- •Агликогенозы
- •ОКИСЛЕНИЕ ГЛЮКОЗЫ
- •Гликолиз
- •Первый этап гликолиза
- •Второй этап гликолиза
- •Гликолитическая оксидоредукция
- •Энергетический эффект окисления глюкозы
- •Анаэробное окисление
- •Аэробное окисление
- •Эффект Пастера
- •Челночные системы
- •Глицеролфосфатный челночный механизм
- •Малат-аспартатный челночный механизм
- •ГЛЮКОНЕОГЕНЕЗ
- •Обход десятой реакции гликолиза
- •Обход третьей реакции гликолиза
- •Обход первой реакции гликолиза
- •Взаимосвязь гликолиза и глюконеогенеза
- •Регуляция гликолиза и глюконеогенеза
- •Регуляция глюконеогенеза
- •Регуляция гликолиза
- •СИНТЕЗ ГЛЮКОЗЫ ИЗ АМИНОКИСЛОТ
- •МЕТАБОЛИЗМ ЭТАНОЛА
- •Утилизация этанола
- •Спиртовое брожение
- •ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ОКИСЛЕНИЯ ГЛЮКОЗЫ
- •Значение пентозофосфатного пути
- •Нарушения пентозофосфатного пути
- •РЕГУЛЯЦИЯ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ В КРОВИ
- •Снижение глюкозы крови
- •Повышение глюкозы крови
- •Гипергликемические состояния
- •Сахарный диабет
- •Причины
- •Сравнительная характеристика типов сахарного диабета
- •Осложнения сахарного диабета
- •Быстрые последствия
- •Отдаленные последствия
- •СТРОЕНИЕ И ОБМЕН ЛИПИДОВ
- •КЛАССИФИКАЦИЯ ЛИПИДОВ
- •ФУНКЦИИ ЛИПИДОВ
- •СТРОЕНИЕ ЛИПИДОВ
- •Жирные кислоты
- •Роль жирных кислот
- •Типы эйкозаноидов
- •Синтез эйкозаноидов
- •Лекарственная регуляция синтеза
- •Триацилглицеролы
- •Функции триацилглицеролов
- •Прогоркание жиров
- •Фосфолипиды
- •Глицерофосфолипиды
- •Сфингофосфолипиды
- •Холестерол
- •Функции холестерола
- •Гликолипиды
- •ВНЕШНИЙ ОБМЕН ЛИПИДОВ
- •Ротовая полость
- •Желудок
- •Кишечник
- •СВОЙСТВА, СОСТАВ И ФУНКЦИИ ЖЕЛЧИ
- •Свойства и состав
- •Роль желчи
- •Образование желчных кислот
- •Кишечно-печеночная циркуляция
- •Нарушение желчеобразования
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ ЛИПИДОВ У ДЕТЕЙ
- •НАРУШЕНИЕ ПЕРЕВАРИВАНИЯ ЛИПИДОВ
- •ВСАСЫВАНИЕ ЛИПИДОВ
- •РЕСИНТЕЗ ЛИПИДОВ В СТЕНКЕ КИШЕЧНИКА
- •Ресинтез триацилглицеролов
- •Ресинтез эфиров холестерола
- •Ресинтез фосфолипидов
- •ФОРМЫ ТРАНСПОРТА ЛИПИДОВ В КРОВИ
- •ТРАНСПОРТ ТРИАЦИЛГЛИЦЕРОЛОВ В КРОВИ
- •Характеристика хиломикронов
- •Общая характеристика
- •Функция
- •Метаболизм
- •Характеристика липопротеинов очень низкой плотности
- •Общая характеристика
- •Функция
- •Метаболизм
- •ПРОМЕЖУТОЧНЫЙ ОБМЕН ЛИПИДОВ
- •Источники и судьба жирных кислот
- •Состояние покоя и отдыха в абсорбтивный период
- •Голодание, мышечная работа, состояние покоя в постабсорбтивный период
- •ИСПОЛЬЗОВАНИЕ ТРИАЦИЛГЛИЦЕРОЛОВ
- •Общая характеристика мобилизации жиров
- •Транспорт жирных кислот и глицерола
- •Окисление жирных кислот с нечетным числом углеродных атомов
- •Окисление ненасыщенных жирных кислот
- •Пример 1. Окисление пальмитиновой кислоты
- •Пример 2. Окисление линолевой кислоты
- •КЕТОНОВЫЕ ТЕЛА
- •ЗАПАСАНИЕ ЖИРОВ
- •Биосинтез жирных кислот
- •Удлинение цепи жирных кислот
- •Гормональная регуляция
- •Метаболическая регуляция
- •Общие принципы биосинтеза
- •Синтез фосфатидной кислоты
- •Синтез триацилглицеролов
- •Синтез фосфолипидов
- •Липотропные вещества
- •НАРУШЕНИЯ ОБМЕНА ТРИАЦИЛГЛИЦЕРОЛОВ
- •Жировая инфильтрация печени
- •Ожирение
- •Основы лечения
- •Сахарный диабет II типа
- •Основы лечения
- •ОБМЕН ХОЛЕСТЕРОЛА
- •Источники
- •Выведение
- •Биосинтез
- •Регуляция синтеза холестерола
- •ТРАНСПОРТ ХОЛЕСТЕРОЛА И ЕГО ЭФИРОВ
- •Характеристика липопротеинов высокой плотности
- •Общая характеристика
- •Функция
- •Обмен
- •Характеристика липопротеинов низкой плотности
- •Общая характеристика
- •Функция
- •Обмен
- •НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРОЛА
- •Атеросклероз
- •Стадии атеросклероза
- •1 стадия – повреждение эндотелия
- •2 стадия – стадия начальных изменений
- •3 стадия – стадия поздних изменений
- •4 стадия – стадия осложнений
- •Основы лечения
- •Нарушения обмена липопротеинов
- •Тип I. Гиперхиломикронемия
- •1. Подтип IIa (семейная гиперхолестеролемия)
- •Болезни накопления липидов – липидозы
- •ГОРМОНЫ
- •КЛАССИФИКАЦИЯ ГОРМОНОВ
- •Классификация по строению
- •Классификация по влиянию на обмен веществ
- •Классификация по месту синтеза
- •МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
- •Мембранные рецепторы
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •Гуанилатциклазный механизм
- •Цитозольные рецепторы
- •ИЕРАРХИЯ И ПРИНЦИПЫ РЕГУЛЯЦИИ ГОРМОНАЛЬНЫХ СИСТЕМ
- •ГОРМОНЫ ГИПОТАЛАМУСА
- •ГОРМОНЫ ГИПОФИЗА
- •Соматотропный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Семейство пептидов проопиомеланокортина
- •Липотропный гормон
- •Мишени и эффекты
- •Меланоцитстимулирующий гормон
- •Строение
- •Синтез
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ, РЕГУЛИРУЮЩИЕ ОБМЕН КАЛЬЦИЯ И ФОСФОРА
- •Кальцитриол
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Паратиреоидный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Гипофункция
- •Гиперфункция
- •Кальцитонин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ ТИРЕОИДНОЙ ФУНКЦИИ
- •Тиреотропный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Йодтиронины
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ ПЕРИФЕРИЧЕСКИХ ЖЕЛЕЗ
- •Катехоламины
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Глюкагон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Инсулин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГРУППА ГОРМОНОВ РЕПРОДУКТИВНОЙ СИСТЕМЫ
- •Окситоцин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Гонадотропные гормоны
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Половые гормоны
- •Строение
- •Синтез
- •Механизм действия
- •Женские половые гормоны
- •Регуляция синтеза и секреции
- •Гормональный цикл женщины
- •Мишени и эффекты
- •Патология
- •Мужские половые гормоны
- •Механизм действия
- •Регуляция синтеза и секреции
- •Мишени и эффекты
- •Патология
- •Производные проопиомеланокортина
- •Адренокортикотропный гормон
- •Строение
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Глюкокортикоиды
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Минералокортикоиды
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •АЗОТСОДЕРЖАЩИЕ ВЕЩЕСТВА КРОВИ
- •Составные компоненты крови
- •БЕЛКИ КРОВИ
- •Типы протеинограмм
- •Белки острой фазы
- •Функции белков плазмы крови
- •ОСОБЕННОСТИ КОЛИЧЕСТВА БЕЛКОВЫХ ФРАКЦИЙ У ДЕТЕЙ
- •ИНДИВИДУАЛЬНЫЕ БЕЛКИ ПЛАЗМЫ КРОВИ
- •Альбумин
- •ФЕРМЕНТЫ КРОВИ
- •Энзимодиагностика
- •Причины изменения активности ферментов в крови
- •Группы ферментов сыворотки крови
- •Единицы измерения активности ферментов
- •ОСТАТОЧНЫЙ АЗОТ КРОВИ
- •Фракции остаточного азота
- •ОБМЕН ЖЕЛЕЗА
- •Суточная потребность
- •Пищевые источники
- •Растительная пища (в 100 г)
- •Животная пища (в 100 г)
- •Всасывание
- •Метаболизм железа
- •Выведение
- •Нарушение обмена железа
- •Избыток железа
- •Железодефицит
- •Причины
- •Симптомы
- •ГЕМОПРОТЕИНЫ. ОБМЕН ГЕМА
- •СТРОЕНИЕ И СИНТЕЗ ГЕМА
- •Регуляция синтеза гема
- •МИОГЛОБИН
- •ГЕМОГЛОБИН
- •Строение гемоглобина
- •Нормальные и патологические формы гемоглобина
- •Нормальные формы
- •Патологические формы
- •Изменение рН среды
- •Кооперативное взаимодействие
- •Роль 2,3-дифосфоглицерата
- •Нарушение синтеза гемоглобина
- •Порфирии
- •Талассемии
- •ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ
- •КАТАБОЛИЗМ ГЕМА
- •НАРУШЕНИЯ ОБМЕНА БИЛИРУБИНА
- •Гемолитическая желтуха
- •Механическая желтуха
- •Паренхиматозная желтуха
- •Нарушения обмена билирубина у детей
- •Гемолитическая болезнь новорожденного
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Физиологическая (транзиторная) желтуха новорожденных
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Желтуха недоношенных
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Негемолитическая гипербилирубинемия новорожденных, вызываемая молоком матери
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
- •РОЛЬ ВНЕКЛЕТОЧНЫХ ИОНОВ ВОДОРОДА
- •РОЛЬ ВНУТРИКЛЕТОЧНЫХ ИОНОВ ВОДОРОДА
- •ОСНОВНЫЕ ПОКАЗАТЕЛИ КОС
- •Водородный показатель
- •Нормальные величины
- •Клинико-диагностическое значение
- •Парциальное давление углекислого газа
- •Нормальные величины
- •Клинико-диагностическое значение
- •Нормальные величины
- •Клинико-диагностическое значение
- •Концентрация буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •КОМПЕНСАЦИЯ ИЗМЕНЕНИЙ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА В ПЛАЗМЕ КРОВИ
- •Буферные системы
- •Бикарбонатная буферная система
- •Фосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Дыхательная система
- •Костная ткань
- •Печень
- •Почки
- •Реабсорбция бикарбонат-ионов
- •Ацидогенез
- •Аммониегенез
- •ВНУТРИКЛЕТОЧНАЯ РЕГУЛЯЦИЯ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА
- •Метаболический ацидоз
- •Причины
- •Компенсация
- •Метаболический алкалоз
- •Причины
- •Компенсация
- •Респираторный ацидоз
- •Причины
- •Компенсация
- •Респираторный алкалоз
- •Причины
- •Компенсация
- •ВОДНЫЙ БАЛАНС
- •Источники воды
- •Выведение воды
- •Регуляция водного баланса
- •БИОХИМИЯ ПОЧЕК
- •ЭКСКРЕТОРНАЯ ФУНКЦИЯ
- •РЕГУЛИРУЮЩАЯ ФУНКЦИЯ
- •МЕТАБОЛИЧЕСКАЯ ФУНКЦИЯ
- •МЕХАНИЗМ ОБРАЗОВАНИЯ МОЧИ
- •Ультрафильтрация
- •Лабораторная оценка фильтрации
- •Реабсорбция
- •Проксимальный извитой каналец
- •Тонкое нисходящее колено петли Генле
- •Тонкое восходящее колено петли Генле
- •Толстая восходящая часть петли Генле
- •Дистальный каналец
- •Конечный отдел дистального канальца и собирательные трубочки
- •Лабораторная оценка реабсорбции
- •БИОХИМИЯ ПЕЧЕНИ
- •Функции печени
- •МЕТАБОЛИЧЕСКАЯ ФУНКЦИЯ
- •Углеводный обмен
- •Липидный обмен
- •Белковый обмен
- •Пигментный обмен
- •Оценка метаболической функции
- •ОБЕЗВРЕЖИВАЮЩАЯ ФУНКЦИЯ
- •Реакции микросомального окисления
- •Антипириновая проба
- •Реакции конъюгации
- •БИОТРАНСФОРМАЦИЯ С ОБРАЗОВАНИЕМ ТОКСИЧНЫХ ПРОДУКТОВ
- •Органотоксичность
- •Химический канцерогенез

Обмен аминокислот и белков |
116 |
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии при помощи АДФ и ингибируется избытком АТФ и НАДН.
Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
ЭНЗИМОДИАГНОСТИКА С ПОМОЩЬЮ АМИНОТРАНСФЕРАЗ
Вмедицине нашло практическое применение определение активности двух ами-
нотрансфераз – аланинаминотрансферазы (АЛТ) и аспартатаминтрансферазы (АСТ).
Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.
Вклинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эф-
фективности их лечения.
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот.
РОЛЬ ТРАНСАМИНИРОВАНИЯ И ТРАНСДЕЗАМИНИРОВАНИЯ
Реакции трансаминирования:
oактивируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
oобеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
oпри прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
117 |
|
|
|
oнеобходимы при внутриклеточном голодании, т.е. при гипогликемиях различного генеза, при сахарном диабете – для использования безазотистого остатка аминокислот
для кетогенеза и глюконеогенеза.
Продукт трансаминирования – глутаминовая кислота: 1) является одной из транспортных форм аминного азота в гепатоциты, 2) способна реагировать со свободным аммиаком, обезвреживая его (см "Связывание аммиака").
Процесс трансдезаминирования идет в организме непрерывно:
oсопряженные реакции трансаминирования и дезаминирования создают поток аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
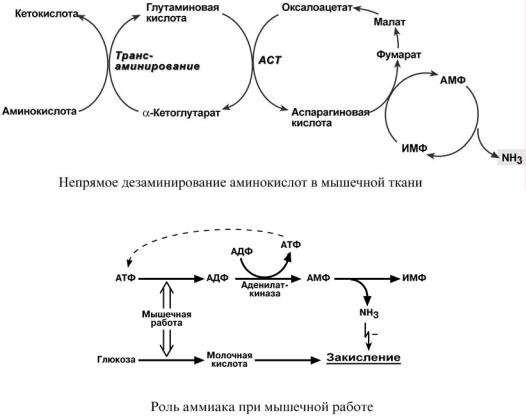
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
ВМЫШЦЕ
Вмышечных клетках при интенсивной работе, когда идет распад мышечных белков, активируется альтернативный способ дезаминирования аминокислот.
Образовавшийся при трансаминировании глутамат при участии АСТ реагирует с оксалоацетатом и образуется аспарагиновая кислота. Аспартат далее передает свою аминогруппу на ИМФ (инозинмонофосфат) с образованием АМФ, который в свою очередь подвергается
дезаминированию с образованием свободного аммиака. Процесс носит защитный характер, т.к. при работе выделяется молочная кислота и аммиак, связывая ионы Н+, предотвращает закисление цитозоля миоцитов.
Обмен аминокислот и белков |
118 |
|
|
ОБМЕН И РОЛЬ КРЕАТИНА
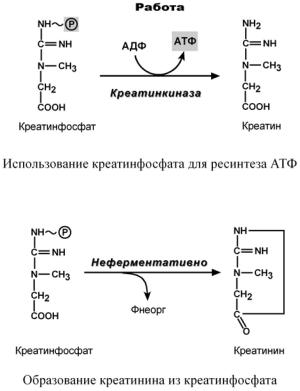
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.
Особенно показательна роль креатина в
мышечной ткани. Креатинфосфат обеспечи-
вает ресинтез АТФ в первые секунды работы (5-10 сек), когда ни анаэробный гликолиз, ни аэробное окисление глюкозы и жирных кислот еще не активировано, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода.
При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являются активаторами креатинкиназы. Реакция еще интересна тем, что на ее примере можно наблюдать обратную положительную связь — активацию фермента продуктом реакции креатином. Это позволяет избежать снижения скорости реакции по ходу работы, которое должно было бы произойти по закону действующих масс из-за снижения концентрации креатинфосфата в работающих мышцах.
Около 3% креатинфосфата постоянно в реакции неферментативного дефосфорилирования превращается в креатинин. Количе-
ство креатинина, выделяемое здоровым человеком в сутки, всегда почти одинаково и зависит только от объема мышечной массы.
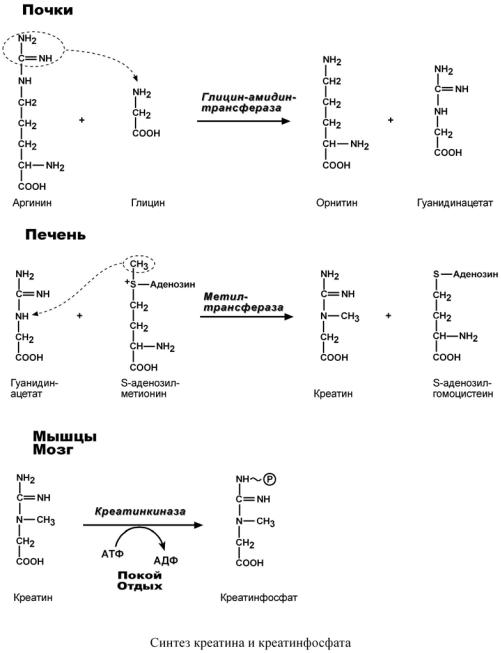
Синтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг. Здесь при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата.
Если синтез креатина опережает возможности его фиксации в мышечной ткани, то развивается креатинурия – появление креатина в моче. Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда к физиологической относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При заболеваниях мышечной системы (при миопатии или прогрессирующей мышечной дистрофии) в моче наблюдаются наибольшие концентрации креатина – патологическая креатинурия.
biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
119 |
|
|
|
