матка / Раздел3.вопр. 1-11
.doc|
1)Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия, относительные количества которых могут изменяться в широких пределах. По агрегатному состоянию растворы могут быть жидкими , газообразными или твёрдыми. . Твердые растворы образуются кристаллизации жидких расплавов или при растворении газов в твердых веществах. Различают твердые растворы замещения, внедрения и вычитания. Твердые растворы замещения, которые образуются при сохранении структуры кристаллической решетки растворителя являются наиболее распространенными. При образовании твердых растворов замещения в узлах кристаллической решетки данного вещества атомы, молекулы и ионы замещаются частицами другого вещества. Образование таких растворов возможно, если оба вещества близки по кристаллическим свойствам и размерам частиц. По приближенному правилу В.Юм-Розери твердые растворы замещения образуются в тех случаях, когда размеры двух частиц отличаются не более чем на 14-15%. Устойчивыми являются твердые растворы замещения любого состава. Твердые растворы внедрения получаются путем внедрения частиц одного вещества в междоузлия кристаллической решетки другого вещества (растворителя). Растворы внедрения образуются в том случае, когда размеры частиц внедряемого вещества меньше размеров частиц растворителя. Такие растворы обычно возникают при растворении растворов неметаллов в металлах. При внедрении новых частиц в промежутки между атомами металла происходит увеличение напряжения в кристаллической решетке, в связи с такие растворы образуются сравнительно редко. Твердые растворы вычитания встречаются значительно реже. Они получаются при выпадении некоторых атомов из кристаллической ячейки, в связи с чем эти растворы иногда называются твердыми растворами с дефектной решеткой. Наиболее часто встречаются жидкие растворы Растворы занимают промежуточное место между химическими соединениями и механическими смесями. Однородность растворов делает их схожими с химическими соединениями, так же на химическое взаимодействие между компонентами растворов указывает выделение теплоты при растворении некоторых веществ. Растворы отличаются от химических соединений тем, что состав взаимодействующих веществ может изменяться в широких пределах. В свойствах раствора можно обнаружить многие свойства компонентов его составляющих, что характерно для механических соединений. Фаза — это гомогенная система, находящаяся в равновесии, или совокупность гомогенных частей гетерогенной системы, находящейся в равновесии. Фазами являются элементарные вещества, соединения, растворы на основе элементов или соединений. Соединения. Признаком того, что данная фаза относится к химическим соединениям, служит отличие ее кристаллической решетки от решеток элементов, из которых она образована. |
2)В однокомпонентных и многокомпонентных системах могут реализовываться состояния, когда в равновесии находятся несколько фаз. Такое состояние системы обычно называют гетерогенным равновесием. правила фаз: В качестве параметров системы в однокомпонентных системах выступают температура и давление, а в многокомпонентных — температура, давление и концентрация компонентов в каждой фазе (состав фаз). В каждой фазе, состоящей из К компонентов, число переменных концентраций равно (К - 1). Число параметров системы, которое можно изменять, не изменяя числа фаз, находящихся в равновесии, называется числом степеней свободы, или вариантностью системы2. Обозначим вариантность системы С. Она равна числу независимых переменных системы; последние представляют собой разность между общим числом переменных параметров системы и числом уравнений связи. Общее число переменных параметров в системе равно Ф(К - 1) + 2. Число уравнений связи между переменными (между концентрациями компонентов в фазах) получают, исходя из требования одинаковости химического потенциала данного компонента во всех фазах системы .Химический потенциал компонента в фазе зависит от его концентрации.
в условиях фазового равновесия происходит равновесное перераспределение компонентов между фазами. Например, в системе, состоящей из двух компонентов (К = 2), в условиях двухфазного равновесия (Ф = 2) для любого из компонентов (например, для компонента 1) реализуется равенство
Таким образом
Отсюда
Или
Отношение С\ / С\ обычно называют равновесным коэффициентом распределения Распределение компонентов между фазами характеризуется равновесными коэффициентами распределения, значения которых получают из уравнений связи типа уравнения .Число уравнений связи для общего случая гетерогенного равновесия в многофазной системе равно числу нижних строк системы К(Ф - 1). Таким образом, вариантность системы, состоящей из К компонентов и Ф фаз, когда в качестве внешних параметров выступают только Р и Т, равна С = (К - 1)Ф + 2 - К(Ф - 1). Раскрытие скобок и приведение подобных в уравнении дает выражение, названное правилом фаз Гиббса: С = К-Ф + 2. В тех случаях, когда число внешних параметров уменьшается на единицу (Р = сопз!; или Т = сопз1), правило фаз записывают следующим образом: С = К - Ф + 1. Если же внешние параметры постоянны (т. е. Р = сопз* и Т = сопз!;), правило фаз имеет вид С = К - Ф.
|
|
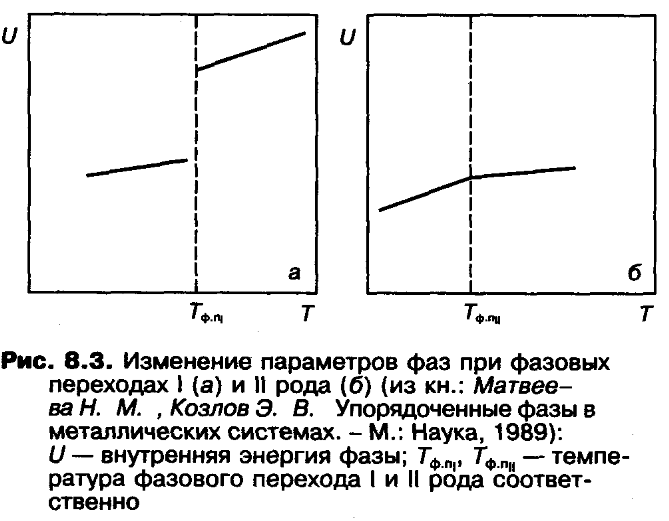
3)Фазовые превращения первого рода — полиморфные (аллотропические) превращения, плавление, кристаллизация и т. п. — сопровождаются скачкообразным изменением первых частных производных термодинамических потенциалов, например
Следовательно, фазовые превращения первого рода сопровождаются скачкообразными изменениями энтальпии, объема и энтропии фазы. Примером фазового перехода I рода, в котором возможно формирование промежуточных (метастабильных) состояний, является распад пересыщенного твердого раствора с образованием критического зародыша новой фазы (рис. 8.4)
|
4) при некоторых, реже встречающихся переходах из одного фазового состояния в другое (ферромагнитное -> парамагнитное, сверхпроводящее -> несверхпроводящее, упорядоченное -> неупорядоченное) скачкообразно изменяются не первые (они непрерывны), а вторые производные термодинамических потенциалов, в частности
Эти фазовые превращения, сопровождаемые скачкообразным изменением коэффициента сжимаемости и теплоемкости , относятся к фазовым превращениям второго рода. Фазовые переходы II рода (фазовые превращения, которые реализуются, как правило, во всем объеме превращающейся фазы) не требуют образования критического зародыша новой фазы; в случае фазовых переходов II рода не возникают промежуточные (метастабильные) состояния
|
|
5)Согласно принципу соответствия, каждой фазе и каждому фазовому равновесию отвечает определенный геометрический образ на диаграмме фазового равновесия. На основе принципа соответствия создана «азбука» построения диаграмм фазового равновесия .В рамках принципа соответствия могут быть сформулированы не только положения, позволяющие построить диаграмму фазовых равновесий, но и облегчающие их анализ.
3. Мерность геометрических элементов, характеризующих то или иное фазовое равновесие, отвечает вариантности соответствующего фазового равновесия. На основе этого положения, базирующегося на правиле фаз Гиббса, строят фазовые диаграммы. Фазовые равновесия (фазовые превращения) в диаграммах фазовых равновесий изображают с помощью сопряженных элементов (точек, линий, поверхностей). Например, на любой фазовой диаграмме (одно-, двух- или трехкомпонентной) сопряженные точки характеризуют составы фаз, претерпевающих нон-вариантные (С = 0) превращения; сопряженные линии — составы фаз, претерпевающих моновариантные превращения (С = 1); сопряженные поверхности — составы фаз, претерпевающих дивариантные превращения (С = 2). Поэтому подобные фазовые равновесия в различных системах описываются разными сопряженными элементами, например: трехфазное равновесие в двух-компонентной системе, построенной в координатах Т—X, описывается точками, а в трехкомпонентной системе, построенной в тех же координатах, — линиями.
|
6) Фазовые диаграммы двойных конденсированных систем строятся в координатах температура—концентрация (Т—X). ). В практическом материаловедении иногда пользуются массовыми процентами (проценты по массе), но при анализе природы образующихся фаз, изучении закономерностей, определяющих предельные концентрации твердых растворов, и в других подобных случаях следует применять атомные проценты (или атомные доли). На диаграмме фазового равновесия двойных систем изображают фазовые области, отделенные одна от другой линиями диаграммы Любую точку на диаграмме можно считать фигуративной точкой сплава, характеризующей его состояние. Проекция точки на ось X соответствует составу сплава, на ось Т — температуре, при которой он рассматривается. Фигуративная точка указывает также на фазовый состав сплава при данной температуре. Если фигуративная точка расположена в однофазной области, то состав фазы совпадает с составом сплава; если — в двухфазной, то состав фаз, находящихся в равновесии при данной температуре, лежит на сопряженных кривых и определяется с помощью коноды, проходящей через эту точку. Конодой называют отрезок изотермы в пределах двухфазной области, пересекающий границы этой области в точках, лежащих на сопряженных кривых. В свою очередь, эти точки являются фигуративными точками равновесных при данной температуре фаз.Таким образом, конода соединяет точки, характеризующие составы фаз, находящихся в равновесии. Количественное соотношение равновесных при данной температуре фаз определяют с помощью правила рычага, которое формулируют так. Отношение массовых (объемных) количеств (Q) фаз, находящихся в равновесии при данной температуре, обратно пропорционально отношению отрезков коноды, заключенных между фигуративной точкой сплава и фигуративными точками соответствующих фаз. Р—Т Диаграммы таких систем представляют собой проекции диаграмм, построенных в координатах С—Т—Р (где С — изобарно-изо-термный потенциал), на плоскость Р—Т . Диаграммы С—Т—Р наглядно демонстрируют равенство химических потенциалов компонента (или адекватное ему в условиях однокомпонентной системы равенство изобарно-изотермных потенциалов фаз) в условиях фазового равновесия. Диаграммы Р—Т — это фазовые диаграммы однокомпонентных систем, в которых фазовые превращения обусловлены только изменениями температуры и давления.
|
|
7) -Диаграммы с неограниченной растворимостью компонентов в жидком и твердом состояниях .Двойные системы А—В, компоненты А и В которых неограниченно растворяются друг в друге в жидком и твердом состояниях, могут быть образованы как химическими элементами, так и соединениями При этом системы, образованные соединениями, называют квазидвойными, так как они представляют собой политермические сечения соответствующих многокомпонентных фазовых диаграмм. -ДИАГРАММЫ ФАЗОВЫХ РАВНОВЕСИЙ ДВОЙНЫХ СИСТЕМ С ОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ, Диаграммы фазовых равновесий с эвтектическим превращением В двойных системах, в которых кристаллические структуры компонентов различаются, а их растворение друг в друге приводит к понижению температур кристаллизации, часто происходят эвтектические превращения. Фазовые диаграммы в которых полупроводник, обладающий направленными и насыщенными химическими связями, плохо растворяет в себе элементы с иным типом химической связи- диаграммами с вырожденной эвтектикой Диаграммы фазовых равновесий с перитектическим превращением Если же при ограниченной растворимости компонентов друг в друге один из них, например В, растворяясь в А, понижает температуру плавления растворов на его основе, а компонент А, растворяясь в В, наоборот, повышает Тпл раствора, то вместо эвтектического превращения реализуется так называемое перитектическое превращение (рис. 10.11, а). Эвтектическое превращение в двойной системе заключается в распаде раствора при охлаждении на две другие фазы; перитектическое превращение, наоборот, представляет собой процесс образования одной фазы в результате взаимодействия двух других фаз, полностью или частично исчезающих при этом Диаграммы фазовых равновесий с химическими соединениями в случае большой отрицательной величины теплоты смешения т. е. при большом химическом сродстве компонентов системы, их взаимодействие приводит к образованию химических соединений. Соединения, для которых эти составы совпадают, называются конгруэнтно плавящимися, или стойкими. Бели же указанные составы не совпадают, соединения называют инконгруэнтно плавящимися, или нестойкими. Построение и анализ фазовых диаграмм:существует два противоположных подхода при построении фазовых диаграмм. Первый заключается в измерении термодинамических характеристик и дальнейшем расчете по термодинамическим законам и закладываемой модели. Второй заключается в экспериментальном построении фазовой диаграммы методами физико-химического анализа.
|
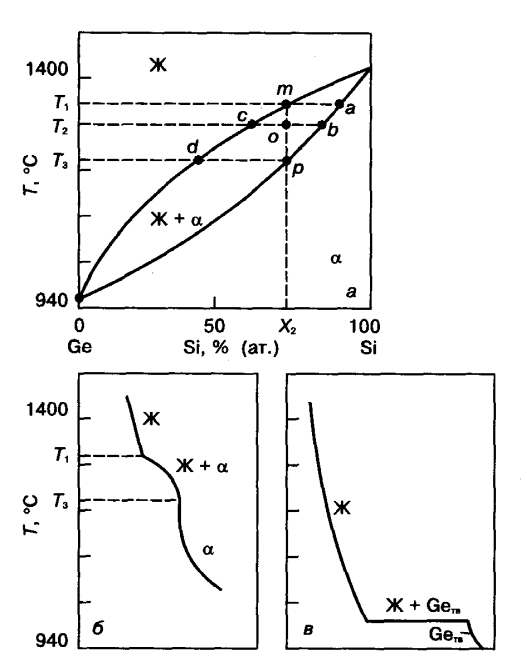
8) Построение диаграмм фазового равновесия двухкомпонентных систем, для которых известны температуры плавления чистых компонентов, взаимодействующих с образованием непрерывного ряда твердых и жидких растворов, проводят следующим образом. Для нескольких температур, лежащих в интервале между температурами плавления компонентов, строят изотермические кривые, отражающие концентрационные зависимости изобарно-изотермных потенциалов твердой и жидкой фаз Затем с помощью графического дифференцирования этих кривых определяют координаты точек (фигуративных), лежащих при выбранной температуре на кривых ликвидуса и солидуса и отвечающих составам жидкой и твердой фаз, находящихся в равновесии. При этом учитывают, что химические потенциалы компонентов в этих точках равны. По полученным фигуративным точкам строят кривые ликвидуса и солидуса Для приближенной оценки значения к0 линии ликвидуса и солидуса обычно заменяют касательными к ним вблизи основного компонента (растворителя), В этом случае значение к0 в области малых концентраций можно считать практически независимым от концентрации. Коэффициент к0 > 1 соответствует случаю, когда примесь повышает температуру плавления растворителя, и, наоборот, к0 < 1— примесь понижает температуру плавления растворителя.
|
|
|
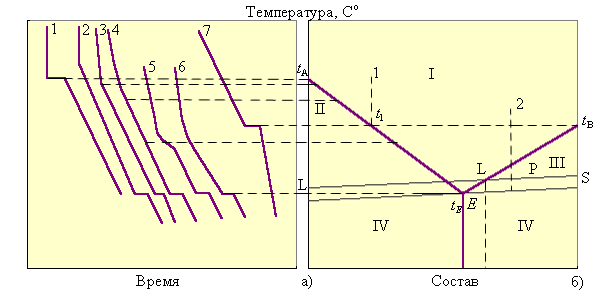
9) Диаграмма температура–состав строится на основании кривых охлаждения (нагревания). Кривые охлаждения – графическое изображение зависимости температуры от времени для исходных чистых веществ A и B и их смесей различного состава. Вид этих кривых свидетельствует о наличии или отсутствии фазовых превращений при некоторых определенных температурах или в интервале температур (рис. 6.11.). Расплав чистого компонента можно рассматривать как растворитель. Согласно закону Рауля, добавление второго компонента (растворенного вещества) вызывает понижение температуры кристаллизации системы (раствора). При охлаждении расплава, пока в охлаждаемой системе не происходит фазовых превращений, температура расплава падает с определенной скоростью. Появление кристаллов сопровождается выделением теплоты кристаллизации и замедляет или приостанавливает падение температуры, вызывая излом или площадку на кривой охлаждения. Из анализа кривых охлаждения (рис. 6.11а) следует, что смеси веществ при охлаждении претерпевают по два фазовых превращения, и изломы на их кривых характеризуют начало выделения из расплава кристаллов вещества A (кривая 2) или вещества B (кривая 4), а площадки – выделение эвтектической смеси, насыщенной в отношении обоих компонентов. Таким образом, кристаллизация жидкой смеси в отличие от кристаллизации чистого вещества (кривые 1,5) сопровождается изменением состава жидкой фазы и лежит в некотором температурном интервале. Смесь эвтектического состава (кривая 3) кристаллизуется подобно чистым компонентам при постоянной температуре, поэтому дает монотонную кривую охлаждения с горизонтальным участком при эвтектической, наименьшей для данной системы температуре. После окончания кристаллизации идет охлаждение отвердевшей системы до температуры окружающей среды. Определив
с помощью кривых охлаждения температуры
кристаллизации для смесей различных
составов, строят диаграмму состояния.
Способ построения ясен из рисунка
6.11б.
Правила построения Т-Х На диаграмме фазового равновесия двойных систем изображают фазовые области, отделенные одна от другой линиями диаграммы. Любую точку на диаграмме можно считать фигуративной точкой сплава, характеризующей его состояние. Проекция точки на ось X соответствует составу сплава, на ось Т — температуре, при которой он рассматривается. Фигуративная точка указывает также на фазовый состав сплава при данной температуре. Если фигуративная точка расположена в однофазной области, то состав фазы совпадает с составом сплава; если — в двухфазной, то состав фаз, находящихся в равновесии при данной температуре, лежит на сопряженных кривых и определяется с помощью коноды, проходящей через эту точку. Конодой (см. гл. 4) называют отрезок изотермы в пределах двухфазной области, пересекающий границы этой области в точках, лежащих на сопряженных кривых. В свою очередь, эти точки являются фигуративными точками равновесных при данной температуре фаз. Таким образом, конода соединяет точки, характеризующие составы фаз, находящихся в равновесии. Правильность построения Д. с. проверяется на основании правила фаз, принципа соответствия и принципа непрерывности
|
10) ) -Диаграммы с неограниченной растворимостью компонентов в жидком и твердом состояниях .Двойные системы А—В, компоненты А и В которых неограниченно растворяются друг в друге в жидком и твердом состояниях, могут быть образованы как химическими элементами, так и соединениями При этом системы, образованные соединениями, называют квазидвойными, так как они представляют собой политермические сечения соответствующих многокомпонентных фазовых диаграмм. Линия А'аВ' (см. рис. 9.2), выше которой все сплавы находятся в жидком состоянии, — линия ликвидус. Эта линия имеет еще и другой смысл: она представляет собой геометрическое место точек, характеризующих состав жидкого раствора с предельной концентрацией растворенного вещества при температуре ликвидус. Линия А'ЬВ', ниже которой все сплавы находятся в твердом состоянии, — линия солидус. Линии ликвидус и солидус являются сопряженными: на них лежат точки, которые характеризуют составы жидкой и твердой фаз, равновесных при данной температуре
Число степеней свободы для однофазных областей будет равно двум: С = К-Ф + 1 = = 2-1 + 1 = 2. Следовательно, в таких областях можно независимо менять два параметра — температуру и концентрацию одного из компонентов в данной фазе, не изменяя при этом числа фаз, находящихся в равновесии; на рис. 9.3, а в подобной области в равновесии находится одна фаза. Действительно, при данной температуре в однофазном состоянии могут находиться как жидкие, так и твердые растворы разного состава. Поэтому для однозначного определения состояния системы нужно указать два параметра: температуру и состав. Число степеней свободы для двухфазной области будет равно единице: С = 2-2 + 1 = 1. Таким образом, в двойной конденсированной системе из трех переменных параметров — температуры и концентрации одного из ком понентов в двух фазах — независимым явля ется только один. Выбрав, например, некото рую температуру, тем самым фиксируем со став равновесных при данной температуре фаз Нонвариантное равновесие имеет место только при температуре кристаллизации (плавления) чистых компонентов. Соответственно кривая охлаждения чистого компонента (см. рис. 9.3, в) отличается от кривой охлаждения двухкомпонентного сплава (см. рис. 9.3, б).
|
|---|---|---|
|
11)
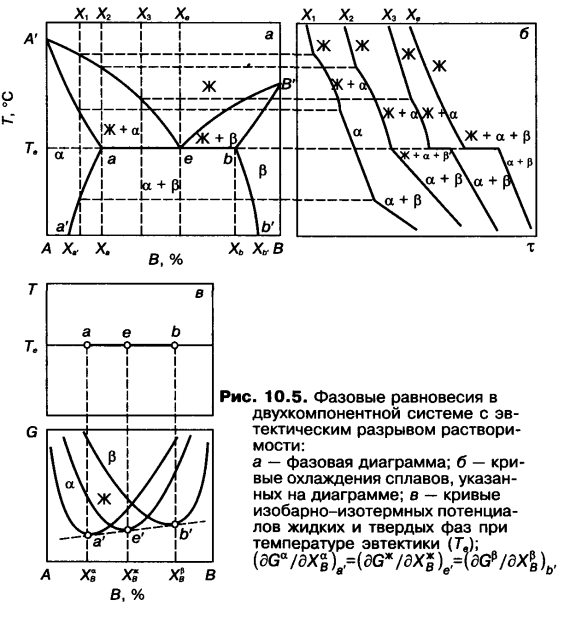
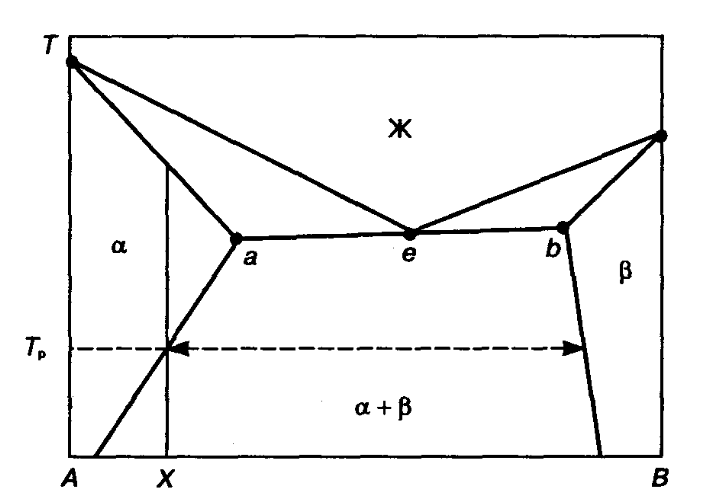
В двойных системах, в которых кристаллические структуры компонентов различаются, а их растворение друг в друге приводит к понижению температур кристаллизации, часто происходят эвтектические превращения. Диаграмма с эвтектическим превращением схематически показана на рис. 10.5, а. Она состоит из семи фазовых областей: однофазные области — жидкий раствор (Ж), твердый раствор на основе компонента А (а), твердый раствор на основе компонента В (Р); двухфазные области — жидкий и твердый растворы на основе компонента А (Ж + а), жидкий и твердый растворы на основе компонента В (Ж + Р), два твердых раствора а и Р; трех фазная область образована тремя фазами фиксированного состава — жидким раствором состава е и двумя твердыми растворами состава сс0 и Вь. Трехфазная область существует при постоянной температуре (температуре эвтектического превращения). Наклонные линии солидуса А'а и В'Ь являются геометрическим местом фигуративных точек твердых растворов предельной концентрации, существующих при определенных температурах в равновесии с жидкими растворами, составы которых лежат на линиях ликвидус А'е и В'е. Линии солидуса и ликвидуса являются сопряженными элементами диаграммы фазового равновесия. В общем случае под сопряженными элементами фазовой диаграммы понимают геометрические элементы (точки, линии, поверхности, ...), которые фиксируют составы фаз, находящихся в равновесии друг с другом при выбранных внешних параметрах (Т, Р). Горизонтальная линия аеЬ — эвтектическая линия. Только три точки на линии аеЬ — фигуративные, они характеризуют предельную концентрацию твердых растворов а (точка а) и В (точка о) и жидкого раствора (точка е) при температуре эвтектического превращения. Линии аа' и ЪЪ' — линии растворимости, на них лежат составы твердых растворов, находящихся в равновесии. Кривые растворимости являются сопряженными кривыми. На рис. 10.5, в приведены кривые изобар-но-изотермных потенциалов твердых растворов а и В и жидкого раствора при температуре эвтектики В сплавах составов от а до о при температуре Те происходит распад жидкого раствора состава е (Же) на два твердых раствора составов а (Тва) и Ь (Твь) по реакции Же ^ Тва + Твь. Особенность эвтектической линии аеЬ состоит также в том, что при эвтектической температуре в сплавах состава от а до о в равновесии находятся три фазы указанного выше состава, поэтому при температуре Те число степеней свободы в этих сплавах равно нулю (С = 2 - 3 + 1 = 0). Таким образом, эвтектическое превращение в двухкомпонентной конденсированной (Р = сопзт,) системе является нонвариантным. Следует обратить внимание на то, что при охлаждении любого сплава, лежащего в двухфазной области (а + Р), начиная с температуры Те, изменяется состав обоих твердых растворов по кривым аа' и ЬЬ', при этом они обедняются растворенным компонентом. Количественное соотношение фаз а и Р определяется по правилу рычага. Для диаграмм с эвтектикой возникает необходимость ввести кроме понятия «фаза» еще понятие «структурная составляющая». Для диаграмм с неограниченной растворимостью в твердом состоянии эти понятия совпадают. В области (а + Р) диаграммы с эвтектикой любой сплав имеет одинаковый фазовый состав: смесь из фаз а и Р, но по условиям образования этих фаз, характеру их расположения и форме частиц сплавы различаются. Нонвариантное превращение, заключающееся в распаде твердого раствора на две другие твердые фазы, принято называть эвтектоидным, а соответствующую структурную составляющую — эвтпектпоидом. важную особенность эвтектоид-ного превращения: оно связано с перемещением (диффузией) компонентов в твердом растворе на очень большие расстояния Характер диаграмм с эвтектикой в системах полупроводник—металл и полупроводник—полупроводник играет важную роль при выборе сплавов для легирования полупроводников и образования контактов методами вплавления или диффузии.
.
|
||


 обе фазы — и
исчезающая в процессе кристаллизации,
и возникающая — обогащаются в ходе
кристаллизации одним и тем же
компонентом. Это одновременное
обогащение одним и тем же компонентом
происходит за счет одновременного
уменьшения количества фазы, более
богатой этим компонентом.По окончании
процесса кристаллизации имеется
только твердая фаза. Если процесс
кристаллизации прошел в равновесных
условиях и процессы диффузии обеспечили
выравнивание концентрации компонента
в твердой фазе, ее состав отвечает
составу исходного жидкого раствора.
обе фазы — и
исчезающая в процессе кристаллизации,
и возникающая — обогащаются в ходе
кристаллизации одним и тем же
компонентом. Это одновременное
обогащение одним и тем же компонентом
происходит за счет одновременного
уменьшения количества фазы, более
богатой этим компонентом.По окончании
процесса кристаллизации имеется
только твердая фаза. Если процесс
кристаллизации прошел в равновесных
условиях и процессы диффузии обеспечили
выравнивание концентрации компонента
в твердой фазе, ее состав отвечает
составу исходного жидкого раствора.