
- •Физика атома, атомного ядра и элементарных частиц
- •Уравнение Шредингера для водородоподобного ато-
- •Волновые -функции (собственные функции урав- нения (12.1)) содержат три целочисленных пара-
- •Графические изображения некоторых функций
- •Вид волновой функции и вероятности нахождения электрона в основном состоянии атома водорода.
- •Вид волновой функции и вероятности нахождения электрона в первом возбужденном состоянии атома водорода.
- •Энергия электрона определяется формулой, в точ- ности совпадающей с результатом, полученным в рамках
- •Момент импульса электрона в атоме определяет- ся орбитальным квантовым числом l:
- •Проекция момента импульса на выделенное на- правление (например, на направление внешне- го магнитного
- •Для наглядности пространственное квантова- ние вектора момента импульса часто изобра- жают графически на
- •Спин (собственный механический момент импуль- са электрона) определяется спиновым кванто-
- •Уровни энергии атома водорода. Толщина линии соответствует вероятности перехода.
- •Схематическое изо- бражение уровней энергии и переходов между ними в атоме водорода
- •Итак, состояние электрона в атоме определяется четырьмя квантовыми числами, перечисленны- ми выше:
- •Согласно принципу Паули, для каждого электрона в атоме эта четверка чисел должна быть
- •Число различных состояний, соответствующих данному орбитальному квантовому числу l, рав-

Физика атома, атомного ядра и элементарных
ядра и элементарных  частиц
частиц
12 (0). Водородоподобный атом. Орбитальный и собственный моменты  импульса электрона и описание
импульса электрона и описание  различных состояний электрона в атоме.
различных состояний электрона в атоме.

Уравнение Шредингера для водородоподобного ато-
ма имеет вид: |
|
|
|
2m |
|
|
|
Ze |
2 |
|
|
|
|
|
|
(12.1) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
E |
|
0 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
4 0r |
|
|
|
|
|
|
|||
где оператор Лапласа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
2 |
|
2 |
|
|
|
1 |
|
|
|
|
|
|
|
1 |
2 |
(12.2) |
|||||
|
|
2 |
|
|
|
|
2 |
|
|
|
sin |
|
|
|
|
2 |
2 |
|
2 |
|||
|
r |
|
r r |
|
r |
sin |
|
|
|
|
|
r |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
sin |
|
|
||||||||||
Решение этого уравнения впервые получил Шредин- гер в 1926 году. Решение можно найти теми же ме- тодами, которыми были решены предыдущие за- дачи, но в данном случае процедура решения ока- зывается довольно громоздкой, поэтому мы ре- шать это уравнение не будем, а рассмотрим основ- ные результаты решения.
тодами, которыми были решены предыдущие за- дачи, но в данном случае процедура решения ока- зывается довольно громоздкой, поэтому мы ре- шать это уравнение не будем, а рассмотрим основ- ные результаты решения. 

Волновые -функции (собственные функции урав- нения (12.1)) содержат три целочисленных пара-
метра (квантовые числа n, l и m): |
|
nlm r, , Rnl r Ylm |
eim (12.3) |
где R и Y - специальные функции, выражающиеся через полиномы Лагерра и Лежандра. Наиболее простые из них имеют вид:
R10 e r , |
R20 2 r e r / 2 , |
|
R21 re r / 2 |
Y00 1, |
Y10 cos , |
Y11 |
sin |
Например: |
211 Are r / 2 sin ei |
|
|

Графические изображения некоторых функций

Вид волновой функции и вероятности нахождения электрона в основном состоянии атома водорода.
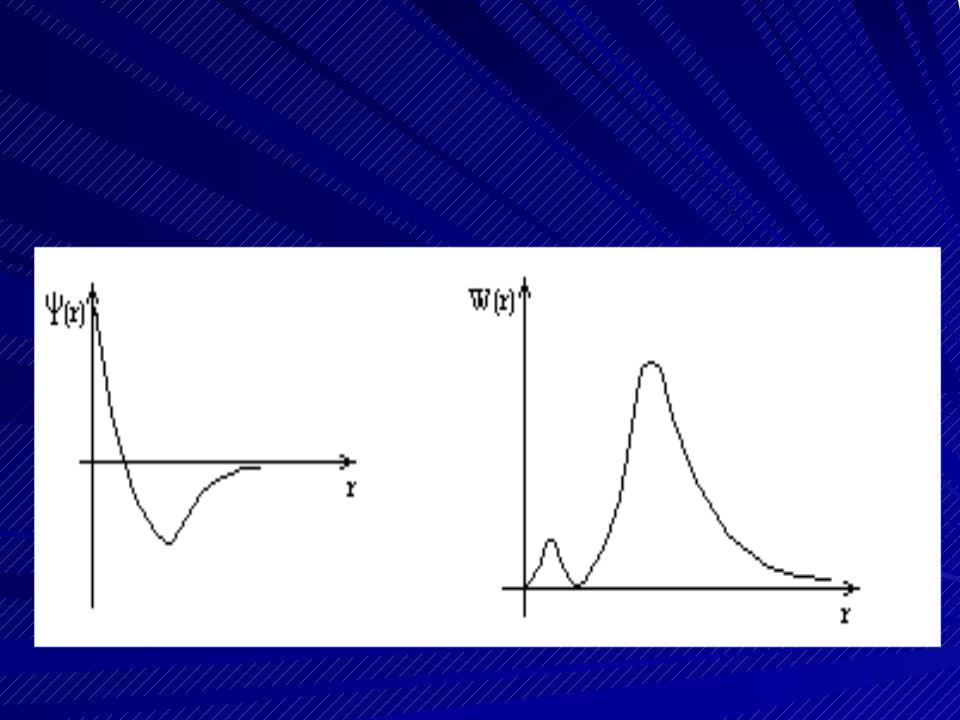
Вид волновой функции и вероятности нахождения электрона в первом возбужденном состоянии атома водорода.

Энергия электрона определяется формулой, в точ- ности совпадающей с результатом, полученным в рамках теории Бора:
En = - |
1 |
Z 2m e4 |
|
||
|
|
|
e |
(12.4) |
|
n |
2 |
2 |
2 |
||
|
|
8hε |
0 |
|
|
где n = 1, 2, 3, ... - "главное квантовое число". Часто применяются следующие условные обо-значения
и термины: K-слой, L-слой и т.д.: |
|
|
||||
n |
1 |
2 |
3 |
4 |
5 |
6 ... |
Условное |
K |
L |
M |
N |
O |
P ... |
обозначение |
|
|
|
|
|
|
Момент импульса электрона в атоме определяет- ся орбитальным квантовым числом l:
L = h l(l +1) |
(12.5) |
где орбитальное квантовое число l может прини- мать значения l = 0, 1, 2, ..., (n-1). Часто применя- ются следующие условные обозначения и тер-
мины: s-оболочка, p-оболочка и т.д.:
l |
0 |
1 |
2 |
3 |
4 |
5 ... |
Условное |
s |
p |
d |
f |
g |
h ... |
обозначение |
|
|
|
|
|
|

Проекция момента импульса на выделенное на- правление (например, на направление внешне- го магнитного поля) определяется магнитным квантовым числом m:
LZ = hm |
(12.6) |
|
Магнитное квантовое число может принимать значения:
m = 0, ±1, ±2, …, ± l,
или:
m = -l, -l+1, -l+2,..., 0, 1, 2, ..., l
всего (2l + 1) значений.
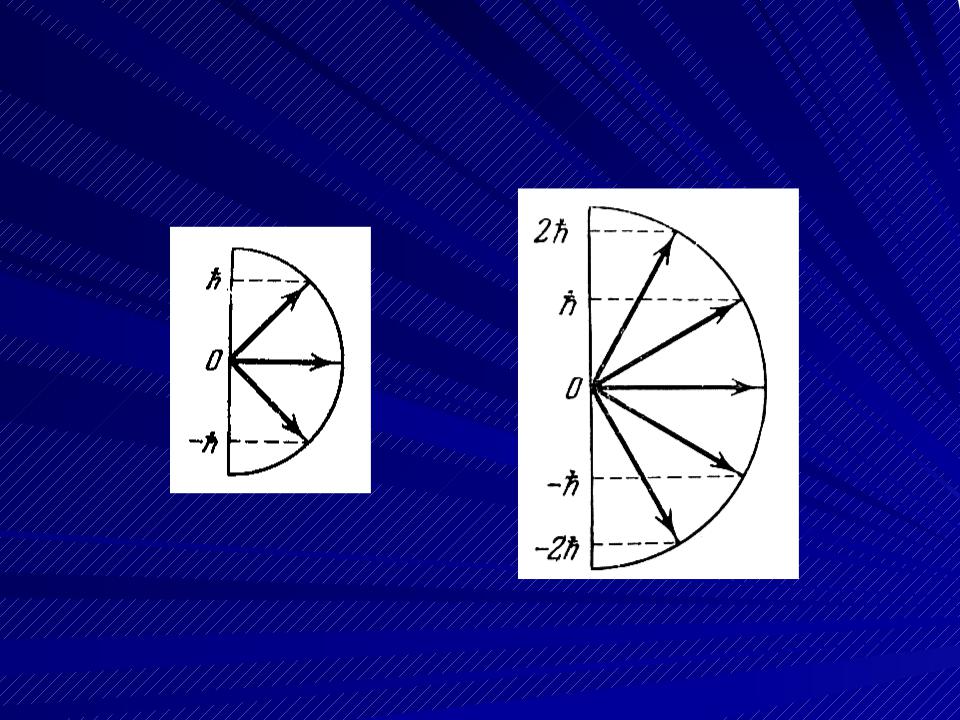
Для наглядности пространственное квантова- ние вектора момента импульса часто изобра- жают графически на векторных диаграммах:
l = 1  l = 2
l = 2
