
Ф изика термодинамика бля лекции и вопросы / OF3_7_Realnye_gazy_mini_1
.pdfЭффект Джоуля–Томсона
Расширение газа происходит адиабатически. Работу по расширению газа производит внешняя сила f1 = p1S. Расширяясь при давлении p2, газ совершает работу по перемещению поршня П2. На поршень П2 действует сила f2 = p2S. Полная работа внешней силы по расширению газа:
δA = p1Sx1 − p2 Sx2 = p1V1 − p2V2
Согласно первому началу термодинамики при адиабатическом расширении газа:
δQ = dU + δAСИСТ = 0
и, следовательно, работа системы выполняется за счёт убыли её внутренней энергии:
δAСИСТ = −dU = −(U2 −U1 )
© А.В. Бармасов, 2006-2013 |
51 |
12+ |
|
Эффект Джоуля–Томсона
Из соотношения работ внешней силы и самой системы:
δAВНЕШН = −δAСИСТ
следует:
δAВНЕШН =U2 −U1
Итак, при адиабатическом расширении реального газа должно выполняться равенство:
p1V1 − p2V2 =U2 −U1
Таким образом, получаем:
U1 + p1V1 =U2 + p2V2 = const
© А.В. Бармасов, 2006-2013 |
52 |
12+ |
|
Эффект Джоуля–Томсона
При адиабатическом расширении реального газа энтальпии его начального и конечного состояний одинаковы.
© А.В. Бармасов, 2006-2013 |
53 |
12+ |
|

Эффект Джоуля–Томсона
Будем считать, что в объёме 1 находился 1 моль реального газа, для которого выполняются следующие соотношения:
|
|
RT1 |
|
a |
|
|
RT1V1 |
|
a |
p1V1 |
= |
|
− |
|
V1 |
= |
|
− |
|
V −b |
V 2 |
V −b |
V |
||||||
|
|
1 |
1 |
|
1 |
1 |
|||
U1 = CV T1 − a V1
В объёме 2 газ, прошедший через дроссель, можно считать разреженным, близким по свойствам к идеальному. Следовательно, для одного моля газа, находящегося в объёме 2, выполняются равенства:
p2V2 = RT2
U2 = CV T2
© А.В. Бармасов, 2006-2013 |
54 |
12+ |
|
Эффект Джоуля–Томсона
|
|
a |
|
|
RT1V1 |
|
a |
|
|
|
|
CV T1 |
− |
|
+ |
− |
|
= CV T2 |
+ RT2 |
||||
|
|
|
|||||||||
|
V1 |
V1 − b V1 |
|
|
|||||||
|
RT1V1 |
= |
RT1V1 − b + b |
= RT + |
RT1b |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
V1 − b |
|
V1 − b |
|
|
|
|
|
|
|
|
1 |
V1 − b |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
CV T1 + RT1 |
+ |
|
RT1b |
− |
|
2a |
= CV T2 + RT2 |
|||||||||||||
|
V1 |
− b |
|
V1 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
T2 − T1 |
= |
|
|
1 |
|
|
|
|
|
RT1b |
− |
2a |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
CV |
+ R |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
V1 − b |
|
V1 |
||||||||||||
|
|
© А.В. Бармасов, 2006-2013 |
55 |
|||||||||||||||||
|
|
|
|
|
|
|
12+ |
|
|
|
|
|
|
|
|
|
|
|
||
Эффект Джоуля–Томсона
В процессе Джоуля– Томсона энтропия возрастает, это необратимый процесс. Разность температур в эффекте Джоуля– Томсона зависит от природы реального газа и от его начальных параметров T1 и V1. При заданном начальном объёме реального газа V1 величина и знак эффекта Джоуля– Томсона зависят от начальной температуры T1: чем ниже T1, тем больше величина положительного эффекта. Эффект Джоуля– Томсона всецело обусловлен отличием реального газа от идеального.
© А.В. Бармасов, 2006-2013 |
56 |
12+ |
|
3.7.6. Сжижение газовв
Из рассмотрения изотерм Ван-дер-Ваальса видно, что одним из способов перевода реального газа в жидкое состояние (сжижение газа) является его сжатие, приводящее к сближению его молекул до возникновения межмолекулярных сил «сцепления».
Однако такой способ сжижения может быть использован лишь для газов, находящихся при температурах ниже критических. Если же газ находится при температуре TК или при более высокой температуре, то никаким сжатием невозможно превратить его в жидкость.
Такие газы, как, например, кислород, азот, водород, гелий имеют низкие значения критической температуры, поэтому для сжижения их необходимо охлаждать.
© А.В. Бармасов, 2006-2013 |
57 |
12+ |
|
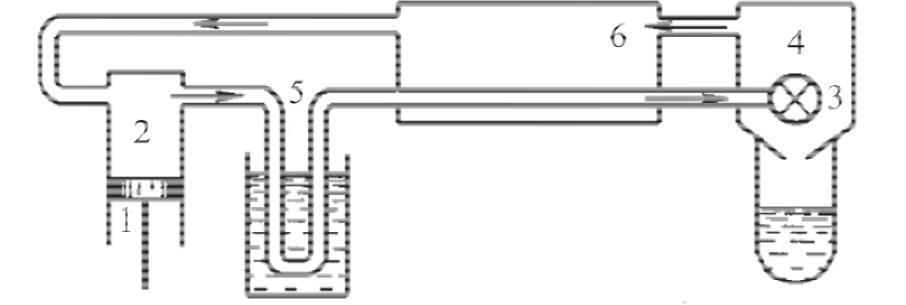
Схема сжижения газов с применением дросселирования газа (машина Линде)
© А.В. Бармасов, 2006-2013 |
58 |
12+ |
|
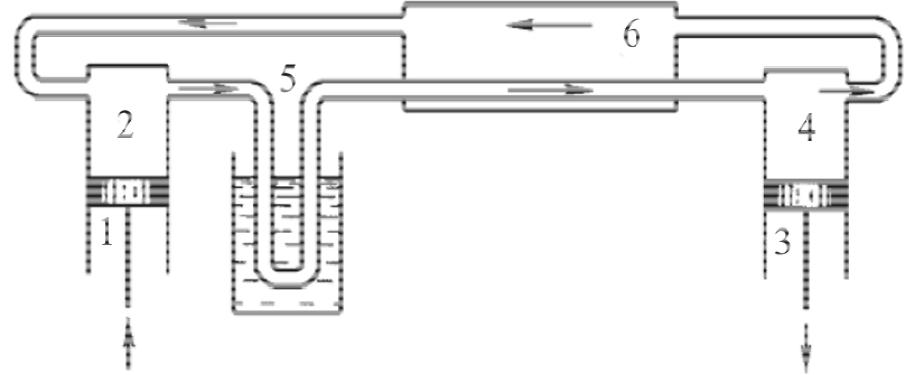
Схема сжижения газов по методу Клода (детандер)
© А.В. Бармасов, 2006-2013 |
59 |
12+ |
|
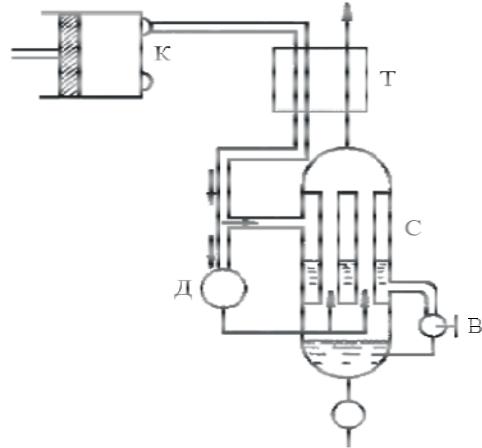
Схема турбодетандера Капицы:
К– компрессор; Т – теплообменник; С – конденсатор;
Д– турбодетандер; В – вентиль
© А.В. Бармасов, 2006-2013 |
60 |
12+ |
|
