
Ф изика термодинамика бля лекции и вопросы / OF3_4_Entropia_Vtoroe_nachalo_termodinamiki_min
.pdfФлуктуации
(Fluctuations)
Любое упорядоченное состояние всегда можно осуществить меньшим числом способов, чем неупорядоченное. Понятно, что наиболее вероятным будет состояние, которое может быть осуществлено наибольшим числом способов. Это состояние и есть равновесное состояние. Поскольку оно всегда осуществляется наибольшим числом способов, система, предоставленная самой себе, перейдёт именно в равновесное состояние. Самопроизвольное отклонение от этого состояния чрезвычайно маловероятно.
В природе происходят самопроизвольные отклонения от равновесия, но они весьма малые и кратковременные. Такие отклонения называют флуктуациями.
© А.В. Бармасов, 1998-2013 |
21 |
12+ |
|
Макроскопическое состояние
Макроскопическое состояние (макросостояние)
термодинамической системы (в частности, идеального газа) определяется значениями её внешних термодинамических параметров (давления р, температуры Т, объёма V, внутренней энергии U и т.п.), доступных измерениям.
Для определения макроскопического состояния однокомпонентной (однофазной системы) достаточно знать значения любых 2 независимых параметров (например, Т и р или Т и V).
© А.В. Бармасов, 1998-2013 |
22 |
12+ |
|
Статистический вес
(Statistical weight)
Наиболее вероятным является то макросостояние, которое можно осуществить с помощью максимального числа микросостояний. Число способов, которыми можно осуществить данное состояние называют статистическим весом
данного состояния.
Тело, предоставленное самому себе, стремится перейти в состояние с бó льшим статистическим весом.
© А.В. Бармасов, 1998-2013 |
23 |
12+ |
|
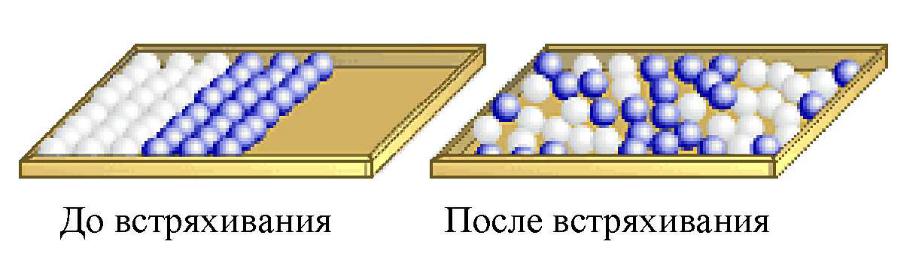
Любой процесс в замкнутой системе завершается переходом системы в состояние с большей степенью беспорядка
© А.В. Бармасов, 1998-2013 |
24 |
12+ |
|
Термодинамическая вероятность
(Thermodynamic probability)
Термодинамической вероятностью W называют число способов размещения частиц Z или число микросостояний, реализующих данное макросостояние.
Математическая вероятность P макросостояния системы не может превышать единицы, а термодинамическая вероятность W всегда больше, или, в крайнем случае, равна единице.
© А.В. Бармасов, 1998-2013 |
25 |
12+ |
|
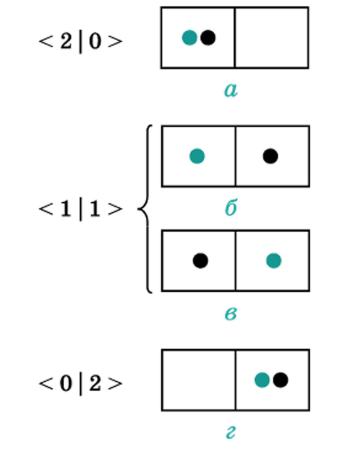
Распределение двух молекул в половинках сосуда
© А.В. Бармасов, 1998-2013 |
26 |
12+ |
|
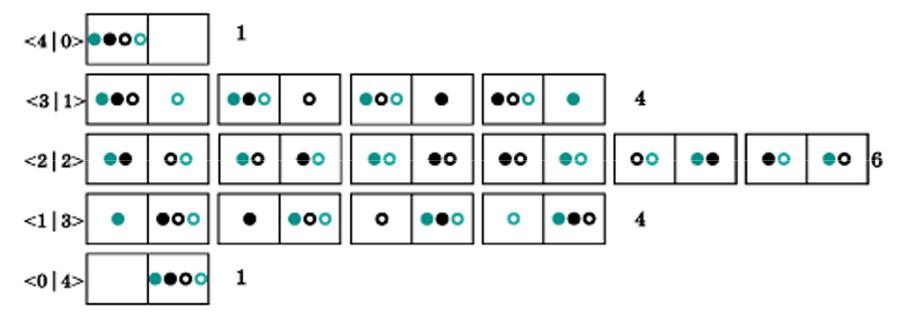
Распределение четырёх молекул в половинках сосуда
© А.В. Бармасов, 1998-2013 |
27 |
12+ |
|
Формула (принцип) Больцмана
Энтропия – мера беспорядка физической системы:
S = k lnW
S > 0
© А.В. Бармасов, 1998-2013 |
28 |
12+ |
|
Подобно всем логарифмам, натуральный логарифм отображает умножение в сложение:
ln ( xy ) = ln ( x) + ln ( y )
© А.В. Бармасов, 1998-2013 |
29 |
12+ |
|
Второе начало термодинамики
(Second principle of thermodynamics)
Второе начало термодинамики:
При всех процессах, происходящих в макроскопической системе, система не может самопроизвольно переходить из более вероятного состояния в менее вероятное. Конечное состояние системы всегда будет или более вероятным, чем начальное, или, по крайней мере, будет иметь ту же вероятность и энтропию.
Фактически второе начало термодинамики устанавливает необратимость макроскопических процессов, протекающих с конечной скоростью: процессы, связанные с теплообменом при конечной разности температур, с трением, с диффузией и др., текущие с конечной скоростью, необратимы, т. е. могут самопроизвольно протекать только в одном направлении.
© А.В. Бармасов, 1998-2013 |
30 |
12+ |
|
