
Лабораторные работы по физике аэрозолей (Чукин В.В.) / clouds
.pdf
® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
В. В. Чукин
Физика облаков
СанктПетербург
2005
® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
1 Фазовые переходы воды в атмосфере
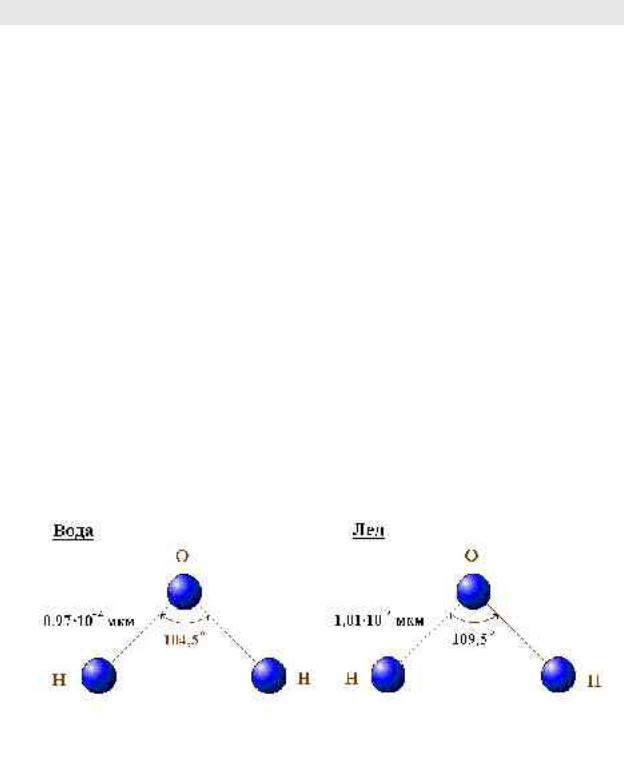
1.1 Структура молекулы воды
Молекула воды состоит из трех атомов (один атом кислорода − O и два атома водорода − H). Три ядра молекулы H2O образуют равнобедренный треугольник с ядром кислорода при вершине и двумя протонами на линии основания.
Для воды боковые стороны треугольника равны 0.97 10−10 м , а угол при вершине − 104.5 ° , для льда − соответственно 1.01 10−10 м и 109.5 ° .
Рисунок 1.1 − Структура молекулы воды и льда
Атом кислорода имеет 8 электронов и две вакансии, водород имеет один электрон (см. таблицу 1.1). Электроны водорода стремятся занять вакансии кислорода и притягиваются к ядру кислорода.

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
Однако заряд восьми электронов полностью компенсирует заряд ядра кислорода, а притянутые два электрона оказываются не скомпенсированными. Они образуют два отрицательных центра при вершине треугольника.
Ядра водорода, вследствие смещения электронов, становятся положительными центрами.
Между ядром водорода в одной молекуле воды и отрицательным центром в другой молекуле может возникнуть электростатическое притяжение. При температуре ниже точки кипения притяжение достаточно, чтобы между отдельными молекулами создалась водородная связь.
Таблица 1.1 − Заполнение электронами орбит в атомах
|
Электронная |
|
1s |
2s |
2p |
3s |
3p |
3d |
|
оболочка |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Максимальное число |
2 |
2 |
6 |
2 |
6 |
10 |
||
|
электронов |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
Водород |
H |
1 |
− |
− |
− |
− |
− |
2 |
Гелий |
He |
2 |
− |
− |
− |
− |
− |
3 |
Литий |
Li |
2 |
1 |
− |
− |
− |
− |
4 |
Бериллий |
Be |
2 |
2 |
− |
− |
− |
− |
5 |
Бор |
B |
2 |
2 |
1 |
− |
− |
− |
6 |
Углерод |
C |
2 |
2 |
2 |
− |
− |
− |
7 |
Азот |
N |
2 |
2 |
3 |
− |
− |
− |
8 |
Кислород |
O |
2 |
2 |
4 |
− |
− |
− |
9 |
Фтор |
F |
2 |
2 |
5 |
− |
− |
− |
10 |
Неон |
Ne |
2 |
2 |
6 |
− |
− |
− |

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
Для жидкой фазы воды характерно быстрое формирование и разрушение водородных связей.
При охлаждении тепловое движение замедляется, при этом водородные связи сохраняются длительное время и соединяют молекулы воды в твердую кристаллическую структуру льда.
Структура кристалла льда описывается так называемыми правилами Бернала и Фаулера:
1.На связь O − O приходится один протон, причем расстояние между H и O может изменяться.
2.С каждым атомом кислорода связаны двпа и только два атома водорода, то есть сохраняется идентичность молекуле воды.
Изза наличия электростатического притяжения между H и O соседних
увеличивается расстояние O − H с 0.96 10−10 м (вода) до м (лед), а также угол при вершине треугольника с 104.5 ° (вода) до 109.5 ° (лед). Расстояние между ближайшими атомами кислорода O равно
м .
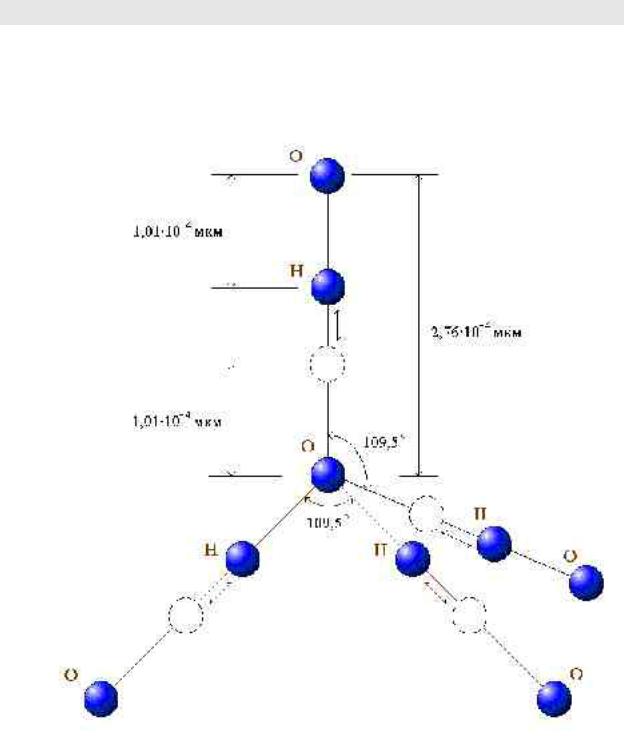
Во льду каждый атом кислорода оказывается связан с четырьмя атомами водорода (два атома связаны кислородной связью, а другие два — водородной связью). Это так называемая тетрагональная (четвертная) связь между атомом кислорода и атомами водорода. Наличие такой связи приводит к появлению слоев из шестиугольников неправильной формы, расположенных друг над другом, что характерно для структуры льда.
® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
Рисунок 1.2 − Кристаллическая структура льда

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
Массу молекулы воды mH2 O можно определить из определения молярной массы воды:
H2 O=N A mH2 O ,
где H |
O |
− |
молярная масса воды, равная 0.018 кг/моль; |
|
2 |
|
|
|
|
N A |
− число Авогадро, равное 6.02213 1023 моль1; |
|||
mH |
|
O |
− |
масса молекулы воды, кг. |
2 |
|
|
|
|
Отсюда масса молекулы равна:
mH2 O= |
H2 O |
|
0.018 |
|
−26 |
|
|
= |
|
|
≈3 10 |
кг. |
|
N A |
6.02213 10 |
23 |
||||
|
|
|
|
|
(1)
(2)
Определим объем, занимаемый молекулой, и линейный размер молекулы (длину).
Объем определяется по известной массе молекулы и плотности воды в жидком состоянии:
v |
|
mH |
2 O |
|
3 10−26 |
−29 |
м3. |
|
В= |
|
|
= |
1000 |
≈3 10 |
|
(3) |
|
В |
|
|||||||
|
|
|
|
|
|
|||
Линейный размер молекулы определяется по известному объему:

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
lВ=3 |
|
=3 |
|
≈3 10−10 м. |
|
vВ |
3 10−29 |
(4) |
Сравните линейный размер молекулы с расстоянием между молекулами в кристаллической решетке (см. рисунок 2.3).
Средняя скорость движения молекулы воды в воздухе V В
определяется температурой окружающего воздуха:
|
8 k T |
|
|
V |
В= mH2 O |
, |
(5) |
где k |
− |
постоянная Больцмана, равная 1.38 10−23 Дж/K; |
T |
− |
температура воздуха, K. |
Число молекул водяного пара N П в единице объема воздуха определяет влажность воздуха:
e=N П k T , |
(6) |
где |
e |
− |
парциальное давление водяного пара, Па; |
|
N П |
− |
концентрация молекул водяного пара, м3. |

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
1.2 Термодинамические системы
Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. Примером может служить вода, находящаяся в соприкосновении с паром и льдом.
Состояние термодинамической системы характеризуется параметрами состояния (температурой, давлением, объемом, плотностью).
Состояние системы, когда все параметры состояния постоянны во времени, называется равновесным состоянием.
Состояние системы, в котором хотя бы один из параметров изменяется, называется неравновесным состоянием.
Термодинамические системы, которые не обмениваются с внешней средой ни энергией, ни веществом, называются изолированным и.
Системы, обменивающиеся энергией и веществом с внешней средой, называются открытыми .
Любая изолированная система придет к стабильному состоянию, то есть состоянию равновесия, за определенный интервал времени, который называется временем релаксации равновесного состояния.
Если время релаксации равновесного состояния рел мало по сравнению со временем протекания процесса проц (изменения внешних

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
условий), то есть рел << проц , то такие |
состояния называются |
квазиравновесными. |
|
Если время релаксации сравнительно велико, |
то есть рел≈ проц , то |
система находится в особого рода нестабильном состоянии, называемом метастабильным.
Примером системы, находящейся в метастабильном состоянии является переохлажденная вода (вода в жидком состоянии при отрицательных температурах).
Самое точное описание ТДС заключается в описании положения всех частиц, образующих систему, и называется микросостоянием системы.
Состояние ТДС, описанное с помощью параметров, характеризующих все тело в целом (объем, давление, температура) называется
макросостоянием .
Если система находится в равновесии, то параметры состояния будут постоянными (v=const, P=const, T=const), то есть макросостояние не будет изменяться. Однако частицы, образующие систему, все время перемещаются, следовательно, микросостояние системы все время изменяется.
Отсюда следует, что одно и тоже макросостояние может осуществляться различными микросостояниями системы.
Число различных микросостояний, с помощью которых можно осуществить одно и тоже макросостояние, называется статистическим весом макросостояния, и обозначается символом Ω.

® Чукин В. В. Физика облаков. Конспект лекций. 2005. (1е неофициальное издание)
Вероятность каждого макросостояния пропорциональна его статистическому весу Ω.
Количественной характеристикой вероятности макросостояния является величина, получившая название энтропии и определяемая выражением:
s=k ln , |
(7) |
где s |
− |
энтропия, Дж/К; |
k |
− |
постоянная Больцмана, Дж/К. |
Свойства энтропии:
1)В ходе необратимого процесса энтропия изолированной системы возрастает.
Это объясняется тем, что изолированная система переходит из менее вероятных состояний в более вероятные, что сопровождается увеличением статистического веса Ω, и следовательно и энтропии s.
2)Энтропия изолированной системы, находящейся в равновесном состоянии, максимальна и постоянна во времени.
Если под действием внешних сил система проходит ряд последовательных равновесных состояний, то такой процесс является
обратимым .
Спонтанный фазовые переходы (испарение, возгонка, плавление) по своей природе − процессы необратимые, вне зависимости от того,
