
- •Введение
- •Происхождение вселенной
- •Происхождение и эволюция Земли
- •Образование земной коры и атмосферы
- •Образование гидросферы
- •Происхождение жизни и эволюция атмосферы
- •Строение Земли
- •Строение Земли (модель Гуттенберга—Буллена)
- •Биосфера
- •Атмосфера
- •Состав атмосферы
- •Источники и стоки атмосферных газов
- •Виды источников
- •3О2 (разряд) → 2о3
- •Виды стоков
- •Природные источники
- •Геохимические источники
- •Биологические источники
- •Реакционная способность следовых веществ в атмосфере
- •Время пребывания следов газов в естественной атмосфере
- •Влияние кислотных дождей на природные объекты
- •Меры борьбы с кислотными осадками
- •Загрязнение воздуха и здоровье
- •Последствия загрязнения воздуха
- •Процессы удаления
- •Литосфера
- •Распространенность (кларки) главных химических элементов в земной коре до глубины 16 км
- •Процессы выветривания
- •1. Растворение
- •2. Окисление
- •3. Кислотный гидролиз
- •4. Выветривание сложных силикатов
- •Анортит каолинит
- •Солнце как источник энергии
Реакционная способность следовых веществ в атмосфере
Очевидно, что газы с коротким временем пребывания в атмосфере могут быть легко удалены. Некоторые из них удаляются в процессе поглощения растениями, твердыми веществами или водой. Однако наиболее частой причиной короткого времени пребывания газа в атмосфере служит протекание химических реакций.
Время пребывания следов газов в естественной атмосфере
-
Газы
Время пребывания
Диоксид углерода
4 года
Оксид углерода
0,1 года
Метан
3,6 года
Муравьиная кислота
10 дней
Азотистый ангидрид
20-30 лет
Оксид азота
4 дня
Диоксид азота
4 дня
Аммиак
2 дня
Диоксид серы
3 -7 дней
Сероводород
1 день
Сероуглерод
40 дней
Серооксид углерода
1год
Диметилсульфид
1 день
Метилхлорид
30 дней
Метилиодид
5 дней
Хлороуглеводороды
4 дня
Большинство микрокомпонентных газов, перечисленных в таблице, не очень активно вступает в реакции с основными компонентами воздуха. На самом деле, наиболее реакционно-способной единицей в атмосфере является фрагмент молекулы воды, радикал гидроксила (ОН.). Этот радикал (реакционно-способный молекулярный фрагмент) образуется в результате фотохимически инициируемой последовательности реакций, которая запускается фотоном света, hv:
О3 + hv О2 + О
О +Н2О 2ОН.
Радикал ОН. может вступать в реакции со многими соединениями атмосферы, поэтому у него короткое время пребывания, и скорости реакций его больше, чем у такого распространенного газа, как O2. Реакция между диоксидом азота (NO2) и радикалом ОН. приводит к образованию HNO3, важной составляющей кислотных дождей:
NO2 + ОН. HNО3
С другой стороны, кинетические измерения в лаборатории показали, что газы, у которых низкие скорости реакций с радикалом ОН., имеют большое время пребывания в атмосфере. В таблице показано, что COS, N2O и даже СН4 имеют большое время пребывания. ХФУ (хлорфторуглеводороды: охлаждающие вещества и распыляющие вещества аэрозолей) также ограниченно вступают в реакции с ОН.,. Подобные газы накапливаются в атмосфере и со временем просачиваются в стратосферу. Там имеют место совершенно другие химические процессы, в которых преобладает не ОН.,, а атомарный кислород (т. е. О). Газы, реагирующие с атомарным кислородом стратосферы, могут препятствовать образованию О3 по реакции
О+О2 О3
и отвечать за истощение озонового слоя стратосферы.
Озон
Образование озона (О3) — это фотохимический процесс с использованием энергии света. Чем меньше длина волны света, тем больше энергии он несет. Чтобы разорвать на части молекулу кислорода (О2), требуется ультрафиолетовое излучение (УФ) с длиной волны меньше 240нм
О2 + hv О + О
Как только образовались атомы кислорода (О), они взаимодействуют с образованием О3:
О2 + О О3
Образование О3 в результате фотохимического процесса может быть уравновешено реакциями, вследствие которых О3 разрушается. Это можно записать в виде
О3 + hv О2 + О
О3 + О 2 О2
вместе с дополнительной реакцией, описывающей разрушительный для атомов кислорода процесс:
О + О + М О2 + М
Отметим присутствие «третьего тела» М, которое забирает избыточную энергию в процессе реакции. Этим третьим телом может быть О2 или молекула азота. Без «третьего тела» образовавшаяся молекула О2 может распасться снова. Эти принципиально «только кислородные» реакции не полно описывают химию О3 поэтому надо принимать но внимание водород (Н), азот (N) и хлор (Сl) содержащие формы:
ОН. + O3 O2 + НО2.
НО2. + О ОН.+ O2
что в сумме дает
О3 + О 2 О2
Подобные реакции могут быть записаны для других форм, например окиси азота (NO), попадающей из двигателей сверхзвуковой авиации, или закиси азота (N2O), которая проходит через тропопаузу и проникает в стратосферу:
NО + О3 О2 + N О2
N О2 + О N О + О 2
N2O(r) может вступить в реакцию через начальную ступень:
N2 О + О 2NO.
Последовательность реакций для хлора из хлорфторуглеводородов такова:
О3 + Сl О 2 + Сl О
Сl О + О О 2 + Сl
Каждая из этих трех пар реакций суммируется так, что О3 и атомарный кислород разрушаются, в то время как молекулы или радикалы ОН, NO или CI возобновляются. Таким образом, они могут рассматриваться как катализаторы разрушения О3 Важным моментом для химии стратосферного О3 в этих каталитических цепях реакций является то, что единственная молекула загрязнителя может служить причиной разрушения большого количества молекул О3.
ХФУ — одни из первых разрушителей озонового слоя стратосферы. Соединения азота также разрушительны для О3, если переносятся в стратосферу, поскольку они включаются в простые последовательности реакций. Именно азотные соединения из выхлопов самолетов коммерческой сверхзвуковой авиации, летающих на больших высотах, были первыми предполагаемыми значительными загрязнителями. В этом случае газам не обязательно было иметь низкую реакционную способность и медленно проникать в стратосферу — они вносились непосредственно из авиационных двигателей.
Большой стратосферный воздушный флот не возник, поэтому внимание в настоящее время сосредоточилось на N2О, гораздо более инертном оксиде азота, который образуется на уровне земли и способен легко проникать в стратосферу. Этот газ выделяется как в результате биологической активности в плодородных почвах, так и вследствие ряда процессов сгорания, наиболее интересными из которых являются происходящие в автомобильных двигателях с каталитическими преобразователями.
Кислотные дожди
Дождевая вода часто содержит различные природные и антропогенные химические вещества, в том числе кислотного характера. Кислая реакция дождевой воды была описана еще в 1684 году английским ученым Робертом Бойлем. Возникает вопрос, какую дождевую воду считать кислой? Простой ответ, что естественная дождевая вода является кислой, если ее рН меньше 7, не годится.
Дождевая вода в природе находится, как правило, в равновесии с окружающими веществами. Величина рН дождевой воды в чистой, без антропогенных примесей атмосфере должна определяться в первую очередь, равновесием с углекислым газом, содержание которого в атмосфере близко к 350 ррм (350 частей на миллион). В этом случае значение рН дождевой воды должно равняться 5,6. Ясно, что дождевая вода с рН = 5,6 является наиболее естественной. Тем не менее, принято другое определение для кислой дождевой воды.
Дождевая вода считается кислой, если ее рН меньше 5. Это связано с тем, что анализ выпадающих осадков (усредненный результат по всему земному шару), дает значение рН вблизи 5. Разброс значений рН заключен в основном в интервале от 4 до 6,3. Тем не менее, наблюдаются значения как очень низкие, вплоть до 2, так и достаточно высокие - в области 8. Кислотные дожди (рН < 5) характерны для высокоурбанизированных областей Западной Европы, США и Японии, но отмечены также и в удаленных океанических районах.
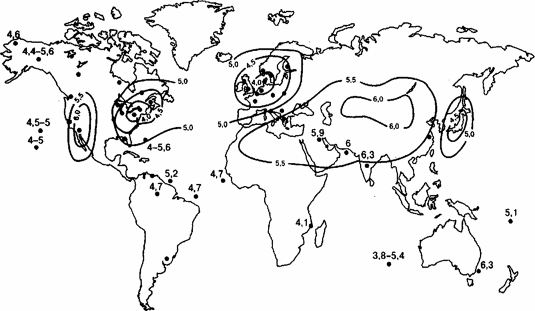
Как следует из карты, антропогенные воздействия представляют собой существенный фактор образования кислотных дождей.
В дождевой воде обнаружены в основном серная, азотная, муравьиная и уксусная кислоты. Их предшественниками являются диоксид серы, диоксид азота и органические соединения.
Потоки и концентрации диоксида серы , оксидов азота и органических соединений в атмосфере
Диоксид серы. Основным природным источником поступления в атмосферу непосредственно SO, являются вулканы. Ежегодное количество выделяющегося в составе вулканических газов диоксида серы составляет 11,8 млн. т
Вулканы служат также в качестве непрямого поставщика SO2, в атмосферу: с вулканическими газами выбрасывается сероводород H2S, который под действием кислорода воздуха превращается в SO2. Образование сероводорода в процессе вулканической деятельности связывают с реакцией, протекающей в паровой фазе при высоких температурах (выше 1800 °С).
Другими непрямыми естественными источниками SО2 являются летучие восстановленные соединения серы - органические сульфиды (меркаптаны, диметилсульфид) и др., которые в атмосфере окисляются до диоксида серы. Эти соединения образуются в результате биогенных процессов из природных соединений — сульфатов и серосодержащего органического материала.
Океан и почва содержат в значительном количестве растворенные сульфаты, которые под влиянием ряда микроорганизмов в анаэробных условиях (в отсутствие кислорода) восстанавливаются до сероводорода.
Скорость восстановления сульфатов и образования сероводорода в морской воде может быть довольно высока
Механизмы образования кислот в атмосфере
В образовании серной кислоты из SО2 в атмосфере участвуют радикалы ОН., которые присутствуют в атмосфере Реакции, ведущие к получению серной кислоты, таковы:
ОН.+ SO2 → HSO.3,
HSO.3 + О2 → SO3 + НО2. SO3 + Н2О → H2S04
В дальнейшем серная кислота либо выпадает на поверхность земли, либо дает соли, реагируя главным образом с аммиаком. Соли обычно выводятся из атмосферы вместе с дождями или за счет гравитационного оседания. Этот механизм обеспечивает вывод диоксида серы из атмосферы примерно за 12 дней.
Другой механизм образования серной кислоты в природе связан с окислением диоксида серы в облачных каплях. В этом случае окислению подвергается частица SO32- или HSO3-. В роли окислителя выступают пероксид водорода и озон;
HSO3- + H2O2 + H3O+ + 2H2O (I)
HSO3- + O3 + H3O = H2SO4 + H2O + O2 (II)
Еще один механизм окисления диоксида серы представляет собой цепной каталитический процесс окисления кислородом активных частиц •SO3 – сопряженный с каталитическим инициированием ионами железа.
Указанные механизмы обеспечивают выведение диоксида серы из атмосферы за 2 – 4 дня. Считается, что вклад газофазного образования серной кислоты по реакциям (I) сопоставим с вкладом образования серной кислоты непосредственно в жидких каплях по реакциям (II).
Образование азотной кислоты в атмосфере происходит двумя основными путями. Первый путь - реакция радикала .ОН с NO2,
.OH + NO2 → HNO, (III)
Эта реакция происходит днем, так как радикал .ОН присутствует в атмосфере только в дневное время.
Муравьиная и уксусная кислоты образуются в результате окисления органических соединений в атмосфере (детальный механизм этих реакций не вполне ясен).
Кислотность осадков
Образующиеся в атмосфере кислоты входят в состав туманов, облачных и дождевых капель. Приведем значения рН и концентраций некоторых примесей в этих природных образованиях:
РН H+мкМ Сl- мкМ
Туман 2,9-4,9 320-500 480-730
Облака 4,4 120 150
Дождевая вода 4,7 19.8 21.7
Такое распределение можно объяснить следующим образом. Концентрация примесей у поверхности земли наибольшая и поэтому в туманах наибольшая концентрация примесей и кислот. На высоте нескольких километров, где существуют облачные капли, концентрация примесей в атмосфере значительно меньше, чем у поверхности. При образовании дождя происходит разбавление облачных капель и, соответственно, концентрация примесей и кислот еще сильнее понижается. Таким образом, для сельского хозяйства и огородов более пагубны туманы, так как они обычно холодные и содержат больше примесей по сравнению с дождевой водой.
Образовавшиеся кислоты выводятся из атмосферы дождями примерно 7 суток. При этом кислоты попадают в водоемы, на растительность, почву и различные объекты человеческой деятельности (здания, памятники и т.д.) Наиболее низкие значения рН дождевой воды наблюдаются в Западной Европе и США. В этих регионах в зависимости от характера антропогенных выбросов в осадках может преобладать либо серная, либо азотная кислота. На территории России ситуация более благоприятная: в среднем значения рН близки к 5,5, а в южных районах Западной и Восточной Сибири средние значения рН находятся вблизи 6.
