
Для студентов 1 / описание лабораторных работ / лр-20
.docЛабораторная работа №20
«Определение отношения молярных теплоемкостей для воздуха»
Цель работы: измерение показателя адиабаты методом Клемана-Дезорма.
Теоретическое введение.
При решении различных инженерных вопросов в теплотехнике часто встречается понятие теплоемкости вещества.
Теплоемкостью вещества С называют физическую величину равную отношению количества теплоты Q к изменению температуры, dT вызванную этим телом. Если изменение температуры составляет один кельвин, то теплоемкость численно равна количеству теплоты, которое необходимо при этом затратить.
Таким образом,
![]() (1)
(1)
В практических расчетах чаще пользуются теплоемкостью, отнесенной к вполне определенному количеству вещества, т. е. удельной и молярной теплоемкостью.
Молярная теплоемкость См определяет количество теплоты, которое необходимо сообщить одному молю вещества, чтобы изменить его температуру на один кельвин. Теплоемкость вещества может быть выражена через молярную теплоемкость См и количество молей формулой
![]() (2)
(2)
У газов теплоемкость существенно зависит от условий, в которых они нагреваются. Если нагрев происходит при неизменном объеме (V=const) то молярная теплоемкость обозначается символом CV. Если при нагревании газа остается неизменным давление газа (P=const), то молярная теплоемкость обозначается символом CP.
Для нахождения молярных теплоемкостей идеального газа СV и СР пользуются первым началом термодинамики, записанным для элементарного процесса
![]() (3)
(3)
где
Q
– количество теплоты сообщенное газу,
dU
– изменение внутренней энергии,
![]() - работа, совершенная газом, Р – давление,
dV
– изменение объема.
- работа, совершенная газом, Р – давление,
dV
– изменение объема.
Тогда в соответствии с выражениями (1) и (3) можно записать
![]() (4)
(4)
где i – число степеней свободы молекул идеального газа, R – универсальная газовая постоянная.
Аналогично для СР получим
![]() (5)
(5)
таким образом,
![]() (6)
(6)
Выражение (6) называют уравнением Мейера.
Обычно на практике измеряют не сами величины СР и СV , а их отношение
![]() (7)
(7)
Параметр газового состояния называют показателем адиабаты, поскольку он входит в уравнение, описывающее следующий адиабатный процесс.
![]() (8)
(8)
Адиабатным называют процесс, при котором газ не отдает телам тепло и не получает его извне, т.е. процесс протекает без теплообмена с окружающей средой (Q=0).
Методика измерений
Для определения методом Клемана-Дезорма используют сосуд (1), снабженный манометром (2), насосом (3) и клапаном (4) (см. рис.).

Если открыть клапан на некоторое время (5-6 секунд), то давление в сосуде станет равным атмосферному P0, температура также равна температуре окружающей среды Т0. Тогда состояние выделенной массы воздуха m будет описываться параметрами V0, T0, P0.
Если в закрытом клапане быстро накачать в сосуд некоторое количество воздуха, то объем рассматриваемой массы воздуха уменьшится, а давление и температура возрастут.
Однако через некоторое время (2-3 минуты) после накачивания воздуха вследствие теплообмена через стенки сосуда температура в сосуде вернется к первоначальной Т0. Давление примет значение
![]() (9)
(9)
где PK1’ – давление, столбом воды в манометре, после прекращения теплообмена. Это состояние воздуха будем считать начальным, характеризующимся параметрами V1, P1, T0.
Если на короткое время (0,5-1 сек.) открыть клапан в сосуде, то воздух в сосуде резко (адиабатно) расширится. В этом случае воздух в сосуде охладится до Т1, т.к. работа расширения газа равна убыли внутренней энергии воздуха. В конце процесса расширения состояние части воздуха m будет характеризоваться параметрами V2, P0, T1.
После закрытия клапана воздух в сосуде начнет нагреваться вследствие теплообмена через стенки сосуда и его температура возрастет от Т1 до Т0. Давление возрастет и станет равным
![]() (10)
(10)
где
![]() -
давление создаваемое столбом воды,
заключенным между уровнями в манометре,
после прекращения теплообмена. Состояние
массы воздуха после установления
равновесия (конечное состояние)
характеризуется параметрами V2,
P2,
T0.
-
давление создаваемое столбом воды,
заключенным между уровнями в манометре,
после прекращения теплообмена. Состояние
массы воздуха после установления
равновесия (конечное состояние)
характеризуется параметрами V2,
P2,
T0.
Переход из начального состояния в промежуточное представляет собой адиабатный процесс. Используя уравнение (8) запишем
![]() (11)
(11)
Поскольку в начальном и конечном состояниях температура воздуха в сосуде одинакова и равна Т0, то
![]() (12)
(12)
возведем обе части уравнения (12) в степень и разделим его на уровне (11) получим
![]()

Прологарифмировав полученное соотношение придем к выражению
![]()
С учетом, что PK1<<P0 и PK2<<P0 разложим выражения lg(P0+PK1) и lg(P0+PK2) в ряд Тейлора и ограничимся двумя первыми членами разложения
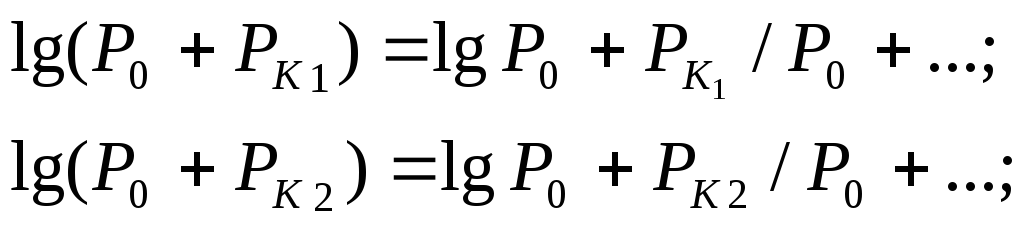 (14)
(14)
Подставляя выражения (14) в формулу (13), получим
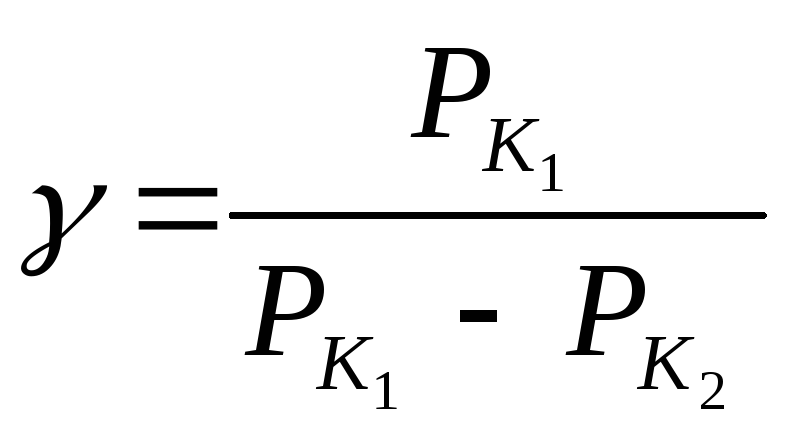
Заменив PK1=gh1 и PK2=gh2, где h1 и h2 – разности уравнений жидкости в манометре, соответствующие начальному и конечному состояниям, приходим к расчетной формуле
![]() (15)
(15)
Экспериментальная часть
-
Открыть клапан на 3-5 секунд, чтобы разность уровней воды в манометре не отличалась от нуля.
-
Быстро сделать 5-10 качков насосом, чтобы разность уровней в манометре составляла 25-30 делений. после выполнения качков шланг, идущий от сосуда к насосу следует перегнуть и надежно закрепить на сгибе, т.к. возможна утечка воздуха из сосуда через насос.
-
Выждать 2-3 минуты для протекания теплообмена между воздухом в сосуде и окружающей средой. При этом разность уровней в манометре несколько уменьшится, а затем стабилизируется. Зафиксировать разность уровней h1.
-
Открыть клапан на короткое время (1-2 секунды), в течении которого воздух расширится и его давление в сосуде сравняется с атмосферным Р0 (разность уровней на манометре станет равной нулю).
-
При закрытом клапане происходит теплообмен через стенки сосуда и давление в сосуде начнет возрастать. В установившемся состоянии (через 2-3 минуты) зафиксировать разность уровней на манометре h2.
-
Эксперимент проделать 5-6 раз и вычислить среднее значение . Сравнить это значение с его теоретическим значением, вычисленным по формуле (7).
-
Определить относительную ошибку в измерении .
Контрольные вопросы
-
В чем заключается различие между удельной и молярной теплоемкостями?
-
Что называют числом степеней свободы молекул?
-
Почему молярная теплоемкость СР больше чем СV?
-
Почему при адиабатном расширении газа падение давления происходит более резко, чем изотермическом?
-
Какую стадию экспериментального процесса в данной работе можно считать соответствующей изохорическому процессу?
-
Почему при адиабатном расширении понижается температура газа?
