
1.7 Термодинамические процессы
1.7.1 Задачи исследования термодинамических процессов
Первый закон термодинамики осуществляет связь между количеством теплоты, внутренней энергией и внешней работой газа в процессе, причем было установлено, что количество теплоты, подведенное к телу или отведенное от него, зависит от характера процесса.
К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся:
а) изохорный (w=const);
б) изобарный (p=const);
в) изотермический (T=const);
г) адиабатный (dq=0, q=0), т.е. протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процессе (т.е. c=const).
Для всех процессов устанавливается общий метод исследования, который заключается в следующем.
-
Определяется уравнение процесса и строится его график.
2. Находится зависимость между основными параметрами в начале и в конце процесса.
3. Определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа
![]()
![]()
 .
.
При сw=const
![]() .
.
4. Определяется внешняя работа газа по формуле
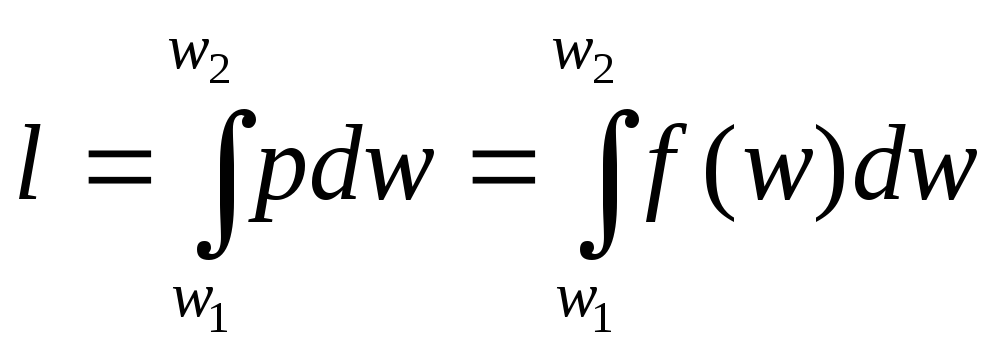 .
.
5. Определяется количество тепла q, участвующее в процессе по формуле
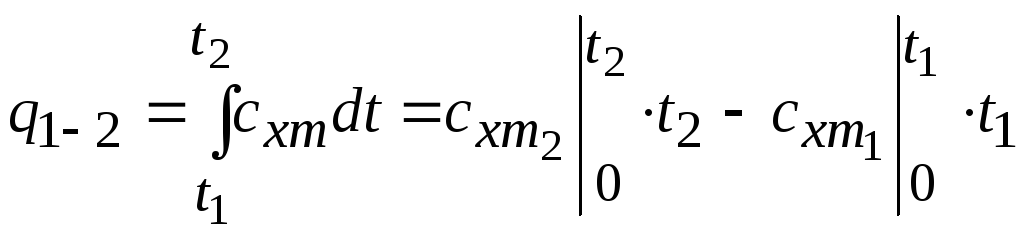 .
.
6. Определяется изменение энтальпии в процессе по формуле, справедливой для всех процессов идеального газа.
![]() .
.
7. Определяется изменение энтропии идеального газа по формуле
![]() ;
;
(1.50)
![]() .
.
1.7.2 Политропные процессы
Как уже было отмечено, процессы, в которых доля тепла, идущего на изменение внутренней энергии, в течение всего процесса остается постоянной, называется политропными. Исследуемый данный процесс в соответствии с п.1.7.1.
-
Уравнение политропного процесса.
Для вывода уравнения политропы воспользуемся уравнением 1-го закона термодинамики, записанного в следующей форме
![]()
и
![]() ,
,
откуда
 (3)
(3)
Поделим второе уравнение (3) на первое
![]() .
.
После элементарных преобразований получим
![]() .
(4)
.
(4)
Отношение
![]() -
показатель политропы (с
- удельная теплоемкость в политропном
процессе).
-
показатель политропы (с
- удельная теплоемкость в политропном
процессе).
Если
этот показатель считать постоянным, то
интегрирование уравнения (4) дает
![]() или
или
![]() .
(5)
.
(5)
Полученное уравнение является уравнением политропы. Это уравнение имеет такой же вид, как и уравнение для адиабатного процесса, рассмотрение которого будет ниже. Поэтому все выражения, полученные из уравнения адиабаты, будут аналогичны соотношениям для политропы.
2. Зависимость между параметрами находят, исходя из уравнения политропного процесса и уравнения состояния. Из уравнения (5) следует, что
![]() или
или
 .
(6)
.
(6)
Из уравнения состояния имеем
![]() .
(7)
.
(7)
Подставив
(7) в (5) получим
![]() или
или
![]() .
.
Следовательно,
![]() откуда
откуда
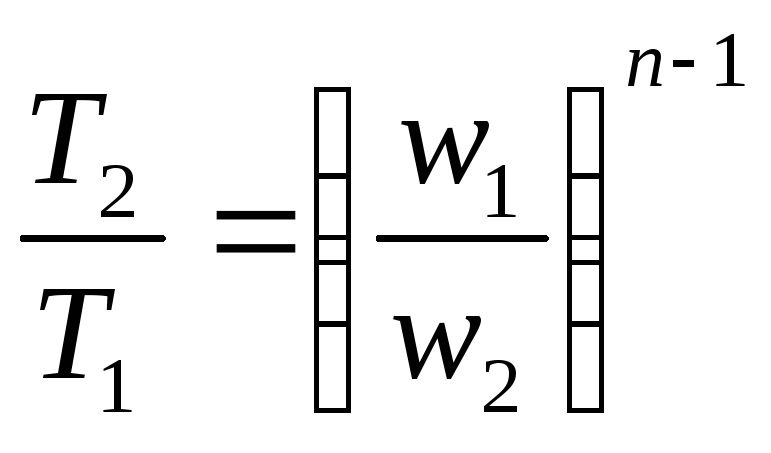 .
(8)
.
(8)
Выразим уравнение состояния в виде
![]() . (9)
. (9)
Тогда
уравнение (5) выразится в виде
![]() или
или
![]() ,
откуда
,
откуда
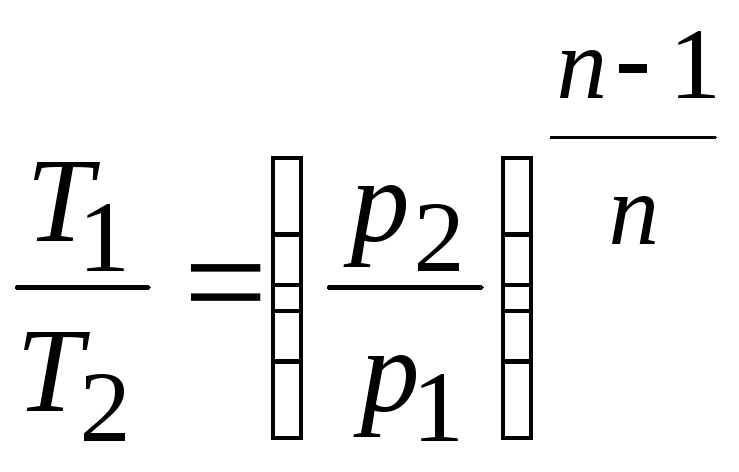 .
(10)
.
(10)
3. Изменение внутренней энергии газа в процессе определится по следующей формуле
![]()
![]()
 .
.
При
сw=const
![]() .
.
4. Внешняя работа, совершаемая газом, определится по формуле
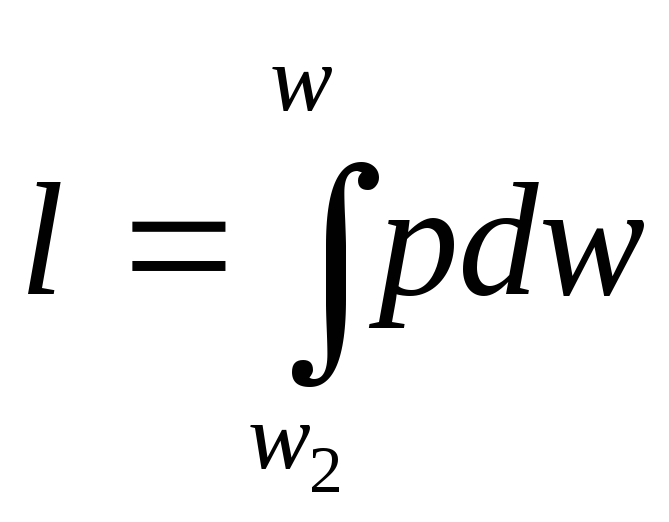 .
.
Функция
![]() определяется по формуле (6), откуда
определяется по формуле (6), откуда
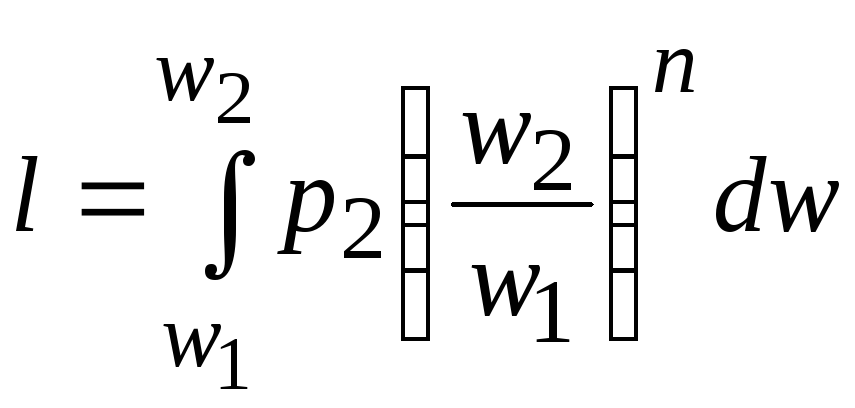 ;
или
;
или
![]() ;
;
![]() .
(11)
.
(11)
5. Количество тепла, подведенного (отведенного) к 1 кг газа, участвующего в процессе:
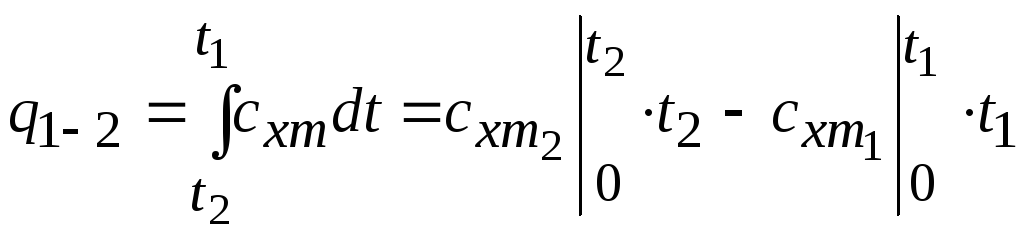 ,
,
где cxm - удельная теплоемкость для политропного процесса, определяемого по формуле:
![]() . (12)
. (12)
Показатель политропы находится опытным путем. Для этого строят график по опытным данным изучаемого процесса, как показано на рисунке 1.2.
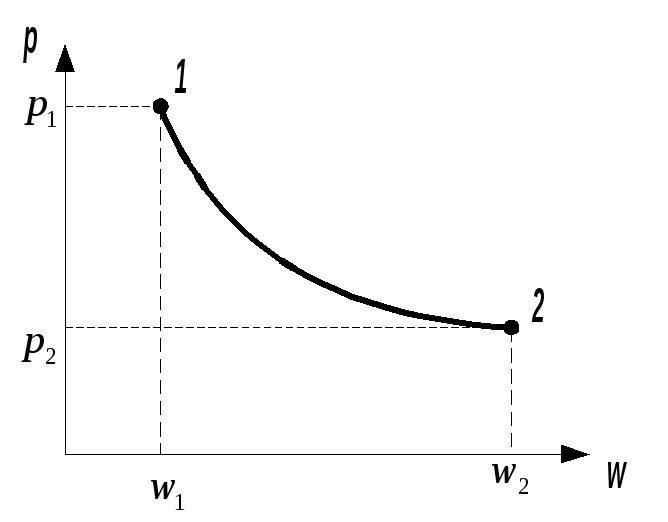
Рис. 1.2. К выводу показателя n.
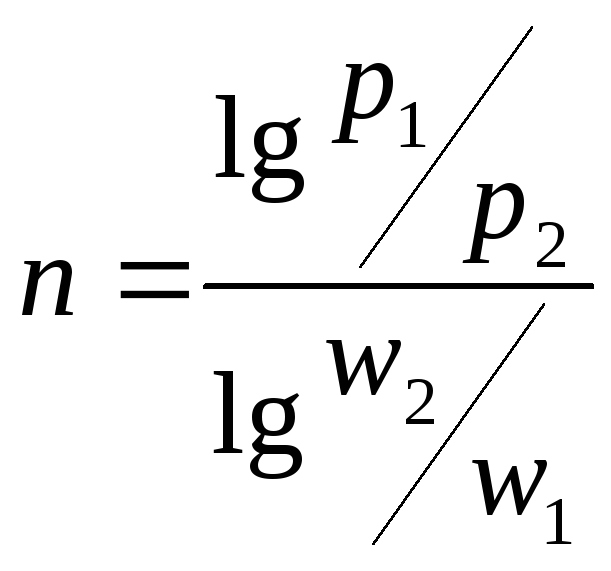 .
(13)
.
(13)
Величина п может принимать конкретные значения.
1.7.3.Изопараметричекие процессы.
а) Изохорный процесс (закон Шарля).
Изохорным
называется процесс, протекающий при
w=const
или dw=0.
Действительно, при
![]()
![]() или
или
![]() ,
откуда
,
откуда
![]() и w=const.
и w=const.
Подобный процесс может совершаться рабочим теплом, находящимся в цилиндре при неподвижном поршне (рис. 1.3), если к газу подводится теплота от источника тепла (положение I) или отводится теплота к холодильнику (положение II).

Рис. 1.3 Изохорный процесс
Уравнение изохорного процесса может быть получено из уравнения состояния при w=const.
![]() .
Но т.к. R
и w
в этом процессе постоянные, то
.
Но т.к. R
и w
в этом процессе постоянные, то
![]() ,
откуда
,
откуда
![]() .
(14)
.
(14)
Таким образом, в изохорном процессе давление газа всегда остается пропорциональным температуре.
Изменение
внутренней энергии определяется по
формуле
![]() или dq
= du
+ pdw.
или dq
= du
+ pdw.
Внешняя
работа определяется по формуле
 .
.
Так как dw = 0 то dl = 0 и
![]() =
0, т.е. работа не совершается.
=
0, т.е. работа не совершается.
Количество теплоты определяется из 1-го закона dq =du+ pdw.
Поскольку dw = 0, то dq = du, где du =cwdT.
Все тепло идет на изменение внутренней энергии.
б) Изобарный процесс (закон Гей-Люссака). Изобарным называется процесс, протекающий при p=const (dp=0). Такой процесс может протекать в цилиндре, поршень которого перемещается без трения так, что давление в цилиндре равняется постоянному давлению окружающей среды (в соответствии с рисунком 1.4).
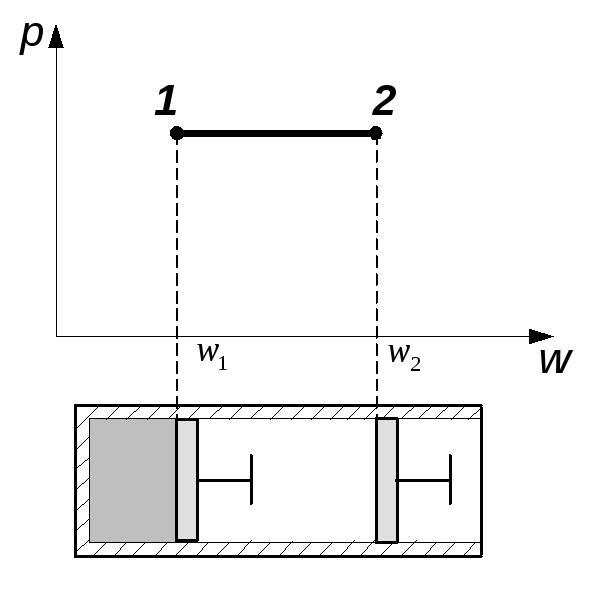
Рис. 1.4 Изобарный процесс
Уравнение
изобарного процесса можно получить при
п=0
политропы
![]() .
.
Действительно,
![]() .
.
Из
уравнения состояния
![]() ;
;
![]() ;
или
;
или
![]() ,
откуда
,
откуда
![]() (15)
(15)
Таким образом, при изобарном процессе объем газа всегда пропорционален абсолютной температуре.
Изменение внутренней энергии определяется по формуле:
![]()
![]()
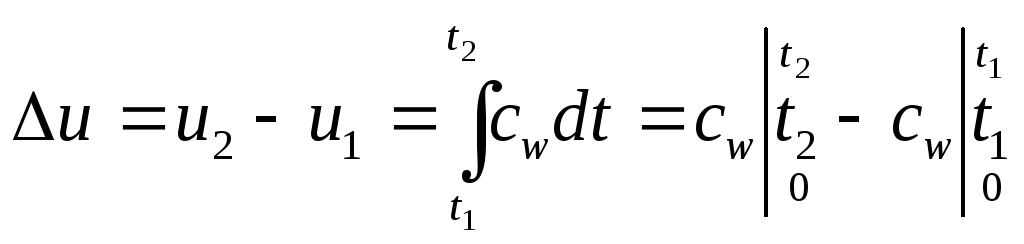 ,
при сw=const
,
при сw=const
![]()
Работа газа в изобарном процессе определяется по формуле
 при
при
![]() .
(16)
.
(16)
Изменение
энтальпии определится по формуле
![]() или при ср
=const.
или при ср
=const.
![]() .
(17)
.
(17)
Из уравнения (16) и (17) следует, что в процессе изменения состояния газа при постоянном давлении внешнюю теплоту можно определить как разность энтальпий начального и конечного состояния газа. Это обстоятельство практически весьма важно, т. к. величины энтальпий имеются во всех таблицах термодинамических свойств газов.
Кроме того, изменение температуры в избранном процессе ведет к изменению внутренней энергии газа. Поэтому на совершение внешней работы расходуется лишь часть теплоты, подведенной (отведенной) к рабочему телу извне.
в) изотермический процесс (закон Бойля-Мариотта).
Изотермическим называется процесс, протекающий при T=const или (dT=0). Такой процесс может протекать, например, в цилиндре поршневой машины, если по мере подвода тепла к газу поршень в цилиндре перемещается, увеличивая объем настолько, что температура остается постоянной (смотри рисунок 1.5).
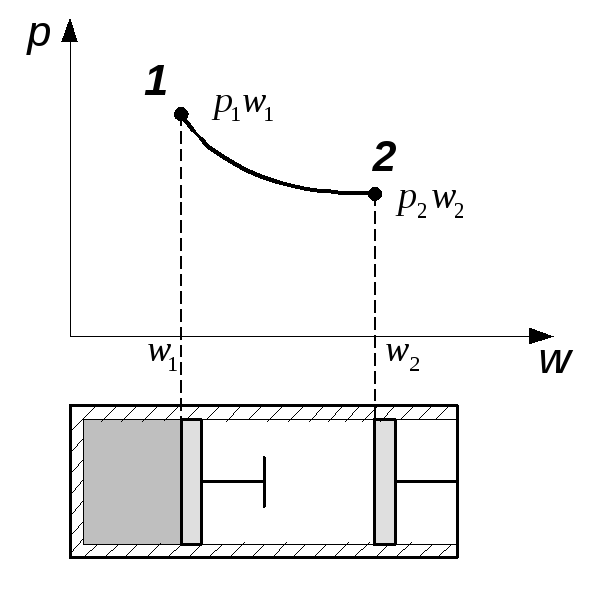
Рис. 1.5 Изотермический процесс
Уравнение процесса может быть получено из уравнения политропы pwn=const при п=1. Тогда pw=const.
Из уравнения состояния pw=RT при Т=const следует, что pw=const.
Отношение
между параметрами начального и конечного
состояния газа в процессе определится
в виде
![]() .
(18)
.
(18)
Таким образом, в изотермическом процессе давление и объем рабочего тела обратно пропорциональны.
Поскольку
![]() ,
то при
,
то при
![]()
![]() .
Аналогично,
.
Аналогично,
![]() при
при
![]()
![]() .
.
Следовательно, исходя из 1-го закона термодинамики, теплота выразится, формулами
 ;
(19)
;
(19)
Из выражений (19) следует, что вся сообщенная газу теплота в изотермическом процессе затрачивается на совершение внешней работы.
