
1. СВОЙСТВА И СТРУКТУРА ВОДЫ
1.1. Аномальность свойств воды
Только в конце XVIII начале XIX в. стало известно, что представляет собой вещество, называемое водой. Опытами Г. Кавендиша, А. Лавуазье, А. Гумбольдта, Ж.Л. Гей-Люссака было доказано, что вода образуется из двух объемов водорода и одного объема кислорода, т.е. имеет химическую формулу Н2О и молекулярную массу 18. Постепенно, однако, становилось ясно, что почти по всем физико-химическим параметрам это вещество уникальное, резко отличающееся от других природных соединений.
Температуры плавления и кипения воды
На них основываются принятые системы отсчета температур.
Избрание воды для создания температурных шкал.
Цельсий (1701-44). Шкала Цельсия –1741 г. Температуры кипения и плавления воды при атмосферном давлении соответственно равны 100оС и 0оС,
Реомюр (1683-1757). Шкала Реомюра 1730 г. Температура кипения воды принята за 80о (1оС = 5/4оR).
Фаренгейт (1686-1736). Точка таяния льда принята 32оF, точка кипения воды – 180оF (tоС = 5/9 tоF - 32).
Открытие периодического закона Д.И.Менделеева (1869 г). Несоответствие физических параметров воды периодическому закону.
Несоответствие периодическому закону видно из сравнения температур кипения и плавления водородных соединений элементов группы кислорода. Данные для Н2Se cнимаются с графика. Для воды видно, что при соответствии периодическому закону температура плавления воды составляла бы около минус 90о, а температура кипения – около -70о. Вода при “нормальных” условиях была бы токсичным дурнопахнущим газом. Жизнь на Земле была бы невозможна.
Благодаря этим «аномальным» свойствам вода оберегает жизнь и регулирует тепловой и газовый режим нашей планеты.
Теплоемкость воды
Удельная теплоемкость воды – самая высокая из всех жидкостей. И здесь вода принята за эталон: для того, чтобы нагреть 1 г воды на 1оС на до затратить 1 калорию тепловой энергии (calor – тепло, лат.). Для сравнения: гипс - 0,27, сухая глина 0,22 кал. (1 кал = 4,187 Дж.). Удельная теплоемкость льда и пара вдвое ниже – 0,5 кал/г.град. Необычайно велики и скрытые теплоты плавления и парообразования воды – 79 и 539 кал. Таким образом, чтобы перевести 1г льда с температурой 0оС в пар надо затратить 79+100+539 = 718 калорий тепла. Благодаря такой чрезвычайно высокой теплоемкости вода является главным регулятором теплового режима на нашей планете. Влияние Мирового океана сказывается практически во всех точках Земли, даже наиболее удаленных от морских берегов, характеризующихся, так называемым, континентальным климатом. Крупные водоемы, и прежде всего, Мировой океан, – регуляторы теплового режима Земли. Для почвенного слоя годовой теплооборот 1,5-3 ккал/см2, для,например, Балтийского и Черного морей 48-52. При отсутствии водоемов летом температура поднималась бы, а зимой опускалась на несколько сот градусов и жизнь на Земле была бы невозможна; наоборот, если бы Земля полностью была бы покрыта океаном, годовая амплитуда воздуха изменялась бы от 0 на экваторе до 5-6оС на полюсах. Влияние океана распространяется на всю планету, включая полюса холода в Антарктиде.
С высокой теплоемкостью воды связаны такие показатели, как скрытая теплота плавления, составляющая 333,7·103 Дж/кг, и скрытая теплота парообразования, составляющая 2258,103 Дж/кг, т.е. для превращения 1 кг льда в жидкость и 1 кг жидкой воды в пар нужны огромные затраты энергии. Это свидетельствует о высокой энергоемкости воды, предопределяющей ее исключительную роль как аккумулятора энергии при протекании природных процессов.
Диэлектрическая постоянная воды ()
Величина диэлектрической постоянной для воды является наиболее высокой из всех жидкостей и равна 80,1 при температуре 20 оС. при температуре около 0оС составляет около 82. Это означает, что при растворении в воде солей, сила электрического взаимодействия между разноименно заряженными частицами уменьшается в 80 раз, в результате чего соли диссоциируют на ионы. У большинства растворителей не выше 50, у неполярных жидкостей (бензин, керосин) не более 3. Это свойство воды предопределяет явление электролитической диссоциации, т.е. способность солей, кислот, щелочей распадаться в водных растворах на разноименно заряженные ионы. Вода инертна как растворитель. Она привносит питательные вещества в живые организмы и выносит шлаки и заменить ее нечем. Т.о. и без этого свойства воды жизнь на Земле была бы невозможна.
Вода растворяет минералы, но они вновь возрождаются, если воду испарить. Эта особенность имеет колоссальное геологическое и биологическое значение, предопределяя водные круговороты самых разных порядков, которые проходят за несколько часов (в живых организмах) и длятся многие миллионы лет в недрах Земли (геологические). По-видимому, и появление жизни на Земле в значительной степени связано с этим удивительным свойством воды.
Плотность воды.
Все вещества обладают максимальной плотностью при температуре плавления, кроме воды. Максимальная плотность воды (1,0 г/см3) соответствует т-ре 3,98о; плотность льда 0,918 г/см3; только вода не тонет в собственном расплаве; на это обратил внимание еще Фалес Милетский. При замерзании воды образуется тонкая защитная корка льда, обеспечивающая сохранение водоемов, прежде всего – Мирового океана – главного регулятора воздушного режима планеты. И без этого свойства воды жизнь обрела бы совсем другие формы.
1.2. Представления о скрытой структуре воды
Структура воды. Тридцатые годы ХХ века принесли новое крупное открытие, связанное с изучением воды: английские физики Дж. Бернал и Р. Фаулер на основании рентгенографических и спектроскопических исследований установили, что молекулы воды определенным образом упорядочены, каждая молекула воды окружена по тетраэдру четырьмя другими. Тем самым была подтверждена высказанная в конце XVIII в. В. Рентгеном мысль о сложном строении жидкой воды и существовании между отдельными молекулами дополнительных связей. Это явление ученые называют структурой воды, хотя понятно, что полностью отождествлять его с кристаллической решеткой твердых веществ нельзя, так как жидкая вода является смесью мономерных и полимерных молекул, связи между отдельными мономерами динамичны: они постоянно появляются, разрушаются, усиливаются, ослабевают.
Главной причиной существования структуры воды является особый тип связи между отдельными атомами – водородной. Эта связь имеет электростатическую природу, но она слабее нормальной валентной связи между атомами водорода и кислорода, образующими отдельные мономеры. В каждом мономере Н2О расстояние между атомами водорода и кислорода составляет 0,1 нм, а угол, образуемый между валентными связями, - около 105º. В водородной связи расстояние между атомами увеличивается до 0,176 нм, причем оно не является строго постоянным.
Существует несколько моделей структуры воды, основанных на идее соединения отдельных мономеров водородной связью. Дж. Бернал и Р. Фаулер предположили существование трех типов расположения молекул: а) структуры, приближающиеся к кристаллической решетке льда, существуют при температуре от 0 до 4ºС; б) структуры типа кварца, преобладают при температуре 4-200ºС ; в) структуры с плотной упаковкой, характерной для нормальных жидкостей (почти лишенные водородных связей), возникают при температуре выше 200 ºС [Блох А.М. Структура воды и геологические процессы .Л., 1969, с.216].
Интересный подход к интерпретации структурных особенностей воды предложил итальянский физик М. Анджено (1967 г.). Согласно его представлениям, каждая молекула воды может участвовать не более чем в двух, но так называемых коллективных, водородных связях, в результате чего сочетание валентных и водородных связей образует звенья разных типов (рис.1).
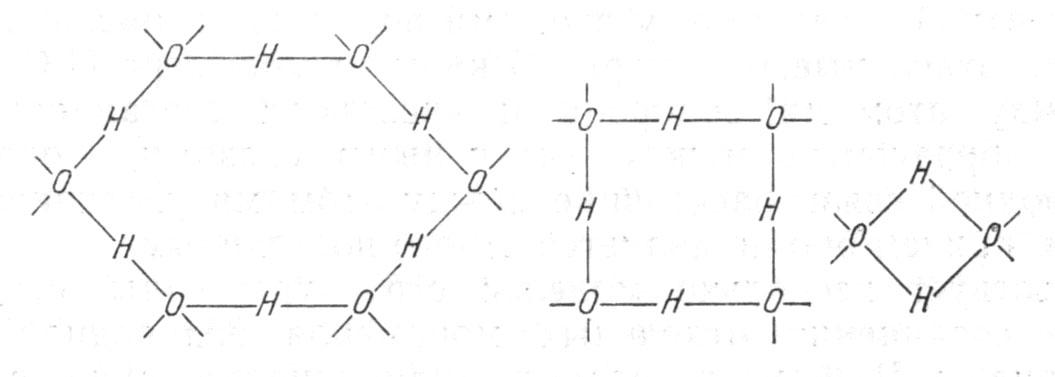
Рис. 1. Молекулярные агрегаты в жидкой воде (по М. Аджендо).
Эти звенья могут формировать цепочки, кольца и более сложные системы, непрерывно образующиеся, разрушающиеся, обменивающиеся молекулами. При этом общее число водородных мостиков в системе остается постоянным и возможные типы агрегатов присутствуют в воде в разных пропорциях в статическом равновесии, определяемом температурой. Кольца из шести молекул, видимо, приближаются к структуре льда.
С позиций структурного строения жидкой воды объясняются все ее аномальные свойства. Необходимость разрушения водородных связей предопределяет высокую энергоемкость воды, в результате чего аномально высокими становятся точки плавления и кипения, теплоемкость и скрытые теплоты плавления и парообразования. При охлаждении воды в интервале температур от 4 до 0ºС происходит перестройка структуры от более плотной тетрагональной к гексагональной упаковке льда. Прочная связь между молекулами воды делает ее инертной по отношению к растворенным веществам. Поскольку структура воды формируется электростатическими связями, на нее воздействуют различные поля (температурное, геодинамическое, магнитное, электрическое).
С повышением температуры структура воды начинает разрушаться. Оценки разных авторов, подсчитывающих процент молекул с сохранившимися водородными связями, близки: в холодной воде структурировано около половины молекул, по достижении температуры 100ºС структурные связи сохраняются примерно у 30 % молекул, а при приближении к критической температуре (374 ºС) структурированные молекулы исчезают.
При приложении давления молекулы жидкостей сближаются и их вязкость повышается. Совсем по-иному ведет себя вода. Первые ступени нагрузок приводят к перестройке структуры воды, заполнению межмолекулярных пустот, сопровождающемуся уменьшением ее вязкости, и только начиная с давлений около 100 МПа (достаточно высоких для природных условий) начинается постепенное повышение вязкости.
