Гидрогеохимия / Коллоиды 233
.doc2.3.3. Коллоидные вещества
Роль коллоидов в самоочищении природных вод и формировании рудных месторождений.
В природных водах происходит постоянный обмен металлами между растворенной формой, частицами коллоидов и донными отложениями. Коллоиды способны активно сорбировать тяжелые металлы. Со временем коллоидные растворы коагулируют, в результате чего сорбированные элементы переходят в твердую фазу. Вода самоочищается.
Устойчивость коллоидных систем зависит от многих факторов. При повышении температуры из-за роста кинетической энергии частиц уменьшается диффузный слой ионов частиц, и при их соударениях они разрушаются или слипаются.
Под коагуляцией понимают сцепление частиц дисперсной фазы, но это равнозначно разрушению коллоидной системы при потере ею устойчивости.
По коагулирующей способности ионы располагаются в следующий ряд:
Na+ < NH4+ < K+, Mg2+ < Ca2+ < Ba2+ < Al3+.
Коагулирующую способность некоторых ионов используют для очистки загрязненной воды, которую проводят коллоидами. Для этого в загрязненную воду добавляют вещества, которые при определенных условиях (например, рН) образуют хлопья, захватывающие загрязнения и осаждающиеся вместе с ними.
Чаще всего для удаления дисперсных примесей пользуются хлоридом алюминия AlCl3, сульфатом алюминия Al2(SO4)3•18H2O, хлоридом железа FeCl3•6Н2О и сульфатом железа FeSO4•7H2O (железный купорос). Эти вещества гидролизуются, но для полного гидролиза и образования малорастворимого гидроксида необходимо связывание образующихся ионов водорода. Для этого в раствор добавляют щелочь (гидроксид-ионы), соду (карбонат- или гидрокарбонат-ионы) и другие вещества.
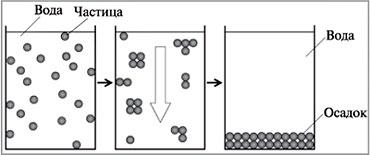
После коагуляции начинается осаждение образовавшихся крупных частиц под действием силы тяжести – седиментация (рис. 8.39). В жидкой среде при коагуляции золей укрупнение частиц до известного предела (до 10–4 см) не сопровождается их оседанием. Дальнейший рост частиц приводит к образованию сгустков или хлопьев (флокул), выпадающих в осадок.
|
|
|
Рис. 8.39. Схема коагуляции и седиментации |
|
|
Гидрофильные коллоиды при осаждении увлекают за собой жидкую фазу (иногда даже полностью), образуя с водой общую массу. Подобные осадки называются гелями, или студнями.
Различают хрупкие и эластичные гели. Хрупкие гели – это двухфазные гетерогенные системы. К хрупким гелям относится, например, гель кремниевой кислоты Н2SiО3. Благодаря жесткости каркаса хрупкого геля его объем при высушивании или обезвоживании мало изменяется. После высушивания образуются хрупкие гели, имеющие сильнопористую структуру с множеством капилляров и пор. Так получают распространенные сорбенты: алюмогель из геля гидроксида алюминия и силикагель из кремниевой кислоты. Сухой торф также можно отнести к аэрогелям, он обладает высокими сорбционными свойствами.
Эластичные гели образуются из некоторых гидрофильных неорганических веществ и высокомолекулярных соединений и в отличие от хрупких гелей являются однофазными системами. Эластичные гели способны к набуханию с увеличением объема в десятки раз по сравнению с собственным объемом полимера. Эти гели обладают малой прочностью. Таковы, например, гели мыл, гидроксидов алюминия и железа.
К числу твердых гелей и золей относятся многочисленные карбонаты, силикаты, фосфаты и другие минералы. В кристаллы примеси соединений железа, хрома, марганца, ванадия и других входят в виде очень высокодисперсных золей и обусловливают их окраску в зависимости от соотношения элементов и их валентного состояния. В большинстве случаев минералы и драгоценные камни могут иметь любую окраску.
Оксид алюминия Al2O3 образует бесцветные кристаллы, которые приобретают различные окраски из-за присутствия дисперсных примесей: рубин и сапфир красной окраски.
Диоксид кремния SiO2 в виде разновидности кварца встречается как драгоценный камень – аметист, агат, яшма.
Аргонит и кальцит, минералы карбоната кальция СаСО3, также образуют ценные камни. При повышении температуры аргонит переходит в кальцит, поэтому аргонит не встречается в древних осадках и распространен в природе меньше кальцита. Жемчуг – это дисперсная система типа «твердое/твердое». В жемчуге кристаллики карбоната кальция окружены тонким слоем перламутра, состоящего из аргонита. Перламутр – внутренний слой раковин двустворчатых и брюхоногих моллюсков, обладающий радужным блеском. При отложении перламутра на инородних частицах, попавших внутрь раковины, образуется жемчуг.
Многие другие минералы являются коллоидными системами. Даже окрашенность алмаза можно объяснить присутствием крайне высокодисперсного золя оксидов марганца и железа (включения резко увеличивают хрупкость и создают проблемы с чисткой).
Если поступление тяжелых металлов в поверхностных водоемах прекращается, поверх загрязненного ила образуется свежий слой "чистых" донных отложений. В результате тяжелые металлы изолируются и выводятся из экосистемы. Именно так водоемы справляются с последствиями антропогенных аварий.
Коллоиды активно участвуют в формировании некоторых типов месторождений: железорудных формаций, полей металлоносных осадков и железомарганцевых конкреций на дне Океана, скоплений бокситов и др.
Например, образование медных месторождений объясняют легкой коагуляцией щелочными водами растворов, содержащих соли меди.
Оксид кремния SiО2
В большинстве случаев SiО2 поступает в воды в результате гидролиза полевых шпатов при выветривании горных пород.
Cвыше половины объема пород земной коры слагают кварц, силикаты, алюмосиликаты. Аморфный кремнезем входит в состав скелета диатомовых водорослей, радиолярий, губок. Кремниевые конкреции встречаются в отложениях в. мела (Крым, Кавказ); в средне и верхнекаменноугольных известняках (Карбоновое плато под Санкт-Петербургом).
В воде аморфный кремнезем малорастворим, при комнатной температуре его растворимость составляет 120 мг/л, а растворимость стабильного кварца более чем на порядок ниже.
Тем не менее кремнекислоты содержатся во всех природных водах, соотношение определяется щелочно-кислотными равновесиями. H2SiO3 – метакремневая кислота; Н4SiO4 – ортокремневая.
При температурах около 100°С растворимость аморфного кремнезема достигает 400 мг/л. Высокие содержания кремнекислоты известны в глубинных кислых (рН < 4) водах.
Кремнекислоты часто даются в виде суммы SiO2.
В ультрапресных водах SiО2 является главным компонентом химического состава. Содержание его возрастает и в щелочных водах, но обычно в подземных водах оно не превышает первых десятков миллиграммов на литр. В воде SiО2 чаще присутствует в молекулярно-диспергированном (H4SiО4, H2SiО3), реже коллоидальном (xSiO2×yН2O) состоянии.
Кремнезем способен отлагаться из вод термальных источников, особенно щелочных азотных терм, образуя специфические осадки — гейзериты. В гейзеритах Долины Гейзеров SiO2 > 90-95 %.
Оксид кремния малотоксичен для человека, животных, микроорганизмов и растений. Для орошения почвы в США рекомендуется использовать воды с предельно допустимой концентрацией (ПДК) кремния в пределах 10—50 мг/л. В связи с образованием труднорастворимых осадков в паровых котлах, бойлерах и турбинах ПДК кремния составляет 1—40 мг/л (в зависимости от давления). Кремнекислота добавляется в мягкие воды как средство защиты металлических трубопроводов от коррозии.
В бальнеологии кремнекислота состава H2SiО3+HSiО3≥50 мг/л используется в качестве лечебного компонента.
Практикуется использование "кремней" для улучшения качества питьевых вод.
Драгоценный камень опал SiО2•nН2О – типичный твердый минеральный гель, встречающийся в отложениях теплых источников. Опал бесцветен, если не содержит окрашивающих его примесей железа, хрома и других, придающих ему желтоватую, красноватую, зеленоватую и даже черную окраску. Для полупрозрачного опала характерна опалесценция (название связано с минералом) – рассеяние света коллоидной системой, в которой показатель преломления частиц дисперсной фазы заметно отличается от показателя преломления дисперсионной среды. Золи кремнезема способны проникать в стволы отмерших деревьев и отлагать в них опал.
Важнейшими веществами в природе и технологии являются кремнезем SiО2, кремниевая кислота, а также золи и гели на их основе. Формулу кремниевой кислоты обычно записывают как H2SiO3, но в научных исследованиях чаще пользуются формулой H4SiO4, чтобы подчеркнуть, что атом кремния связан с четырьмя группами ОН, образуя тетраэдрическую структуру.
Золи кремнезема, которые используются в современных технологиях, относятся к нанодисперсному, т.е. наиболее мелкораздробленному, состоянию кремнезема. При образовании кремниевой и поликремниевых кислот атом кремния может образовать максимально четыре химические связи с четырьмя атомами кислорода. Каждый атом кислорода связан с еще одним атомом кремния. Благодаря системе этих связей происходит образование пространственных структур геля поликремниевых кислот.
Наиболее часто для получения геля кремниевой кислоты используются растворы силиката натрия. Гидролиз силиката натрия можно описать уравнением:
Na2SiO3 + 3H2O = Н4SiO4 + 2NaOН,
или в ионном виде:
SiO32– + 3H2O = Н4SiO4 + 2OН–.
Выделившаяся
в результате реакции гидролиза слабая
кремниевая кислота H4SiO4
содержит четыре группы OH, способные к
реакции поликонденсации с образованием
связей между атомами кремния через атом
кислорода
![]() Si–O–Si
Si–O–Si![]() .
Конденсация кремниевой кислоты проходит
по уравнению:
.
Конденсация кремниевой кислоты проходит
по уравнению:
(НO)3Si–OH + HO–Si(OH)3 = (HO)3Si–O–Si(OH)3 + Н2О.
По этому уравнению в конденсации участвует одна из четырех групп ОН. При участии других групп ОН проходит поликонденсация, и образуются полимерные кремниевые кислоты различной структуры: линейной, разветвленной, циклической, плоскостной, пространственной
Гидрокси́ды железа.
Пределы растворимости ПРFе(OH)2 – 4,8.10-16; Fe(OH)3 – 4.10-38.
При окислении (Fe2+→Fe3+) и гидролизе образуется коллоидный осадок гидроксида железа (III), ухудшающий органолептические показатели воды.
В подземных водах обычно преобладает закисное железо (Fe2+), и только в кислых водах (например, рудничных) основным мигрантом является Fe3+ (в составе комплексов на основе гидроксила, хлора, фтора, органических кислот).
Ограниченная миграционная способность этого компонента обусловлена наличием окислительного и сульфидного геохимических барьеров на путях миграции.
Во многом поэтому Железо Fe2+, Fe3+ относительно широко распространено в земной коре (кларк 4,2 %), оно входит в состав горных пород и минералов (железорудные формации, магнетит, гематит, сидерит, гётит, железистые силикаты и пр.).
При высоких концентрациях Fe2+ осадки гидроксидов забивают трубопроводы и водозаборную арматуру.
В подземных водах оно содержится в относительно небольших количествах (единицы, десятки миллиграммов на литр), изредка (в резко восстановительной обстановке) достигая сотен и в исключительных случаях тысяч миллиграммов на литр.
Гидрокси́ды марганца.
Предел растворимости ПРMn(OH)2 – 4.10-14.
Марганец Мn2+ содержится в водах в концентрациях на порядок меньших, чем железо. Имеются отличия и в миграционных способностях. Это обусловлено большей устойчивостью Мn2+ в окислительных условиях. В особенности это проявляется при разгрузке субмаринных гидротерм. Железо переходит во взвешенное (коллоидальное) состояние вблизи источника, а марганец – на заметном удалении, иногда до нескольких километров.
Установлено, что наиболее эффективно Мn2+ переводится во взвешенное состояние с участием бактерий.
В концентрациях больше 0,1 мг/л марганец делает воду мутной, а при концентрациях 0,5 мг/л появляется металлический привкус. Предположительно оказывает мутагенное действие на теплокровных животных и токсичен для растений в концентрациях свыше 0,5 мг/л. ПДК этого элемента в питьевой воде составляет в России 0,1 мг/л, в других странах колеблется от 0,05 до 0,1 мг/л.
Образование железомарганцевые конкреции (дно Океана; Финский залив).
Начальные сведения о рудных образованиях на дне открытого океана были получены в ходе проведения первой в истории мировой науки комплексной океанологической экспедиции на английском судне “Челленджер”, продолжавшейся почти четыре года (1872-1876).
18 февраля 1873 г. при проведении драгировки в 160 милях к юго-западу от Канарских о-вов со дна были подняты черные округлые желваки - железомарганцевые конкреции, содержащие, как показали уже первые анализы, значительное количество никеля, меди и кобальта. Правда, несколько ранее, в 1868 г., во время экспедиции Н.Норденшельда на шведском судне “София”, похожие конкреции были подняты со дна Карского моря, но эта находка осталась практически незамеченной.
Другой тип подобных образований - железомарганцевые корки, которые, в отличие от конкреций, образуют протяженные относительно тонкие покровы на твердых породах различного состава, преимущественно на подводных поднятиях. Они были открыты и впервые описаны совместно с конкрециями в результате той же экспедиции на “Челленджере” и лишь много позднее выделены в самостоятельный морфологический тип.
Главное геохимическое различие между Mn и Fe в океане сводится к многообразию минеральных форм, в которых Fe выводится в осадочную толщу как в окислительных, так и в восстановительных условиях, в то время как Mn может находиться в твердофазной форме только в окисленных условиях.
Из восстановленных осадков растворенный Mn мигрирует к поверхности дна и в в благоприятных фациальных условиях (высокие содержания растворенного кислорода в морской воде и низкие скорости седиментации) формирует рудные отложения в двух основных формах: железо-марганцевые конкреции (ЖМК) и корки.
Казалось бы, что само название этих стяжений свидетельствует о геохимической близости свойств главных рудообразующих металлов - Fe и Mn. Но это не совсем так. Еще В. И. Вернадский отмечал, что в природе в зоне гипергенеза нет ни одного железо-марганцевого минерала.
Кроме того железистые и марганцеворудные формации на суше хотя и сопутствуют друг другу, но всегда разделены во времени и пространстве. Это связано с разницей в стандартных потенциалах окисления - более низком у Fe и высоком у Mn. Поэтому Fe окисляется легче Mn и соответственно раньше образует окисные твердофазные соединения.
Гидрокси́ды алюминия.
Предел растворимости ПР Al(OH)3 – 1,9.10-33.
Другие формулы: H3AlO , H3AlO , HAlO2,
[Al2O3 H2О]. nH2О — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами
Источники поступления алюминия в природные воды:
-
частичное растворение глин и алюмосиликатов;
-
атмосферные осадки;
-
сточные воды различных производств.
В природных водах алюминий присутствует в ионной, коллоидной и взвешенной формах. Миграционная способность невысокая. Образует довольно устойчивые комплексы, в том числе органоминеральные, находящиеся в воде в растворенном или коллоидном состоянии.
Концентрация алюминия в поверхностных водах обычно колеблется в пределах n.10-2 — n.10-1 мг/дм3, в некоторых кислых водах иногда достигает нескольких граммов в 1 дм3.
Ионы алюминия обладают токсичностью по отношению к многим видам водных живых организмов и человеку
ПДКв составляет 0.5 мг/дм3
Используется для очистки питьевых вод
Наиболее часто на хозяйственно-питьевых водопроводах в качестве коагулянта применяют неочищенный алюминия сульфат, который содержит 33% безводного алюминия сульфата и до 23% нерастворимых примесей.
В настоящее время промышленность выпускает также и очищенный алюминия сульфат, который содержит не более 1% нерастворимых примесей.
При добавлении к воде алюминия сульфат (сернокислый глинозем) вступает в реакцию с кальция и магния гидрокарбонатами, которые всегда содержатся в природной воде и обусловливают ее устранимую жесткость и щелочность:
Al2(SO4)3 + ЗСа(НСO3)2 = 2Аl(ОН)3 + 3CaSO4 + 6СO2
Al2(SO4)3 + ЗMg(НСO3)2 = 2Аl(ОН)3 + 3MgSO4 + 6СO2
Основным для процесса коагуляции является образование алюминия гидроксида. Аl(ОН)3 образует в воде коллоидный раствор, который придает ей опалесценцию и быстро коагулирует, образуя хлопья во всей толще воды. Они имеют заряд, противоположный заряду коллоидных частиц гуминовых веществ, которые содержатся в природной воде. Благодаря этому коллоидные частицы коагулянта нейтрализуют заряд коллоидных гуминовых частиц воды.
Они устраняют взаимное отталкивание, нарушают кинетическое равновесие коллоидного раствора. Частички становятся неспособными к диффузии, объединяются (агломерируются) и выпадают в осадок.
Хлопья же самого коагулянта адсорбируют коллоидные и мелкие взвешенные частицы и выпадают на дно, механически захватывая с собой крупную взвесь.
Вследствие процесса коагуляции не только повышается скорость и эффективность осаждения взвеси, но и значительно уменьшается природная цветность воды, обусловленная наличием в ней гуминовых соединений.
Обесцвечивание, которого невозможно добиться другими способами очистки, происходит вследствие адсорбции гуминовых веществ на поверхности хлопьев коагулянта и дальнейшего выпадения в осадок. Уменьшение количества взвеси способствует также значительному уменьшению количества бактерий и вирусов, содержащихся в воде.
Коагуляция происходит эффективно при условии, если концентрация гидрокарбонат-ионов в воде будет хотя бы эквивалентна количеству алюминия сульфата, который добавляется. В противном случае гидролиз не происходит, алюминия гидрооксид не образует коллоидного раствора и не коагулирует.
Образование бокситов.
В 1821 г. французский химик Вернье впервые исследовал и описал встречающуюся близ города Ле Бо (Les Baux), на юге Франции, горную породу, содержащую 52% Аl2О3, 27,6% F2О3 и 20,4 % Н2О, причем назвал ее по месту нахождения бокситом (bauxite).
В настоящее время бокситы являются важнейшей алюминиевой рудой, на которой, за немногими исключениями, базируется почти вся мировая алюминиевая промышленность.
По внешнему виду бокситы представляют глиноподобную, а часто каменистую породу, иногда плотного, иногда пористого сложения. Для них характерна большая дисперсность составных частей, нередко приближающаяся к дисперсности коллоидов. Цвет бокситов весьма разнообразен, но чаще всего красный различных оттенков.
По одной из гипотез, бокситы являются продуктом выветривания древней коры с последующим механическим перемещением и переотложением остаточного продукта, находящегося в коллоидном состоянии.
По другой - бокситы являются химическим осадком, образовавшимся при разложении растворов алюминиевых, железных и титановых солей (получавшихся за счет выщелачивания природными водами изверженных пород) в момент поступления их в водоемы — моря и озера.
Акад. А. Е. Ферсман приводит следующую схему осаждения гидратов окиси алюминия из растворов алюминиевых солей при разных значениях рН, иллюстрирующую возможность гидрохимического образования скоплений алюминия (в виде гидратов):
|
рН ниже 4 |
рН = 4—7 |
рН =7-11 |
рН = 13—14 |
|
Алюминий растворяется (Алюминий, как катион) |
Алюминий осаждается |
Алюминий остается в осадке |
Алюминий растворяется (Алюминий, как анион) |
Из этой схемы видно, что алюминий растворяется лишь при очень высоких и при очень низких рН. Первое редко осуществляется в земной коре; гораздо важнее вторая группа растворов — кислых, в виде которых алюминий очень легко мигрирует (выносится).
К таким растворам относятся и некоторые типы гидротерм, характеризующиеся повышенными концентрациями алюминия.