
- •Дисциплина: Органическая химия
- •1. Предельные углеводороды (алканы). Номенклатура. Изомерия. Основные способы получения. Химические свойства: реакции радикального замещения (Sr) и расщепления. Применение.
- •5. Реакции полимеризации диенов. Натуральный и синтетический каучуки. Строение, получение и применение их в промышленности.
- •6. Сопряженные диены. Химические свойства: реакции присоединения, окисления, димеризации, диеновый синтез. Полимеризация.
- •Электрофильное присоединение галогеноводородов
- •Присоединение галогенов
- •8. Номенклатура, изомерия, строение, способы получения и химические свойства предельных галогенпроизводных. Отдельные представители.
- •1. Гидролиз гпу:
- •9. Реакции нуклеофильного замещения предельных галогенпроизводных. Механизмы sn1 и sn2, закономерности их протекания. Химические свойства
- •Механизм sn2
- •Механизм sn1
- •10. Реакции элиминирования предельных галогенпроизводных. Механизмы е1 и е2. Химические свойства полигалогенпроизводных. Применеие галогенпроизводных. Отдельные представители.
- •11. Непредельные и ароматические галогенпроизводные. Способы получения, строение и химические свойства. Ариновые механизмы замещения в ароматическом ряду.
- •1. Галогенирование
- •1. Прямое галогенирование
- •2. Хлорметилирование
- •12. Одноатомные спирты. Номенклатура. Строение. Способы получения. Химические свойства. Отдельные представители и их применение. Общая характеристика. Номенклатура
- •Получение. Свойства
- •13. Двух- и трехатомные спирты. Способы получения. Химические свойства. Отдельные представители и их применение.
- •14. Одноатомные и двухатомные фенолы. Номенклатура. Способы получения. Химические свойства. Отдельные представители и их применение. Строение. Номенклатура
- •16. Альдегиды и кетоны. Химические свойства: реакция конденсации, реакции с азотсодержащими соединениями. Отдельные представители и их применение.
- •Отдельные представители альдегидов и кетонов
- •17. Дикарбонильные соединения. Получение, химические свойства, применение. Отдельные представители.
1. Предельные углеводороды (алканы). Номенклатура. Изомерия. Основные способы получения. Химические свойства: реакции радикального замещения (Sr) и расщепления. Применение.
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами, или алканами (международное название), называются соединения, состав которых выражается общей формулой С nН2n+2, где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана(C5 — C17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов — нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Нормальные алканы имеют названия от греческих числительных. Разветвленные алканы называют по систематической номенклатуре ИЮПАК. Названия характеризуются суффиксом –ан. Все разветвленные алканы рассматриваются как производные углеводородов с наиболее длинной цепью. Все атомы с цепи нумеруются с конца, ближайшего к заместителю. Каждый заместитель обозначается цифрой, указывающей положение в цепи, и группы называются в алфавитном порядке. Для одинаковых заместителей употребляют префиксы: ди-, три- и т.д.
Изомерия обусловлена изомерией углеродного скелета.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при
нагревании:
|
|
tº. Ni |
|
|
СН3-СН=СН2 + Н2 |
→ |
СН3-СН2-СН3, |
СНз-C≡СН + 2Н2 → СН3-СН2-СН3.
2. Получение из галогенпротводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
С2Н5Br + 2Na + Br-C2H5 → C2H5-C2H5 + 2NaBr.
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
|
|
t° |
|
|
CH3COONa + NaOH |
→ |
СН4↑ + Na2CO3. |
4.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н2 → СН4.
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
Аl4С3 + 12Н2О = ЗСН4↑ + 4Аl(ОН)3.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями - перманганатом калия KMnО4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью σ-связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканывступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ, substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
|
|
Сl2 |
|
Сl2 |
|
Сl2 |
|
Сl2 |
|
| |
|
СН4 |
→ |
СН3Сl |
→ |
СН2Сl2 |
→ |
СНСl3 |
→ |
ССl4 |
|
(*) |
|
|
-HCl |
|
-HCl |
|
-НСl |
|
-HCl |
|
|
|
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи:
|
|
hv | |
|
Сl2 |
→ |
2Сl• |
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl•+ СН4→НСl + СН3•
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3• + Сl2→СН3Сl + Сl•
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl• + Cl• → Сl2, СН3• + СН3• → С2Н6, СН3• + Cl• → СН3Сl•
Суммарное уравнение реакции:
|
|
hv |
|
|
СН4 + Сl2 |
→ |
СН3Сl + НСl. |
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH2Cl2, CHCl3, ССl4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
|
|
t ° |
|
|
CH3-CH3 + HNO3 |
→ |
CH3-CH2-NO2 + H2O. |
При радикальных реакциях (галогенирование, нитрование) в первую очередь замешаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем — вторичного (390 кДж/моль) и только потом — первичного (415 кДж/моль).
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
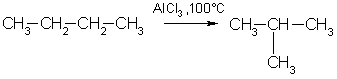
4. Крекинг — это гемолитический разрыв связей С-С, который протекает при нагревании и под действием катализаторов. При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
C8H18 → C4H10 + С4Н8,
2СН4 → С2Н2 + ЗН2,
С2Н6 → С2Н2 + 2Н2.
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
|
|
|
Мягкое каталитическое окисление бутана кислородом воздуха - один из промышленных способов получения уксусной кислоты:
t°
2C4H 10 + 5O2 → 4CH3COOH + 2Н2О .
кат
На воздухе алканы сгорают до СО2 и Н2О:
СnН2n+2 + (Зn+1)/2О2 = nСО2 + (n+1)Н2О.
Применение:
Основные источники – нефть и природный газ. Газообразные вещества используются как источник топлива ( метан , пробутановая смесь).
Нефтяные продукты используют для производства пластмасс, синтетических волокон, каучуков и т.д.
Некоторые жидкие формы используются как растворители и в качестве ракетного топлива.
Вазелин и вазелиновое масло используют в медицине и косметологии, а также в парфюмерии.
Парафин – для изготовления свечей, в медицине.
2. Алкены. Номенклатура. Изомерия. Цис-, транс- изомеры. Способы получения: дегидрогенизация предельных углеводородов, дегидратация спиртов, дегидрогалогенирование, крекинг нефти. Химические свойства: реакции окисления, полимеризации, димеризации. Отдельные представители и их применение.
Алкены – предельные углеводороды с формулойCnH2n
Строение. Изомерия и номенклатура
Простейшими непредельными (ненасыщенными) соединениями являются углеводороды, содержащие одну или несколько двойных связей. Алкены, содержащие две двойные связи, называются диенами, содержащие три двойные связи — триенами и т.д. Соединения с несколькими двойными связями имеют общее название полиены.
Алкенами называются непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса — этилен СН2 = СН2, в связи с чем алкены также называют этиленовыми углеводородами. Ближайшие гомологи этилена:
|
СН3-СН=СН2 |
СН3-СН2-СН=СН2 |
СН3-СН=СН-СН3 |
|
пропилен |
бутен-1 |
бутен-2 |
Простейший алкен с разветвленным углеродным скелетом:

2-метил промен
Общая формула гомологического ряда алкенов СnН2n. Она совпадает с общей формулой циклоалкана, поэтому алкены и циклоалканы являются межклассовыми изомерами.
При отщеплении атома водорода от молекул алкенов образуются непредельные радикалы обшей формулы CnH2n-1, простейшие из которых — винил (этенил) иаллил (пропенил):
|
СН2=СН- |
СН2=СН-СН2- |
|
винил |
аллил |
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Три σ-связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120° друг к другу; π-связь образована при перекрывании негибридных 2р-орбиталей соседних атомов углерода. При этом атомные р-орбитали перекрываются не в межъядерном пространстве, а вне его. Поэтому такое "боковое" перекрывание менее эффективно, чем осевое, и, следовательно, π-связь является менее прочной, чем σ-связь. Дополнительное π-связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием σ- и π-связей. Длина двойной связи С=С составляет 0.133 нм, что существенно меньше длины одинарной связи (0,154 нм). Энергия двойной связи (606 кДж/моль) меньше удвоенного значения энергии одинарной связи (347-2 = 694 кДж/моль); это обусловлено меньшей энергией π-связи.
Структурная изомерия алкенов обусловлена изомерией углеродного скелета (например, бутен-1 и 2-метилпропен) и изомерией положения двойной связи.Пространственная, или цис-транс-изомерия обусловлена различным положением заместителей относительно плоскости двойной связи.
Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться по одну сторону от плоскости двойной связи (цис-изомер) или по разные стороны (транс-изомер), например:
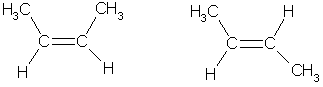
цис-бутен-2 транс-бутен-2
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс-изомеров.
В алкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание -ан заменяется на -ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
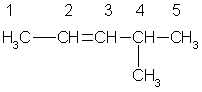
4метилпентен -2
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 - С4 — газы. С5 – С15 — жидкости, начиная сC16 — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
|
|
t |
|
|
С8Н18 |
→ |
С4Н10 + С4Н8 |
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов - дегидрирование алканов:
|
|
t, Cr2O3 |
|
|
СН3-СН2-СН3 |
→ |
СН3-СН=СН2 + Н2 |
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная π-связь. К таким реакциям относятся следующие.
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
|
|
H2SO4 |
|
|
СН3-СН2-ОН |
→ |
СН2=СН2 + Н2О |
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
|
|
С2Н6ОН |
|
|
СН3-СН2-СНВr-СН3 + КОН |
→ |
СН3-СН=СН-СН3 + КВr + Н2О |
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
CH2Br-CHBr-CH3 + Mg → СН2=СН-СН3 + MgВr2.
Химические свойства
Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АE:
|
|
Н* |
|
|
nCH2=CHR |
→ |
(-CH2-CHR-)n |
где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение — полимером , число n-степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
ЗСН2=СН2 + 2КМnО4 + 4Н2О ЗНОСН2-СН2ОН + 2MnO2↓ + 2KOH.
В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
|
|
[О] |
|
|
СН3-СН=СН-СН3 |
→ |
2СН3-СООН |
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
СnН2n + Зn/2О2 → nСО2↑ + nН2О.
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
СnН2n + nО2 → nCO↑ + nH2O.
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:

При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлор-метане при температурах ниже комнатной, то происходит реакция присоединения, и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой — при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
Низшие алкены — важные исходные вещества для промышленного органического синтеза. Из этилена получают этиловый спирт, полиэтилен, полистирол. Пропен используют для синтеза полипропилена, фенола, ацетона, глицерина.
Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
![]()
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям:

Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:

Этот карбокатион присоединяется к следующей молекуле алкена с образованием "димерного карбокатиона":

"Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1):
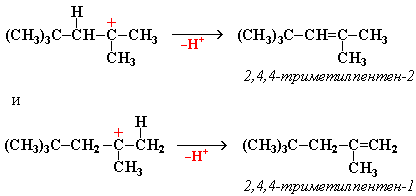
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения "изооктана" (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина ("изооктан" – стандарт моторного топлива с октановым числом 100).
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону.
3. Алкены. Химические свойства: реакции электрофильного присоединения (AdE). Правило Марковникова. Применение правило Марковникова в реакциях присоединения к несиметричным олефинам. Радикальный механизм присоединения (AdR) (перекисный эффект Караша).
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом AE(от англ, addition electrophilic).
Реакции злектрофильного присоединения это ионные процессы, протекающие в несколько стадий.На первой стадии электрофильная частица (чаще всего это бывает протон H+) взаимодействует с π-электронами двойной связи и образует π-комплекс, который затем превращается в карбокатион путем образования ковалентной σ-связи между электрофильной частицей и одним из атомов углерода:

алкен π-комплекс карбокатион
На второй стадии карбокатион реагирует с анионом X-, образуя вторую σ-связь за счет электронной пары аниона:

Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд.
Распределение
зарядов определяется смещением
π-электронной
плотности под влиянием заместителей:
.
Электронодонорные заместители, проявляющие +I -эффект, смещают π-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд.
Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ(X= Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды (перекисный эффект Караша) :
СН3-СН=СН2
+ НВr
СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
|
|
R-O-O-R |
|
|
СН3-СН=СН2 + НВr |
→ |
СН3-СН2-СН2Вr |
обращает на себя тот факт, что реакция идет против правила Марковникова. такое аномальное явление называется пероксидный эффект.
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
Инициирование радикальной цепи:

Рост цепи:

Обрыв цепи:

Хлороводород и йодоводород не присоединяются к алкенам по радикальному механизму (только в присутствие пероксидов – перекисный эффект Караша – описан выше).
Эффект Караша (перекисный эффект) — обращение региоселективностипри присоединениигалогеноводородовкалкенамв присутствиикислородаилиперекисей. Данный эффект, впервые описанный М. Карашем и Ф. Майо в 1933 году, заключается в образовании аномального продукта, формально не соответствующегоправилу Марковникова. Это связывают с изменением механизма реакции, которая в данном случае протекает не какэлектрофильное присоединение, а какрадикальное присоединение.

2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН → СН3-СН(ОН)-СН3.
3) Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 → ВrСН2-СН2Вr.
Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
|
|
t, Ni |
|
|
СН3-СН=СН2 + Н2 |
→ |
СН3-СН2-СН3 |
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АE:
|
|
Н* |
|
|
nCH2=CHR |
→ |
(-CH2-CHR-)n |
где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение — полимером , число n-степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
4. Диеновые углеводороды. Номенклатура. Три основных типа диеновых углеводородов. Способы получения сопряженных диеновых углеводородов: дивинила, изопрена. Получение дивинила по методу С.В. Лебедева.
Строение. Изомерия и номенклатура
Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Если двойные связи разделены в цепи только одной s-связью, то их называют сопряженными. Важнейшие представители сопряженных диенов:
СН2 = СН-СН = СН2 СН2 = С(СН3)-СН = СН2. бутадиен-1,3 изопрен
Существуют также диены с системой С = С = С, называемые аленами: такие двойные связи называют кумулированными. Первый член гомологического ряда — аллен СН2 = С = СН2 : бесцветный газ с tnл = -136,2 °С и tкип = -34,5 °С.
Далее рассмотрим только сопряженные диены, имеющие большое практическое значение.
В сопряженных диенах p-электронные облака двойных связей перекрываются между собой и образуют единое p-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):
![]()
Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С-С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p-электронов и тем устойчивее молекула.
Для алкадиенов характерны те же виды изомерии, что и для алкенов:
1) изомерия углеродного скелета.
2) изомерия положения двойных связей
3) цис-транс-изомерия.
Номенклатура. Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание -ан заменяется на -диен.
Диеновые углеводороды различаются расположением двойных связей, такое расположение вследствие эффектов сопряжения связей сказывается на их реакционной способности. Существуют три класса диенов:
Аллены — диены с кумулированными связями, замещённые производные пропадиена-1,2 H2C=C=CH2
Сопряжённые диены или 1,3-диены — замещённые производные бутадиена-1,3 CH2=CH–CH=CH2
Изолированные диены, в которых двойные связи располагаются через две и более простых связи С–С
Получение. Основной промышленный способ получения диенов — дегидрирование алканов.
Бутадиен-1,3 (дивинил) получают из бутана:
|
|
t,Сr2О3 |
|
|
СН3-СН2-СН2-СН3 |
→ |
СН2=СН-СН=СН2 + 2Н2, |
а изопрен (2-метилбутадиен-1,3) — из 2-метилбутана:
|
|
t, Сr2О3 |
|
|
СН3-СН(СН3)-СН2-СН3 |
→ |
СН2=С(СН3)-СН=СН2+2Н2. |
Бутадиен-1,3 можно также получать по реакции Лебедева путем одновременного дегидрирования и дегидратации этанола:
|
|
t, ZnO, Al2O3 |
|
|
2С2Н5ОН |
→ |
СН2=СН-СН=СН2 + Н2 + 2Н2О. |

