Теплотехника шпоры / 9-16
.doc|
9первый закон термодинамики Первый закон гласит: все подведенное к рабочему телу теп- ло расходуется на изменение его внутренней энергии и соверше- ние работы расширения. Математическое выражение 1-го закона термодинамики dq = du + dl = du + pdv. где q – удельная теплота, Дж/кг; u – удельная внутренняя энергия, Дж/кг; l – удельная работа изменения объема, Дж/кг. Закон идеальных газов – «Внутренняя энергия идеального газа зависит лишь от его температуры» Следовательно, изменение внутренней энер- гии не зависит от вида процесса, а зависит только от начально- го и конечного состояний рабочего тела, которые определяются по его параметрам. dq = du. (1.42а) Так как процесс изохорный, то dq = сvdT, (1.42б) где сv – средняя удельная массовая изохорная теплоемкость, Дж/(кг·К). Следовательно, du = сvdT. (1.43) После интегрирования получим u2 – u1 = cv(T2 – T1), (1.43а) где u1, u2 - удельная внутренняя энергия в начале и в конце про- цесса, Дж/кг; T2 и T1 – начальная и конечная температура в термодинами- ческом процессе, К. Подставив в уравнение (1.42) выражение pdv = d(pv) – vdp, получим dq = du + d(pv) – vdp или dq = d(u + pv) – vdp. С учетом обозначений i = u + pv получим dq = di – vdp.
Величина i является новой функцией состояния, так как она определена значениями внутренней энергии u, давления p и удельного объема v. Эту величину называют удельной энтальпи- ей, Дж/кг – функцией состояния системы, равной сумме внутрен- ней энергии u и работы ввода тела удельным объемом v в среду с давлением p.
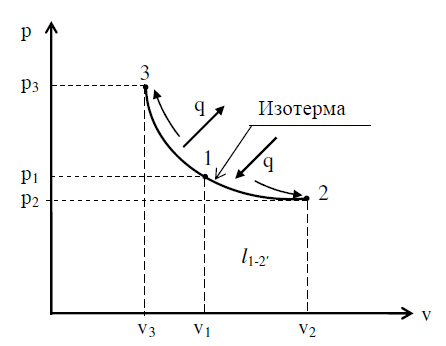
14изотермический процесс Процесс, в котором подвод тепла к рабочему телу (газу) (отвод тепла от него) происходит при постоянной температуре (T = cоnst), называется изотермическим процессом. Уравнение изотермического процесса можно вывести из характеристического уравнения для двух состояний 1 и 2: р1v1 = RT1 и р2v2=RT2, откуда при T = cоnst р1v1 = р2v2 или рv = cоnst
Площадь, расположенная под кривой процесса (2-v2-v1-1-2), измеряет работу расширения. Из математики известно, что площадь, расположенная под равнобокой гиперболой, а, следовательно, и работа 1 кг идеаль- ного газа равна
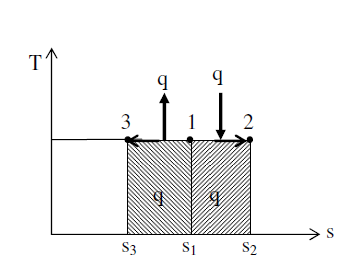
Изотермическому процессу расширения при подводе тепла к газу (энтропия возрастает) соответствует линия 1-2, изотермическому сжатию (энтропия уменьшается) – прямая линия 1-3.
16 Политропный процесс Уравнение политропного процесса
каждому процессу соответствует свое значение показателя по- литропы. В общем случае он может принимать значение в интер- вале – ∞ < n < + ∞. При
ный процесс. Для доказательства этого представим уравнение политропного процесса в виде
извлечем корень n-й степени из обеих частей уравнения (1.88б) и получим
При
Если показателю n придать значение равное нулю (n = 0), то vn = 1 и уравнение политропы превращается в уравнение изобар- ного процесса р = const. При n = 1 уравнение политропы принимает вид уравнения изотермы рv = const, а если n = k, то уравнение рvk = const опишет кривую адиабаты. |
10Внутренняя энергия и энтальпия «Внутренняя энергия идеального газа зависит лишь от его температуры» Следовательно, изменение внутренней энер- гии не зависит от вида процесса, а зависит только от начально- го и конечного состояний рабочего тела, которые определяются по его параметрам. dq = du.. Величина i является новой функцией состояния, так как она определена значениями внутренней энергии u, давления p и удельного объема v. Эту величину называют удельной энтальпи- ей, Дж/кг – функцией состояния системы, равной сумме внутрен- ней энергии u и работы ввода тела удельным объемом v в среду с давлением p. Изменение удельной энтальпии в любом термодинамиче- ском процессе определяется только начальным и конечным со- стоянием тела и не зависит от характера процесса. Теплота, подведенная при постоянном давлении, идет толь- ко на изменение энтальпии данной системы. Так как di = du + d(pv) = cvdT + RdT, то di = (cv + R)dT. В соответствии с законом Майера cv + R = cp получим di = cpdT. (1.47) Таким образом, изменение энтальпии идеального газа чис- ленно равно количеству теплоты, подводимой к газу при его на- гревании при постоянном давлении.
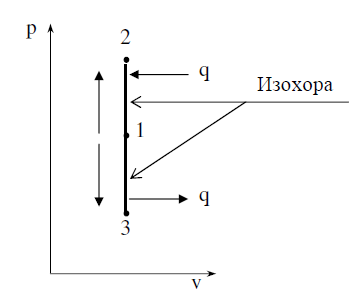
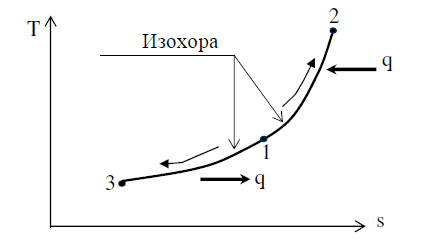
12изохорный процесс По определению изохорный процесс протекает при постоянном объеме (v = const). Следовательно, внешней работы расширения газа в процессе не происходит dq = du + dl = du + pdv В любом процессе количество тепла, подводимое к единице количества газа, равно dq = cdT, (1.55а) для изохорного процесса dq = cvdT. (1.55б) Так как v = const, то dq = du и du = cvdT. (1.55в) Для одного килограмма газа удельное количество тепла q, Дж/кг q = cv( t2 – t1). (1.56) Характеристические уравнения для двух состояний газа 1, 2 p1v = RT1 и p2v = RT2 и, деля почленно эти два уравнения одно на другое, получим p2 /p1=T2/T1, откуда р/Т = const. (1.57) свидетельствует о том, что в изохор- ном процессе давление газа изменяется прямо пропорционально его абсолютной температуре
вследствие отсутствия в идеальном газе сил сцепления между молекулами, уравнение изменения внутренней энергии будет справедливо для любого процесса u2 – u1 = cv(T2 – T1) = cv(t2 – t1). Если в формулу (1.50), определяющую изменение энтропии, подставить v1 = v2, то для изохорного процесса при сv = const получим.
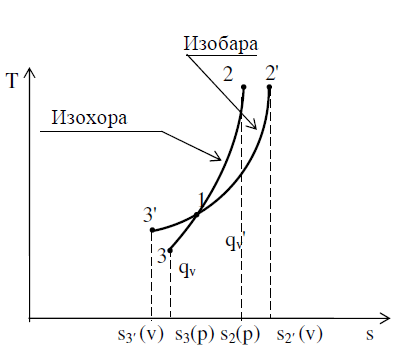
Для случая подвода тепла к газу эта кривая (1-2) идет в сто- рону увеличения энтропии и вверх, так как внутренняя энергия, а вместе с ней и его температура, возрастает.
|
11Второй закон термодинамики второй закон термодинамики устанавливает направление самопроизвольных процессов в природе и определяет условия превращения теплоты в работу. Он утверждает, что теплота в природе самопроизволь- но переходит от более нагретых тел к менее нагретым телам. Используя равенство dq = cvdT + pdv, с учетом того, что р/Т = R/v, получим
Выражение dq/T при равновесном состоянии газа – полный дифференциал некоторой функции состояния, называемой энтропией – s, Дж/(кгК)
Исходя из уравнения (1.49), можно сказать, что энтропия изменяется в равновесных процессах только вследствие подвода или отвода тепла. Проинтегрируем (1.48) с учетом (1.49) и, приняв cv = const,
где s1, s2 – значения энтропии в начале и в конце термодинами- ческого процесса
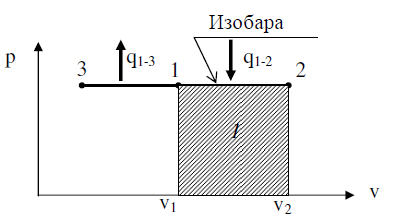
13 Изобарным процессом называют процесс, проходящий припостоянном давлении (р = const). Следовательно, в этом процессе происходит внешняя работа расширения газа. В соответствии с первым законом термодинамики будем иметь dq = du + dl = cvdT + pdv = cpdT. (1.60) Работа расширения определится из выражения dl = pdv сле-дующим образом:
Работа в изобарном процессе для идеального газа, учитывая характеристическое уравнение pV = MRT, будет равна p(V2 – V1) = MR(T2 – T1) (1.63) или L = MR(T2 – T1). (1.64) Тогда qp = cv (t2 – t1) + R(T2 – T1) (1.65) или cp(t2 – t1) = cv(t2 – t1) + R (T2 – T1), (1.66) где разности температур относятся к одним и тем же состояниям газа и поэтому равны между собой, а сокращение дает ср – сv = R. (1.67)
Так как сp > сv, то при одних и тех же температурах T1 и T2 изменение энтропии в изобарном процессе больше (s2 – s1)р > (s2 – s1)v, чем в изохорном процессе.
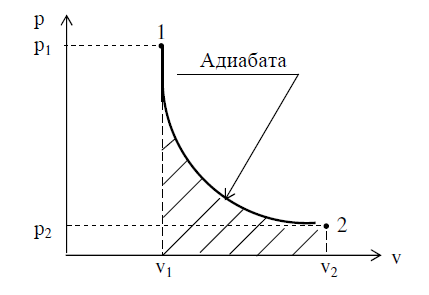
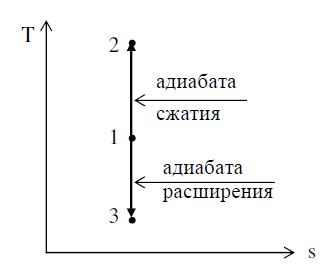
15Адиабатный процесс Процесс, в котором тепло к газу не подводится и от него не отводится, называют адиабатным. Аналитическое выражение первого закона термодинамики для адиабатного процесса, при котором q = 0, принимает следующий вид: (u2 – u1) + l = 0, откуда l = – (u2 – u1) = сv(T1 – T2). уравнение адиабаты в следующем виде: pvk = const. формула, определяющая работу газа в адиабатном процессе, примет вид
к-показатель адиабаты, является постоянным
|