
- •3.Основные положения атомно-молекулярного учения
- •8. Принцип Паули. Принципы заполнения орбиталей.
- •28. Закон Рауля
- •29. Закон Вант-Гоффа. Осмос
- •30. Закон Генри. Растворимость.
- •31 Температура кипения и замерзания раствора.
- •32. Растворы электролитов. Сильные и слабые электролиты.
- •33. Водородный показатель
- •34. Гидролиз солей
- •36. Строение мицеллы
- •37. Кристаллическое и аморфное состояние веществ. Типы кристаллической решетки.
- •39. Методы получения металлов
- •40. Электролиз. Законы электролиза
- •41. Гальванические элементы
- •42. Коррозия металлов
- •43. Методы защиты металлов от коррозии
- •44. Сплавы. Основные типы двухкомпонентных диаграмм состояния.
- •46. Минеральные вяжущие вещества, и их химический состав.
- •49. Классификация органических соединений.
39. Методы получения металлов
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов.( Легирование – это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.) Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Существуют несколько основных способов получения металлов.
Восстановление:
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем)
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, — Сu2+ 2Сl
Катод (восстановление): Анод (окисление):
Сu2+ 2е- = Сu0 2Cl - 2е- = Сl°2
40. Электролиз. Законы электролиза
Электролиз — физико-химическое явление, состоящее в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, которое возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — ионы кислотных остатков и гидроксильной группы — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия , хлора, хлорорганических соединений, диоксида марганца, пероксида водорода.
Электролиз находит применение в очистке сточных В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит:

если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Количественные характеристики электролиза выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
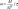 ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
