
- •Хроматографический метод анализа
- •Классификация хроматографических методов
- •Газовая хроматография
- •Газоадсорбционная хроматорафия
- •Газожидкостная хроматография
- •Основные узлы газового хроматографа
- •Детекторы
- •Теоретические основы хроматографии
- •Оценка эффективности, селективности и разделительной способности хроматографических колонок
- •Качественный анализ
- •Количественный анализ
Хроматографический метод анализа
Хроматография – это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Неподвижной фазой обычно служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу.
Компоненты анализируемой смеси вместе с подвижной фазой перемещаются вдоль стационарной фазы, которую обычно помещают в колонку (стеклянную или металлическую трубку). Если молекулы разных компонентов разделяемой смеси обладают различной адсорбируемостью или растворимостью, то время их пребывания в неподвижной фазе, а следовательно, и средняя скорость передвижения по колонке различны. Одни компоненты остаются в верхнем слое сорбента, другие, с меньшей адсорбируемостью, оказываются в нижней части колонки, некоторые покидают колонку вместе с подвижной фазой. Так достигается разделение компонентов. Хроматография – динамический метод, связанный с многократным повторением сорбционных и десорбционных процессов, так как разделение происходит в потоке подвижной фазы. Это обеспечивает эффективность хроматографического метода по сравнению с методами сорбции в статических условиях.
Сорбция – поглощение паров, газов или растворенных веществ (сорбата) твёрдым телом или жидкостью (сорбентом) из окружающей среды, обратный процесс называют десорбцией. Различают поглощение вещества всей массой жидкого сорбента (абсорбция); поверхностным слоем твёрдого или жидкого сорбента (адсорбция). Сорбция, сопровождающаяся химическим взаимодействием сорбента с поглощаемым веществом (сорбатом), называется хемосорбцией.
При постоянной температуре адсорбция увеличивается с ростом концентрации раствора или давления газа. Зависимость количества поглощенного вещества от концентрации раствора или давления газа при постоянной температуре называют изотермой адсорбции. Математически эта зависимость может быть выражена уравнением Ленгмюра.
![]()
где n – количество адсорбированного вещества при равновесии;
n∞- максимальное количество вещество, которое может быть адсорбировано на данном адсорбенте;
b- постоянная;
с – концентрация.
По
Ленгмюру на поверхности твердого тела
имеется некоторое число мест с минимальной
энергией, расположенных через определенные
интервалы по всей поверхности. Их число
равно n∞.
На этих местах могут адсорбироваться
молекулы из раствора или газа. В области
небольших концентраций изотерма линейна
(рис. 1), т.к. при bc1
знаменатель становится равным единице
и уравнение переходит в:
![]()
Это уравненение линейной адсорбции. Оно соответствует уравнению Генри. (Г-коэффициент Генри). При высокой концентрации bc1 уравнение Ленгмюра принимает вид n=n∞, что соответствует насыщению: изотерма адсорбции выходит на прямую, параллельную оси абсцисс.
Иногда зависимость количества адсорбированного вещества от концентрации раствора или давления газа отличается от изображенной на рисунке (например, вогнутой или S-образной). Это может быть вызвано образованием на поверхности адсорбента полимолекулярного слоя или неоднородностью поверхности.
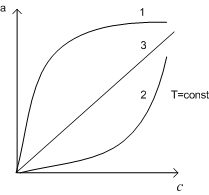
Рис.1 Изотермы адсорбции
При адсорбции двух или нескольких веществ уравнение для i-того компонента принимает вид
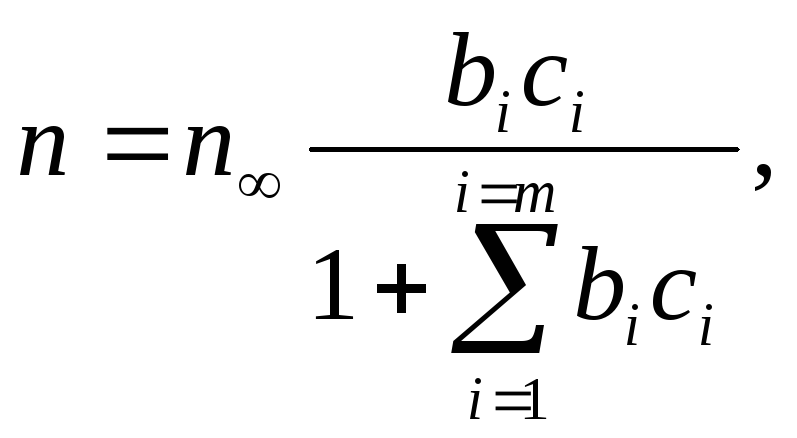
Следует отметить также, что количество адсорбированного вещества будет определяться не только его концентрацией, но и сродством к адсорбенту. При адсорбции нескольких веществ, проявление сродства особенно заметно, так как возможно вытеснение одних сорбированных веществ другими, обладающими большим сродством, хотя имеющими, может быть, и меньшую концентрацию.
К преимуществам хроматографического анализа можно отнести, то что с помощью хроматографии возможны:
разделение сложных смесей органических и неорганических веществ на отдельные компоненты,
очистка веществ от примесей,
концентрирование веществ из сильно разбавленных растворов,
качественный и количественный анализ исследуемых веществ.
