
- •Глава IV Гидратация олефиновых углеводородов
- •1 Теоретические основы процесса гидратации олефинов
- •2 Технологические основы процесса гидратации олефинов
- •1.1 Химизм процесса
- •1.2 Термодинамика и кинетика процесса
- •1.3 Катализаторы, механизм процесса
- •1.4 Побочные процессы
- •2 Технологические основы процесса гидратации олефинов
Глава IV Гидратация олефиновых углеводородов
1 Теоретические основы процесса гидратации олефинов
2 Технологические основы процесса гидратации олефинов
1.1 Химизм процесса
Процессы гидратации непредельных углеводородов очень широко используются в промышленности органического синтеза для получения кислородсодержащих соединений. Этим методом из олефинов получают одноатомные спирты, в частности гидратацией этилена — этиловый спирт:
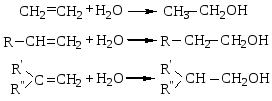
Все олефины, за исключением этилена, при гидратации образуют вторичные или третичные спирты. Так как присоединение воды к олефинам всегда происходит по правилу Марковникова. Правило Марковникова находит объяснение с позиции электронной теории органических реакций. Вследствие того, что электроотрицательность углерода больше, чем водорода, углерод в метильной группе СН3 несет на себе некоторый отрицательный заряд. Это приводит к сдвигу σ-электронов связи Н3С – СН в направлении центрального атома углерода. Этот сдвиг в свою очередь влечет за собой гораздо большее смещение подвижных π-электронов двойной связи в направлении, указанной изогнутой стрелкой:

Таким
образом, электронные сдвиги Н![]() С,
Н3С
С,
Н3С![]() СН
вызывают сильный
сдвиг электронов двойной связи, т.е.
поляризацию со сдвигом электронной
плотности к атому углерода, не соединенному
с алкильной группой:
СН
вызывают сильный
сдвиг электронов двойной связи, т.е.
поляризацию со сдвигом электронной
плотности к атому углерода, не соединенному
с алкильной группой:
![]()
Протон присоединяется к тому ненасыщенному атому углерода, который несет частичный отрицательный заряд. Ясно, что им будет атом углерода, связанный с меньшим числом алкильных групп (более насыщенный водородом). Анионная часть реагента направляется к атому углерода с наименьшей электронной плотностью — к наименее гидрогенизованному.
1.2 Термодинамика и кинетика процесса
Рассмотрим равновесие основной реакции: гидратации - внутримолекулярной дегидратации:
![]()
Она протекает с выделением тепла (∆Н°298 = -46 кДж/моль), следовательно, ее равновесие смещается вправо при понижении температуры. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутена в зависимости от температуры представлено графически на рис. 59. Видно, что равновесие невыгодно для гидратации олефинов, так как при 150—300°С,

Рис. 1 Температурная зависимость изменения энергии Гиббса для гидратации этилена (1), пропилена (2) и изобутена (3)
Рис. 2 Зависимость равновесной степени конверсии этилена в этанол от давления при разных температурах и. соотношении С2Н4:Н2О= =1:1
когда катализаторы процесса достаточно активны, ∆G° имеет большую положительную величину и равновесие смещено в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Гидратации олефинов благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так, последняя при 250-300 °С и атмосферном давлении составляет всего 0,1-0,2 %, что совершенно неприемлемо для практических целей, но при 7-8 МПа и тех же температурах она возрастает до 12-20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис. 60, причем аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления.
Следует отметить, что при приближении к равновесию скорость гидратации и селективность падают, что делает невыгодным проведение реакции до степеней конверсии, близких к равновесным.
Скорость реакции зависит от строения олефина и длины его углеродной цепи. С наибольшей скоростью протекает гидратация олефинов разветвленного строения. Чем короче углеродная цепь олефина, тем труднее присоединяется к нему вода; наиболее трудно гидратируется этилен. Олефины по изменению реакционной способности можно расположить в следующий ряд, который объясняется электрофильным механизмом гидратации, определяемым сравнительной стабильностью промежуточных карбокатионов:
![]()
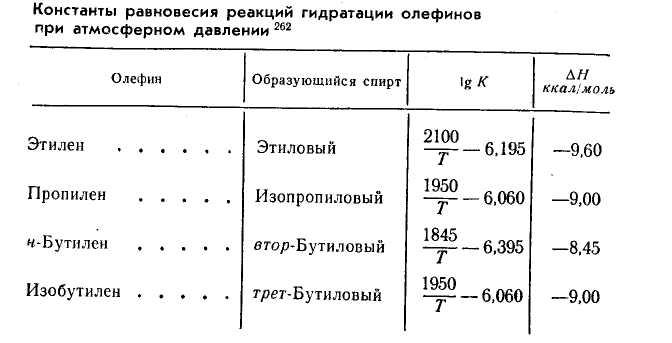 Данные
о зависимости константы равновесия
реакций гидратации некоторых олефинов
от температуры и о тепловом эффекте
реакций приведены в таблице.
Данные
о зависимости константы равновесия
реакций гидратации некоторых олефинов
от температуры и о тепловом эффекте
реакций приведены в таблице.
Графически зависимость константы равновесия от температуры показана на рис. 108.

.
Рис. 108. Влияние температуры на константы равновесия реакций гидратации некоторых олефинов: 1 – гидратация этилена, 2 – гидратация пропилена, 3 – гидратация н-бутилена.
