
- •*Закон эквивалентов Рихтера (1792 –
- •"Начальные основания стехиометрии или искусства измерения химических элементов«
- •«Опыт химической статистики» 1803 г.
- •В 1799-1806 гг. установил, что отношение количеств
- •Открыл несколько новых эмпирических закономерностей:
- •Основные положения теории Дальтона :
- •1914 г. – американский учёный Теодор Ричардс был удостоен Нобелевской премии за уточнение
- •Если имеется лишь одно бинарное соединение двух элементов, то его молекула (сложный атом)
- •Решению проблемы атомных весов способствовало открытие ещё целого ряда стехиометрических законов.
- •"Равные объёмы газов при одинаковых давлении и температуре содержат одинаковое число молекул, так
- •Атомные веса всех элементов должны быть целочисленны и кратны атомному весу водорода.
- •Удельная теплоёмкость твёрдых элементов (простых веществ в твёрдом состоянии) обратно пропорциональна атомному весу
- •«Два соединения могут образовать Смешанные кристаллы
- •В 1814 г. Берцелиус опубликовал первую таблицу атомных весов, в которой были приведены
- •Возрождение закона Авогадро (закон Авогадро- Жерара)
- •«Конспект курса химической философии» (1858)
- •Доказательство несомненной связи между химическими реакциями и электричеством в виде первой электрической батареи
- •Основные идеи теории состояли в следующем:
- •Простая и наглядная дуалистическая система:
- •Берцелиус расположил все элементы в ряд по знаку и величине присущего их атомам
- •Дуалистическая система Берцелиуса предполагает, что каждое соединение состоит из двух частей, имеющих различную
- •Теория весьма удачно объясняла многие реакции между неорганическими веществами.


*Закон эквивалентов Рихтера (1792 –
*Закон постоянных отношений Пруста (1799 – 1806)
*Закон кратных отношений Дальтона (1802 – 1808)
*Закон соединения газов между собой Гей-Люссака (1805 – 1080)
*Закон Авогадро (1811)
*Закон изоморфизма Митчерлиха (1818 – 1819)
*Закон удельных теплоемкостей Дюлонга и Пти (1819)
*Законы электролиза Фарадея (1834)
*Закон постоянства количества теплоты Гесса (1840)
*Закон атомов Канницаро (1858)

"Начальные основания стехиометрии или искусства измерения химических элементов«
1793 г.
"Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты«
При образовании соединений элементы вступают во взаимодействие в строго определённых пропорциях

«Опыт химической статистики» 1803 г.
Предположил, что элементы могут соединятся друг с другом в любых пропорциях в зависимости от массы реагирующих веществ
1803 г. – теория химического сродства, обусловленного силами притяжения и зависящего от плотности вещества и его количества

В 1799-1806 гг. установил, что отношение количеств
элементов в составе соединения всегда постоянно
"Всегда неизменные отношения, эти постоянные признаки, характеризующие истинные соединения, как искусственно полученные, так и природные»
Вопрос о причинах постоянства состава оставался открытым

Открыл несколько новых эмпирических закономерностей:
-закон парциальных давлений (закон Дальтона)
-закон растворимости газов в жидкостях (закон Генри-Дальтона)
-закон кратных отношений
"Новая система химической философии«
1808 г.
Разработал свою атомно-молекулярную теорию.

Основные положения теории Дальтона :
*1. Все вещества состоят из большого числа атомов (простых или сложных).
*2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
*3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
*4. Важнейшим свойством атомов является атомный вес.

1914 г. – американский учёный Теодор Ричардс был удостоен Нобелевской премии за уточнение атомных масс некоторых элементов.
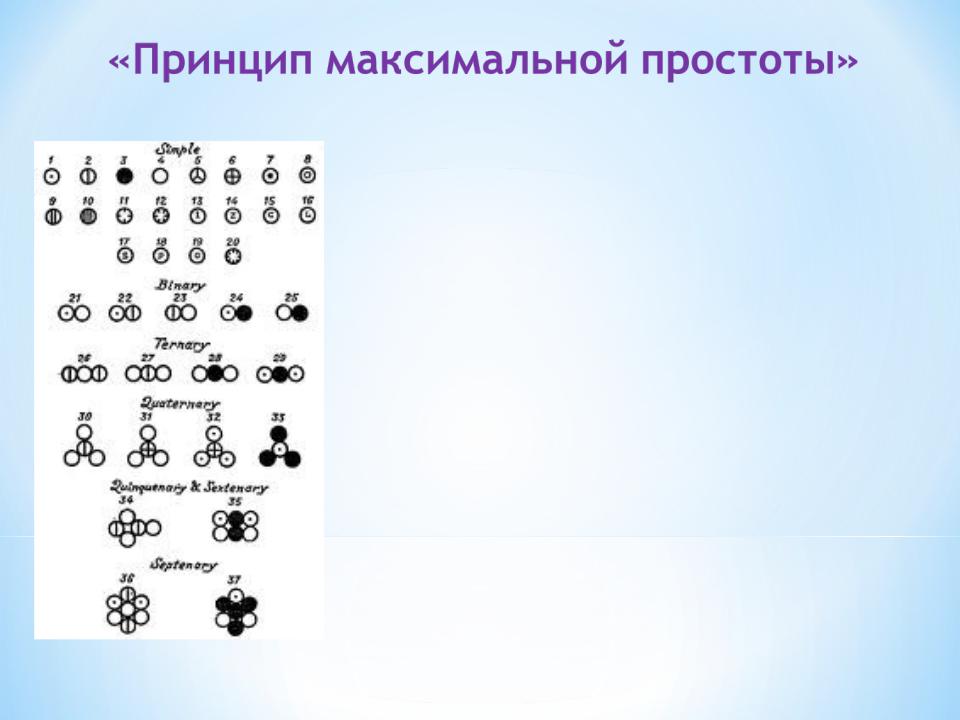
Если имеется лишь одно бинарное соединение двух элементов, то его молекула (сложный атом)
образована одним атомом одного элемента и одним атомом другого.
Тройные и более сложные атомы образуются лишь в том случае, когда имеются несколько соединений, образованных двумя элементами.
Отсюда неправильное определение атомных весов металлов на основании состава оксидов.

Решению проблемы атомных весов способствовало открытие ещё целого ряда стехиометрических законов.
«При взаимодействии газов их объёмы и объёмы газообразных продуктов соотносятся как простые числа»
1 объем хлора + 1 объем водорода =
2 объема хлороводорода

"Равные объёмы газов при одинаковых давлении и температуре содержат одинаковое число молекул, так что плотность газов служит мерой массы их молекул и отношение объёмов при соединении суть не что иное, как отношение между числом молекул, соединяющихся между собой при образовании сложной молекулы".
Основания для гипотезы Авогадро – закон Гей-Люссака и опыт Николсона-Карлайла.
Следствием из гипотезы Авогадро являлось предположение о том, что газообразные водород, кислород, азот и хлор состоят из двухатомных молекул.
