
YOBA-3000 / Khimia_1_5
.docxРастворы.
Сильные и слабые электролиты.
Растворы - однородные гомогенные системы, термодинамически устойчивые, состоящие из двух или более компонентов и продуктов их взаимодействия.
Классификация:
-жидкие
-твердые
-газообразные
-Низкомолекулярные (НМС-М менее 5000 г/моль)
-Высокомолекулярные (ВМС-М более 5000 г/моль)
-растворы электролитов
-растворы неэлектролитов
По современным представлениям жизнь зародилась в океане, из него многие обитатели вышли на сушу и в воздух, сохранив в своем составе воду.
Биологическая роль растворов
-
Многие биологические среды – растворы (кровь, лимфа, слюна, моча, спинномозговая жидкость). Все они являются растворами солей, белков, углеводов, липидов в воде;
-
Все биохимические реакции протекают в растворах;
-
Биологические жидкости способствуют усвоению питательных веществ, лекарственных веществ;
-
Растворы переносят питательные вещества ко всем органам и тканям организма;
-
С помощью растворов происходит выведение продуктов метаболизма из организма.
Растворы
-
В растворе различают растворитель и растворенное вещество, хотя с точки зрения термодинамики все составляющие раствора одинаковы.
-
Растворителем принято считать то вещество, которое содержится в растворе в большем количестве.
-
Самым распространенным растворителем на Земле является вода.
Вода в организме человека
В организме взрослого человека содержится до 60% воды, из которой 30% – внутри клеток; 20% - внеклеточная жидкость, состоящая из плазмы крови, межклеточной жидкости, внутриглазной жидкости, спинномозговой жидкости и жидкого содержимого желудочно-кишечного тракта.
Термодинамика процесса растворения
При растворении твердого вещества в жидкости происходят процессы:
-
Разрушение кристаллической решетки (эндотермический процесс)
-
Взаимодействие частиц растворенного вещества с молекулами растворителя (экзотермический процесс)
Результирующая этих двух процессов определяет тепловой эффект процесса растворения в целом:
-
Если на разрушение кристаллической структуры растворяемого вещества затрачивается энергии больше(1), чем выделяется при гидратации (2), то процесс растворения будет эндотермическим (произойдет увеличение энтальпии системы)
-
Если энергия, выделяющая при гидратации (2), больше энергии, необходимой для разрушения кристаллической структуры растворяемого вещества (1), то процесс растворения будет экзотермическим (произойдет уменьшение энтальпии системы)
Растворимость и ее зависимость от различных факторов:
-
Под растворимостью понимают способность вещества растворяться в том или ином растворителе
Растворимость зависит от:
-
Природы растворителя и растворенного вещества
-
Давления (только для газов)
-
Температуры (если процесс растворения экзотермический, то понижение температуры способствует растворению и наоборот)
-
Зависимость растворимости газов от давления выражена законом Генри: Количество газа, растворенного при данной температуре в определенном объеме жидкости, прямо пропорционально давлению газа:
С = КР
С – концентрация газа в насыщенном растворе (моль/л)
Р – давление газа над раствором
К – постоянная Генри
Закон Генри лежит в основе процесса обмена газов между организмом человека и окружающей средой и позволяют установить причины некоторых заболеваний (кессонной болезни, у водолазов, летчиков и представителей других профессий).
Растворы электролитов
-Сильные электролиты (степень диссоциации 40-100%)
-Слабые электролиты (степень диссоциации 2% и менее)

Растворы слабых электролитов
-
Слабые электролиты диссоциируют не полностью и в их растворах устанавливается равновесие между процессом диссоциации и обратным процессом:
CH3COOH <=> CH3COO- + H+
-
К процессу диссоциации слабых электролитов можно применить закон действующих масс и вывести константу диссоциации (константу равновесия):

C – общая концентрация кислоты
А – степень диссоциации
Са – концентрация каждого из ионов
С-Са – концентрация недиссоциированных молекул
-
Следовательно:


-
Данное выражение является математическим выражением закона разведения Оствальда для слабого бинарного электролита
-
Степень диссоциации слабых электролитов очень мала, поэтому ею можно пренебречь в знаменателе и получить более упрощенное математическое выражение закона разведения Оствальда:
Степень диссоциации слабого электролита обратно пропорциональна концентрации.
Степень диссоциации слабого электролита прямо пропорциональна разведению.

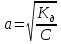
Диссоциация воды. Ионное произведение воды, pH и pOH
-
Вода – вещество с малой степенью ионизации, поэтому к процессу ее диссоциации можно применить закон действующих масс:
Н2О ↔ H+ + OH-



pH и pOH
-
От величины рН зависит поведение клеток и их биологическая активность
-
Отклонение значения рН биологических жидкостей от нормы может стать причиной тяжелых заболеваний
-
Обменные процессы в организме совершаются в водных средах, вода и продукты ее диссоциации – ионы водорода и гидроксид-ионы – являются необходимыми факторами, определяющими структуру и биологические свойства белков, нуклеиновых кислот и других клеточных компонентов.
pH биологических жидкостей
-
Кровь – 7,36
-
Молоко – 7,0-7,3
-
Слюна – 6,9
-
Желудочный сок – 0,8-2,0
-
Спинномозговая жидкость – 7,70-7,85
-
Желчь – 7,8
Сильные электролиты
-
Не подчиняются закону разведения Оствальда, для них Кд не является постоянной величиной и зависит от концентрации раствора.
-
Даже в умеренно концентрированных растворах сильных электролитов ионы находятся на столь близких расстояниях, что электростатическое взаимодействие оказывает заметное влияние на характер их движения, поэтому степень диссоциации, рассчитанная по электропроводности, меньше единицы (теоретически должна быть ей равна)
-
Создается впечатление, что диссоциация в растворе происходит не полностью и в растворе имеется некоторое количество недиссоциированных молекул. Это противоречие попытались устранить ученые Дюбай и Хюккель: ионы в растворах сильных электролитов окружены ионной атмосферой из противоионов, поэтому, если такой электролит поместить в электрическом поле, то ион будет двигаться в одном направлении, а его ионная атмосфера – в другом, замедляя движение иона.
-
В результате этих взаимодействий снижается электрическая проводимость, поэтому степень диссоциации, определяемая по ней, является кажущейся, т.к. не соответствует действительной степени распада электролита на ионы.
-
Следовательно, можно считать, что во всех процессах в растворах электролитов участвую лишь «активные» ионы, т.е. ионы, не участвующие в данный момент в межионном взаимодействии. Поэтому американский ученый Льюис предложил вместо концентрации использовать понятие активности.

-
Под активностью понимают эффективную концентрацию, в соответствие с которой он участвует в различных процессах.

f – коэффициент активности
а – активность
С – концентрация электролита
-
Значение f для электролита зависит от интенсивности электрического поля и ионной силы раствора (I), которая представляет полусумму произведений концентраций всех ионов на квадрат их заряда.



Ионная сила плазмы крови – 0,15 моль/кг
