
YOBA-3000 / Khimia_1_4
.docxКинетика, катализ, химическое равновесие.
Кинетика – раздел физической химии, изучающий скорости и механизмы химических реакций.
Скорость химической реакции – это число элементарных актов реакции в единицу времени в единицу объема (для гомогенных систем) или на единицу поверхности раздела фаз (для гетерогенных систем),

Классификация химических реакций
Химические реакции:
- мгновенные (взрыв)
- медленные (образование угля, нефти…)
- гомогенные: N2(г) + О2(г) = 2NO(г)
- гетерогенные: Fe(тв) + CuSO4(p,) = Cu(тв) + FeSO4(p.)
-
Простые: Ba2+ + SO42- = BaSO4
-
Сложные:
-
Параллельные
-
Последовательные
-
Сопряженные
-
Цепные (фотохимические)




Влияние концентрации реагирующих веществ на скорость химических реакций.
Закон действующих масс
При постоянной температуре скорость химической реакции пропорциональна действующим массам – молярным концентрациям реагирующих веществ, взятым в степени соответствующих стехиометрических коэффициентов.

Физический смысл константы состоит в том, что она численно равна скорости химической реакции при условии, что концентрации реагирующих веществ равны 1 моль/л.

Молекулярность простых реакций - число частиц, участвующих в одновременном акте взаимодействия.
Порядок простых реакций – число, равное сумме показателей степеней концентраций реагирующих веществ в уравнении для скорости реакции.

 Вывод:
в случае гомогенных реакций молекулярность
и порядок простых реакций совпадают. В
случае гетерогенных реакций молекулярность
выше порядка реакции.
Вывод:
в случае гомогенных реакций молекулярность
и порядок простых реакций совпадают. В
случае гетерогенных реакций молекулярность
выше порядка реакции.
Влияние температуры на скорость химических реакций.
Закон Вант-Гоффа
При повышении t на каждые 10о скорость химической реакции увеличивается в 2-4 раза.

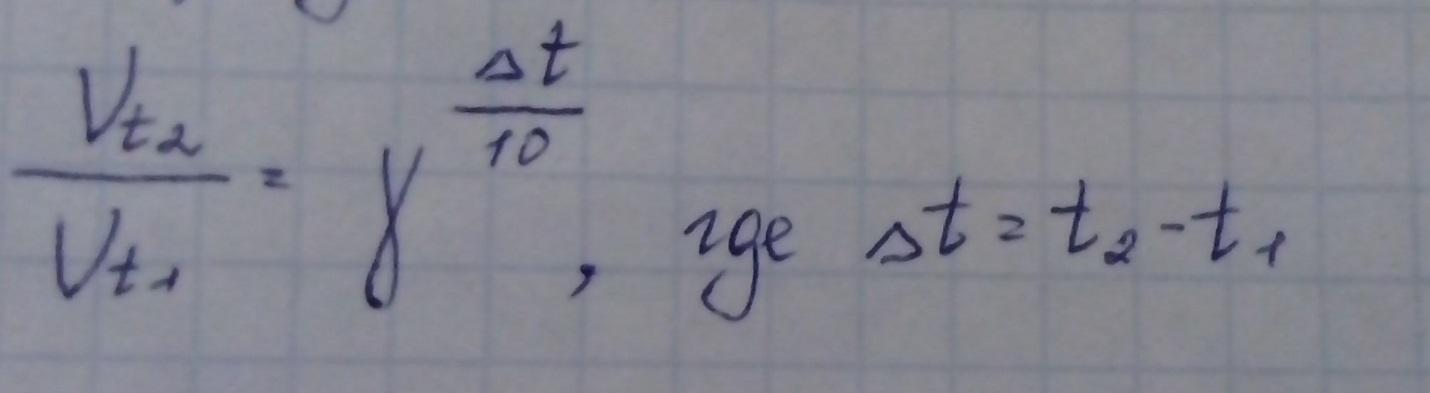 Энергия
активации – та минимальная дополнительная
энергия, которую необходимо собирать,
молекулам сверх среднего ее значения.
Энергия
активации – та минимальная дополнительная
энергия, которую необходимо собирать,
молекулам сверх среднего ее значения.
Уравнение Аррениуса:
 Влияние
катализатора на скорость химических
реакций
Влияние
катализатора на скорость химических
реакций
Катализаторы – это вещества, изменяющие скорость химических реакций, остающиеся при этом в химически неизменном виде.
Катализ – это процесс изменения скорости химических реакций под действием катализатора.
Катализ:
- гомогенный (катализатор и реагирующие вещества находятся в одной фазе)
- гетерогенный (катализатор и реагирующие вещества находятся в разных фазах)
Особенности биокатализаторов:
- высокая эффективность:
А) 2H2O2 → 2H2O + O2 (Ea = 75 кДж/моль)
Б) 2H2O2 → 2H2O + O2 (Ea = 23 кДж/моль)
V химической реакции увеличивается в 3*1011 раз
- ориентационный эффект (повышает скорость биохимических реакций примерно в 1000 раз)
- действует в условиях постоянных температур (10о-60оС)
- действие ферментов зависит от рН среды (рН = 4-10)
Механизм положительного действия катализатора
Роль катализатора – уменьшение Еа

 Смещение
химического равновесия называется
сдвигом
химического равновесия.
Смещение
химического равновесия называется
сдвигом
химического равновесия.
Принцип Ле-Шателье
Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие сместится в сторону той из двух реакций, которая противодействует данному изменению.

