
YOBA-3000 / Khimia_1_6_Diffuzia_i_osmos
.docxДиффузия и осмос. Законы осмоса.
Диффузия
-
Самопроизвольный процесс выравнивания концентрации, идущий из раствора с большей концентрацией растворенных частиц в раствор с меньшей их концентраций.
-
С1 > C2 – направление диффузии
-
Явление диффузии обусловлено хаотическим тепловым движением молекул и ионов, находящихся в растворе.
-
Диффузия – процесс самопроизвольный
-
Движущей силой диффузии является увеличение энтропии системы.
Диффузия. Закон Фика
-
Скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество, и градиенту концентрации этого вещества:
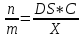
D – коэффициент диффузии
S – площадь поверхности
Скорость диффузии возрастает с повышением температуры, градиента концентрации, понижением вязкости растворителя и размера частиц.
Диффузия и организм человека
-
Путем диффузии происходит насыщение крови кислородом.
-
Площадь поверхности альвеол легких очень велика (80 м2), поэтому кислород активно переходит в эритроциты. Концентрация кислорода в венозной крови приближается к нулю, следовательно, градиент концентрации кислорода между атмосферой и кровью очень большой, что приводит к активному поглощению кислорода (закон Фика).
Осмос. Законы осмоса.
Если на пути диффундирующих частиц поставить полупроницаему мембрану, начнется процесс односторонней диффузии –
ОСМОС – преимущественно одностороннее проникновение молекул растворителя через полупроницаему мембрану из растворителя в раствор или из раствора с меньшей концентрацией растворенных частиц в раствор с большей их концентрацией
С1>C2 - направление осмоса (противоположно диффузии)
Естественные
-животного происхождения
-растительного происхождения
Искусственные
-целлофан, коллодий, гексациано(II)феррат меди – Cu2[Fe(CN)6].
С точки зрения термодинамики, движущей силой осмоса является стремление системы к выравниванию концентрации, т.к. при этом энтропия системы возрастает, а энергия Гиббса уменьшается, следовательно, осмос – самопроизвольный процесс.
Давление, которое необходимо создать, чтобы остановить осмос, называется осмотическим давлением.
В 1887 г. Вант-Гофф установил закон, согласно которому:
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно находилось в газообразном состоянии при той же температуре и занимало бы тот же объем.
Закон Вант-Гоффа
Для идеального раствора осмотическое давление можно вычислить по уравнению Менделеева-Клайперона:
PV=nRT, где Р = Р (осм);
V – объем, занимаемый раствором;
N – число молей растворенного вещества
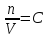
P(осм.) = CRT
Если полупроницаемой мембраной разделены 2 раствора, обладающие одинаковым осмотическим давлением, проникновения растворителя через мембрану не наблюдается. Такие растворы называются изотоническими.
Раствор, обладающий большим осмотическим давлением, чем другой, сравниваемый с ним раствор, называется гипертоническим.
Если осмотическое давление одного раствора меньше, чем другого, взятого за стандарт, то такой раствор называется гипотоническим.
P1>P2 (раствор Р1 гипертоничен по отношению к раствору с Р2)
Исходя из математического выражения закона Вант-Гоффа можно предполагать, что растворы самых разнообразных веществ с одинаковой молярной концентрацией, должны быть изотоничны.
Однако, оказалось, что величина осмотического давления для электролитов и неэлектролитов при одинаковой концентрации, неодинакова. Она всегда больше для элеткролитов.
Данный факт можно объяснить тем, что растворы электролитов всегда содержат большее число частиц, т.к. в растворах они диссоциируют на ионы.
Поэтому, чтобы использовать законы идеальных растворов для количественного описания коллигативных свойств растворов, Вант-Гофф ввел в уравнение поправочный изотонический коэффициент i:
Pосм = iCRT
Изотонический коэффициент можно определить экспериментально:
