
YOBA-3000 / Vvedenie_v_bioorganicheskuyu_khimiyu
.docxВведение в биоорганическую химию.
Пространственное строение органических молекул.
Биоорганическая химия возникла на стыке наук, таких как:
-
Органическая химия
-
Биологическая химия
-
Биология
-
Молекулярная генетика, однако, базируется она в основном на материале органической химии, используя ее теоретические представления и весь арсенал ее методов исследования.
Главная цель изучения биоорганической химии заключается в формировании системных знаний о структуре и закономерностях в химическом поведении основных классов природных органических соединений, лежащих в основе как строения живых объектов, так и всех процессов жизнедеятельности.
Основные понятия органической химии
Химический состав молекулы – представляет собой количество атомов отдельных химических элементов, входящих в данную молекулу. Выражается в виде молекулярной формулы, например, для молочной кислоты. С3Н6О3
Химическое строение вещества – устойчивый порядок соединения атомов в молекуле с учетом характера связей между ними.
Химическое строение вещества может быть представлено в виде структурной формулы или формулы строения, например, для молочной кислоты:
СН3-СН(ОН)-СООН
Конфигурация – фиксированное пространственное расположение атомов или атомных групп в молекуле относительно друг друга.
Конфигурация может быть представлена или в виде стереохимических формул или в виде проекционных формул Фишера. Для лактата:

Конформациями называют различные энергетически неравноценные геометрические формы молекулы соединения, переходящие друг в друга за счет вращения отдельных частей молекулы вокруг одинарных связей. Конформации могут быть представлены или в виде стереохимических формул, или в виде проекционных формул Ньюмена.
Внутренняя энергия молекулы – энергия взаимодействия входящих в нее атомов и кинетическая энергия, обусловленная движением молекулы. Энергия атомных взаимодействий в молекуле может быть подразделен на:
-
Энергию химических связей между атомами
-
Энергию так называемых несвязных взаимодействий (конформационная энергия).
Химический состав молекулы может быть установлен в ходе качественного и количественного элементарного анализа химического соединения, а на основании изучения свойств соединения может быть установлено его химическое строение.
Возможность выяснения химического строения соединения на основе изучения его свойств является краеугольным камнем теории химического строения, предложенного А. И. Бутлеровым.
Именно А. И. Бутлеров впервые обратил внимание на то, что различный порядок соединения одних и тех же атомов может дать различные вещества, тем самым он дал объяснение широко распространенному в мире органических соединений явлению изомерии. Этот вид изомерии получил название структурной изомерии.

Вместе с тем, во второй половине 19 века выяснилось, что существуют вещества, имеющие одинаковый порядок соединения атомов в молекуле, но отличающиеся друг от друга по некоторым свойствам, таким, например, как способность вращать в разные стороны плоскость поляризованного луча света или способность кристаллизоваться в виде кристаллов, похожих друг на друга как предмет и его зеркальное изображение.
Необходимость объяснения этих различий привела к формированию новой области химии – стереохимии, т.е. учения о трехмерной структуре.
В основе стереохимии органических соединений лежит идея тетраэдричности насыщенного атома углерода.
При изображении строения органической молекулы все связи между атомами располагают в одной плоскости, предполагая тем самым, что и молекулы плоские, двумерные.
Вант Гофф и Лебель были первыми, кто указал на ошибочность такого рода представлений.
В реальном трехмерном пространстве валентные связи атома углерода располагаются не в одной плоскости, а под углом друг к другу. Если по всем четырем валентностям атом углерода связан с одинаковыми атомами или группами атомов, то угол между валентными связями составляет 109.5 градусов, а валентные связи будут направлены к вершинам тетраэдра. И тогда молекула становится трехмерной.
При изображении на бумаге такого тетраэдрического атома углерода поступают следующим образом:
-
Связи, лежащие в плоскости бумаги изображают обычными линиями;
-
Связи, идущие к наблюдателю, изображают в виде зачерненного клина;
-
Связи, уходящие за плоскость бумаги – пунктиром или заштрихованным клином
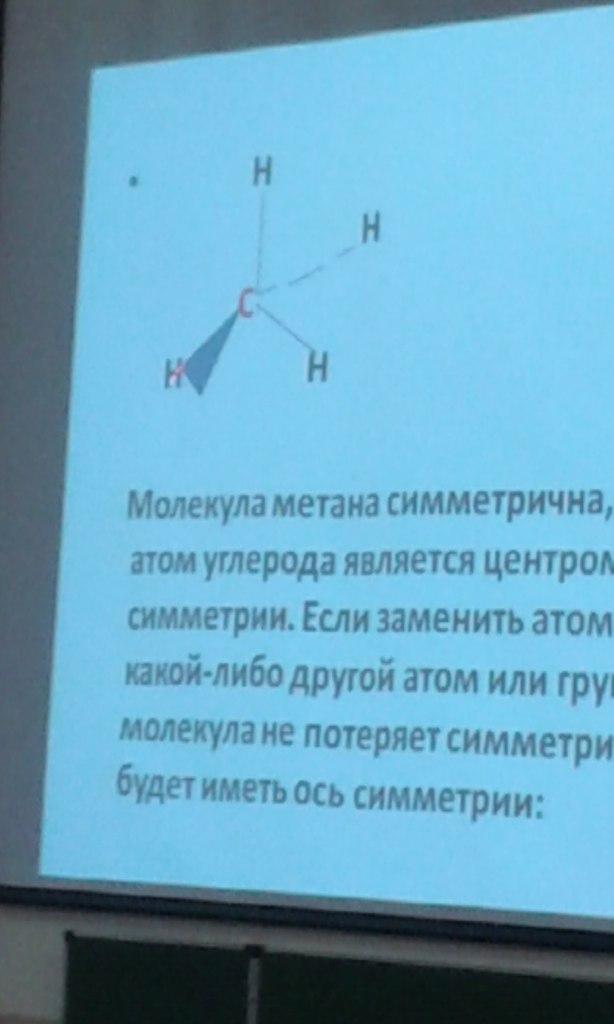
Молекула метана симметрична, поскольку атом углерода является центром ее симметрии. Если заменить атом водорода на какой-либо другой атом или группировку, молекула не потеряет симметричности, т.к. будет иметь ось симметрии:

Замена еще одного атома водорода на какую-либо другую группировку также не приведет к потере симметрии, т.к. сохранится плоскость симметрии.

При замене третьего атома водорода на группировку не идентичную двум другим, молекула теряет все элементы симметрии.
Такие молекулы получили название хиральных молекул.
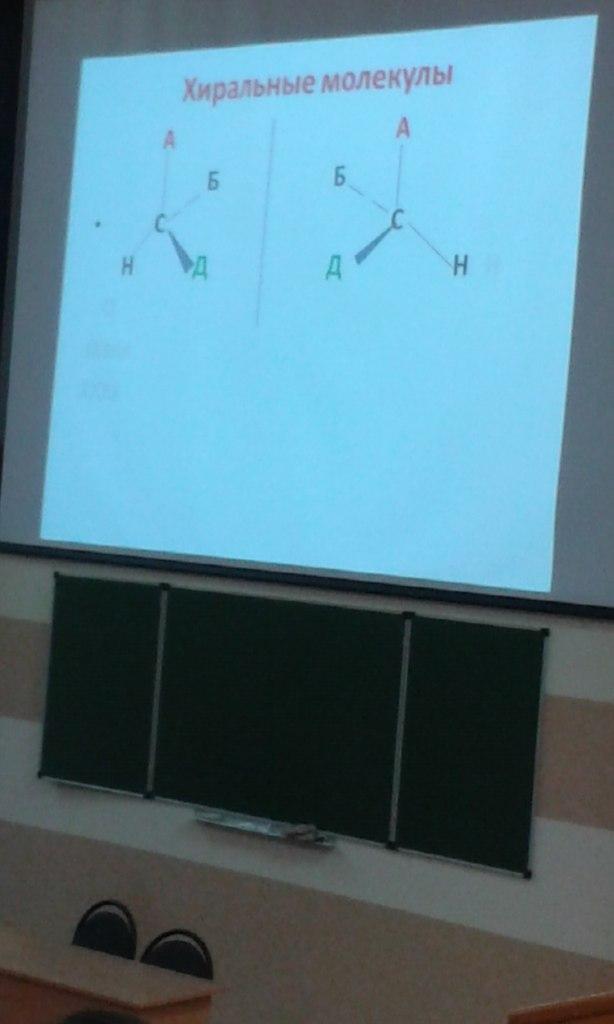
Хиральные молекулы
Хиральные молекулы могут существовать в двух пространственных формах, похожих друг на друга как предмет и его изображение в зеркале («хирон» - рука). Эти молекулы не идентичны, поскольку попытки совместить одну молекулу с другой безуспешны.
Данные молекулы – изомеры, отличающиеся друг от друга не порядком соединения атомов в молекуле, а их фиксированным расположением.
Изомерия, связанная с различным пространственным расположением атомов в молекуле, называется пространственной или стереоизомерией.
В виду того, что порядок соединения атомов в молекулах рассматриваемых изомеров одинаков, они чрезвычайно сходны друг с другом по химическим свойствам. Тем не менее их можно различить по некоторым физическим свойствам, например, по способности вращать плоскость поляризованного луча света (один из них вращает влево, другой – вправо).
Такие стереоизомеры получили название оптических (зеркальных) изомеров.
Оптической активностью обладают только хиральные молекулы; молекулы, имеющие те или иные элементы симметрии (ахиральные), оптической активностью не обладают.
Все хиральные молекулы содержат в своей структуре атом углерода, связанный по всем четырем валентностям с разными атомами или атомными группировками – хиральный атом, в качестве которого обычно находится атом углерода в состоянии sp-3 гибридизации.
В качестве хиральных атомов могут быть атомы серы, азота, фосфора.
Оптические изомеры, являющиеся зеркальными изомерами, называются энантиомерами.
Энантиомер, вращающий плоскость поляризованного луча вправо, обозначается как /+/, а вращающий плоскость луча поляризованного луча влево, обозначается как /-/.
Эквимолекулярные смеси энантиомеров, содержащих равные количества право- и левовращающих изомеров, называются рацемическими смесями (рацематами).
Рацематы оптической активностью не обладают.
D и L стереохимические ряды
Конфигурация асимметрического атома углерода в соединении может быть описана тем или иным способом. Наиболее широко применяются правила Фишера, использующие обозначения D и L и правила Кана-Ингольда-Прелога, использующие обозначения R и S.
Правила Фишера связывают расположение атомов и атомных групп у асимметрического атома углерода рассматриваемого соединения со стандартом, в качестве которого был избран глицериновый альдегид /+/.
Этому энантиомеру глицеринового альдегида была произвольно приписана определенная конфигурация, которую обозначили как D.
Левовращающему глицериновому альдегиду приписали зеркальную конфигурацию, которую обозначили буквой L.

Конфигурация хиральной молекулы обозначается D или L в зависимости от того, аналогична ли она конфигурации D или L глицеринового альдегида.

В молекуле может присутствовать несколько асимметрических атомов углерода. В таком случае количество стереоизомеров возрастает. Часть из них будет зеркальными изомерами (энантиомерами).
Остальные стереоизомеры, не являющиеся энантиомерами, называются диастереомерами.
Общее число стереоизомеров можно рассчитать по формуле 2n, где n – число асимметрических центров в молекуле.
Диастереомеры отличаются друг от друга по физическим и химическим свойствам.
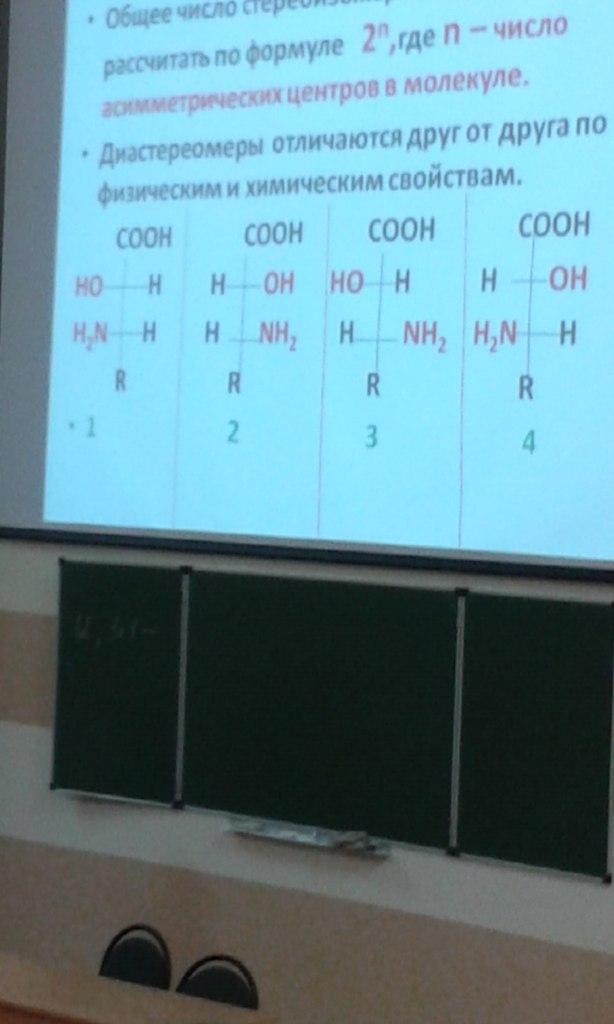
1,2; 3,4 – энантиомеры
1,3; 1,4; 2,3; 2,4 – диастереомеры
Связь пространственного строения с биологической активностью
Большинство метаболитов являются хиральными молекулами. При взаимодействии одних хиральных молекул с другими хиральными молекулами появляются различия в их химических свойствах. Такие молекулы обычно реагируют одновременно несколькими реакционными центрами и характер их взаимодействия будет зависеть от их взаимной ориентации.
В процессе обмена в клетке участвует L-яблочная кислота, L-молочная кислота, L-аминокислоты, D-сахара.
Хиральными молекулами являются белки, построенные из L-аминокислот, фосфолипиды, витамины, гормоны и т.д.
Стереоизомерия лежит в основе специфичности взимодействия субстрат – фермент, гормон – рецептор, антиген – антитело и др.
Фармакологическое действие ряда лекарственных веществ обусловлено их взаимодействием с рецепторами клетки.
При создании новых лекарственных веществ, имеющих хиральные центры, следует иметь в виду, что различные энантиомеры могут обладать различным и даже противоположным действием, биодействием.
Например, препарат талидомид (+)R-изомер – хороший транквилизатор и снотворное, а(-)S-энантиомер – является тератогеном (оказывает токсическое действие на плод).
Левовращающий энантиомер кокаина почти в 2 раза более активен в качестве местного анастетика, чем его правовращающий оптический антипод.
Из двух энантиомеров адреналина наибольшую фармакологическую активность имеет R(-) адреналин; S(+) адреналин биологической активностью не обладает.
Причиной такой специфичности взаимодействия является комплементарность – взаимное соответствие дополняющих друг друга структур (макромолекул, коферментов, субстратов, радикалов и др.), определяемое их пространственной структурой и химическими свойствами (способностью образовывать водородные и другие связи).
Аналогичная картина характерна и для ряда других лекарственных средств. Так, правовращающий изопропиладреналин (изодрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.
Лекарственное средство противоопухлевого действия саркозилин является левовращающим энантиомером; правовращающий сарколизин не активен.
